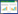文章信息
- 孔繁菲, 马剑, 丛蓉, 杨慧, 冷洪锐, 马晓欣
- KONG Fanfei, MA Jian, CONG Rong, YANG Hui, LENG Hongrui, MA Xiaoxin
- miR-497-5p在子宫内膜病变组织中的表达及临床意义
- Expression of miR-497-5p in Endometrial Lesions and Its Clinical Significance
- 中国医科大学学报, 2018, 47(7): 593-596, 600
- Journal of China Medical University, 2018, 47(7): 593-596, 600
-
文章历史
- 收稿日期:2018-02-23
- 网络出版时间:2018-06-28 9:43
子宫内膜癌是最常见的妇科恶性肿瘤[1],多数发生于50岁以上妇女。全面彻底了解子宫内膜癌流行病学、病理生理学和管理策略有助于妇产科医生识别患病风险增加的妇女,并有利于该病的早期诊断[2]。针对子宫内膜癌有效的靶向治疗是临床医生亟待思考的问题,其分子机制也成为近几年的研究热点。子宫内膜癌被认为与“不和谐”激素产生有关,microRNA(miRNA)是调节激素产生的主要因子之一[3]。研究发现,miR-497-5p不仅在冠状动脉疾病[4]和特发性肺纤维化[5]的发生过程中发挥作用,并在结直肠癌[6]、口咽鳞状细胞癌[7]、血管肉瘤[8]和人乳头瘤病毒(human papillomavirus,HPV)感染的宫颈癌[9]中差异表达。但有关miR-497-5p与子宫内膜癌关系的研究目前尚未见报道,因此,本研究拟探讨miR-497-5p的表达在子宫内膜癌发生发展中的临床病理意义。
1 材料与方法 1.1 材料 1.1.1组织标本:选取中国医科大学附属盛京医院2011年至2017年期间行子宫内膜活检诊断的子宫内膜癌内膜组织110例(子宫内膜癌组),患者年龄26~76岁,平均54.37岁;非典型增生子宫内膜20例(非典型增生组),患者年龄30~60岁,平均50.85岁;因宫颈病变行全子宫切除术的正常子宫内膜组织30例(正常子宫内膜组,其中包括增生期内膜及分泌期内膜组织),患者年龄34~67岁,平均46.4岁。上述患者在术前均未行放化疗及激素治疗。110例子宫内膜癌中,根据国际妇产科联盟(FIGO 2009)临床分期及病理分级,Ⅰ期30例,Ⅱ期30例,Ⅲ期30例,Ⅳ期20例;根据WHO标准组织学分级,高分化子宫内膜癌38例,中低分化子宫内膜癌72例;淋巴结转移阳性27例,淋巴结转移阴性83例;浸润子宫肌层 < 1/2者61例,浸润子宫肌层≥1/2者49例。标本离体后,及时用4%多聚甲醛固定,常规脱水、浸蜡、包埋、切片。所有切片均经2名高级职称病理医师复阅诊断。本研究经过中国医科大学附属盛京医院伦理委员会批准(编号:2017PS171K)。
1.1.2主要试剂:miR-497-5p原位杂交试剂盒购自武汉博士德生物工程有限公司,DAB显色试剂盒购自北京中山金桥生物技术有限公司,Mayer苏木素染液购自北京索莱宝公司。
1.2 原位杂交检测石蜡切片经常规脱蜡至水后,用3%H2O2灭活内源性酶,暴露mRNA核酸片段。用1%多聚甲醛室温固定10 min,滴加预杂交液进行恒温41 ℃预杂交4 h,洗去多余液体。直接滴加杂交液(miR-497-5p的专项探针序列为5’-ACAAACCACAGTGTGCTGCTG- 3’),并用原位杂交专用盖玻片盖在切片上,恒温41 ℃杂交过夜。次日,洗涤后滴加封闭液,再滴加生物素化鼠抗地高辛,37 ℃孵育60 min;之后依次滴加SABC和生物素化过氧化物酶;DAB显色后苏木素复染,充分水洗;乙醇脱水,二甲苯透明,封片;去除杂交液作为阴性对照。所有图像(×400)均由正置显微镜获取。
1.3 实验结果判定采用双盲评分法判定原位杂交结果,miR-497-5p mRNA阳性反应颗粒定位于细胞质。每张切片随机选取5个视野(×400),按着色强度及阳性区域所占的百分比进行结果判定。按着色强度评分:0分,无着色;1分,浅黄色;2分,黄色;3分,棕黄色以及棕褐色。按阳性区域所占百分比评分:阴性为0分,阳性区域所占百分比≤10%为1分,> 10%~50%为2分,> 50%~75%为3分,> 75%为4分。取2项评分的乘积作为总分,≤2分为阴性(-),3~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。-/+为低表达,++/+++为高表达。由2位有经验的病理切片观察者分别阅片以控制误差。
1.4 生物信息学分析为了验证miR-497-5p在子宫内膜癌中的表达及其与生存时间的关系,本研究组从癌症和肿瘤基因图谱(The Cancer Genome Atlas,TCGA)数据库获取了miR-497-5p的mRNA的组织表达数据(其中子宫内膜癌546例,对照组33例)以及537例子宫内膜癌患者的生存时间数据,并进行分析。
1.5 统计学分析采用SPSS 21.0统计软件分析数据,计数资料采用χ2或Fisher确切概率检验,生存分析采用Kaplan-Meier法,P < 0.05为差异有统计学意义。
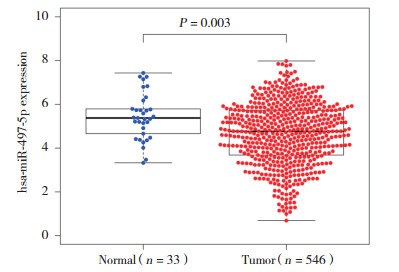
2 结果 2.1 不同子宫内膜组织中miR-497-5p的表达原位杂交结果表明,miR-497-5p mRNA定位于细胞质中,阳性表达呈现棕黄色、棕褐色均匀颗粒状或片状。子宫内膜癌组、非典型增生组和正常子宫内膜组miR-497-5p的阳性表达率分别为64.5%(71/110)、90%(18/20)、93.3%(28/30),子宫内膜癌组织和非典型增生子宫内膜组织中的表达明显低于正常子宫内膜组织(图 1),差异有统计学意义(P < 0.001,P = 0.004 4)(表 1)。此外,从TCGA数据库中获取546例子宫内膜癌和33例正常子宫内膜组织的miR-497-5p的表达数据,分析显示其在子宫内膜癌组织明显低于正常子宫内膜组织(图 2),差异有统计学意义(P = 0.003)。
|
| A, normal secretory endometrium; B, atypical hyperplasia; C, endometrial carcinoma. 图 1 miR-497-5p在子宫内膜组织中的表达原位杂交法×400 Fig.1 Expression of miR-497-5p in endometrium tissue In situ hybridization ×400 |
| Group | n | Positive expression [n(%)] | P |
| Normal endometrium | 30 | 28(93.3) | |
| Atypical hyperplasia endometrium | 20 | 18(90.0) | 0.004 4 |
| Endometrial carcinoma | 110 | 71(64.5) | < 0.000 1 |
|
| 图 2 对TCGA数据库中miR-497-5p在子宫内膜组织中的表达分析(实时PCR) Fig.2 Real-time PCR analysis of miR-497-5p expression in endometrial tissues (data retrieved from the TCGA dataset) |
2.2 miR-497-5p的表达与子宫内膜癌临床病理参数和预后的关系
高分化子宫内膜癌组织中miR-497-5p的高表达率(52.6%,20/38)明显高于中低分化子宫内膜癌组织(8.3%,6/72,P < 0.001)。早期内膜癌(Ⅰ~Ⅱ期)中miR-497-5p的高表达率(36.7%,22/60)明显高于晚期内膜癌(Ⅲ~Ⅳ期)(8.0%,4/50),差异有统计学意义(P < 0.001)。肿瘤浸润深度 < 1/2子宫内膜癌组织中miR-497-5p的高表达率(31.1%,19/61)明显高于浸润深度≥1/2子宫内膜癌组织(14.3%,7/49),差异有统计学意义(P = 0.039)。无淋巴结转移的子宫内膜癌组织miR-497-5p的高表达率(28.9%,24/83)明显高于有淋巴结转移(7.4%,2/27),差异有统计学意义(P = 0.022)。miR-497-5p的表达强度与患者的年龄无明显相关性(P > 0.05)(表 2)。
| Clinical pathological parameters | n | Low expression | High expression | Positive rate(%) | P | High expression rate(%) | P | |||
| - | + | ++ | +++ | |||||||
| Age(year) | ||||||||||
| < 60 | 77 | 26 | 31 | 16 | 4 | 66.2 | 0.572 | 26.0 | 0.378 | |
| ≥60 | 33 | 13 | 14 | 6 | 0 | 45.0 | 18.2 | |||
| FIGO stage | ||||||||||
| Ⅰ+Ⅱ | 60 | 15 | 23 | 19 | 3 | 75.0 | 0.012 | 36.7 | < 0.001 | |
| Ⅲ+Ⅳ | 50 | 24 | 22 | 3 | 1 | 52.0 | 8.0 | |||
| Differentiation | ||||||||||
| High-grade | 38 | 2 | 16 | 16 | 4 | 94.7 | < 0.001 | 52.6 | < 0.001 | |
| Moderate+low-grade | 72 | 37 | 29 | 6 | 0 | 48.6 | 8.3 | |||
| Muscular invasion depth | ||||||||||
| <1/2 | 61 | 15 | 27 | 15 | 4 | 75.4 | 0.008 | 31.1 | 0.039 | |
| ≥1/2 | 49 | 24 | 18 | 7 | 0 | 51.0 | 14.3 | |||
| Lymphnode metastasis | ||||||||||
| No | 83 | 26 | 33 | 20 | 4 | 68.7 | 0.112 | 28.9 | 0.022 | |
| Yes | 27 | 13 | 12 | 2 | 0 | 51.9 | 7.4 | |||
利用TCGA数据库中269例miR-497-5p低表达的子宫内膜癌患者及268例miR-497-5p高表达的子宫内膜癌患者的生存时间数据行进生存分析,结果显示,miR-497-5p高表达子宫内膜癌患者较低表达子宫内膜癌患者生存率高(P < 0.05)(图 3)。

|
| 图 3 TCGA数据库中子宫内膜癌组织中miR-497-5p高低表达与预后分析 Fig.3 Kaplan-Meier survival curves for endometrial cancer cases with high and low miR-497-5p expression (data retrieved from the TCGA dataset) |
3 讨论
miRNAs是一类内源性的非编码RNA,在不同的生物学过程和癌症进展中起重要作用[10]。miR-497是由人类染色体17p13.1上的MIR497HG(基因ID:100506755)基因的第一内含子编码的高度保守的miRNA,属于miR-15家族(miR-15a,miR-15b,miR-16,miR-195,miR-424和miR-497),此家族共享相同的3’-UTR结合种子序列AGCAGCA[11]。miR-497已被报道为多种人类癌症的肿瘤抑制剂。
研究[12]表明,miR-497-5p在骨肉瘤组织中表达水平显著下调,骨肉瘤细胞中miR-497-5p过表达能够显著抑制肿瘤细胞增殖,并在体外诱导G0/G1细胞周期停滞和凋亡。此外,miR-497在卵巢癌组织和SKOV3细胞中表达明显减少,SKOV3细胞中miR-497过表达可诱导PAX2蛋白表达,诱导细胞凋亡,抑制细胞增殖、迁移和侵袭[13]。在患HPV感染的中国维吾尔族女性宫颈癌中,miR-497-5p在癌组织中的的表达显著低于正常组织[9]。但miR-497-5p在子宫内膜癌中的临床意义尚未见报道。
本研究利用原位杂交方法检测了子宫内膜癌、非典型增生及正常子宫内膜组织中miR-497-5p的表达情况,结果发现,子宫内膜癌组织及非典型增生子宫内膜组织中,miR-497-5p的表达水平均明显低于正常内膜组织,提示miR-497-5p可能参与子宫内膜病变的发生发展过程。本研究又进一步发现,miR-497-5p的表达与临床FIGO分期、分化级别、肿瘤浸润深度和淋巴结转移密切相关。临床分期越高,分化等级越低,肿瘤浸润深度越深,miR-497-5p的表达越低,有淋巴结转移者miR-497-5p的表达较无淋巴结转移者低。但是miR-497-5p的表达与患者年龄之间未发现明显相关,可能与组织标本的个体特异有关。本研究组推测miR-497-5p可能通过与靶基因结合而影响子宫内膜癌的发生发展。通过对TCGA数据库中的大量随访信息进行分析,发现miR-497-5p的表达与子宫内膜癌患者的生存时间相关。以上研究结果提示,miR-497-5p可能为子宫内膜病变进展过程中的重要作用因子之一,并可能成为一种子宫内膜癌患者预后的预测指标。
然而,本研究仍然存在一定的局限性。关于miR-497-5p在子宫内膜癌细胞系中如何影响肿瘤的增殖、迁移、侵袭以及凋亡的机制,仍有待于进一步研究。
综上所述,miR-497-5p可以作为子宫内膜癌临床风险预测的参考指标,本研究结果为其在肿瘤的发生发展过程中的作用提供新的理论支持。
| [1] |
SGO CLINICAL PRACTICE ENDOMETRIAL CANCER WORKING GROUP, BURKE WM, ORR J, et al. Endometrial cancer:a review and current management strategies:part Ⅰ[J]. Gynecol Oncol, 2014, 134(2): 385-392. DOI:10.1016/j.ygyno.2014.05.018 |
| [2] |
SGO CLINICAL PRACTICE ENDOMETRIAL CANCER WORKING GROUP, BURKE WM, ORR J, et al. Endometrial cancer:a review and current management strategies:part Ⅱ[J]. Gynecol Oncol, 2014, 134(2): 393-402. DOI:10.1016/j.ygyno.2014.06.003 |
| [3] |
WIDODO, DJATI MS, RIFAI M. Role of microRNAs in carcinogenesis that potential for biomarker of endometrial cancer[J]. Ann Med Surg(Lond), 2016, 7: 9-13. DOI:10.1016/j.amsu.2016.01.091 |
| [4] |
SU SH, WU CH, CHIU YL, et al. Dysregulation of vascular endothelial growth factor receptor-2 by multiple miRNAs in endothelial colony-forming cells of coronary artery disease[J]. J Vasc Res, 2017, 54(1): 22-32. DOI:10.1159/000449202 |
| [5] |
CHEN X, SHI C, WANG C, et al. The role of miR-497-5p in myofibroblast differentiation of LR-MSCs and pulmonary fibrogenesis[J]. Sci Rep, 2017, 7: 40958. DOI:10.1038/srep40958 |
| [6] |
PICHLER M, STIEGELBAUER V, VYCHYTILOVA-FALTEJSKOVA P, et al. Genome-wide miRNA analysis identifies miR-188-3p as a novel prognostic marker and molecular factor involved in colorectal carcinogenesis[J]. Clin Cancer Res, 2017, 23(5): 1323-1333. DOI:10.1158/1078-0432.CCR-16-0497 |
| [7] |
WONG N, KHWAJA SS, BAKER CM, et al. Prognostic microRNA signatures derived from The Cancer Genome Atlas for head and neck squamous cell carcinomas[J]. Cancer Med, 2016, 5(7): 1619-1628. DOI:10.1002/cam4.718 |
| [8] |
CHEN Y, KUANG D, ZHAO X, et al. miR-497-5p inhibits cell proliferation and invasion by targeting KCa3.1 in angiosarcoma[J]. Oncotarget, 2016, 7(36): 58148-58161. DOI:10.18632/oncotarget.11252 |
| [9] |
GAO D, ZHANG Y, ZHU M, et al. miRNA expression profiles of HPV-infected patients with cervical cancer in the Uyghur population in China[J]. PLoS One, 2016, 11(10): e0164701. DOI:10.1371/journal.pone.0164701 |
| [10] |
XU Y, CHEN J, GAO C, et al. MicroRNA-497 inhibits tumor growth through targeting insulin receptor substrate 1 in colorectal cancer[J]. Oncol Lett, 2017, 14(6): 6379-6386. DOI:10.3892/ol.2017.7033 |
| [11] |
YANG G, XIONG G, CAO Z, et al. miR-497 expression, function and clinical application in cancer[J]. Oncotarget, 2016, 7(34): 55900-55911. DOI:10.18632/oncotarget.10152 |
| [12] |
SUN Z, LI A, YU Z, et al. MicroRNA-497-5p suppresses tumor cell growth of osteosarcoma by targeting ADP ribosylation factor-like protein 2[J]. Cancer Biother Radiopharm, 2017, 32(10): 371-378. DOI:10.1089/cbr.2017.2268 |
| [13] |
LIN Z, ZHAO J, WANG X, et al. Overexpression of microRNA-497 suppresses cell proliferation and induces apoptosis through targeting paired box 2 in human ovarian cancer[J]. Oncol Rep, 2016, 36(4): 2101-2107. DOI:10.3892/or.2016.5012 |
 2018, Vol. 47
2018, Vol. 47