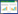文章信息
- 宋起滨, 王哲, 王宇令, 李杨, 林爽
- SONG Qibin, WANG Zhe, WANG Yuling, LI Yang, LIN Shuang
- 脂肪源性干细胞促进大鼠神经施万细胞增殖和分泌功能
- Adipose-derived Stem Cells Promote Rat Schwann Cell Proliferation and Secretion of Nerve Regeneration Factors
- 中国医科大学学报, 2018, 47(6): 527-531
- Journal of China Medical University, 2018, 47(6): 527-531
-
文章历史
- 收稿日期:2017-10-13
- 网络出版时间:2018-05-21 10:39
2. 中国医科大学附属盛京医院病理科, 沈阳 110004
2. Department of Pathology, Shengjing Hospital, China Medical University, Shenyang 110004, China
虽然周围神经损伤后具有一定的再生潜能,但是一般情况下损伤的周围神经很难实现完全的再生[1]。周围神经损伤后,施万细胞可以快速地从成髓鞘状态向生长支持的形态转换,损伤的神经远端会有大量的施万细胞增殖,增殖的同时施万细胞会向近端迁移构成基底膜束或者形成Bungner带,一般情况下,在损伤3 d后施万细胞的增殖和转换会达到高峰。施万细胞能够分泌大量的神经营养因子、细胞因子和细胞外基质分子,刺激周围神经再生,促进轴突生长。但因施万细胞自体来源有限,作用时间较短,导致神经损伤难以完全再生[2-4]。
干细胞是组织工程与再生医学中常用的种子细胞,具有快速自我更新和多向分化的能力。其中,脂肪源性干细胞(adipose-derived stem cells,ADSCs)因具有产量高、获取过程损伤小等优势而被广泛应用。研究[5]发现促有丝分裂和分化因子可以诱导ADSCs向类似施万细胞分化,分化后的细胞能够表达胶质细胞标记物和营养因子受体。但也有研究[6-7]指出ADSCs很难分化成完全的施万细胞,其旁分泌功能对周围神经再生的作用要远大于分化功能。
本研究将大鼠神经施万细胞用ADSCs条件培养基培养或与ADSCs共培养后,发现ADSCs条件培养基及ADSCs共培养均能促进大鼠神经施万细胞的增殖及分泌功能,为周围神经再生的研究提供了新的思路。
1 材料与方法 1.1 材料 1.1.1 实验动物4周龄健康成年SD大鼠,体质量90~130 g,用于分离培养ADSCs,由我院实验动物中心提供。本实验获得我院动物伦理委员会审批。
1.1.2 主要试剂大鼠神经施万细胞(沈阳汇佰生物有限公司);Ⅱ型胶原酶(美国Sigma公司),胎牛血清(杭州四季青生物工程有限公司),DMEM培养基(美国Hyclone公司),胰蛋白酶(美国Corning公司),四甲基偶氮唑蓝(北京汇佰生物有限公司),FITC标记的抗大鼠CD31、CD90、CD45和CD44(美国BD公司),神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain derived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell line derived neurotrophic factor,GDNF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和GAPDH抗体(美国Santa cruz公司),二抗、ELISA试剂盒(北京中杉金桥生物技术有限公司),SYBR试剂盒(日本TaKaRa公司)。
1.2 方法 1.2.1 ADSCs分离培养用Hanks液清洗SD大鼠双侧腹股沟区脂肪,剪碎脂肪,加入Ⅱ型胶原酶,37 ℃消化40 min。培养基终止消化后1 000 r/min离心5 min,用培养基重悬细胞,吹打均匀,置37 ℃、5%CO2培养箱中培养。此后每2~3 d换液1次,待细胞融合至90%时用胰蛋白酶消化传代。
1.2.2 细胞培养将大鼠神经施万细胞接种于含10%灭活胎牛血清的DMEM培养基中,置37 ℃、5%CO2培养箱中培养。
1.2.3 ADSCs表面标记物鉴定取第三代ADSCs消化离心计数后,用PBS将细胞浓度调节为5×105/mL。取500 μL细胞悬液,分别加入FITC标记的CD31、CD90、CD45和CD44抗体(PBS作为对照),4 ℃孵育30 min,PBS洗1次,PBS重悬细胞,使用流式细胞仪检测。
1.2.4 ADSCs条件培养基获取待第三代ADSCs在完全培养基中达到90%融合时,更换为含1%胎牛血清的DMEM培养基,继续培养48 h后收集培养液,0.22 μL滤器过滤,获得ADSCs条件培养基。
1.2.5 ADSCs与大鼠神经施万细胞的间接培养将大鼠神经施万细胞接种于transwell下室中,实验组在transwell上室中接种200 μL浓度为5×105/mL的ADSCs,对照组则不添加ADSCs。
1.2.6 ELISA按照ELISA试剂盒说明书,使用双抗体夹心法,包被上样,加抗体,底物显色,通过酶标仪分析结果。
1.2.7 MTT实验将用ADSCs条件培养基培养的大鼠神经施万细胞以1×104/mL浓度接种于96孔培养板中,终体积200 μL,以正常培养基培养的大鼠神经施万细胞作为对照。待细胞贴壁后,于0、12、24、36和48 h(每个浓度、每个时间点分别设3个复孔)分别加入5 mg/mL MTT溶液10 μL,置37 ℃、5%CO2培养箱中培养4 h后,弃上清,每孔中加入200 μL DMSO,震荡10 min,在490 nm处记录吸光值。于0、12、24、36和48 h(每个浓度、每个时间点分别设3个复孔)在与ADSCs共培养的大鼠神经施万细胞中加入5 mg/mL MTT溶液10 μL,置37 ℃、5%CO2培养箱中培养4 h后,弃上清,每孔中加入200 μL DMSO,震荡10 min,在490 nm处记录吸光值。
1.2.8 Western blotting细胞培养48 h后使用RIPA裂解液搜集并裂解细胞,提取蛋白,通过G250定量后,取30 μg蛋白进行电泳(80~120V)、转膜(100 V,1 h)后,用5%脱脂奶粉室温封闭1 h。加入一抗4 ℃过夜后,TBST清洗3次。二抗室温孵育1 h后,TBST清洗3次。ECL发光。
1.2.9 实时PCRTRIZOL法提取培养48 h的大鼠神经施万细胞RNA,反转录成cDNA,进行实时PCR反应。NGF正向引物序列为5’-ATGTCCATGTTGTTCT AC-3’,反向引物序列为5’-CAGCCTCTTCTTGCAGC C-3’;BDNF正向引物序列为5’-GACCATCCTTTTC CTTAC-3’,反向引物序列为5’-CTATCTTCCCCTTTT AATGG-3’;GDNF正向引物序列为5’-GAACCAAGC CAGTGTATCTCC-3’,反向引物序列为5’-CGTCTCT GCCTTTGTCCTC-3’;VEGF正向引物序列为5’-GAT GAAGCCCTGGAGTGC-3’,反向引物序列为5’-GGT GGTGTGGTGGTGACAT-3’;GAPDH正向引物序列为5’-GGCAAATTCAACGGCACAGT-3’,反向引物序列为5’-TAGGGCCTCTCTTGCTCAGT-3’。
1.3 统计学分析采用SPSS 17.0软件进行统计学分析,用非配对t检验比较2组数据,P < 0.05为差异有统计学意义。
2 结果 2.1 ADSCs细胞鉴定流式分析结果显示,所提取的细胞CD31阴性(0.38%),CD45阴性(17.53%),CD44阳性(92.31%),CD90阳性(96.42%),证明ADSCs细胞提取培养成功。见图 1。
|
| 图 1 ADSCs表面抗原标记物检测 Fig.1 Detection of surface antigen markers on ADSCs |
2.2 ADSCs条件培养基中神经营养因子的检测
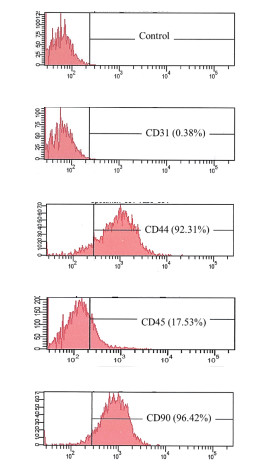
通过ELISA检测发现,ADSCs条件培养基中含有大量常见的与神经再生相关的因子,其中,NGF、BDNF、GDNF、VEGF的含量分别为(85.12±1.92)、(184.22±18.32)、(96.97±1.39)、(488.18±4.82)pg/mL,均明显高于对照组,差异有统计学意义(P < 0.05)。见图 2。
|
| * P < 0.05 vs control. 图 2 不同培养基中神经营养因子的含量 Fig.2 Contents of neurotrophic factors in different mediums |
2.3 ADSCs条件培养基及ADSCs对大鼠神经施万细胞增殖的影响
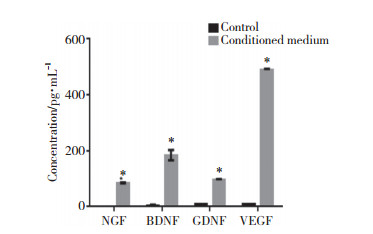
MTT检测结果显示,ADSCs条件培养基可以明显促进大鼠神经施万细胞增殖(图 3A);与ADSCs共培养也可促进大鼠神经施万细胞的增殖(图 3B)。
|
| A, the effects of ADSCs conditioned medium on Schwann cells proliferation; B, the effects of co-culture with ADSCs on Schwann cells proliferation. *P < 0.05 vs control group. 图 3 ADSCs条件培养基及ADSCs共培养对大鼠神经施万细胞增殖的影响 Fig.3 Effects of medium conditioned with ADSCs or co-cultured with ADSCs on the proliferation of Schwann cells |
2.4 不同浓度ADSCs对大鼠神经施万细胞中神经营养因子表达的影响
Western blotting与实时PCR结果显示,与对照组相比,使用ADSCs条件培养基培养或与ADSCs共培养的实验组大鼠神经施万细胞中NGF、BDNF、GDNF和VEGF蛋白及mRNA表达水平均增高,差异有统计学意义(均P < 0.05),提示用条件培养基培养或与ADSCs共培养大鼠神经施万细胞能够促进细胞中神经营养因子的表达,见图 4、5。
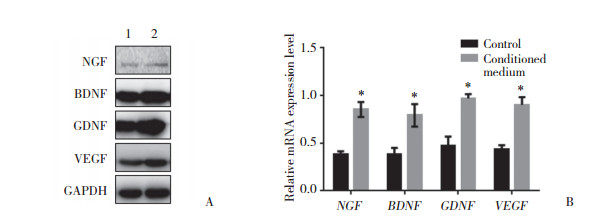
|
| A, Western blotting result; B, real time PCR result. 1, control; 2, conditioned medium. *P < 0.05 vs control group. 图 4 ADSCs条件培养基对大鼠神经施万细胞中神经营养因子表达的影响 Fig.4 Effects of medium conditioned with ADSCs on the expression of neurotrophic factor in rat Schwann cells |
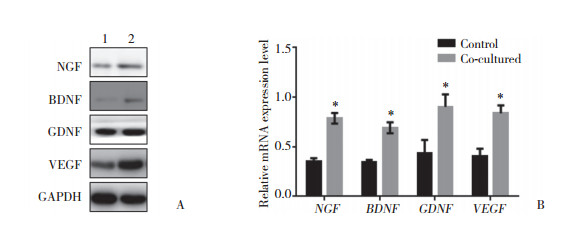
|
| A, Western blotting result; B, real time PCR result. 1, control; 2, co-cultured. *P < 0.05 vs control group. 图 5 ADSCs共培养对大鼠神经施万细胞中神经营养因子表达的影响 Fig.5 The expression of neurotrophic factors in rat Schwann cells when co-cultured with ADSCs |
3 讨论
干细胞能够促进周围神经的再生,但其作用机制目前尚不清楚[8]。研究[9-11]表明,骨髓间充质干细胞及ADSCs可以分化为施万细胞,进而在神经修复中发挥重要作用,但也有研究认为干细胞所分化出的施万细胞仅为类施万细胞,仅具有施万细胞的表型,并不能够在体内发挥施万细胞的生理功能。体内实验[12]证明,骨髓间充质干细胞及ADSCs移植到坐骨神经损伤处后,仅有极小部分能够分化成施万细胞,对整体的神经修复作用不大。目前,大多数研究[13]认为,在促进周围神经损伤修复中发挥重要作用的是干细胞的旁分泌作用,为了明确ADSCs在外周神经损伤修复中的作用,本研究在获取大鼠ADSCs后,分别将大鼠神经施万细胞用ADSCs条件培养基培养或与ADSCs共培养,并检测了ADSCs对大鼠神经施万细胞的影响。
很多细胞因子能够在周围神经系统中发挥重要作用。周围神经受损后NGF表达上调,可以促进信号的传递以及轴突的生长;周围神经损伤后,BDNF的表达也有一定程度的上升,BDNF可以促进周围神经髓鞘的形成;周围神经受损后,GDNF表达大量增加,促进感觉神经等的再生[14];新生血管能够为神经再生提供营养,VEGF的表达可以促进血管的再生,也可以刺激轴突的生长,促进施万细胞的增殖并抑制其凋亡[15-16]。本研究通过ELISA检测发现ADSCs条件培养基中含有大量的神经营养因子,这些成分都可以促进周围神经的再生,促进大鼠神经施万细胞的增殖。
本研究还发现,ADSCs条件培养基和ADSCs细胞共培养均可促进大鼠神经施万细胞的增殖,并促进该细胞中NGF、BDNF、GDNF和VEGF的表达。提示ADSCs不仅自身能够分泌神经营养因子,还能促进大鼠神经施万细胞增殖并分泌神经营养因子。
综上所述,ADSCs可以分泌大量有利于周围神经再生的生长因子,ADSCs及其条件培养基能促进大鼠神经施万细胞增殖并分泌神经营养因子,从而有助于周围神经的再生。
| [1] |
XIE S, LU F, HAN J, et al. Efficient generation of functional Schwann cells from adipose-derived stem cells in defined conditions[J]. Cell Cycle, 2017, 16(9): 841-851. DOI:10.1080/15384101.2017.1304328 |
| [2] |
REICHENBERGER MA, MUELLER W, HARTMANN J, et al. ADSCs in a fibrin matrix enhance nerve regeneration after epineural suturing in a rat model[J]. Microsurgery, 2016, 36(6): 491-500. DOI:10.1002/micr.30018 |
| [3] |
HSIEH SC, CHANG CJ, CHENG WT, et al. Effect of an epineurial-like biohybrid nerve conduit on nerve regeneration[J]. Cell Transplant, 2016, 25(3): 559-574. DOI:10.3727/096368915X688920 |
| [4] |
JIANG L, ZHENG Y, CHEN O, et al. Nerve defect repair by differentiated adipose-derived stem cells and chondroitinase ABC-treated acellular nerves[J]. Int J Neurosci, 2015, 20: 1-9. DOI:10.3109/00207454.2015.1048547 |
| [5] |
ZACK-WILLIAMS SD, BUTLER PE, KALASKAR DM. Current progress in use of adipose derived stem cells in peripheral nerve regeneration[J]. World J Stem Cells, 2015, 7(1): 51-64. DOI:10.4252/wjsc.v7.i1.51 |
| [6] |
TSE KH, NOVIKOV LN, WIBERG M, et al. Intrinsic mechanisms underlying the neurotrophic activity of adipose derived stem cells[J]. Exp Cell Res, 2015, 331(1): 142-151. DOI:10.1016/j.yexcr.2014.08.034 |
| [7] |
LIU Y, ZHANG Z, QIN Y, et al. A new method for Schwann-like cell differentiation of adipose derived stem cells[J]. Neurosci Lett, 2013, 551(13): 79-83. DOI:10.1016/j.neulet.2013.07.012 |
| [8] |
RAZAVI S, MARDANI M, KAZEMI M, et al. Effect of leukemia inhibitory factor on the myelinogenic ability of Schwann-like cells induced from human adipose-derived stem cells[J]. Cell Mol Neurobiol, 2013, 33(2): 283-289. DOI:10.1007/s10571-012-9895-2 |
| [9] |
RAZAVI S, AHMADI N, KAZEMI M, et al. Efficient transdifferentiation of human adipose-derived stem cells into Schwann-like cells:A promise for treatment of demyelinating diseases[J]. Adv Biomed Res, 2012, 1(11): 12. DOI:10.4103/2277-9175.96067 |
| [10] |
LUO H, ZHANG Y, ZHANG Z, et al. The protection of MSCs from apoptosis in nerve regeneration by TGFβ1 through reducing inflammation and promoting VEGF-dependent angiogenesis[J]. Biomaterials, 2012, 33(17): 4277-4287. DOI:10.1016/j.biomaterials.2012.02.042 |
| [11] |
WAND Y, ZHAO Z, REN Z, et al. Recellularized nerve allografts with differentiated mesenchymal stem cells promote peripheral nerve regeneration[J]. Neurosci Lett, 2012, 514(1): 96-101. DOI:10.1016/j.neulet.2012.02.066 |
| [12] |
SOWA Y, IMURA T, NUMAJIRI T, et al. Adipose-derived stem cells produce factors enhancing peripheral nerve regeneration:influence of age and anatomic site of origin[J]. Stem Cells Dev, 2012, 21(11): 1852-1862. DOI:10.1089/scd.2011.0403 |
| [13] |
REID AJ, SUN M, WIBERG M, et al. Nerve repair with adipose-derived stem cells protects dorsal root ganglia neurons from apoptosis[J]. Neuroscience, 2011, 199(10): 515-522. DOI:10.1016/j.neuroscience.2011.09.064 |
| [14] |
YANG L, FANG JS, WANG W, et al. Transplantation of Schwann cells differentiated from adipose-derived stem cells modifies reactive gliosis after contusion brain injury in rats[J]. J Int Med Res, 2011, 39(4): 1344-1357. DOI:10.1177/147323001103900421 |
| [15] |
SUN F, ZHOU K, MI WJ, et al. Combined use of decellularized allogeneic artery conduits with autologous transdifferentiated adipose-derived stem cells for facial nerve regeneration in rats[J]. Biomaterials, 2011, 32(32): 8118-8128. DOI:10.1016/j.biomaterials.2011.07.031 |
| [16] |
ZHANG H, YANG R, WANG Z, et al. Adipose tissue-derived stem cells secrete CXCL5 cytokine with neurotrophic effects on cavernous nerve regeneration[J]. J Sex Med, 2011, 8(2): 437-446. DOI:10.1111/j.1743-6109.2010.02128.x |
 2018, Vol. 47
2018, Vol. 47