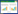文章信息
- 倪莎, 郭绮璇, 汪玲, 欧阳玲, 周欣
- NI Sha, GUO Qixuan, WANG Ling, OUYANG Ling, ZHOU Xin
- miR-152靶向Mirk/Dyrk1B调控人卵巢癌干细胞紫杉醇敏感性的研究
- miR-152 Regulates the Sensitivity of Human Ovarian Cancer Stem Cells to Paclitaxel by Targeting Mirk/Dyrk1B
- 中国医科大学学报, 2018, 47(6): 481-485, 489
- Journal of China Medical University, 2018, 47(6): 481-485, 489
-
文章历史
- 收稿日期:2018-03-14
- 网络出版时间:2018-05-19 16:42
卵巢癌是致死率最高的女性生殖系统恶性肿瘤,晚期卵巢癌的5年生存率长期徘徊于20%~30%。化疗耐药是造成卵巢癌预后不佳的主要原因之一,深入研究卵巢癌的化疗耐药机制对提高卵巢癌的化疗疗效、改善患者预后具有重大意义。
肿瘤干细胞被认为是肿瘤耐药的根源,深入研究肿瘤干细胞化疗耐药的分子机制有助于深入认识肿瘤耐药的机理并寻找相应的治疗靶点。本研究组前期研究发现,miR-152在卵巢癌干细胞球中低表达,过表达miR-152可以影响卵巢癌细胞的增殖活性,提示其可能与卵巢癌干细胞化疗耐药有关。为进一步探讨miR-152在卵巢癌干细胞化疗耐药中的作用,本研究检测了miR-152差异表达对人卵巢癌干细胞球紫杉醇敏感性的影响,并初步验证了其靶基因,为深入理解卵巢癌耐药机制、寻找新的治疗靶点提供依据。
1 材料与方法 1.1 卵巢癌干细胞培养将人卵巢癌细胞株OVCAR3接种于DMEM-High Glu完全培养基(美国GIBCO公司)中,置于5%CO2、37 ℃恒温细胞培养箱中培养。常规消化贴壁细胞,将细胞沉淀重悬于无血清培养基,置于超低吸附培养瓶中培养。无血清培养体系:DMEM-F12为基础培养基,包括40 ng/mL重组表皮细胞生长因子、20 ng/mL重组成纤维细胞生长因子、10 ng/mL重组白血病抑制因子、4 µg/mL肝素、5%牛血清蛋白、1%青链霉素、50%无血清肿瘤细胞培养基。观察细胞球形态、大小及折光性等,评估干细胞球生长状态。
1.2 建立miR-152差异表达体系实验分组:实验组(转染miR-152 mimics)、反义链组(转染miR-152 inhibitor)、阴性对照组(转染miR-152对应的阴性对照序列)、空白对照组(不转染任何序列)。miR-152 mimics、miR-152 inhibitor、阴性对照均由苏州吉玛生物有限公司合成。按Lipo2000(美国Invitrogen公司)说明书进行转染操作。转染48 h后移去培养基,加入Trizol RNA Isolation Reagent(美国Invitrogen公司),按照说明书步骤提取RNA。使用PrimeScript RT reagent Kit with GDNA Erase(日本TaKaRa公司)进行cDNA合成。实时PCR以管家基因U6作为内参照,miR-152、U6上下游引物均由上海生工生物有限公司合成。使用SYBR PremixEx Taq(Tli RNaseH Plus)(日本TaKaRa公司)进行扩增,反应条件:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 30 s,40个循环。
1.3 CCK-8实验常规消化、计数卵巢癌干细胞球,以DMEM-F12培养基重悬于低吸附96孔板,每孔接种细胞5×103个;转染后24 h加入紫杉醇,浓度分别为5、10、20、40、80、160、320、640 nmol/L(每个浓度设3个复孔),加药后48 h移去培养基,每孔加入90 μL DMEM-F12培养基与10 μL CCK-8溶液,混匀后置入细胞培养箱;4 h后通过酶标仪检测450 nm处吸光度值。
1.4 双荧光素酶报告基因实验根据Mirk/Dyrk1B 3’-UTR和miR-152的序列预测二者的结合位点,构建Mirk/Dyrk1B 3’-UTR pmir-GLO野生型及突变型载体,由江苏吉玛公司合成。采用双荧光素酶报告基因系统(美国Promega公司)检测荧光素酶活性。
1.5 蛋白免疫印迹实验常规消化、离心后取细胞沉淀,提取蛋白并测浓度;用SDS-PAGE聚丙烯酰胺凝胶电泳进行免疫印迹实验,一抗Mirk/Dyrk1B 1︰1 000稀释,GAPDH 1︰5 000稀释(美国Abcam公司),用Quantiy One软件进行灰度值分析,以目的条带与GAPDH条带的灰度比值作为相对表达量。
1.6 统计学分析实时PCR采用2-ΔΔCt相对定量法,以U6的表达量作为内参照,分别计算实验组与对照组的ΔCt,根据公式ΔΔCt=(实验组目的基因Ct-内参照Ct)-(对照组目的基因Ct-内参照Ct),相对表达量=2-ΔΔCt。计量资料用x±s表示,组间比较采用独立样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 OVCAR3细胞在无血清悬浮培养条件下形成干细胞球并连续传代通过无血清悬浮培养法由人卵巢癌细胞系OVCAR3中获得干细胞球,可在无血清培养条件下连续传代5代以上,且随着培养时间延长,细胞球逐渐富集(图 1)。

|
| 图 1 卵巢癌干细胞球在无血清培养基中悬浮生长并逐渐富集 Fig.1 Ovarian cancer stem cell spheres growed in serum-free medium and enriched over time |
2.2 OVCAR3卵巢癌干细胞球低表达miR-152,上调miR-152的表达可增强卵巢癌干细胞球对紫杉醇的敏感性
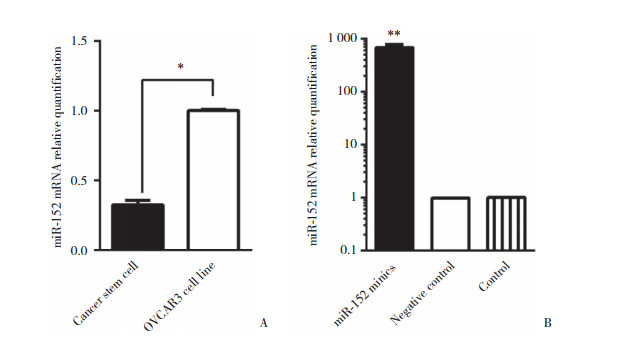
卵巢癌干细胞球组和OVCARE贴壁细胞组ΔCt值分别为18.98±0.137和14.58±0.98,卵巢癌干细胞球中miR-152的表达量相对于贴壁细胞中miR-152的表达量为0.13,差异有统计学意义(P < 0.05),提示miR-152在卵巢癌干细胞球中的表达水平明显低于贴壁细胞(图 2A)。转染miR-152 mimics的实验组细胞miR-152的表达量明显高于阴性及空白对照组,差异有统计学意义(P < 0.01),证明转染成功(图 2B)。不同浓度紫杉醇处理后,实验组卵巢癌干细胞球的存活率明显低于对照组,差异有统计学意义(P < 0.05)(图 3)。
|
| A, mir-152 level in OVCAR3 cancer stem cell spheres is lower than adherent cells; B, mir-152 level in mir-152 mimics transfected cells is higher than control.*P < 0.05, **P < 0.01 vs control. 图 2 mir-152在卵巢癌干细胞球中的表达情况 Fig.2 The expression level of mir-152 in ovarian cancer stem cell spheres |
|
| 图 3 上调miR-152表达可增强卵巢癌干细胞球对紫杉醇的敏感性 Fig.3 Upregulation of mir-152 enhanced the sensitivity of ovarian cancer stem cells to paclitaxel |
2.3 过表达miR-152可下调Mirk/Dyrk1B的表达
双荧光素酶报告基因实验结果显示,实验组荧光素酶活性显著低于各对照组(P < 0.01),提示miR-152可与Mirk/Dyrk1B野生型质粒结合进而降低荧光素酶活性,证实miR-152能够特异性结合Mirk/Dyrk1B 3’-UTR区域(图 4)。

|
| *P < 0.01 vs other groups. 图 4 miR-152可与Mirk/Dyrk1B野生型质粒结合并降低荧光素酶活性 Fig.4 mir-152 could bind to the Mirk/Dyrk1b 3'-UTR and reduced the relative luciferase |
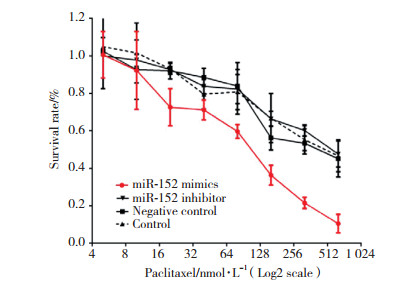
Western blotting结果(图 5)显示,实验组与siRNA-Mirk/Dyrk1B组中Mirk/Dyrk1B表达量均较对照组明显降低(P < 0.01)。
|
| *P < 0.01 vs control. 图 5 miR-152 mimics与siRNA-Mirk/Dyrk1B均可降低卵巢癌干细胞球中Mirk/Dyrk1B的表达水平 Fig.5 Upregulation of mir-152 or downregulation of Mirk/Dyrk1B could reduce the Mirk/Dyrk1B protein level |
2.4 miR-152与Mirk/Dyrk1B差异表达影响卵巢癌干细胞球对紫杉醇的敏感性
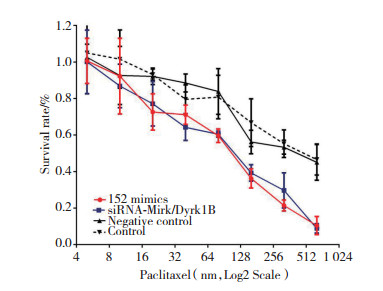
以紫杉醇处理的卵巢癌干细胞球中,miR-152组与siRNA-Mirk/Dyrk1B组细胞存活率明显低于对照组,差异均有统计学意义(P < 0.05),miR-152组与siRNA-Mirk/Dyrk1B组相比,差异无统计学意义(图 6)。
|
| 图 6 上调miR-152或下调Mirk/Dyrk1B均可提高卵巢癌干细胞球对紫杉醇的敏感性 Fig.6 Upregulation of mir-152 or downregulation of Mirk/Dyrk1B could enhance the sensitivity of ovarian cancer stem cells to paclitaxel |
2.5 miR-152与Mirk/Dyrk1B差异表达影响卵巢癌干细胞球中耐药相关蛋白表达水平
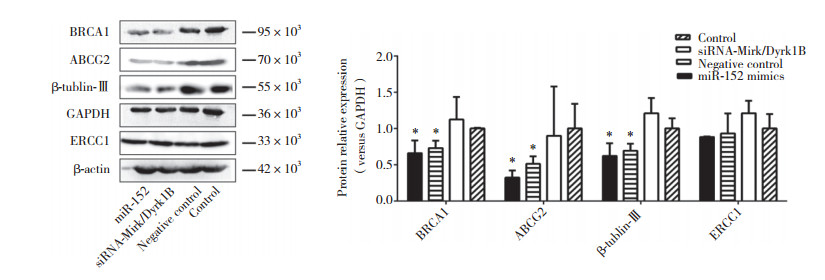
Western blotting结果(图 7)显示,miR-152组与siRNA-Mirk/Dyrk1B组中ABCG2、β-tublinⅢ、BRCA1的表达水平均明显低于对照组,差异有统计学意义(P < 0.05),但miR-152组与siRNA-Mirk/Dyrk1B组间无统计学差异(P > 0.05)。ERCC1蛋白水平在所有组中均无统计学差异(P > 0.05)。
|
| *P < 0.05 vs control and negative control. 图 7 上调miR-152或下调Mirk/Dyrk1B对卵巢癌干细胞球中各耐药相关蛋白表达的影响 Fig.7 Upregulation of mir-152 or downregulation of Mirk/Dyrk1B could alter the drug resistance related protein levels |
3 讨论
1994年,LAPIDOT等[1]在急性白血病细胞中鉴定出一群髓性起源细胞,这些细胞表现出类似于干细胞的特征,具有分化、增殖及自我更新的潜力。之后,REYA等[2]正式提出了“肿瘤干细胞”这一概念。肿瘤干细胞能够高表达多种耐药蛋白以及抗凋亡蛋白,以逃脱传统化疗药物的杀伤作用并导致凋亡逃逸,被认为是肿瘤化疗耐药的根源。
研究[3-6]表明,miRNAs的异常表达与恶性肿瘤的化疗耐药密切相关。miR-152位于染色体17q21.32,在多种恶性肿瘤中发挥抑癌基因的作用。miR-152在卵巢癌组织与细胞系SKOV3、OVCAR3中低表达,过表达miR-152对卵巢癌细胞的增殖、侵袭、转移等恶性生物学行为具有明显的抑制作用[7-9]。上调miR-152能抑制卵巢癌干细胞球的增殖与克隆形成[8, 10]。有研究[9, 11]通过miRNA基因芯片方法在化疗耐药的卵巢癌患者组织中筛选出62个异常表达的miRNA并通过RT-PCR进行验证,结果发现miR-152在化疗耐药组与化疗敏感组患者中的表达具有显著差异。还有研究[10, 12]通过类似方法在卵巢癌患者血清中筛选出包括miR-152在内的多个异常表达的miRNA,并通过生物信息学方法预测这些miRNA可能通过靶向WNT、AKT/mTOR、TLR-4/MyD88等信号转导通路发挥作用。本研究由人卵巢癌细胞系OVCAR3中分离培养卵巢癌干细胞球,发现miR-152在卵巢癌干细胞球中的表达水平明显低于贴壁细胞,上调miR-152能够明显增加卵巢癌干细胞球对紫杉醇的敏感性,提示miR-152与卵巢癌干细胞球的化疗敏感性相关,并可能通过这一机制影响卵巢癌患者的化疗耐药进程。
miRNA本身不编码蛋白,它通过与靶基因的mRNA互补结合调控mRNA的翻译环节,结合方式包括:与靶基因mRNA 3’-UTR序列结合,形成复合体,阻断靶基因的翻译;与靶基因mRNA互补结合,对靶基因mRNA产生切割效应,降低mRNA的稳定性[11-14]。为了进一步探讨miR-152在卵巢癌干细胞球中的作用机制,本研究通过生物信息学网站(http://microran.sanger.ac.uk,http://www.targetscan.org/,http://pictar.bio.nyu.edu)预测Mirk/Dyrk1B可能是miR-152的靶基因,并进行了验证。结果证实,miR-152能够与Mirk/Dyrk1B的3’-UTR区域特异性结合,上调miR-152表达能够降低Mirk/Dyrk1B的表达水平,提示Mirk/Dyrk1B是miR-152的下游靶基因,上调miR-152能够抑制Mirk/Dyrk1B表达。同时,上调miR-152或直接下调Mirk/Dyrk1B表达均能增加卵巢癌干细胞球对紫杉醇的敏感性,在这一过程中,卵巢癌干细胞球中的耐药相关蛋白ABCG2、β-tublinⅢ、BRCA1表达水平下调,提示miR-152通过靶向Mirk/Dyrk1B影响卵巢干细胞化疗耐药。
Mirk/Dyrk1B基因定位于19q12-q13.11,在人类的睾丸组织中首次被发现[13-15]。Mirk/Dyrk1B只在人类的肌肉和脑组织中表达,其他正常组织中不表达,但在胰腺癌、结肠癌、卵巢癌等多种恶性肿瘤中高表达[15-18]。过表达Mirk/Dyrk1B可以下调细胞内的活性氧簇(reactive oxygen species,ROS)水平,促进细胞存活。下调Mirk/Dyrk1B表达会使细胞内的ROS水平升高,细胞在高ROS的作用下活性降低,增殖及克隆能力下降,进而死亡[18-21]。此外,Mirk/Dyrk1B能够诱导肿瘤细胞进入静止期,使其免受以分裂细胞群为靶点的化疗药物的杀伤作用[21-22]。或通过激活mTOR/AKT信号转导通路发挥细胞毒性作用[23]。Mirk/Dyrk1B可能通过类似的机制影响卵巢癌干细胞的化疗耐药进程。
综上,本研究证明miR-152可以靶向Mirk/Dyrk1B调控人卵巢癌干细胞球对紫杉醇的敏感性。miR-152与Mirk/Dyrk1B可作为卵巢癌治疗的潜在靶点,针对两者设计有效的靶向治疗药物有望提高卵巢癌患者对紫杉醇的敏感性,进而提高卵巢癌患者的5年生存率,改善预后。
| [1] |
LAPIDOT T, SIRARD C, VORMOOR J, et al. A cell initiating human a-cute myeloid leukaemia after transplantation into SCID mice[J]. Nature, 1994, 367(6464): 645-648. DOI:10.1038/367645a0 |
| [2] |
REYA T, MORRISON SJ, CLARKE MF, et al. Stem cells, cancer, and cancer stem cells[J]. Nature, 2001, 414(6859): 105-111. DOI:10.1038/35102167 |
| [3] |
ZHANG YJ, LIU XC, DU J, et al. miR-152 regulates metastases of non-small cell lung cancer cells by targeting neuropilin-1[J]. Int J Clin Exp Pathol, 2015, 8(11): 14235-14240. |
| [4] |
ZHAI R, KAN X, WANG B, et al. miR-152 suppresses gastric cancer cell proliferation and motility by targeting CD151[J]. Tumour Biol, 2014, 35(11): 11367-11373. DOI:10.1007/s13277-014-2471-2 |
| [5] |
THEODORE SC, DAVIS M, ZHAO F, et al. MicroRNA profiling of novel African American and Caucasian prostate cancer cell lines reveals a reciprocal regulatory relationship of miR-152 and DNA methyltranferase1[J]. Oncotarget, 2014, 5(11): 3512-3525. DOI:10.18632/oncotarget.1953 |
| [6] |
HUANG H, HU M, LI P, et al. miR-152 inhibits cell proliferation and colony formation of CD133(+) liver cancer stem cells by targeting KIT[J]. Tumour Biol, 2015, 36(2): 921-928. DOI:10.1007/s13277-014-2719-x |
| [7] |
ZHOU X, ZHAO F, WANG ZN, et al. Altered expression of miR-152 and miR-148a in ovarian cancer is related to cell proliferation[J]. Oncol Rep, 2012, 27(2): 447-454. DOI:10.3892/or.2011.1482 |
| [8] |
LI LW, XIAO HQ, MA R, et al. miR-152 is involved in the proliferation and metastasis of ovarian cancer through repression of ERBB3[J]. Int J Mol Med, 2018, 41(3): 1529-1535. DOI:10.3892/ijmm.2017.3324 |
| [9] |
QIN W, XIE W, HE Q, et al. MicroRNA-152 inhibits ovarian cancer cell proliferation and migration and may infer improved outcomes in ovarian cancer through targeting FOXP1[J]. Exp Ther Med, 2018, 15(2): 1672-1679. DOI:10.3892/etm.2017.5529 |
| [10] |
HE J, YU JJ, XU Q, et al. ATG14 by EGR1-MIR152 sensitizes ovarian cancer cells to cisplatin-induced apoptosis by inhibiting cyto-protective autophagy[J]. Autophagy, 2015, 11(2): 373-384. DOI:10.1080/15548627.2015.1009781 |
| [11] |
LIU L, ZOU J, WANG Q, et al. Novel microRNAs expression of patients with chemotherapy drug-resistant and chemotherapy-sensitive epithelial ovarian cancer[J]. Tumour Biol, 2014, 35(8): 7713-7717. DOI:10.1007/s13277-014-1970-5 |
| [12] |
REAM L, NORRIS L, SAADEH FA, et al. A novel serum microRNA panel to discriminate benign from malignant ovarian disease[J]. Cancer Lett, 2015, 356(28): 628-636. DOI:10.1016/j.canlet.2014.10.010 |
| [13] |
LEDER S, WEBER Y, ALTAFAJ X, et al. Cloning and characterization of Dyrk1B, a novel member of the DYRK family of protein kinases[J]. Biochem Biophys Res Commun, 1999(2): 474-479. DOI:10.1006/bbrc.1998.9967 |
| [14] |
BAGGA S, BRACHT J, HUNTER S, et al. Regulation by let -7 and lin-4 miRNAs results in target mRNA degradation[J]. Cell, 2005, 122(4): 553-563. DOI:10.1016/j.cell.2005.07.031 |
| [15] |
XIANG Y, MA N, WANG D, et al. miR-152 and miR-185 co-contribute to ovarian cancer cells cisplatin sensitivity by targeting DNMT1 directly:a novel epigenetic therapy independent of decitabine[J]. Oncogene, 2014, 33(3): 378-386. DOI:10.1038/onc.2012.575 |
| [16] |
DENG X, EWTON DZ, LI S, et al. The kinase Mirk/Dyrk1B mediates cell survival in pancreatic ductal adenocarcinoma[J]. Cancer Res, 2006, 66(8): 4149-4158. DOI:10.1158/0008-5472.CAN-05-3089 |
| [17] |
GAO J, ZHENG Z, RAWAL B, et al. Mirk/Dyrk1B, a novel therapeutic target mediates cell survival in non-small cell lung cancer cells[J]. Cancer Biol Ther, 2009, 8(17): 1671-1679. DOI:10.4161/cbt.8.17.9322 |
| [18] |
KELLAND IR. Preclinical perspectives on platinum resistance[J]. Drug, 2000, 59(4): 1-8. DOI:10.2165/00003495-200059004-00001 |
| [19] |
DENG X, FRIEDMAN E. Mirk kinase inhibition blocks the in vivo growth of pancreatic cancer cells[J]. Genes Cancer, 2014, 5(9/10): 337-347. DOI:10.18632/genesandcancer.29 |
| [20] |
JING H, EILEEN F. Depleting Mirk/Dyrk1B kinase increases cisplatin toxicity in ovarian cancer cells[J]. Genes Cancer, 2010, 1(8): 803-811. DOI:10.1177/1947601910377644 |
| [21] |
JING H, HOLLY D, FRIEDMAN EA. Ovarian cancer cells, not normal cells, are damaged by Mirk/Dyrk1B/Dyrk1B kinase Inhibition[J]. Int J Cancer, 2013, 132(10): 2258-2269. DOI:10.1002/ijc.27917 |
| [22] |
TIBERIO P, CAVADINI E, ABOLAFIO G, et al. 4-oxo-N-(4-hydroxyphenyl) retinamide:two independent ways to kill cancer cells[J]. PLoS One, 2010, 5(10): e13362. DOI:10.1371/journal.pone.0013362 |
| [23] |
SINGH R, DHANYAMRAJU PK, LAUTH M. DYRK1B blocks canonical and promotes non-canonical Hedgehog signaling through activation of the mTOR/AKT pathway[J]. Oncotarget, 2017, 8(1): 833-845. DOI:10.18632/oncotarget.13662 |
 2018, Vol. 47
2018, Vol. 47