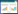文章信息
- 宋宠, 劳力军
- SONG Chong, LAO Lijun
- 神经节苷脂GD3和CD3+T淋巴细胞在胃癌中的表达及相关性研究
- Correlation between Ganglioside GD3 and CD3+T Lymphocyte Expression in Gastric Cancer
- 中国医科大学学报, 2018, 47(5): 435-438, 442
- Journal of China Medical University, 2018, 47(5): 435-438, 442
-
文章历史
- 收稿日期:2017-11-27
- 网络出版时间:2018-04-26 13:52
胃癌是我国常见的消化道恶性肿瘤之一,具有高发病率和高死亡率的特点[1]。目前对于胃癌的发病机制尚不明确,但既往研究[2]表明在胃癌的进展过程中,肿瘤细胞通过促进免疫细胞凋亡或降低免疫细胞功能,抑制机体对肿瘤的特异性免疫应答反应,产生免疫逃逸。T淋巴细胞作为一种重要的免疫活性细胞,直接参与细胞免疫并调节机体免疫应答。有研究[3]显示,在早期胃癌患者的外周血中增殖性T淋巴细胞数量高于进展期胃癌,表明胃癌的进展与T淋巴细胞减少有关。神经节苷脂是细胞膜的组成部分,可以从多种肿瘤细胞表面脱落。随着肿瘤恶性程度的增高,外周循环血中的神经节苷脂含量增加明显,提示神经节苷脂可能与肿瘤的发展关系密切[4]。实验研究[5-7]显示,肿瘤神经节苷脂能抑制T淋巴细胞功能,诱导T淋巴细胞凋亡。本研究通过免疫组织化学方法检测人胃癌及癌旁组织中神经节苷脂GD3和CD3+T淋巴细胞的表达,分析两者间的相关性并探讨其临床意义。
1 料与方法 1.1 一般资料选取2010年6月至2014年6月期间于锦州医科大学附属第一医院普外科经术前胃镜下取病变组织活检、术中病变组织病理检测被证实为胃癌的病例38例,其中男27例,女11例,年龄28~84岁,中位年龄59岁。38例患者术前均未进行化疗、放射治疗、免疫治疗等,临床信息完整。38例患者均经我院病理科2位资深医生双盲阅片诊断为胃溃疡型中—低分化腺癌。将胃癌肿瘤组织设为A组,将同一患者癌旁胃壁组织(距肿瘤边缘 > 5 cm,且病理证实无肿瘤细胞浸润)设为B组。全部病例排除胃部消化性溃疡病变及其他消化系统疾病。
1.2 主要试剂鼠抗人GD3单克隆抗体(ab11779,美国Abcam公司),鼠抗人CD3单克隆抗体(AB28005,美国Absci公司),山羊抗鼠二抗(ab6785,美国Abcam公司),浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司)。
1.3 研究方法手术中收集新鲜肿瘤标本,标本离体后切取肿瘤组织、癌旁胃壁组织(距肿瘤边缘 > 5 cm,且病理证实无肿瘤细胞浸润),将收集的组织用中性多聚甲醛固定,石蜡包埋,切片,行HE染色和免疫组织化学染色。鼠抗人GD3抗体和鼠抗人CD3抗体分别按1:200和1:100稀释。
1.4 结果判定 1.4.1 HE染色由2位资深病理科医生双盲阅片判定所取组织是否为胃癌组织和癌旁正常胃壁组织。
1.4.2 免疫组化染色GD3标记细胞膜或细胞质呈黄色为阳性细胞,呈圆形或者不规则形态;CD3标记细胞膜或细胞质呈黄色为阳性细胞,呈圆形或者不规则形态。A组低倍镜视野下选取癌巢密集区,取5个高倍镜(×400)视野计数。B组低倍镜视野下选取胃壁腺叶组织密集区,取5个高倍镜(×400)视野计数。按染色细胞所占比例与染色强度判定结果,依据染色细胞所占比例,< 5%计0分,5%~ < 25%计1分,25%~ < 50%计2分,≥50%计3分;依据染色强度,细胞无染色计0分,浅黄色计1分,棕黄色计2分,深棕色计3分。每张切片计分为染色细胞所占比例与染色强度之积,所得分数≥1为阳性,< 1为阴性。
1.5 统计学分析实验数据采用SPSS 17.0统计学软件进行统计分析。同一检测指标不同组间差异用χ2检验,神经节苷脂GD3与CD3+T淋巴细胞的表达相关性用Spearman秩相关性分析。P < 0.05为差异有统计学意义。
2 结果 2.1 HE染色经由2位资深病理科医生双盲阅片判定所取组织为胃癌组织和癌旁正常胃壁组织(距肿瘤边缘 > 5 cm)。见图 1。
|
| A,gastric cancer tissue;B,adjacent tissue. 图 1 HE染色结果×100 Fig.1 HE staining results ×100 |
2.2 免疫组化染色
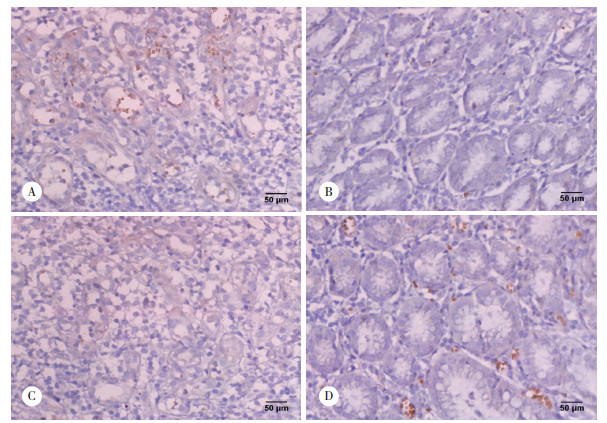
神经节苷脂GD3在胃癌组织和癌旁组织中的表达均定位于细胞膜及细胞质。胃癌组织和癌旁组织中的阳性表达率分别为81.58%(31/38)和28.95%(11/38),组间比较差异有统计学意义(χ2=21.289,P < 0.01),见图 2A、2B。
|
| A,GD3 expression in gastric cancer tissues;B,GD3 expression in adjacent tissues;C,CD3 expression in gastric cancer tissues;D,CD3 expression in adjacent tissues. 图 2 免疫组化染色结果×200 Fig.2 Immunohistochemical staining results ×200 |
CD3+T淋巴细胞在胃癌组织和癌旁组织中的阳性表达率分别为23.68%(9/38)和78.95%(30/38),组间比较差异有统计学意义(χ2=23.227,P < 0.01),见图 2C、2D。
2.3 神经节苷脂GD3与CD3+T淋巴细胞表达的相关性分析胃癌组织及癌旁组织中神经节苷脂GD3与CD3+T淋巴细胞表达的相关性,结果提示2种组织中两者的表达均呈负相关(胃癌组织:r = -0.744,P < 0.01;癌旁组织:r = -0.678;P < 0.01)。见表 1。
| CD3+T lymphocyte | Gastric cancer tissue(n) | Adjacent(n) | |||||
| GD3 positive | GD3 negative | Total | GD3 positive | GD3 negative | Total | ||
| Positive | 4 | 5 | 9 | 5 | 25 | 30 | |
| Negative | 27 | 2 | 29 | 6 | 2 | 8 | |
| Total | 31 | 7 | 38 | 11 | 27 | 38 | |
| r | -0.534 | -0.524 | |||||
| P | < 0.01 | < 0.01 | |||||
3 讨论
神经节苷脂是细胞膜的组成部分,是一种含有一个或多个唾液酸残基的鞘糖脂,参与细胞黏附、增殖、识别以及信号转导的调节[8]。近年来,研究[9]表明神经节苷脂可以从多种肿瘤细胞表面脱落,故而在肿瘤组织中表达明显增高,同时神经节苷脂在肿瘤发生、发展和转移的过程中具有重要作用。
YEH等[10]发现GD3和GD3合成酶在多形性胶质母细胞瘤干细胞中高度表达,可与CD133结合,提示其在胶质母细胞瘤致瘤性中起关键作用。恶性肿瘤的迁移和增殖取决于由肿瘤衍生的血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)触发的血管生成。TIPER等[11]研究表明肿瘤细胞脱落神经节苷脂可以引发强烈的VEGF受体二聚化和自磷酸化,降低血管内皮细胞血管生成信号传导的阈值,激活下游信号通路,有利于肿瘤血管生成。此后,LIU等[12]通过构建基因敲除肿瘤模型,发现基因敲除细胞几乎形成无血管肿瘤;添加纯化肿瘤神经节苷脂之后,基因敲除细胞接种物部分恢复了血管生成和肿瘤生长,进一步证实肿瘤神经节苷脂可以促进肿瘤血管生成。同样,CHUNG等[13]发现肿瘤脱落神经节苷脂在微环境中使巨噬细胞活化并分泌MCP-1以激活内皮细胞,从而加速肿瘤微环境中的血管生成,以促进肿瘤进展。王天然等[4]通过对神经节苷脂含量测定分析表明,肠癌患者血清中神经节苷脂显著增加,其诊断价值优于癌胚抗原。易珊等[14]检测肺癌、乳腺癌、胃癌和肠癌患者的唾液酸含量发现,4种癌组织中GD3均有较高的阳性表达率,可能成为这4种癌症临床检测的肿瘤标志物。本实验通过检测神经节苷脂GD3的表达,发现与癌旁组织相比,GD3在胃癌组织中的阳性表达率显著上升,差异有统计学意义。
在肿瘤的发展中,肿瘤细胞可以通过多种机制逃避机体免疫系统的识别和攻击,达到免疫逃逸,从而在体内生存和增殖[15]。在肿瘤免疫逃逸的众多机制中,肿瘤组织诱导的免疫抑制作用被广泛接受。研究发现神经节苷脂抑制细胞免疫应答的多个步骤,包括抗原呈递、T细胞的增殖和功能。
本研究通过检测并分析人胃癌组织及癌旁组织中神经节苷脂GD3与CD3+T淋巴细胞的含量,发现这2种组织中二者的表达水平呈负相关。有研究[16]显示,肿瘤神经节苷脂通过抑制核转录因子kB蛋白活化,干扰抗原呈递细胞功能,抵抗肿瘤免疫响应。肿瘤神经节苷脂可促进调节性T细胞活性,与肿瘤坏死因子α协同诱导T细胞凋亡[17]。同时,神经母细胞瘤衍生神经节苷脂能与肿瘤坏死因子受体相互作用,激活Caspases级联反应,诱导T细胞凋亡[7]。肿瘤神经节苷脂能够增加骨髓来源抑制细胞数量,促进其功能[18],包括直接抑制抗肿瘤细胞免疫应答,募集调节性T细胞和抑制效应T细胞浸润,促进肿瘤细胞的免疫逃逸[19-23]。同时,肿瘤衍生的神经节苷脂通过阻碍T细胞受体诱导的溶解性颗粒释放来抑制细胞毒性T细胞的溶解功能[24]。
综上所述,本研究发现胃癌组织中神经节苷脂GD3的表达水平高于癌旁组织,胃癌组织以及癌旁组织中神经节苷脂GD3与CD3+T淋巴细胞的表达呈负相关。神经节苷脂能够促进肿瘤血管生成、抑制免疫反应,促进肿瘤发生、发展和转移,其机制值得进一步深入研究。
| [1] |
张超, 王爱平, 景丽伟, 等. 胃癌患者焦虑状况与心理韧性及希望水平的相关性[J]. 中国医科大学学报, 2016, 45(8): 739-741, 753. DOI:10.12007/j.issn.0258-4646.2016.08.016 |
| [2] |
WANG M, BUSUTTIL RA, PATTISON S, et al. Immunological battlefield in gastric cancer and role of immunotherapies[J]. World J Gastroenterol, 2016, 22(28): 6373-6384. DOI:10.3748/wjg.v22.i28.6373 |
| [3] |
PENG LS, MAO FY, ZHAO YL, et al. Altered phenotypic and functional characteristics of CD3+CD56+ NKT-like cells in human gastric cancer[J]. Oncotarget, 2016, 7(34): 55222-55230. DOI:10.18632/oncotarget.10484 |
| [4] |
王天然, 许爱国, 李丽娟, 等. 肠道疾病患者血清神经节苷脂含量测定分析[J]. 四川医学, 2008, 29(12): 1705-1707. DOI:10.3969/j.issn.1004-0501.2008.12.058 |
| [5] |
INOKUCHI J, NAGAFUKU M, OHNO I, et al. Heterogeneity of gangliosides among T cell subsets[J]. Cell Mol Life Sci, 2013, 70(17): 3067-3075. DOI:10.1007/s00018-012-1208-x |
| [6] |
XU Y, CHEN L, XU B, et al. Higher numbers of t-bet+ tumor-infiltrating lymphocytes associate with better survival in human epithelial ovarian cancer[J]. Cell Physiol Biochem, 2017, 41(2): 475-483. DOI:10.1159/000456600 |
| [7] |
MAHATA B, BISWAS S, RAYMAN P, et al. GBM derived gangliosides induce T cell apoptosis through activation of the caspase cascade involving both the extrinsic and the intrinsic pathway[J]. PLoS One, 2015, 10(7): e0134425. DOI:10.1371/journal.pone.0134425 |
| [8] |
GROUX-DEGROOTE S, GUERARDEL Y, DELANNOY P. Gangliosides:structures, biosynthesis, analysis, and roles in cancer[J]. Chembiochem, 2017, 18(13): 1146-1154. DOI:10.1002/cbic.201600705 |
| [9] |
FABRIS D, ROZMAN M, SAJKO T, et al. Aberrant ganglioside composition in glioblastoma multiforme and peritumoral tissue:a mass spectrometry characterization[J]. Biochimie, 2017, 137: 56-68. DOI:10.1016/j.biochi.2017.03.001 |
| [10] |
YEH SC, WANG PY, LOU YW, et al. Glycolipid GD3 and GD3 synthase are key drivers for glioblastoma stem cells and tumorigenicity[J]. Proc Natl Acad Sci USA, 2016, 113(20): 5592-5597. DOI:10.1073/pnas.1604721113 |
| [11] |
TIPER IV, TEMKIN SM, SPIEGEL S, et al. VEGF Potentiates GD3-mediated immunosuppression by human ovarian cancer cells[J]. Clin Cancer Res, 2016, 22(16): 4249-4258. DOI:10.1158/1078-0432.CCR-15-2518 |
| [12] |
LIU Y, WONDIMU A, YAN S, et al. Tumor gangliosides accelerate murine tumor angiogenesis[J]. Angiogenesis, 2014, 17(3): 563-571. DOI:10.1007/s10456-013-9403-4 |
| [13] |
CHUNG TW, CHOI HJ, PARK MJ, et al. The function of cancer-shed gangliosides in macrophage phenotype:involvement with angiogenesis[J]. Oncotarget, 2017, 8(3): 4436-4448. DOI:10.18632/oncotarget.13878 |
| [14] |
易珊. 多聚唾液酸和三聚唾液酸在肺癌、乳腺癌、胃癌和肠癌中的表达及其意义[D]. 厦门大学, 2012: 1-72. http://cn.bing.com/academic/profile?id=67010c1869677558e0f200f7ebfadda0&encoded=0&v=paper_preview&mkt=zh-cn
|
| [15] |
张锦鹏, 李瑞超, 高轩, 等. 肿瘤免疫逃逸机制的研究进展[J]. 生命的化学, 2017, 37(3): 367-372. |
| [16] |
PARK J, KWAK CH, HA SH, et al. Ganglioside GM3 suppresses lipopolysaccharide-induced inflammatory responses in rAW 264.7 macrophage cells through NF-κB, AP-1, and MAPKs signaling[J]. J Cell Biochem, 2018, 119(1): 1173-1182. DOI:10.1002/jcb.26287 |
| [17] |
MIYATA M, ICHIHARA M, TAJIMA O, et al. UVB-irradiated keratinocytes induce melanoma-associated ganglioside GD3 synthase gene in melanocytes via secretion of tumor necrosis factor α and interleukin 6[J]. Biochem Biophys Res Commun, 2014, 445(2): 504-510. DOI:10.1016/j.bbrc.2014.02.038 |
| [18] |
WONDIMU A, LIU Y, SU Y, et al. Gangliosides drive the tumor infiltration and function of myeloid-derived suppressor cells[J]. Cancer Res, 2014, 74(19): 5449-5457. DOI:10.1158/0008-5472.CAN-14-0927 |
| [19] |
LIU Y, CHENG Y, XU Y, et al. Increased expression of programmed cell death protein 1 on NK cells inhibits NK-cell-mediated anti-tumor function and indicates poor prognosis in digestive cancers[J]. Oncogene, 2017, 36(44): 6143-6153. DOI:10.1038/onc.2017.209 |
| [20] |
GABRILOVICH DI, OSTRAND-ROSENBERG S, BRONTE V. Coordinated regulation of myeloid cells by tumours[J]. Nat Rev Immunol, 2012, 12(4): 253-268. DOI:10.1038/nri3175 |
| [21] |
TALMADGE JE, GABRILOVICH DI. History of myeloid-derived suppressor cells[J]. Nat Rev Cancer, 2013, 13(10): 739-752. DOI:10.1038/nrc3581 |
| [22] |
SCHLECKER E, STOJANOVIC A, EISEN C, et al. Tumor-infiltrating monocytic myeloid-derived suppressor cells mediate CCR5-dependent recruitment of regulatory T cells favoring tumor growth[J]. J Immunol, 2012, 189(12): 5602-5611. DOI:10.4049/jimmunol.1201018 |
| [23] |
LESOKHIN AM, HOHL TM, KITANO S, et al. Monocytic CCR2(+) myeloid-derived suppressor cells promote immune escape by limiting activated CD8 T-cell infiltration into the tumor microenvironment[J]. Cancer Res, 2012, 72(4): 876-886. |
| [24] |
LEE HC, WONDIMU A, LIU Y, et al. Ganglioside inhibition of CD8+ T cell cytotoxicity:interference with lytic granule trafficking and exocytosis[J]. J Immunol, 2012, 189(7): 3521-3527. DOI:10.4049/jimmunol.1201256 |
 2018, Vol. 47
2018, Vol. 47