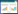文章信息
- 姜力铭, 宋戈, 夏商, 陈旭
- JIANG Liming, SONG Ge, XIA Shang, CHEN Xu
- 转化生长因子β1对人牙髓干细胞成纤维向分化的作用
- Effects of Transforming Growth Factor-β1 on the Fibrogenic Differentiation of Human Dental Pulp Stem Cells
- 中国医科大学学报, 2018, 47(5): 398-401, 405
- Journal of China Medical University, 2018, 47(5): 398-401, 405
-
文章历史
- 收稿日期:2017-11-24
- 网络出版时间:2018-04-26 13:36
牙髓组织是位于牙齿根管内的纤维结缔组织,富含神经、血管和淋巴。固有牙髓的细胞外基质由多种胶原和蛋白质组成,不仅可以保持牙髓三维结构的完整性,还能够调控细胞的相关基因表达[1]。然而,外伤、龋病、牙周炎等因素容易造成牙髓组织感染甚至坏死,导致牙齿易于折裂,因此如何促进牙髓组织再生成为亟待解决的问题[2-4]。有研究[5]证明,当牙本质受到外界因素刺激时可以分泌骨形态发生蛋白、转化生长因子β1(transforming growth facor-β1,TGF-β1)、血管内皮生长因子等多种生长因子,参与调控人牙髓干细胞(human dental pulp stem cells,hDPSCs)的迁移和分化。同时,hDPSCs受到刺激后会迁移至受损组织处参与组织修复[6]。
TGF-β1是一类多功能性细胞因子,参与调节细胞增殖、迁移、分化、凋亡和细胞外基质形成等多个环节。TGF-β1通过与细胞表面受体(TGF-β1 receptors,TβRI)结合并活化TβRI,激活丝氨酸苏氨酸激酶,引发Smad蛋白所调控的受体磷酸化,并与Smad4结合成复合体调控特定基因的转录[7-8]。TGF-β1的作用具有细胞特异性,依赖于TGF-β1信号通路中相关蛋白的浓度,同时又受其他协同或拮抗TGF-β1信号通路的其他通路的影响[9]。PIATTELLI等[10]发现在不可逆性牙髓炎中,炎症牙髓组织中的成牙本质细胞层高表达TGF-β1,提示TGF-β1对于炎症牙髓的牙本质修复具有重要意义。另有研究[11]表明,TGF-β1能够调节牙髓细胞的生长、胶原的合成以及胶原晶格的收缩,与细胞外基质形成密切相关。因此,本实验通过研究不同浓度的TGF-β1对hDPSCs增殖和成纤维分化功能的影响,探讨TGF-β1促进牙髓组织再生的可能性。
1 料与方法 1.1 材料α-MEM、胰蛋白酶(Hyclone公司,美国),胎牛血清(Gibco公司,美国),TGF-β1(PEPROTECH公司,美国),茜素红(Sigma公司,美国),RNA提取试剂盒(TaKaRa公司,日本),PCR引物(Eurofins公司,比利时)。
1.2 方法 1.2.1 hDPSCs的提取、培养和成骨/成脂分化鉴定选取无龋坏、牙髓炎、牙髓坏死及根尖周炎的健康正畸牙,拔除后置于含有抗生素的培养基中。用含100 U/mL的青霉素/链霉素的PBS冲洗牙齿。将牙齿劈开后,取出完整牙髓组织,置于离心管中,加入消化酶[Ⅰ型胶原酶(3 mg/mL): Ⅱ型分散酶(4 mg/mL) 1: 1],37 ℃放置30 min,每10 min斡旋1次。然后经70 µm细胞筛过滤后获得单细胞悬液,接种于培养皿,3~5代细胞用于后续实验。细胞培养21 d时,PBS冲洗细胞2次,4%甲醛溶液固定15 min后,去离子水冲洗2次,每孔加入1 mL茜素红溶液(20 g/L,pH4.2)染色20 min,去离子水冲洗4次,显微镜观察。将细胞以5×104/孔的密度接种于6孔板内,达80%融合后更换成脂诱导培养基培养,细胞培养至21 d时,油红O染色,观察脂滴形成情况。
1.2.2 MTT法检测TGF-β1对hDPSCs增殖活性的影响将hDPSCs以2×103/孔的密度接种于96孔板内,配置含TGF-β1浓度分别为1、5、10、20 ng/mL的α-MEM用于细胞(实验组)培养,以不含TGF-β1的α-MEM为对照组,每3 d换液1次,分别于第1、3、7天时,每孔加入噻唑蓝20 μL,37 ℃培养箱继续培养4 h,吸出培养液/噻唑蓝混合液,每孔加入100 μL二甲基亚砜,测试波长570 nm的吸光度值。
1.2.3 实时PCR将hDPSCs以5×104/孔的密度接种于6孔板内,配置含TGF-β1浓度分别为1、5、10、20 ng/mL的α-MEM(实验组)用于细胞培养,以不含TGF-β1的α-MEM为对照组,每3 d换液1次,分别于第7和14天提取细胞RNA,行RT-PCR,反应条件为95℃ 30 s预变性,95 ℃ 3 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。实验重复3次。引物序列见表 1。
| Gene | Primer sequence | Expected PCR product size(bp) |
| GAPDH | F: 5’-TTCTTTTGCGTCGCCAGCCGA-3’ | 96 |
| R: 5’-GTGACCAGGCGCCCAATACGA-3’ | ||
| Collagen I | F: 5’-TGCTGTTGGTGCTAAGGG-3’ | 177 |
| R: 5’-GCAATACCAGGAGCACCATTG-3’ | ||
| Fibronectin | F: 5’-TGTTCGTGCAGCTGTTTAC-3’ | 196 |
| R: 5’-GCCACCGTAAGTCTGGGTTA-3’ | ||
| Periostin | F: 5’-TTGAGACGCTGGAAGGAAAT-3’ | 199 |
| R: 5’-AGATCCGTGAAGGTGGTTTG-3’ | ||
| α-SMA | F: 5’-CCGGTTGGCCTTGGGGTTCAGGGGTGC-3’ | 733 |
| R: 5’-TCTCTCCAACCGGGGTCCCCCCTCCAGCG-3’ |
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析。计量资料用x±s表示,采用两独立样本t检验进行均数的比较,P < 0.05为差异有统计学意义。
2 结果 2.1 hDPSCs的培养和鉴定原代培养的hDPSCs贴壁生长,形态呈长梭形,类似成纤维细胞。经成骨诱导培养21 d后,细胞内可见明显的矿化结节形成,茜素红染色呈阳性。经成脂诱导液培养21 d后,可见脂滴形成,油红O染色呈阳性。见图 1。
|
| A,hDPSCs(×10);B,alizarin red straining(×10);C,oil red O staining(×40). 图 1 hDPSCs及其成骨/成脂分化能力 Fig.1 Osteogenic and adipogenic potentials of the cultured hDPSCs |
2.2 TGF-β1对hDPSCs增殖的影响
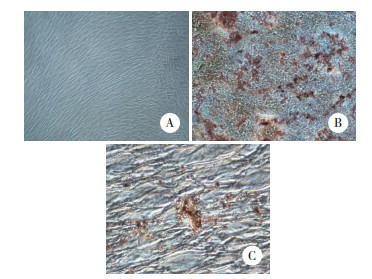
细胞分别经浓度为1、5、10和20 ng/mL的TGF-β1处理1、3和7 d后进行MTT检测。结果显示,第1天时实验组和对照组的吸光度值无统计学差异;第3天时10 ng/mL组和20 ng/mL组的吸光度值低于对照组,差异有统计学意义(P < 0.05),表明高浓度TGF-β1能抑制hDPSCs增殖;第7天时,1 ng/mL组和5 ng/mL组吸光度值高于对照组,差异有统计学意义(P < 0.05),另外2个浓度的实验组与对照组间无统计学差异。说明低浓度TGF-β1能促进hDPSCs的增殖。见图 2。
|
| * P < 0.05 vs control. 图 2 不同浓度TGF-β1对hDPSCs增殖的影响 Fig.2 Effects of the different concentrations of TGF-β1 on the proliferation of hDPSCs |
2.3 TGF-β1对hDPSCs成纤维分化的影响
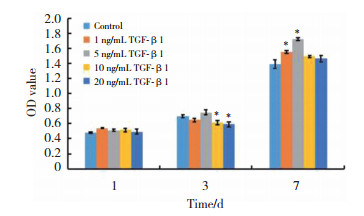
第7天时,1、5和10 ng/mL组的Collagen I表达水平分别为对照组的8.2倍、9.3倍和8.1倍,α-SMA的表达水平分别为对照组的6.2倍、6.7倍和5.8倍。各实验组Periostin的表达水平均明显高于对照组,其中5 ng/mL和10 ng/mL组的Periostin表达水平为1 ng/mL和20 ng/mL的3.2倍和1.8倍(P < 0.05)。10 ng/mL组的Fibronectin表达水平为对照组的5.5倍,比1 ng/mL组、5 ng/mL组和20 ng/mL组分别高5.3倍、1.39倍和1.7倍。第14天时,各实验组Collagen I、Fibronectin、Periostin和α-SMA表达水平均有下降,但仍高于对照组。5 ng/mL组Fibronection表达水平最高,为对照组的3.6倍,10 ng/mL组Periostin表达水平最高,为对照组的10.4倍。见图 3。
|
| A,Collagen I;B,α-SMA;C,Fibronection;D,Periostin. * P < 0.05 vs control. 图 3 不同浓度TGF-β1诱导hDPSCs成纤维分化相关因子mRNA的表达 Fig.3 mRNA expression levels of fibrogenic-related factors in the hDPSCs induced by TGF-β1 |
3 讨论
KIM等[12]研究发现TGF-β1通过调控转录调控受体因子1促进间充质干细胞的增殖。有学者[13]将浓度分别为0、1、5和10 ng/mL的TGF-β1加入骨髓间充质干细胞12 h后,通过细胞计数、MTT和RT-PCR检测细胞增殖相关因子(P53、Mdm2、Akt1、Wnt3、Phospho-Akt和β-catenin等)的表达情况,结果表明各实验组的细胞数量均高于对照组,Mdm2、Akt1、Wnt3、Phospho-Akt和β-catenin的表达增强,P53的表达受到抑制,证明了低浓度的TGF-β1可以促进骨髓间充质干细胞的增殖。另有研究[14]证实,与低浓度TGF-β1(< 5 ng/mL)相比,高浓度的TGF-β1(> 25 ng/mL)处理脂肪干细胞14 d时可明显促进其增殖。TGF-β1对不同类型的干细胞均有促进增殖的作用,但有效浓度和时间依赖性差异较大。本研究结果发现,TGFβ1处理hDPSCs第3天时,低浓度组(1 ng/mL和5 ng/mL)与对照组细胞增殖情况无显著差异,高浓度组(10 ng/mL和20 ng/mL)细胞生长受到抑制,第7天时,低浓度组活细胞数量明显高于对照组和高浓度组。
牙髓细胞主要由成纤维细胞组成,成纤维细胞可以分泌CollagenⅠ、CollagenⅢ、Fibronectin、骨黏连蛋白、骨涎蛋白和蛋白多糖[6]。有研究[1]发现,与脱落乳牙干细胞相比,hDPSCS分泌的细胞外基质中CollagenⅠ的表达水平更高,Fibronectin在2种细胞中的表达无显著差异。本研究结果中,TGF-β1能够显著促进hDPSCs表达牙髓组织的标志性细胞外基质Collagen I和Fibronectin,在处理浓度为5 ng/mL时效果尤为显著。
Periostin又名骨母细胞特异性因子2,相对分子量为93 300,存在于牙周膜内。它可以影响胶原纤连蛋白的合成和牙周膜成纤维细胞的增殖和迁移,在保持组织功能、完整性和强度方面起重要作用[15-16]。研究[17]证实Periostin也存在于包括牙髓在内的多种组织中。WIESEN等[18]用10 ng/mL和20 ng/mL的TGF-β1分别作用于hDPSCs、人牙髓成纤维细胞和鼠MDPC-23成骨细胞样细胞,发现TGF-β1可明显促进hDPSCs表达Periostin,而下调人牙髓成纤维细胞中Periostin的表达。本研究发现5 ng/mL和10 ng/mL TGF-β1组可以显著提高hDPSCs的Periostin表达水平。
血管形成是牙髓组织修复的关键性指标,α-SMA是血管平滑肌细胞的标记物之一。XU等[19]将荧光标记的骨髓来源干细胞注射入小鼠牙髓摘除术动物模型中用于观察牙髓组织再生情况,术后8周牙齿切片的免疫荧光分析可见牙髓干细胞、成骨细胞和血管平滑肌细胞相关标记物α-SMA的表达,证明了移植的骨髓来源干细胞具有新生血管的能力并可以形成牙髓样组织。本研究结果显示,TGF-β1可以明显促进hDPSCs表达α-SMA。
牙髓组织再生是一个极其复杂的过程,首先形成凝血块,激活血小板并释放多种细胞因子和生长因子,随后免疫细胞迁移至组织受损处,自身干细胞收到刺激信号后也会迁移至组织损伤处,通过细胞增殖、分化并分泌细胞外基质参与组织修复和再生。关于牙髓组织再生和修复的研究,除了模拟体内微环境诱导hDPSCs形成牙髓样组织之外,如何诱导hDPSs向神经细胞和血管内皮细胞分化,使新生的牙髓样组织恢复神经反应和营养供给亦是牙髓再生的重要研究方向。本研究初步探索了TGF-β1促进hDPSCs向成纤维细胞分化的可能性,对牙髓及牙周膜等纤维结缔组织的再生具有一定的理论意义。
| [1] |
SP HM, IRINA K, MARANDUBA C, et al. Expression of extracellular matrix proteins in human dental pulp stem cells depends on the donor tooth conditions[J]. J Endod, 2010, 36(5): 826-831. DOI:10.1016/j.joen.2010.02.020 |
| [2] |
KUANG R, ZHANG Z, JIN X, et al. Nanofibrous spongy microspheres for the delivery of hypoxia-primed human dental pulp stem cells to regenerate vascularized dental pulp[J]. Acta Biomater, 2016, 33: 225-234. DOI:10.1016/j.actbio.2016.01.032 |
| [3] |
GAUTAM S, GALGALI SR, SHEETHAL HS, et al. Pulpal changes associated with advanced periodontal disease:a histopathological study[J]. J Oral Maxillofac Pathol, 2017, 21(1): 58-63. DOI:10.4103/0973-029X.203795 |
| [4] |
马学娟, 陈旭. 牙源性干细胞应用于牙髓牙本质再生研究进展[J]. 中国实用口腔科杂志, 2017, 10: 635-638. DOI:10.19538/j.kq.2017.10.014 |
| [5] |
ROMBOUTS C, JEANNEAU C, BAKOPOULOU A, et al. Dental pulp stem cell recruitment signals within injured dental pulp tissue[J]. Dent J, 2016, 4(2): 8. DOI:10.3390/dj4020008 |
| [6] |
TATULLO M, MARRELLI M, SHAKESHEFF KM, et al. Dental pulp stem cells:function, isolation and applications in regenerative medicine[J]. J Tissue Eng Regen Med, 2015, 9(11): 1205-1216. DOI:10.1002/term.1899 |
| [7] |
KUBICZKOVA L, SEDLARIKOVA L, HAJEK R, et al. TGF-β-an excellent servant but a bad master[J]. J Transl Med, 2012, 10: 183. DOI:10.1186/1479-5876-10-183 |
| [8] |
ZHAO R, LI N, XU J, et al. Quantitative single-molecule studyt of TGF-β/Smad signaling[J]. Acta Biochim Biophys Sin (Shanghai), 2018, 50(1): 51-59. DOI:10.1093/abbs/gmx121 |
| [9] |
DIJKE PT, HILL CS. New insights into TGF-β-Smad signaling[J]. Trends Biochem Sci, 2004, 29(5): 265-273. DOI:10.1016/j.tibs.2004.03.008 |
| [10] |
PIATTELLI A, RUBINI C, FIORONI M, et al. Transforming growth factor-beta 1(TGF-beta1) expression in normal healthy pulps and in those with irreversible pulpitis[J]. Int Endod J, 2004, 37(2): 114-119. DOI:10.1111/iej.2004.37.issue-2 |
| [11] |
CHAN CP, LAN WH, CHANG MC, et al. Effects of TGF-beta s on the growth, collagen synthesis and collagen lattice contraction of human dental pulp fibroblasts in vitro[J]. Arch Oral Biol, 2005, 50(5): 469-479. DOI:10.1016/j.archoralbio.2004.10.005 |
| [12] |
KIM W, BARRON DA, SAN MR, et al. RUNX1 is essential for mesenchymal stem cell proliferation and myofibroblast differentiation[J]. Proc Natl Acad Sci USA, 2014, 111(46): 16389-16394. DOI:10.1073/pnas.1407097111 |
| [13] |
ZHANG F, REN T, WU J, et al. Small concentrations of TGF-β1 promote proliferation of bone marrow-derived mesenchymal stem cells via activation of Wnt/β-catenin pathway[J]. Indian J Exp Biol, 2015, 53(8): 508-513. |
| [14] |
JOSH F, TOBITA M, TANAKA R, et al. Concentration of PDGFAB, BB and TGF-β1 as valuable human serum parameters in adipose-derived stem cell proliferation[J]. J Nippon Med Sch, 2013, 80(2): 140-147. DOI:10.1272/jnms.80.140 |
| [15] |
HAMILTON DW. Functional role of periostin in development and wound repair:implications for connective tissue disease[J]. J Cell Commun Signal, 2008, 2(1/2): 9-17. DOI:10.1007/s12079-008-0023-5 |
| [16] |
CONWAY SJ, IZUHARA K, KUDO Y, et al. The role of periostin in tissue remodeling across health and disease[J]. Cell Mol Life Sci, 2014, 71(7): 1279-1288. DOI:10.1007/s00018-013-1494-y |
| [17] |
ZHOU M, KAWASHIMA N, SUZUK N, et al. Periostin is a negative regulator of mineralization in the dental pulp tissue[J]. Odontology, 2015, 103(2): 152-159. DOI:10.1007/s10266-014-0152-7 |
| [18] |
WIESEN RM, PADIAL-MOLINA M, VOLK SL, et al. The expression of periostin in dental pulp cells[J]. Arch Oral Biol, 2015, 60(5): 760-767. DOI:10.1016/j.archoralbio.2015.02.008 |
| [19] |
XU W, JIANG S, CHEN Q, et al. Systemically transplanted bone marrow-derived cells contribure to dental pulp regeneration in a chimeric mode[J]. J Endod, 2016, 42(2): 263-268. DOI:10.1016/j.joen.2015.10.007 |
 2018, Vol. 47
2018, Vol. 47