文章信息
- 杨帆, 陈英剑, 吴艳花, 胡成进
- YANG Fan, CHEN Yingjian, WU Yanhua, HU Chengjin
- 人激肽释放酶相关肽10 ELISA方法建立及其临床应用
- Establishment of a Method for Detecting Kallikrein 10 in the Serum and Its Clinical Application
- 中国医科大学学报, 2018, 47(4): 299-304
- Journal of China Medical University, 2018, 47(4): 299-304
-
文章历史
- 收稿日期:2017-06-16
- 网络出版时间:2018-04-09 11:15
2. 济南军区总医院实验诊断科, 济南 250031
2. Department of Laboratory Medicine, General Hospital of Jinan Military Command Region, Jinan 250031, China
人激肽释放酶(kallikreins,KLKs)基因表达一组在调节正常生理功能中具有重要作用的丝氨酸蛋白酶,是近年来发现的一类对肿瘤诊断和预后颇具潜力的标志物家族。该家族共包括15个基因(KLK1~KLK15),分别编码含230个氨基酸的人KLKs相关肽(KLK1~KLK15) [1],越来越多的研究[2-5]证明其与肿瘤发生发展具有密切相关性。KLK10基因也称NSE1基因,免疫定位于细胞质,无组织特异性[6],编码含276个氨基酸的丝氨酸蛋白酶—KLK10[7],目前研究未发现其蛋白酶活性[8]。研究[9-12]表明KLK10 mRNA及相关肽的表达异常与乳腺癌、卵巢癌等恶性肿瘤的发生发展密切相关[13-16],其中CpG岛甲基化导致KLK10 mRNA的沉默是肿瘤发生发展的重要环节。国外研究[17]报道KLK10与乳腺癌浸润具有相关性,KLK10的表达缺失可以作为乳腺原位癌发展为浸润性导管癌的指征之一,且出现KLK10甲基化乳腺癌患者比未出现KLK10甲基化患者的预后差[18],表明KLK10有潜力成为乳腺肿瘤预后的标志物。LUO等[19-20]还发现KLK10与乳腺癌患者三氧苯胺和曲妥珠单抗的个体化治疗具有相关性,可作为其耐药的预测标记物。本研究拟建立KLK10血清学检测方法,进而快速测定血清KLK10含量,为临床和后续研究奠定基础。
1 材料与方法 1.1 研究对象及分组收集济南军区总医院甲状腺乳腺外科2015年至2016年收治的女性乳腺癌患者血清标本80例,平均年龄(42±3.7)岁。参照TNM分期系统和乳腺癌分子分型新方法[18],分为乳腺导管内癌、浸润性乳腺癌;其中浸润性乳腺癌又分为Luminal A型、Luminal B型、HER-2-rich型、三阴型。根据病理学淋巴结转移情况分为转移组和未转移组。同期收集济南军区总医院女性乳腺良性病患者血清标本50例,平均年龄(43±4.1)岁。乳腺癌患者及乳腺良性病标本均经术后病理学确诊,术前均未进行临床治疗。另收集济南军区总医院女性健康体检血清50例作为对照组,入选标准为既往无乳腺癌等乳腺相关疾病,体检未见其他恶性疾病。平均年龄(44±5.4)岁。3组年龄差异无统计学意义(P﹥0.05),具有可比性。
研究对象均清晨空腹采血,采集静脉血(5 mL),3 000 r /min离心5 min分离血清,置于-80 ℃冰箱保存。
1.2 材料 1.2.1 实验菌/细胞株与动物Rosetta (DE3)菌株购自TIANGEN公司;BALB/c小鼠均为SPF级,雌性,6~8周龄,购买于山东大学实验动物中心(许可证号:SCXK20150008)。新西兰大白兔,雄性,2.5~3 kg,购买于济南西岭角养殖繁育基地(许可证号:SCXK20150001)。
1.2.2 实验主要试剂弗氏佐剂购自Sigma-Aldrich公司;IMAC Ni-Charged Resin购自美国伯乐BIO-RAD公司;双色预染蛋白质Marker (MP203),Bradford蛋白质定量试剂盒购自TIANGEN公司;Protein A IgG纯化试剂盒购自Thermo Fisher Scientific公司;Glue B型活化辣根过氧化物酶购自泰天河生物技术有限公司。
1.2.3 实验仪器全自动酶标洗板机购自上海汇松科技有限公司;低温高速离心机购自德国Eppendorf公司;恒温金属浴购自博科生物有限公司;超声破碎机购自宁波新芝生物科技有限公司;680酶联免疫检测仪购自美国BIO-RAD公司。
1.3 方法 1.3.1 KLK10重组蛋白制备将含有KLK10 cDNA序列的pET28a载体导入E.coli Rosetta (DE3)中培养。加入1 mmol/L IPTG在28 ℃诱导8 h后收集菌体,利用超声破碎仪裂解菌体获得裂解上清,采用Ni-NTA亲和层析的方法纯化裂解上清,得到KLK10重组蛋白。利用SDS-PAGE和Western blotting对重组蛋白进行鉴定,通过Bradford蛋白定量方法检测KLK10重组蛋白浓度。
1.3.2 KLK10单克隆/多克隆抗体制备采用杂交瘤技术诱生富含KLK10单克隆抗体(monoclonal antibody,mAb)的小鼠腹水,利用KLK10重组蛋白免疫雄性新西兰大白兔获得抗血清[21]。蛋白A纯化柱纯化腹水及抗血清,获得KLK10单克隆/多克隆抗体(polyclonal antibody,pAb)。
1.3.3 KLK10 ELISA检测方法建立Clue B型活化辣根过氧化物酶标记KLK10多克隆抗体,7.5 μg/mL KLK10单抗100 μL 4 ℃包被过夜;次日洗涤,洗涤后扣干孔内残留液体;每孔加入含4%牛血清白蛋白(BSA) 200 μL,置37 ℃封闭2 h后洗涤;将浓度为0、3.125、6.25、12.5、25、50、100 ng/mL的KLK10重组蛋白和血清样本分别加入包被微孔中,每孔100 μL,每例标本均设置1个复孔,37 ℃孵育1 h后洗涤;将酶标多抗按1:800的比例稀释,每孔100 μL,37 ℃孵育30 min后洗涤,去除未结合的酶结合物;向各反应孔内加入底物3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)各50 μL,37 ℃避光孵育10 min;每孔加入2 mol/L硫酸溶液50 μL终止反应;用酶标比色仪测定各孔在450 nm处的吸光度(A)值;以不同KLK10重组蛋白浓度和相应的A值绘制标准曲线,计算出血清标本中KLK10含量。
1.3.4 KLK10 ELISA检测方法评估(1)检测范围,检测下限和标准曲线检测最高值确定检测范围。(2)精密度,将2份不同血清样本同批连续测定8次,得到批内变异系数;将2份不同血清样本按照1次/d连续测定8 d,得到批间变异系数。(3)特异性,采用建立好的双抗体夹心ELISA检测方法对有可能的其他干扰因素或同源蛋白(BSA、KLK5、KLK6)进行检测,观察是否存在交叉反应。(4)重复性,选择标准曲线范围内的4个浓度(5、10、15、20 ng/mL)的KLK10重组蛋白,每个浓度反复测定6次,分析检测方法的重复性。(5)样品稳定性,将KLK10重组蛋白用PBS稀释至系列浓度,均分成3份,分别放置0、3和6 h后利用本方法检测,根据检测结果分别绘制标准曲线并进行比较。(6)样品回收率测定,将重组蛋白分别用PBS稀释至2、10、50、100 ng/mL,用本方法对样本进行检测,根据检测得到的OD450值和标准曲线计算出每个浓度的测定值,计算样品回收率。
1.3.5 血清CEA和CA153检测方法使用罗氏combs 6001全自动电化学发光分析检测仪检测乳腺癌组血清中CEA和CA153的含量。临界参考值分别为CEA 5 ng/mL和CA153 25 U/mL [22]。
1.4 统计学分析应用SPSS 21.0对数据进行统计学分析,所有指标均进行正态性检验,定量资料用x±s表示,差异性检验采用两独立样本t检验,定性资料的差异性检验采用列联表(R×C表)的χ2检验,当列联表中超过20%的理论频数 < 5时采用Fisher确切概率法或似然比。P < 0.05为差异有统计学意义。
2 结果 2.1 KLK10原核诱导表达及鉴定根据SDS-PAGE结果,KLK10原核诱导的最佳诱导条件为1 mmol/L IPTG在28 ℃条件下诱导8 h。通过SDS-PAGE和Western blotting对KLK10重组蛋白进行鉴定(图 1),可见32×103处明显条带,与KLK10重组蛋白分子量一致。KLK10纯化后重组蛋白浓度约为2 mg/mL。
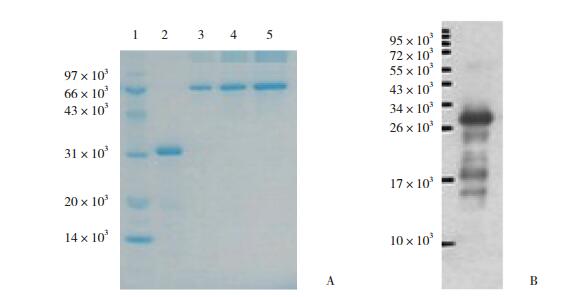
|
| 1, marker; 2, purified protein (1 μg); 3, BSA 0.5 μg; 4, BSA 1 μg; 5, BSA 2 μg. A, the SDS-PAGE of KLK10 recombinant protein; B, detection of anti -His-tag antibody of 0.5 g purified protein. 图 1 KLK10重组蛋白SDS-PAGE和Western blotting鉴定 Fig.1 SDS-PAGE and Western blotting of KLK10 recombinant protein |
2.2 pAb和mAb效价与浓度测定
采用间接酶联免疫吸附法测定pAb和mAb的效价,分别以磷酸盐缓冲液、免疫前静脉血清作为对照,测定450 nm处的吸光值,判定P/N≥2.1时的最大稀释度为抗体效价。结果显示,pAb和mAb的效价分别为1:107,1:106。通过Bradford蛋白定量方法检测纯化后pAb和mAb的浓度,分别为1.2、10.1 mg/mL。
2.3 确定最佳工作条件单克隆抗体和酶标多抗的最佳工作条件:单抗包被浓度为7.5 μg/mL,酶标多抗工作浓度为1:800。
2.4 绘制KLK10蛋白浓度标准曲线测定KLK10蛋白浓度(100、50、25、12.5、6.25、3.125、0 ng/mL)与其相应的A值绘制标准曲线,见图 2。直线回归方程:y=0.008 3x+0.198 3 (R2 > 0.99),线性范围为0.2~200 ng/mL。
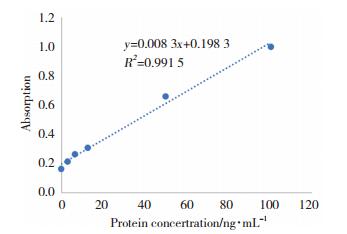
|
| 图 2 酶联免疫法标准曲线 Fig.2 Standard curve of ELISA |
2.5 方法学评价 2.5.1 检测下限
最低检测线是测量出的最低标准品检测浓度±2SD得到的浓度,确定为本方法的检测下限为0.245 ng/mL。
2.5.2 精密度分别检测批内及批间样本来判断该方法的精密度,批内平均变异系数为4%~9%,批间平均变异系数为5%~8%。
2.5.3 特异性检测发现本检测方法对于KLK10高度同源的KLK5和KLK6的检测结果随着浓度的增高存在波动,但2者的波动并不存在固定的趋势,且反应程度与浓度无关,因此该检测方法与两者无交叉反应。
2.5.4 重复性6次测定4个浓度(5、10、15、20 ng/mL)的KLK10重组蛋白相对标准差,分别为3.24%、4.55%、4.78%、5.69%,证明重复性良好。
2.5.5 样品回收率检测不同浓度的KLK10重组蛋白,将得出的OD450值代入标准曲线,计算出相应的浓度,计算回收率并进行对比,结果显示样品回收率较好。见表 1。
| PC(ng/mL) | DC(ng/mL) | Recovery (%) | RSD (%) |
| 2 | 1.73±0.57 | 92 | 28 |
| 10 | 10.25±1.21 | 101 | 21 |
| 50 | 46.82±5.64 | 89 | 25 |
| 100 | 102.35±15.64 | 98 | 23 |
| PC,protein concentration;DC:determination concentration;RSD,relative standard deviation. | |||
2.6 临床应用 2.6.1 定量检测样本血清中KLK10含量
乳腺癌患者、乳腺良性病患者、健康对照组血清中KLK10的检测结果分别为(0.88±0.45)、(1.35±0.56)、(1.57±0.88) ng/mL,乳腺癌患者血清KLK10含量明显低于乳腺良性患者和健康对照组(P= 0.025),乳腺良性患者和健康对照组比较无统计学差异(P= 0.134)。根据ROC曲线得到cut-off值为1.48 ng/mL,将KLK10含量低于cut-off值判定为阳性。80例乳腺癌患者中有58例低于阈值,KLK10检测灵敏性为72.5%,特异性为88%,Youden指数(正确诊断指数)为0.605。
2.6.2 血清KLK10含量与乳腺癌临床指标相关分析结果显示,KLK10含量与临床分期相关(P < 0.05),而与病理学分型以及转移情况不相关(P > 0.05),见表 2。
| Index | n | KLK10 (﹢) | KLK10 (-) | P | |||
| n | PP(%) | n | PP(%) | ||||
| Stage | 0.013 | ||||||
| Ⅰ | 26 | 9 | 34.6 | 17 | 65.4 | ||
| Ⅱ | 44 | 35 | 79.5 | 9 | 20.5 | ||
| Ⅲ | 10 | 10 | 100.0 | 0 | 0.0 | ||
| Molecular type | 0.276 | ||||||
| Luminal A | 18 | 11 | 61.1 | 7 | 38.9 | ||
| Luminal B | 32 | 22 | 68.8 | 10 | 31.2 | ||
| HER2-rich (+) | 9 | 6 | 66.7 | 3 | 33.3 | ||
| Triple negative | 5 | 3 | 60.0 | 2 | 40.0 | ||
| Metastasis | 0.082 | ||||||
| Transfer | 18 | 15 | 83.3 | 3 | 16.7 | ||
| Non-transfer | 62 | 46 | 74.2 | 16 | 25.8 | ||
| KLK10 cut-off=1.48 μg/L;PP,percent point. | |||||||
2.6.3 KLK10与乳腺癌常用血清学标志物的比较
结果显示,KLK10对乳腺癌的诊断灵敏性、特异性、准确率以及Youden指数均较高(表 3),证明KLK10具有诊断乳腺癌的潜力。
| Indicator | KLK10 | CEA | CA153 |
| Sensitivity | 72.5 | 25.0 | 40.0 |
| Specificity | 88.0 | 96.0 | 98.0 |
| Accuracy | 78.4 | 52.3 | 62.3 |
| Youden index | 60.5 | 21.0 | 38.0 |
2.6.4 KLK10、CEA、CA153联合诊断的评价
结果显示,不同形式的组合均可提高诊断灵敏性和准确率,联合检测效果更好(表 4)。
| Item | Sensitivity | Specificity | Accuracy | Youden index |
| KLK10+CEA | 61.3 | 92.0 | 73.1 | 53.3 |
| KLK10+CA153 | 78.8 | 94.0 | 84.6 | 72.8 |
| CEA+CA153 | 43.8 | 98.0 | 64.6 | 41.8 |
| KLK10+CEA+CA153 | 81.3 | 96.0 | 86.9 | 77.3 |
3 讨论
乳腺癌是西方女性最常见的恶性肿瘤,我国发病率和病死率也呈现逐年增高的趋势[23]。目前国内乳腺癌诊断还是依靠影像学检查和病理诊断,两者费用较高,且对患者具有一定的危害。血清学检测是临床早期筛查、治疗、预后判断的常用方法,具有简便、成本低,可长期、动态监测疾病发展等优势。本研究建立了KLK10双抗体夹心ELISA检测试剂盒,并进行了方法学评估,证明该方法灵敏性和特异性较高,精密度、重复性和稳定性较好,可用于KLK10的定量分析。采用本方法检测血清KLK10含量发现,乳腺癌患者血清中KLK10的含量低于乳腺良性病患者和健康对照组(P < 0.05),证明KLK10在乳腺癌患者血清中表达降低;浸润性导管癌Ⅰ期和Ⅱ期患者血清中KLK10含量明显高于Ⅲ期患者(P < 0.05),证明KLK10的表达与肿瘤的浸润性有关,随着浸润的深入,表达逐渐受到抑制直至缺失,与此前KLK10 mRNA的研究结果一致[24]。经过分析发现血清KLK10含量与乳腺癌的临床分子分型和转移情况之间没有显著性差异(P > 0.05),证明血清KLK10的表达与雌激素、孕激素以及HER2+的表达不具有显著相关性(P > 0.05),由于本研究纳入的三阴型乳腺癌标本数量有限,因此不能完全确证KLK10不受体内激素调节,仍需加大样本量进行进一步确证。
目前临床上常用的乳腺癌血清标志物为CEA和CA153,研究[25-26]表明CEA和CA153在乳腺癌诊断中具有一定的临床价值,但单独应用于临床诊断时仍具有一定局限性。本研究发现KLK10对乳腺癌的诊断灵敏性、准确率和Youden指数均高于CEA和CA153,证明KLK10有潜力成为乳腺癌的新型血清标志物。联合诊断结果显示,不同形式的组合均可提高诊断灵敏性,且CA153和KLK10联合检测可提高灵敏性。而CEA、CA153和KLK10 3者联合检测的灵敏性、准确率和Youden指数升高幅度并不显著,临床意义不大。
综上所述,KLK10是一种非常有潜力的标志物,对临床乳腺癌的早期诊断和预后判断具有重要意义。
| [1] |
LUNDWALL A, BAND V, BLABER M, et al. A comprehensive nomenclature for serine proteases with homology to tissue kallikreins[J]. Biol Chem, 2006, 387(6): 637-641. DOI:10.1515/BC.2006.082 |
| [2] |
SOTIROPOULOU G, PAMPALAKIS G, DIAMANDIS EP. Functional roles of human kallikrein-related peptidases[J]. Biol Chem, 2009, 284(48): 32989-32994. DOI:10.1074/jbc.R109.027946 |
| [3] |
CLEMENTS JA, WILLEMSEN NM, MYERS SA, et al. The tissue kallikrein family of serine proteases:functional roles in human disease and potential as clinical biomarkers[J]. Crit Rev Clin Lab Sci, 2004, 41(3): 265-312. DOI:10.1080/10408360490471931 |
| [4] |
DORN J, BEAUFORT N, SCHMITT M, et al. Function and clinical relevance of kallikrein-related peptidases and other serine proteases in gynecological cancers[J]. Crit Rev Clin Lab Sci, 2014, 51(2): 63-84. DOI:10.3109/10408363.2013.865701 |
| [5] |
SCORILAS A, MAVRIDIS K. Predictions for the future of kallikrein-related peptidases in molecular diagnostics[J]. Expert Rev Mol Diagn, 2014, 14(6): 713-722. DOI:10.1586/14737159.2014.928207 |
| [6] |
PETRAKI CD, KARAVANA VN, LUO LY, et al. Human kallikrein 10 expression in normal tissues by immunohistochemistry[J]. J Histochem Cytochem, 2002, 50(9): 1247-1261. DOI:10.1177/002215540205000912 |
| [7] |
LUO LY, GRASS L, HOWARTH DJ, et al. Immunofluorometric assay of human kallikrein 10 and its identification in biological fluids and tissues[J]. Clin Chem, 2001, 47(2): 237-246. |
| [8] |
LI B, GOYAL J, DHAR S, et al. CpG methylation as a basis for breast tumor-specific loss of NES1/kallikrein 10 expression[J]. Cancer Res, 2001, 61(21): 8014-8021. |
| [9] |
GRIN A, SAMAAN S, TRIPATHI M, et al. Evaluation of human tissue kallikrein-related peptidases 6 and 10 expression in early gastroesophageal adenocarcinoma[J]. Hum Pathol, 2015, 46(4): 541-548. DOI:10.1016/j.humpath.2014.12.005 |
| [10] |
JIAO X, LU HJ, ZHAI MM, et al. Overexpression of kallikrein gene 10 is a biomarker for predicting poor prognosis in gastric cancer[J]. World J Gastroenterol, 2013, 19(48): 9425-9431. DOI:10.3748/wjg.v19.i48.9425 |
| [11] |
KOLIN DL, SY K, ROTONDO F, et al. Prognostic significance of human tissue kallikrein-related peptidases 6 and 10 in gastric cancer[J]. Biol Chem, 2014, 395(9): 1087-1093. DOI:10.1515/hsz-2014-0143 |
| [12] |
LUO LY, BUNTING P, SCORILAS A, et al. Human kallikrein 10:a novel tumor marker for ovarian carcinoma?[J]. Clin Chim Acta, 2001, 306(1/2): 111-118. |
| [13] |
ZHANG Y, BHAT I, ZENG M, et al. Human kallikrein 10, a predictive marker for breast cancer[J]. Biol Chem, 2006, 387(6): 715-721. DOI:10.1515/BC.2006.090 |
| [14] |
顾平, 盛世乐, 黄钢. 生物标志物在乳腺癌研究中的应用[J]. 上海交通大学(医学版), 2007, 127(11): 1396-2004. DOI:10.3969/j.issn.1674-8115.2007.11.030 |
| [15] |
EWAN KING L, LI X, CHEIKH SAAD BOUH K, et al. Human kallikrein 10 ELISA development and validation in breast cancer sera[J]. Clin Biochem, 2007, 40(13/14): 1057-1062. DOI:10.1016/j.clinbiochem.2007.05.008 |
| [16] |
YUNES MJ, NEUSCHATZ AC, BORNSTEIN LE, et al. Loss of expression of the putative tumor suppressor NES1 gene in biopsy-proven ductal carcinoma in situ predicts for invasive carcinoma at definitive surgery[J]. Int J Radiat Oncol Biol Phys, 2003, 56(3): 653-657. DOI:10.1016/S0360-3016(03)00068-3 |
| [17] |
GOLDHIRSCH A, WOOD WC, COATES AS, et al. Strategies for sub-types-dealing with the diversity of breast cancer:highlights of the St. Gallen international expert consensus on the primary therapy of early breast cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-1747. DOI:10.1093/annonc/mdr304 |
| [18] |
KIOULAFA M, KAKLAMANIS L, STATHOPOULOS E, et al. Kallikrein 10(KLK10) methylation as a novel prognostic biomarker in early breast cancer[J]. Ann Oncol, 2009, 20(6): 1020-1025. DOI:10.1093/annonc/mdr733 |
| [19] |
LUO LY, DIAMANDIS EP, LOOK MP, et al. Higher expression of human kallikrein 10 in breast cancer tissue predicts tamoxifen resist-ance[J]. Br J Cancer, 2002, 86(11): 1790-1796. DOI:10.1038/sj.bjc.6600323 |
| [20] |
阮贝鸿. 探索乳腺癌细胞系中曲妥珠单抗耐药相关的生物标志物[D]. 杭州: 浙江大学, 2016.
|
| [21] |
丁洁, 何杨, 杨剑锋, 等. 双抗体夹心ELISA测定人血浆可溶性血管内皮钙黏蛋白方法的建立及其应用研究[J]. 中国实验血液学杂志, 2017, 25(2): 562-566. DOI:10.7534/j.issn.1009-2137 |
| [22] |
BABLOK W, PASSING H, BENDER R, et al. A general regression procedure for method transformation. Application of linear regression procedures for method comparison studies in clinical chemistry, Part Ⅲ[J]. Clin Chem Clin Biochem, 1988, 26(11): 783-790. |
| [23] |
TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [24] |
LIU XL, WAZER DE, WATANABE K, et al. Identification of a novel serine protease-like gene, the expression of which is down-regulated during breast cancer progression[J]. Cancer Res, 1996, 56(14): 3371-3379. |
| [25] |
赵晶, 刘红, 张爱敏, 等. 乳腺癌患者血清可溶性肿瘤标志物的临床价值研究[J]. 中国肿瘤临床, 2008, 35(24): 1411-1414. DOI:10.3969/j.issn.1000-8179.2008.24.010 |
| [26] |
朱丽娜. 乳腺癌几种常用肿瘤标志物的研究意义[J]. 世界最新医学信息文摘, 2015, 15(71): 43. DOI:10.3969/j.issn.1671-3141.2015.71.025 |
 2018, Vol. 47
2018, Vol. 47




