文章信息
- 焦奥, 李晓航, 石悦, 吕武, 孙宁, 张城硕, 李峰, 张佳林
- JIAO Ao, LI Xiaohang, SHI Yue, LÜ Wu, SUN Ning, ZHANG Chengshuo, LI Feng, ZHANG Jialin
- 大鼠肝细胞与胰岛内皮细胞融合细胞系的建立及鉴定
- Establishment and Identification of a Fusion Cell Line Produced by Electrofusion of Rat Hepatocytes and Islet Endothelial Cells
- 中国医科大学学报, 2018, 47(4): 294-298
- Journal of China Medical University, 2018, 47(4): 294-298
-
文章历史
- 收稿日期:2017-09-21
- 网络出版时间:2018-04-09 11:14
肝脏组织工程是在体外构建仿生的肝组织,用于肝脏的替代治疗,但肝脏组织体积庞大、代谢异常活跃,没有血管输送氧气和养料就会迅速衰竭[1],所以肝脏组织工程血管化是亟待解决的问题。本研究通过细胞电融合法构建了一株由肝细胞系与胰岛内皮细胞融合而成的杂交细胞系BRL-ies。流式细胞仪鉴定结果显示,融合细胞体积、细胞内颗粒密度均显著增加,胞内DNA含量加倍。实时定量PCR及Western blotting检测结果显示,BRL-ies既表达肝组织特异性蛋白GS,又表达内皮细胞特异性抗原CD31。BRL-ies细胞的构建方法可为解决肝脏组织工程种子细胞血管化问题提供一个新思路。
1 材料与方法 1.1 材料 1.1.1 实验动物SD大鼠,雄性,体质量200~250 g,购自本溪长生生物公司。
1.1.2 细胞系大鼠肝细胞BRL-3A购于中国科学院细胞库。
1.1.3 设备细胞融合仪(宁波新芝电融合仪CRY-3B)。
1.1.4 试剂RPMI 1640、DMEM高糖培养基购于南京凯基公司;FBS胎牛血清购于美国Gibco公司;甲磺酸乙酯(ethyl methanesulfonate,EMS)、8-氮鸟嘌呤(8-azaguanine,8-AG)、HAT培养基添加剂、HT培养基添加剂、胶原酶Ⅴ型购于美国Sigma公司;D-Hanks、CCK-8试剂盒、细胞周期检测试剂盒购于上海碧云天公司。实时PCR相关试剂购于日本Takara公司。
1.2 方法 1.2.1 细胞培养大鼠肝细胞BRL-3A用含10% FBS的DMEM高糖培养基于37℃、5% CO2培养箱内培养。
1.2.2 BRL-3A细胞HGPRT缺陷型的构建及筛选按照文献[2]的方法,将BRL-3A细胞按2×105/孔铺入6孔板中。12 h后更换含500 μg/mL EMS的完全培养基培养基诱变24 h。之后在显微镜下观察,见半数漂浮死亡,PBS洗3次,更换普通培养基,连续培养72 h。待细胞汇合度达80%,更换含20 μg/mL 8-AG的完全培养基进行筛选。HGPRT缺陷型的BRL-3A细胞可在含8-AG的培养基中克隆增殖。
1.2.3 CCK-8检测细胞HAT敏感性细胞按5×103/孔铺入96孔板中,24 h后更换HAT培养基,此后每24 h使用CCK-8试剂盒检测对细胞活力进行检测,于酶标仪450 nm波长处读取各孔吸光度,绘制增殖曲线。
1.2.4 胰岛内皮细胞的准备及培养按照文献[3]的方法通过胆总管灌注法获取SD大鼠胰岛。通过密度梯度离心及反复手检法获取纯净胰岛。将胰岛至于15 mL离心管中离心沉降,弃上清,加入3 mL含0.05%胰蛋白酶及0.02% EDTA的消化液,后将离心管置于小型水浴锅中保持37℃,用一次性吸管对胰岛反复吹打10 min,获得单细胞悬液。随后立即加入1 mL FBS、10 mL D-Hanks溶液终止消化,离心后将胰岛单细胞悬浮于含10% FBS的RPMI-1640培养基于37℃、5% CO2培养箱中培养,培养24~48 h后移除悬浮细胞,贴壁细胞中有较多数量的胰岛内皮细胞。
1.2.5 细胞电融合方案及融合细胞的筛选将待融合细胞消化为单细胞,通过细胞计数板计数胰岛内皮细胞与BRL-3A H2细胞,按1:1比例将2种细胞混合后离心,使用电融合液(0.3 mmol/L葡萄糖,使用氢氧化钠调节pH值为7.2~7.4,滤器过滤除菌,4 ℃保存备用)洗涤混合细胞2次,离心后用适量电融合液重悬使细胞密度达到2×106/mL。电极(间距2 mm)使用75%乙醇浸泡30 min消毒,消毒后使用无菌蒸馏水洗涤,超净台内晾干备用。用移液器吸取80 μL细胞悬液于融合槽电极间,给予48 V、2 000 kHz成串脉冲持续60 s。随后立即停止成串脉冲,激活融合脉冲使细胞融合,融合脉冲的电压为400 V、幅度为20 μs。融合后的细胞重悬于无血清培养基中,离心去上清,加入含20% FBS的完全培养基,吹打均匀后扑铺入96孔板中。24 h后更换HAT培养基筛选48 h,随后更换HT培养基培养。
1.2.6 流式细胞仪鉴定融合细胞将BRL-3A H2与BRL-ies细胞消化为单细胞悬液,分别计数2×105细胞于1.5 mL离心管中,离心后用PBS洗涤。再次离心沉淀细胞,加入1 mL预冷70%乙醇,轻轻吹打混匀,4℃过夜。之后1 000 g离心3~5 min,沉淀细胞。加入约1 mL预冷的PBS,重悬细胞。再次离心沉淀细胞,每管细胞样品中加入0.5 mL碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37℃避光水浴30 min。随后冰浴备用,等待上机。
1.2.7 实时PCR检测将待测细胞按1×106/mL铺入6 cm培养皿中,培养24~48 h后,使用Trizol法提取细胞mRNA。反转录条件为37 ℃ 15 min,85 ℃ 5 min,4 ℃静置;扩增条件为预变性95 ℃ 30 s,PCR反应95 ℃ 5 s,60 ℃ 30 s,共40个循环。各引物由生工生物工程(上海)股份有限公司设计合成,引物序列如下。GAPDH,上游引物5’-TTCCTACCCCCAATGTATCCG-3’,下游引物5’-CATGAGGTCCACCACCCTGTT-3’;GS,上游引物5’-GTACTCTGGACTGTGACCCCA-3’,下游引物5’-TGGCTGCTCACCATGTCCATT-3’;CD31,上游引物5’-GAGGTGACAGAAGGTGGGATTG-3’,下游引物5’-TGGCAGCGAAACACTAACAGG-3’。
1.2.8 Western blotting将细胞(1×106)铺入6 cm培养皿,培养24~48 h,后用RIPA裂解液(包含PMSF)提取胞内蛋白,使用BCA法检测蛋白浓度,用裂解液配平各样品蛋白浓度,加入上样缓冲液,蛋白煮沸变性,-20 ℃保存。配置10% SDS-PAGE凝胶,取上述蛋白制品每孔上样20 μL,电泳后转至PVDF膜上,5%脱脂奶粉封闭1 h后加一抗室温孵育1 h后4 ℃过夜,一抗体浓度分别为GS (abcam ab49873) 1:1 000;CD31 (abcam ab28364) 1:1 000;β-Actin (proteintech) 1:1 000,第2天复温2 h后加二抗室温孵育1 h,最后加ECL发光液显影。
1.3 统计学分析应用Graphpad prism 6软件进行统计学处理及图表制作,采用x±s描述计量资料,组间差异比较采用t检验及单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 BRL-3A HGPRT缺陷型细胞具有较强的HAT敏感性经过EMS诱变及8-AG筛选,得到了抗8-AG的BRL-3A细胞株,通过单克隆共得到了3株BRL-3A HGPRT缺陷性细胞,分别命名为BRL-3A H1、BRL-3A H2、BRL-3A H3。CCK-8细胞活力检测发现,BRL-3A H2对HAT最为敏感,可在HAT作用48 h内彻底死亡,见图 1。优选BRL-3A H2细胞株进行融合实验。

|
| 图 1 CCK-8检测HGPRT缺陷型细胞HAT敏感性 Fig.1 HAT sensitivity testing by CCK-8 |
2.2 融合细胞的形态学观察
经过电融合及HAT筛选,得到了多种融合细胞,其中BRL-ies胞体巨大被首先发现,并通过克隆环克隆出来。其中BRL-3A H2细胞呈多角形(图 2A~C),BRL-ies细胞呈长梭形(图 2D~F)。形态学发生较显著变化。

|
| 图 2 BRL-3A H2细胞与BRL-ies细胞的光镜照片 Fig.2 Representative bright-field microscopy images of BRL-3A H2 and BRL-ies cells |
2.3 融合细胞的流式细胞仪分析
通过流式细胞仪检测发现,融合细胞BRL-ies的体积及胞内颗粒密度均与融合前的BRL-3A H2细胞存在统计学差异(P < 0.001),见图 3。其中,BRL-ies细胞的平均体积(FSC值)增大为BRL-3A H2细胞的1.55倍,胞内颗粒密度(SSC值)增大为BRL-3A H2细胞的1.91倍。除此之外,BRL-ies细胞胞内DNA含量加倍,见图 4A,证明BRL-ies是一株较为稳定的融合细胞。根据流式细胞仪结果分析,BRL-ies为四倍体细胞,其中四倍体状态占66.1%,八倍体占16.6%。BRL-3A H2细胞中二倍体状态占47%,四倍体32.8%,见图 4B、4C。
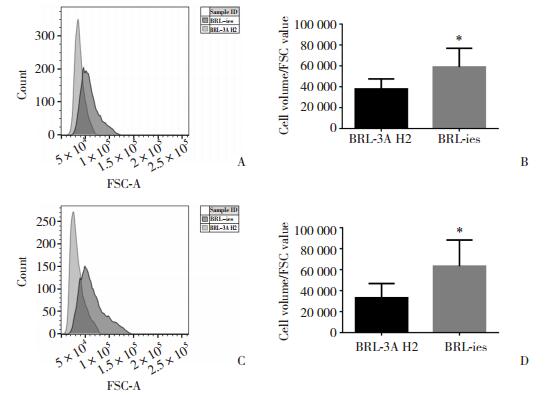
|
| A, FSC values detected by flow cytometry; B, histogram of FSC values; C, SSC values detected by flow cytometry; D, histogram of FSC values. *P < 0.001 vs BRL-3A H2 cells. 图 3 流式细胞仪检测细胞体积及胞内颗粒秘密度 Fig.3 Volume and intracellular granule density of the hybrid cells detected by flow cytometry |

|
| A, DNA content of BRE-3A H2 and BRL-ies cells; B, DNA content of BRL-3A H2 cells; C, DNA content of BRL-ies cells. 图 4 流式细胞仪检测细胞DNA含量 Fig.4 DNA content of the hybrid cells detected by flow cytometry |
2.4 BRL-ies细胞特异性基因表达情况
实时定量PCR结果显示,BRL-ies既表达GS又表达CD31,并且GS mRNA的表达水平显著高于融合前BRL-3A H2细胞(P < 0.001),见图 5。Western blotting结果显示与实时定量PCR结果基本一致,见图 6。BRL-ies细胞同时表达GS与CD31。但GS蛋白表达量与BRL-3A无统计学差异。

|
| A, CD31 mRNA expression; B, GS mRNA expression. *P < 0.001 vs BRL-3A H2 cells. 图 5 实时定量PCR检测CD31和GS相对表达量 Fig.5 Real-time PCR analysis of CD31 and GS expression |
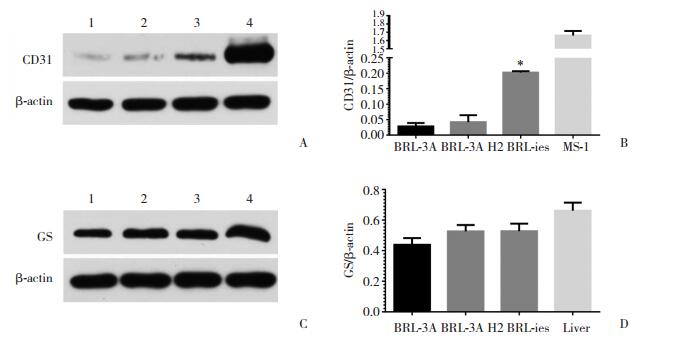
|
| A, CD31 protein expression; B, gray intensity of CD31 protein expression; C, GS protein expression; D, gray intensity of GS protein expression. *P < 0.001 vs BRL-3A H2 cells. 1, BRL-3A;2, BRL-3A H2;3, BRL-ies; 4, MS-1. 图 6 Western blotting检测CD31和GS的表达情况 Fig.6 Western blotting analysis of CD31 and GS expression |
3 讨论
我国是肝病大国,肝功能衰竭是各种肝病患者死亡的主要原因[4]。目前,原位肝移植是治疗肝功能衰竭最有效的方法,但供肝短缺严重限制了肝移植手术的广泛开展[5]。为解决这一问题,医学科学工作者研发了多种肝移植替代疗法,其中包括肝/干细胞移植,生物人工肝及肝脏组织工程等。肝/干细胞移植操作简单、对受体影响小,但大量研究表明肝/干细胞移植疗效不确切,仅能部分缓解肝功能衰竭;生物人工肝一方面具有肝脏的解毒功能,另一方面又可以通过反应器中的肝细胞达到肝脏的合成、代谢、分泌等功能,近10年来得到了巨大发展,但由于其为暂时代替肝脏功能,只能被用于肝移植前的等待期,不能从根本上解决供肝短缺这一问题;肝脏组织工程是利用生物学和工程学的基本原理在体外构建类肝脏组织器官,是解决供肝不足最有前景的方法之一,然而体外培养的人工肝组织用于临床前必须解决血管化这一难题。
为了使体外培育的组织块更易于在体内血管化,绝大多数学者采用种子细胞与内皮细胞混合培养或叠加的方式构建肝组织[6-8]。主要利用了内皮细胞可加速血管生成、抗凝、抗炎等诸多特性[9-10]。
本课题组通过细胞电融合技术及HAT筛选策略,构建了一株由大鼠肝细胞系BRL-3A与原代大鼠胰岛内皮细胞融合而成的可稳定传代的四倍体细胞。这株细胞即具有内皮细胞表型,表达CD31,又具有肝细胞特性,表达较高水平的谷氨酰胺合成酶。但此细胞株是否具备促进血管化及肝细胞解毒功能有待未来进一步研究。
综上所述,本研究成功构建了一株既具有内皮细胞表型又具有肝细胞特征的融合细胞。这株细胞或许可为肝脏组织工程提供一种新的种子细胞,为肝脏组织工程的血管化问题提供了新的解决思路。
| [1] |
ZHANG L, GUAN Z, YE JS, et al. Research progress in liver tissue engineering[J]. Biomed Mater Eng, 2017, 28(S1): S113-S119. DOI:10.3233/BME-171632 |
| [2] |
贺武, 宋今丹. HGPRT缺陷性人结肠癌细胞株的建立[J]. 细胞生物学杂志, 1998(2): 79-82, 99. |
| [3] |
李晓航, 张佳林, 李乐, 等. 1种新型功能性杂交胰岛β细胞系的建立[J]. 中国医科大学学报, 2013(2): 143-148. |
| [4] |
BERNAL W, HYYRYLAINEN A, GERA A, et al. Lessons from look-back in acute liver failure? A single centre experience of 3300 patients[J]. J Hepatol, 2013, 59(1): 74-80. DOI:10.1016/j.jhep.2013.02.010 |
| [5] |
WANG FS, FAN JG, ZHANG Z, et al. The global burden of liver disease:the major impact of China[J]. Hepatology, 2014, 60(6): 2099-2108. DOI:10.1002/hep.27406 |
| [6] |
KHOJASTEH A, FAHIMIPOUR F, JAFARIAN M, et al. Bone engineering in dog mandible:coculturing mesenchymal stem cells with endothelial progenitor cells in a composite scaffold containing vascular endothelial growth factor[J]. J Biomed Mater Res B Appl Biomater, 2016, 105(7): 1767-1777. DOI:10.1002/jbm.b.33707 |
| [7] |
DU C, NARAYANAN K, LEONG MF, et al. Induced pluripotent stem cell-derived hepatocytes and endothelial cells in multi-component hydrogel fibers for liver tissue engineering[J]. Biomaterials, 2014, 35(23): 6006-6014. DOI:10.1016/j.biomaterials.2014.04.011 |
| [8] |
LESMAN A, KOFFLER J, ATLAS R, et al. Engineering vessel-like networks within multicellular fibrin-based constructs[J]. Biomaterials, 2011, 32(31): 7856-7869. DOI:10.1016/j.biomaterials.2011.07.003 |
| [9] |
MICHIELS C. Endothelial cell functions[J]. J Cell Physiol, 2003, 196(3): 430-443. DOI:10.1002/jcp.10333 |
| [10] |
PERRY L, FLUGELMAN MY, LEVENBERG S. Elderly patient-derived endothelial cells for vascularization of engineered muscle[J]. Mol Ther, 2017, 25(4): 935-948. DOI:10.1016/j.ymthe.2017.02.011 |
 2018, Vol. 47
2018, Vol. 47




