文章信息
- 张利华, 张丽艳, 张小康, 徐超龙, 周义
- ZHANG Lihua, ZHANG Liyan, ZHANG Xiaokang, XU Chaolong, ZHOU Yi
- β-淀粉样蛋白诱导的阿尔茨海默病大鼠模型中BDNF与TRPC3的关系
- Relationship between BDNF and TRPC3 in a Rat Model of Alzheimer's Disease Induced by β-amyloid Protein
- 中国医科大学学报, 2018, 47(3): 217-221
- Journal of China Medical University, 2018, 47(3): 217-221
-
文章历史
- 收稿日期:2017-10-30
- 网络出版时间:2018-03-02 17:38
阿尔茨海默病(Alzheimer’s disease,AD)又称老年痴呆症,是一种以记忆、学习、认知功能改变为主要特征的神经系统退行性疾病。病因假说很多,其中β-淀粉样蛋白(β-amyloid protein,Aβ)异常沉积占主导地位。其主要病理特征是在患者大脑皮质、海马区出现老年斑和神经元纤维缠结,此外还有神经元缺失、神经元突触异常等病理改变。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是中枢神经系统中分布最广泛的营养因子,在突触可塑性、神经元存活方面起着关键作用。最近的研究[1]报道,AD患者的血清中BDNF水平降低,且发现健康老年受试者的脑脊液中BDNF水平低下可能预示着未来会出现认知衰退。哺乳动物中的经典瞬时受体电位通道蛋白(canonical transient receptor potential channel,TRPC)是一种非典型钙离子通道,与神经系统的生长、增殖、分化和凋亡密切相关。BDNF通过激活TRPC3促进树突棘的生长发育[2]。卡洛西汀通过促进TRPC6和磷酸化环磷腺苷效应元件结合蛋白的表达从而治疗脑缺血损伤[3]。在癫痫大鼠海马神经元初代培养中,BDNF和TRPC3表达增加对癫痫引起的细胞损伤起保护作用[4]。在视网膜缺血性损伤的研究中发现,BDNF/酪氨酸激酶受体B通过调节TRPC3/6通道的表达进而发挥神经节细胞的保护作用。
本课题组的前期研究[5]发现,在Aβ诱导的AD小鼠模型中,TRPC4表达增加。但目前关于BDNF和TRPC3在Aβ所致的AD模型中的关系及作用机制尚不清楚。本研究采用SD大鼠侧脑室注射寡聚型Aβ1-42的方法模拟AD [6],利用逆转录聚合酶链反应(RT-PCR)和Western blotting检测大鼠海马组织中TRPC3和BDNF mRNA和蛋白表达,探讨它们之间的关系,为AD发病机制研究提供新的证据,同时也为预防和治疗AD提供新的思路。
1 材料与方法 1.1 实验材料 1.1.1 动物24只5周龄200~220 g的SPF级雄性SD大鼠(辽宁长生生物技术有限公司)。
1.1.2 试剂Aβ和BDNF兔单克隆抗体(英国Abcam公司);重组人源BDNF(美国Peprotech公司);总RNA小量制备试剂盒(美国Axygen公司);逆转录试剂盒(加拿大Abm公司);BCA蛋白浓度测定试剂盒和SDS-PAGE凝胶配制试剂盒(上海碧云天公司);TRPC3兔多克隆抗体(台湾Arigo公司);β-actin小鼠单克隆抗体和辣根酶标记山羊抗兔IgG(H+L)(美国Proteintech公司);辣根酶标记山羊抗小鼠IgG(H+L)(北京中杉金桥公司)。
1.2 方法 1.2.1 Aβ1-42寡聚化处理注射前,将Aβ1-42室温放置1 h,低速离心10 min,溶解在灭菌PBS溶液中(浓度为1 μg/μL),并在37 ℃恒温箱中孵育48 h诱导寡聚化,放置冰上备用。
1.2.2 AD模型制备大鼠经腹腔注射10%水合氯醛(0.4 mL/100 g)麻醉,头部消毒后将皮肤沿矢状线切开1 cm,棉签蘸碘伏消毒,剔除骨膜,完全暴露颅骨前囟,置于脑立体定位仪上,侧脑室导管放置位置根据《大鼠脑立体定位图谱》确定,前囟后0.8 mm,中线向右旁开1.5 mm,深度3.5 mm。置管后在管周前、左、右3个位置分别拧入小螺丝半固定,涂以牙科水泥固定,晾干后缝合。肌注青霉素5 d预防感染。待手术应激消失后,用微量注射器经导管缓慢注射Aβ1-42 10 μL,注射速度约为2 μL/min,注射结束留针3 min,使溶液充分弥散。对照组注射同等剂量的PBS溶液。
1.2.3 BDNF给药根据说明书溶解和稀释BDNF,分装后置于-40 ℃冰箱低温保存,避免反复冻融。Aβ1-42给药14 d后即水迷宫实验前1 d,从第15天起,给予AD+BDNF组大鼠BDNF水溶液,剂量为10 μL(0.025 μg/μL),持续给药5 d。
1.2.4 Morris水迷宫行为学检测Aβ1-42给药后第16天,利用MT-200 Morris水迷宫跟踪分析系统(成都泰盟科技有限公司)检测各组大鼠学习和记忆能力。前5 d进行定位航行实验,将待测大鼠头部面向池壁放入水中,让其寻找目标象限内的隐藏平台,所用时间即逃避潜伏期,依据该时间的长短检测大鼠的空间学习能力,3次/d,平台位置不动,象限不重复。第6天进行空间探索实验,将平台撤去,记录大鼠穿越平台次数以及在平台所在象限停留时间,以检测大鼠的空间记忆能力。
1.2.5 RT-PCR检测TRPC3和BDNF mRNA的表达Morris水迷宫实验结束后将大鼠断头取海马组织,-80 ℃超低温冰箱保存,以备RT-PCR实验以及Western blotting实验使用。提取大鼠海马组织总RNA后进行逆转录。以逆转录所得的cDNA为模板进行PCR扩增,所需引物由金斯瑞生物科技公司合成。β-actin上游引物5’-AGCGGGAAATCGTGCGTG-3’,下游引物5’-CAGGGTACATGGTGGTGCC-3’;BDNF上游引物5’-CTGAGCGTGTGTGACAGTATTAGCG-3’,下游引物5’-CAGCCTTCCTTCGTGTAACCCAT-3’;TRPC3,上游引物5’-CTGGCCAACATAGAGAAGGAGT-3’,下游引物5’-CACCGATTCCAGATCTCCAT-3’。琼脂糖凝胶成像结果采用Gel Image System软件进行分析。
1.2.6 Western blotting检测TRPC3和BDNF蛋白的表达向低温保存的海马组织中加入含有蛋白酶抑制剂的RIPA裂解液200 μL,12 000 r/min离心5 min。取上清液,采用BCA法得出标准曲线,根据样品吸光度计算得出蛋白浓度。蛋白上样量为30 μg/10 μL,室温下SDS-PAGE凝胶电泳1 h,TRPC3(分子量91 000)采用湿转方式转膜2 h,BDNF(分子量15 000)采用半干转方式转膜20 min,放入5%脱脂牛奶中摇床封闭1 h,加入适度稀释度的一抗TRPC3(1:2 000)、BDNF(1:2 000)、β-actin(1:5 000)4 ℃孵育过夜。翌日TBST漂洗15 min×3次,加入适度稀释的二抗(1:2 000),冰上孵育2 h,TBST漂洗15 min×3次,最后,用化学发光成像系统(中国天能公司)进行ECL显影,用Gel Image System软件对实验结果进行分析。
1.3 统计学分析采用SPSS 17.0统计软件进行统计学处理,数据以x±s表示,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 BDNF对AD大鼠空间学习记忆能力有改善作用侧脑室导管Aβ1-42给药14 d后,从第15天开始,BDNF连续给药5 d,期间进行水迷宫实验。第5天大鼠逃避潜伏期AD组较PBS组延长,有统计学差异[分别为(31.06±4.01)s和(24.23±4.62)s,P < 0.05];第6天穿越平台次数AD组较PBS组减少(分别为3.25±0.45和6.62±0.46,P < 0.05),表明AD组大鼠的空间学习记忆能力下降。而第5天大鼠逃避潜伏期AD+BDNF组较AD组缩短[分别为(23.30±4.84)s和(31.06±4.01)s,P < 0.05];第6天穿越平台次数AD+BDNF组较AD组增加(分别为5.83±0.75和3.25±0.45,P < 0.05),表明BDNF对AD大鼠空间学习记忆能力有改善作用。见图 1。

|
| A, escape latencies of the three groups; B, numbers of platform crossing of the three groups during the probe trial. * P < 0.05 vs PBS group; # P < 0.05 vs AD+BDNF group. n = 8. 图 1 Morris水迷宫实验中各组大鼠行为学比较 Fig.1 Behavioral comparisons of each group of rats in the Morris water maze |
2.2 BDNF促进TRPC3 mRNA的表达
RT-PCR结果显示,AD组与PBS组相比,BDNF和TRPC3 mRNA相对含量均降低(P < 0.05)。AD+BDNF组与AD组相比,TRPC3 mRNA相对含量增加(P < 0.05)。见图 2。
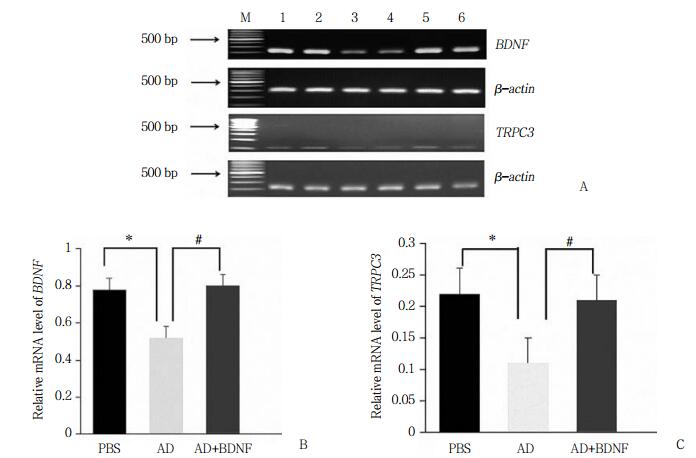
|
| A, BDNF and TRPC3 mRNA in rats in each group; B, relative levels of BDNF mRNA in rats in each group; C, relative levels of TRPC3 mRNA in rats in each group. M, marker; lane 1-2, PBS group; lane 3-4, AD group; lane 5-6, AD+BDNF group. * P < 0.05 vs PBS group; # P < 0.05 vs AD+BDNF group.n = 4. 图 2 RT-PCR检测大鼠海马区BDNF和TRPC3 mRNA的表达水平 Fig.2 Expression of BDNF and TRPC3 mRNA in the hippocampus of rats detected by RT-PCR |
2.3 BDNF促进TRPC3蛋白的表达
Western blotting结果显示,AD组与PBS组相比,BDNF和TRPC3蛋白相对含量均降低(P < 0.05),AD+BDNF组与AD组相比,TRPC3蛋白相对含量增加(P < 0.05)。见图 3。

|
| A, BDNF and TRPC3 protein in rats in each group; B, relative levels of BDNF protein in rats in each group; C, relative levels of TRPC3 protein in rats in each group. Lane 1-2, PBS group; lane 3-4, AD group; lane 5-6, AD+BDNF group. * P < 0.05 vs PBS group; # P < 0.05 vs AD+BDNF group. n = 4. 图 3 Western blotting检测各组大鼠海马区BDNF和TRPC3蛋白表达 Fig.3 Expression of BDNF and TRPC3 protein in the hippocampus detected by Western blotting |
3 讨论
研究[7]表明,Aβ在脑内沉积形成老年斑是AD最具特征的病理改变,与大脑认知障碍密切相关。Aβ在AD的发病机制中起着核心作用,但它通过何种机制造成神经元损伤,尚不清楚。在转基因AD小鼠脑组织中观察到BDNF的降低可能会促进神经元萎缩和突触损伤,而BDNF的上调可以控制AD的认知衰退[8]。本研究中,AD组大鼠BDNF表达下降,空间学习记忆能力减退;当给予AD大鼠一定剂量的BDNF时,可明显改善其空间学习记忆能力,与之前ZHANG等[9]的研究结果一致。
有研究[10]表明,在心肌缺血性损伤及癫痫大鼠模型中,BDNF与TRPC3/6协同作用,对神经元损伤起保护作用。本研究中,AD组大鼠TRPC3表达下降,当给予AD大鼠一定剂量的BDNF时,TRPC3 mRNA和蛋白水平均明显增加,说明BDNF可能通过上调TRPC3从而发挥其改善AD大鼠认知障碍的作用,这在AD模型中尚属首次发现。
有研究[11]表明,BDNF通过钙调蛋白依赖性蛋白激酶激酶激活TRPC5或TRPC6通道从而诱导谷氨酸亚基1翻译和突触生长。也有研究[12]表明,哌嗪类化合物通过激活DAG,进而引起TRPC3/6/7介导的Ca2+内流,发挥BDNF样神经营养作用。但在AD模型中,BDNF通过何种途径调控TRPC3的表达,仍需进一步的试验证实。
综上所述,本研究表明,BDNF可能通过上调TRPC3表达,从而发挥其对AD大鼠认知障碍的改善作用,但其具体机制有待研究。这可能对临床预防和治疗AD有一定帮助。
| [1] |
DINIZ BS, TEIXEIRA AL. Brain-derived neurotrophic factor and Alzheimer's disease:physiopathology and beyond[J]. Neuromolecular Med, 2011, 13(4): 217-222. DOI:10.1007/s12017-011-8154-x |
| [2] |
AMARAL M D, POZZOMILLER L. TRPC3 channels are necessary for brain-derived neurotrophic factor to activate a nonselective cationic current and to induce dendritic spine formation[J]. Neurosci, 2007, 27(19): 5179-5189. DOI:10.1523/JNEUROSCI.5499-06.2007 |
| [3] |
CHAO G, MA Y, MA S, et al. The role of TRPC6 in the neuroprotection of calycosin against cerebral ischemic injury[J]. Sci Rep, 2017, 7(1): 3039. DOI:10.1038/s41598-017-03404-6 |
| [4] |
YANG ZW, WU F, ZHANG SL. Effects of ganoderic acids on epileptiform discharge hippocampal neurons:insights from alterations of BDNF, TRPC3 and apoptosis[J]. Pharmazie, 2016, 71(6): 340-344. DOI:10.1691/ph.2016.5889 |
| [5] |
张改改, 张丽艳, 邹丹, 等. 经典瞬时受体电位通道蛋白在β淀粉样蛋白诱导的阿尔茨海默病小鼠海马区的表达[J]. 中国医科大学学报, 2016, 45(12): 1100-1104. DOI:10.12007/j.issn.0258-4646.2016.12.010 |
| [6] |
于方, 拓西平, 吕建勇. 侧脑室注射β-淀粉样蛋白制作阿尔茨海默病样大鼠模型[J]. 实用老年医学, 2010, 24(6): 475-478. DOI:10.3969/j.issn.1003-9198.2010.06.011 |
| [7] |
WEI Z, CHEN XC, SONG Y, ET AL. Amyloid β protein aggravates neuronal senescence and cognitive deficits in 5XFAD mouse model of Alzheimer's disease[J]. Chin Med J (Engl), 2016, 129(15): 1835-1844. DOI:10.4103/0366-6999.186646 |
| [8] |
NAGAHARA AH, MATELING M, KOVACS I, et al. Early BDNF treatment ameliorates cell loss in the entorhinal cortex of APP transgenic mice[J]. Neurosci, 2013, 33(39): 15596-15602. DOI:10.1523/JNEUROSCI.5195-12.2013 |
| [9] |
ZHANG L, FANG Y, LIAN Y, et al. Brain-derived neurotrophic factor ameliorates learning deficits in a rat model of Alzheimer's disease induced by Aβ1-42[J]. PLoS One, 2015, 10(4): e0122415. DOI:10.1371/journal.pone.0122415 |
| [10] |
HANG P, ZHAO J, CAI B, et al. Brain-derived neurotrophic factor regulates TRPC3/6 channels and protects against myocardial infarction in rodents[J]. Int J Biol Sci, 2015, 11(5): 536-545. DOI:10.7150/ijbs.10754 |
| [11] |
FORTIN DA, SRIVASTAVA T, DWARAKANATH D, et al. BDNF activation of CaM-kinase kinase via TRPC channels induces the translation and synaptic incorporation of GluA1 containing calcium-permeable AMPARs[J]. Neurosci, 2012, 32(24): 8127-8137. DOI:10.1523/JNEUROSCI.6034-11.2012 |
| [12] |
SAWAMURA S, HATANO M, TAKADA Y, et al. Screening of transient receptor potential canonical channel activators identifies novel neurotrophic piperazine compounds[J]. Mol Pharmacol, 2016, 89(3): 348-363. DOI:10.1124/mol.115.102863 |
 2018, Vol. 47
2018, Vol. 47