文章信息
- 丁虹淋, 董理鸣, 刘兵, 李宁, 刘屹立
- 同时同侧肾血管肉瘤合并肾透明细胞癌1例
- Renal Angiosarcoma with Ipsilateral Renal Clear Cell Carcinoma: a Case Report
- 中国医科大学学报, 2018, 47(2): 174-176
- Journal of China Medical University, 2018, 47(2): 174-176
-
文章历史
- 收稿日期:2017-05-10
- 网络出版时间:2018-01-08 10:55
原发性肾血管肉瘤十分罕见,同时同侧并发肾血管肉瘤与肾透明细胞癌的重复癌更鲜见报道。我院于2017年2月收治1例肾占位性病变患者,病理报告证实为原发性肾血管肉瘤合并肾透明细胞癌。为了提高对该病的认识、促进日后的进一步研究,现结合文献回顾病例。
1 临床资料患者,女,77岁,因“无痛性肉眼血尿2个月,发现左肾占位1个月”入院。既往有高血压病史20年,心衰病史10年,否认糖尿病病史,否认家族肿瘤病史。专科查体:左肾区轻度叩痛,余无特殊异常体征。泌尿系CT平扫提示:左肾软组织肿块影(图 1A)。肾脏多普勒超声提示:左肾形态失常,皮髓质界限欠清晰,左肾上部可见6.1 cm×4.4 cm中高回声,边界欠清,下部可见1.4 cm×1.0 cm高回声,边界不清(图 1B)。计算机体层尿路成像提示:左肾上极占位性病变,考虑血管来源性占位病变或血管平滑肌脂肪瘤,左肾下极考虑肾癌可能性大,子宫底部占位性病变,右侧附件区占位性病变,畸胎瘤,盆腔内少量积液。余肺、肝、脑及骨未见特殊异常影像学征象。糖链抗原125为41.2 U/mL,神经元特异烯醇化酶为17.70 ng/mL,余生化检查未见特殊异常。
|
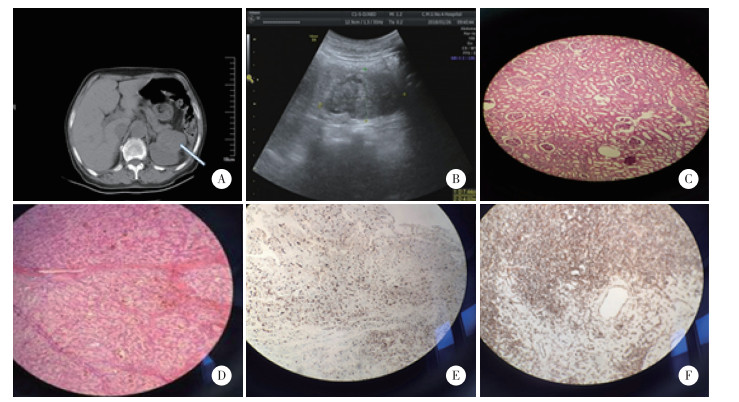
| A,肾血管肉瘤CT平扫肾内见较均匀的稍高密度肿块,与肾实质分界不清(箭头示);B,彩超提示皮髓质界限欠清晰,左肾上部可见6.1 cm×4.4 cm的中高回声展位;C,血管肉瘤HE染色可见肿瘤组织由大小不等、形态不一的血管构成(×100);D,透明细胞癌HE染色可见肿瘤细胞体积较大,具有丰富的嗜酸性胞质,胞膜清楚(×100);E,血管肉瘤Ki-67免疫组化染色(×100);F,透明细胞癌CD10免疫组化染色(×100). 图 1 肾占位性病变的影像学和病理学的表现 |
行经腰部左肾癌根治术,术中观察左肾上极见一直径约为4 cm的外突肿物,与前部腹膜粘连较重;左肾下极见一肿物直径约6 cm,触之较硬,未突破包膜。切开大体标本,肾上极肿物约4 cm×3 cm,呈囊性,肾下极可见6 cm×6 cm肿物,呈金黄色。肾上极肿物免疫组化(图 1C、E)结果提示:CK(-),Vimentin(++),CD34(++),CD31(++),CD10(-),RCC(-),EMA(-),Acyin(SM)(+),Fli-1(+),INI-1(+),Ki-67(+) > 40%,Melanoma(-),S-100(-),符合肾血管肉瘤。肾下极肿物免疫组化(图 1D、F)结果提示:CKL(+),Vimentin(+),CD10(+),CD34(+),Ki-67(+) > 10%,S-100(-),符合肾透明细胞癌。患者术后切口愈合良好,无明显不适,顺利出院。出院1个月后随访,无明显复发及远处转移征象。
2 讨论肾血管肉瘤是极为罕见的肿瘤,通常来自正常的内皮细胞变异形成。自1942年首例病例报道以来,该病的病因及发病机制仍未知,可能存在的暴露因素有肾移植治疗、砷、氯乙烯、氧化钍胶体和辐射等[1]。据以往病例报道[2],发病年龄50岁以上占74%,中位发病年龄为58岁,其中男性发病率约为女性的3~4倍。
原发性肾血管肉瘤早期临床表现为腰部不适、血尿或镜下血尿、腹部可触及肿块、腰肋痛或无任何症状。彩超检查可见肿瘤内血流信号明显,多表现为高血供肿瘤;CT平扫与肾癌难以鉴别,增强扫描可呈“快进快出”的特点[2-4]。肾血管肉瘤的病理学特点是肉眼观为暗红色,可见边界不清的肿块。高倍电镜下可见肿瘤组织由大小不等、形态不一的血管构成,血管壁内衬多形内皮细胞且互相吻合呈网状结构,管腔内皮细胞肿胀伴异型性,能见到少量核分裂[5-6]。免疫组织化学染色检测血管内皮细胞标志物对于血管肉瘤的诊断和鉴别有重要作用,最主要是肿瘤细胞对内皮标志物染色阳性,如CD31、CD34、Vimentin等。而肾透明细胞癌CK8/18、CK8、S-100、EMA、Melanoma和HMB-45等呈阴性表达[1, 4, 7-8]。这就凸显了肿瘤病理类型是根据多个内皮标志物的综合评估诊断,而不是单一抗体标志物就可明确诊断的。
大多数报道的病例均行根治性肾切除术,但术后是否应用化疗药物和放射治疗仍存在争议,因为一些学者发现化疗辅助放射治疗虽具有局部控制作用,但对能否延长生存期存在不同的见解[4]。现阶段后续应用药物治疗主要包括重组白细胞介素2、索拉非尼等,治疗预后通常差。而原发性血管肉瘤无特殊针对基因型靶向药物,预后通常较差,如果存在转移,生存率极差,转移主要存在于肺、肝、骨。许多研究[4, 9]证实预后最重要的因素与肿瘤大小有关。
肾透明细胞癌是人体肾脏最常见的恶性肿瘤,约占细胞癌的70%~80%,并且肾癌的发病率逐年上升,彩超、计算机体层尿路成像在肾癌诊断中起到主要作用[10]。肾透明细胞癌病因复杂多样且尚不清楚,主要包含吸烟、肥胖、职业、放射、药物和家族史等,肾透明细胞癌的早期临床表现为血尿、腹部包块及疼痛[11]。肾透明细胞癌大体标本表现为类圆形,切面可见钙化、出血和坏死,瘤体外可有薄膜[12]。高倍电镜下表现为肿瘤细胞体积较大,具有丰富的嗜酸性胞质,胞膜清楚,呈梭形细胞和瘤巨细胞组织象,间质有丰富的毛细血管[13]。当CD10、Vimentin在肿瘤细胞膜或同时伴有胞质阳性、肿瘤细胞Mowy胶状铁阴性或呈粗颗粒时,应考虑肾透明细胞癌的诊断[14]。肾癌分期是选择手术方式的基本依据,根治性肾切除是公认的肾癌手术方式,效果显著。考虑到术后局部复发及术后发生远处转移,因此在术后需要配合合理的药物干预,主要有多靶点酪氨酸激酶抑制剂、VEGF抗体、mTOR通路抑制剂等几类[15]。
同一器官同时性重复癌非常罕见,肾血管肉瘤与肾透明细胞癌在临床表现及影像学表现差异不明显,无法明确做出鉴别诊断,并且病因及暴露因素存在交叉。因此,目前对2种类型肿瘤的鉴别主要依靠病理诊断和免疫组化。虽然两者鉴别诊断困难,但是其预后治疗明显不同,血管肉瘤手术及药物治疗效果相对于透明细胞癌较差。
综上所述,肾血管肉瘤合并肾透明细胞癌鲜见报道,本组1例患者同侧肾脏出现2种不同病理类型的肿瘤,其病因不明,不除外机体自身基因改变及特殊暴露因素所致。该病例提示,应重视2种疾病的鉴别诊断、治疗以及2种病理细胞类型的相关性。鉴于2种疾病的特殊性,需重视研究2种病理类型有无共同的靶向治疗药物。
| [1] |
CELEBI F, PILANCI KN, SAGLAM S, et al. Primary renal angiosarcoma with progressive clinical course despite surgical and adjuvant treatment:a case report[J]. Oncol Lett, 2015, 9(4): 1937-1939. DOI:10.3892/ol.2015.2902 |
| [2] |
周祥福, 周琦, 张涛, 等. 原发性肾血管肉瘤一例报告并文献复习[J]. 中华腔镜泌尿外科杂志电子版, 2009, 3(5): 393-397. DOI:10.3969/j.issn.1674-3253.2009.05.005 |
| [3] |
DOUARD A, PASTICIER G, DEMINIRE C, et al. Primary angiosarcoma of the kidney:case report and literature review[J]. Prog Urol, 2012, 22(7): 438-441. DOI:10.1016/j.purol.2011.11.006 |
| [4] |
OLUWAROTIMI OA. Clinicopathological features of primary angiosarcoma of the kidney:a review of 62 cases[J]. Transl Androl Urol, 2015, 4(4): 464-473. DOI:10.3978/j.issn.2223-4683.2015.05.04 |
| [5] |
玄延花. 原发性肾血管肉瘤1例[J]. 中国肿瘤临床, 2008, 35(10): 595-595. DOI:10.3969/j.issn.1000-8179.2008.10.019 |
| [6] |
曹志刚, 曾金云, 熊敏, 等. 肾血管肉瘤1例报告[J]. 临床泌尿外科杂志, 1997, 12(5): 320-320. DOI:10.13201/j.issn.1001-1420.1997.05.038 |
| [7] |
GRAPSA D, SAKELLARIOU S, POLITI E. Fine-needle aspiration cytology of primary renal angiosarcoma with histopathologic and immunocytochemical correlation:a case report[J]. Diagn Cytopathol, 2014, 42(10): 872-876. DOI:10.1002/dc.23051 |
| [8] |
IACOVELLI R, ORLANDO V, PALAZZO A, et al. Clinical and pathological features of primary renal angiosarcoma[J]. Can Urol Assoc J, 2014, 8(3/4): E223-E2336. DOI:10.5489/cuaj.1585 |
| [9] |
SOUZA OE, ETCHEBEHERE RM, LIMA MA, et al. Primary renal angiosarcoma[J]. Int Braz J Urol, 2006, 32(4): 448. DOI:10.1590/S1677-55382006000400011 |
| [10] |
吴阶平. 吴阶平泌尿外科学[M]. 山东: 山东科学技术出版社, 2012, 887-919.
|
| [11] |
郭震华. 实用泌尿外科学[M]. 北京: 人民卫生出版社, 2009, 143-144.
|
| [12] |
DELAHUNT B, BETHWAITE PB, NACEY JN. Outcome prediction for renal cell carcinoma:evaluation of prognostic factors for tumours divided according to histological subtype[J]. Pathology, 2007, 39(5): 459-465. DOI:10.1080/00313020701570061 |
| [13] |
杜晓敏. 肾脏透明细胞癌的病理诊断分析[J]. 中外医疗, 2015(20): 6-7. DOI:10.3969/j.issn.1674-0742.2015.20.003 |
| [14] |
AVERY AK, BECKSTEAD J, RENSHAW AA, et al. Use of antibodies to RCC and CD10 in the differential diagnosis of renal neoplasms[J]. Am J Surg Pathol, 2000, 24(2): 203. DOI:10.1097/00000478-200002000-00006 |
| [15] |
叶志华. 肾细胞癌的靶向治疗药物研究现状[J]. 国际泌尿系统杂志, 2012, 32(1): 93-97. DOI:10.3760/cma.j.issn.1673-4416.2012.01.028 |
 2018, Vol. 47
2018, Vol. 47