文章信息
- 洪澄英, 陈怀生, 曹静, 杜玉洛, 刘雪燕, 李威
- HONG Chengying, CHEN Huaisheng, CAO Jing, DU Yuluo, LIU Xueyan, LI Wei
- β受体拮抗剂对脓毒症大鼠心肌细胞线粒体损伤的保护作用
- Protective Effect of a β-Receptor Antagonist on the Impairment of Cardiocyte Mitochondria in a Rat Sepsis Model
- 中国医科大学学报, 2018, 47(12): 1123-1127
- Journal of China Medical University, 2018, 47(12): 1123-1127
-
文章历史
- 收稿日期:2017-10-25
- 网络出版时间:2018-11-29 9:05
脓毒症是严重感染所导致的全身炎症反应综合征[1],病情发展常可引起多脏器功能衰竭,病死率达20%~30%[2]。研究显示约60%脓毒症患者出现心功能不全[3-4],而合并心功能不全患者病死率高[5]。目前研究[6]认为,心肌线粒体功能损伤是脓毒症患者心功能不全的主要原因之一,修复心肌线粒体功能可能对脓毒症心功能不全有一定缓解作用。有研究[7]表明β受体拮抗剂有助于改善脓毒症所致的心肌损害。评估β受体拮抗剂治疗脓毒症患者的疗效和安全性的研究表明β受体拮抗剂不增加死亡风险[8],并有可能有益于患者的预后[9]。动物实验[10]也表明β受体拮抗剂可以抑制脓毒症模型大鼠心肌细胞凋亡、改善血流动力学参数。本研究探讨β受体拮抗剂对脓毒症大鼠心肌细胞线粒体功能的影响。
1 材料与方法 1.1 大鼠模型建立和分组SD雄性大鼠20只,体质量250~350 g,购自国家动物实验种子中心上海分中心暨上海斯莱克实验动物责任有限公司。实验进行前20~25 ℃和60%湿度条件下12 h光照/12 h黑暗交替,适应性饲养1周。然后按照简单随机数字法分为4组,每组5只,分别为对照组、模型组、美托洛尔组和艾司洛尔组。对照组大鼠不做处理。其余3组参考文献[11]采用小剂量内毒素持续注射诱导建立脓毒症模型:根据大鼠体质量准备内毒素(10 mg/kg),加生理盐水溶解为10 mL,经大鼠尾部静脉注射[0.42 mL/(kg·h)]并持续24 h。建模成功后美托洛尔组经尾注射美托洛尔0.05 mg(冲击量),然后持续注射美托洛尔[0.2 mg/(kg·h)] [12];艾司洛尔组经尾注射艾司洛尔[15 mg/(kg·h)] [13];模型组注射等量的生理盐水。各组均持续治疗48 h。
1.2 检测指标(1)模型成功验证:记录各组大鼠精神状态、生活习惯、体温,眼眶静脉取血检测白细胞(white blood cell,WBC)数(血常规分析仪),肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)水平(ELISA)。(2)治疗前(0 h)、治疗24 h和48 h后检测各组大鼠心率、平均动脉血压;(3)治疗48 h后,处死大鼠,取心肌组织切片行病理学检测(HE染色,电子显微镜下观察各组线粒体);(4)治疗48 h后,采用qPCR和Western blotting分别检测各组线粒体内膜特异的腺甘酸转移酶(adenosine transferase,ANT)mRNA和蛋白表达水平。
1.2.1 ELISA检测眼眶静脉取血(0.3 mL),采用离心机3 000 r/min 4 ℃离心10 min,然后-80 ℃冰箱保存。采用ELISA试剂盒(美国R & D公司)检测各组血清中TNF-α、IL-6表达水平,所有操作严格按照ELISA试剂盒说明书进行。
1.2.2 qPCR检测将大鼠心肌组织在液氮中迅速磨碎,加入1 mL Trizol溶液,上下颠倒混匀,室温放置10 min使组织充分裂解;加入0.2 mL氯仿,上下颠倒混匀,室温放置5 min,溶液分成上下两层;4 ℃ 12 000 r/min离心15 min;小心吸取上层清液(约0.6 mL)到新的离心管中;加入等体积-20 ℃预冷的异丙醇,轻柔颠倒混匀后室温放置5 min,观察白色沉淀析出;4 ℃ 12 000 r/min离心10 min,倒掉上清液,收集RNA沉淀;加入1 mL 75%乙醇(DEPC水稀释)洗涤RNA,7 500 r/min离心5 min(4 ℃);弃去乙醇,吹干后加入20~100 μL的RNase-free或高温灭菌的DEPC水溶解;取1 μL样品测定样品浓度以及纯度,260/280在1.8~2.0之间,260/230在2.0~3.0之间为佳;取约100 ng RNA用于琼脂糖胶电泳,检测其是否降解;RNA样品-80 ℃保存备用。去除DNA杂质,在RNase-free或DEPC处理过的200 μL离心管中,配制如下反应体系,95 ℃处理3 min或70 ℃处理15 min,使RNA聚合酶失活,合成获得cDNA第一链。分别制作上游引物(5’-GTATCTGTCATCAAAGAAGGCTG-3’)和下游引物(3’-CTACCATCGGTTGTCAGACTT-5’),采用PCR检测仪进行定量扩增,并定量检测各指标。RT-PCR扩增程序为:42 ℃预处理5 min;94 ℃度热变性10 s;94 ℃热处理5 s,60 ℃延伸35 s,循环40次;72 ℃ 5 min。以β-actin为内参,利用定量PCR仪自带软件算法2-ΔΔCt获得各指标的相对表达量。
1.2.3 Western blotting检测心肌匀浆收集细胞,RIPA裂解液冰上裂解细胞30 min,测定蛋白浓度,按50 μg/mL蛋白含量配制上样蛋白样品。SDS-聚丙烯酰胺凝胶电泳后将蛋白转移至硝酸纤维素膜(NC膜)上,5%脱脂牛奶封闭蛋白,依次孵育一抗、二抗,Bradford法进行组织匀浆的蛋白定量,以GAPDH为内参照,比较ANT蛋白表达情况。最后用底物发光法进行显色,胶片曝光。
1.3 统计学分析采用SPSS 22.0和GraphPad Prism 6.01进行统计分析。数据采用x±s表示。组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠模型建立内霉素建模后,模型组、美托洛尔组和艾司洛尔组大鼠均出现精神萎靡不振、竖毛、嗜睡、眼鼻渗血、稀便等脓毒症症状,而对照组未有上述症状。与对照组比较,模型组、美托洛尔组和艾司洛尔组体温和和WBC显著降低(均P < 0.001),而血清TNF-α及IL-6表达水平都显著升高(均P < 0.05),表明脓毒症模型建立成功。见表 1。
| Group | Temperature(℃) | P1 | WBC(×109/L) | P2 | TNF-α(pg/mL) | P3 | IL-6(pg/mL) | P4 |
| Control | 38.4±0.2 | - | 4.9±0.5 | - | 13.74±8.35 | - | 17.48±13.20 | - |
| Model | 37.3±0.2 | < 0.001 | 2.1±0.4 | < 0.001 | 64.89±32.70 | 0.010 | 85.61±26.80 | < 0.001 |
| Metoprolol | 37.4±0.1 | < 0.001 | 2.0±0.5 | < 0.001 | 58.33±30.92 | 0.014 | 80.47±28.00 | 0.002 |
| Esmolol | 37.3±0.1 | < 0.001 | 2.0±0.4 | < 0.001 | 70.10±27.58 | 0.002 | 96.37±29.07 | < 0.001 |
| P value meant the significance between control group and each other group. | ||||||||
2.2 各组大鼠治疗前(0 h)、治疗24、48 h后心率和平均动脉压比较
结果显示,治疗前美托洛尔组、艾司洛尔组与模型组比较心率和平均动脉压没有统计学差异(均P > 0.05);治疗48 h后与模型组比较,美托洛尔组(P = 0.034)与艾司洛尔组(P = 0.027)心率显著降低,而美托洛尔组(P = 0.040)与艾司洛尔组(P = 0.038)平均动脉压显著升高。见表 2。
| Group | Heart rate(beat/min) | Mean arterial pressure(mmHg) | |||||
| 0 h | 24 h | 48 h | 0 h | 24 h | 48 h | ||
| Control | 241±31 | 250±42 | 242±35 | 108±8 | 104±9 | 107±10 | |
| Model | 317±38 | 325±41 | 334±46 | 84±12 | 85±13 | 80±11 | |
| Metoprolol | 337±32 | 292±36 | 270±321) | 86±13 | 91±9 | 97±111) | |
| Esmolol | 322±39 | 286±36 | 265±341) | 83±10 | 87±11 | 98±121) | |
| 1)P < 0.05 vs model group. | |||||||
2.3 各组大鼠治疗48 h后心肌细胞HE染色结果
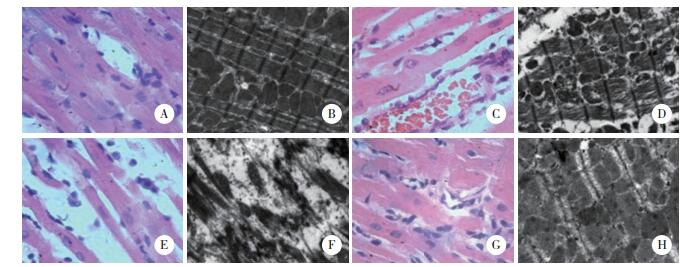
结果显示,治疗48 h后对照组大鼠心肌细胞组织致密,未见明显血管扩张;电镜下可见肌纤维排列有序,线粒体、肌浆网规则可见。模型组大鼠心肌细胞排列疏松,细胞间可见炎症细胞浸润;电镜下细胞肌纤维断裂,线粒体、肌浆网形态辨认困难。美托洛尔组和艾司洛尔组大鼠心肌细胞形态接近对照组大鼠心肌细胞,但仍见充血和炎症细胞浸润;电镜下可见心肌细胞肌纤维束排列有序,线粒体、肌浆网形态可见但有部分异常。表明β受体拮抗剂可以一定程度恢复脓毒症模型大鼠心肌细胞线粒体的损伤。见图 1。
|
| A, HE staining of rat in control group (× 400); B, mitochondria morphology of rat in control group (× 10 000); C, HE staining of rat in model group (× 400); D, mitochondria morphology of rat in model group (×10 000); E, HE staining of rat in metoprolol group (×400); F, mitochondria morphology of rat in metoprolol group (×10 000); G, HE staining of rat in esmolol group (×400); H, mitochondria morphology of rat in esmolol group (×10 000). 图 1 各组大鼠治疗48 h后心肌HE染色及线粒体观察 Fig.1 Appearance of the mitochondria at 48 h after treatment visualized by HE staining |
2.4 各组大鼠心肌组织线粒体内膜ANT mRNA及蛋白表达比较
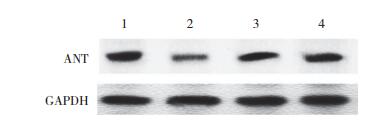
结果显示,治疗48 h后,心肌组织线粒体内膜ANT的表达水平与模型组(0.7±0.3)比较,美托洛尔组(1.6±0.6,P = 0.017)和艾司洛尔组(1.7±0.7,P = 0.018)ANT mRNA表达水平显著增高;Western blotting检测结果显示,与模型组比较,美托洛尔组和艾司洛尔组ANT蛋白水平也增高(图 2)。表明β受体拮抗剂对治疗脓毒症大鼠心肌细胞线粒体具有一定保护作用。
|
| 1. control group; 2. model group; 3. metoprolol group; 4. esmolol group. 图 2 各组心肌组织ANT蛋白表达比较 Fig.2 Myocardial ANT protein expression in each group |
3 讨论
脓毒症可以导致明显的心肌损伤,本研究发现,脓毒症模型大鼠心肌细胞疏松,排列出现紊乱,细胞间可见炎症细胞浸润,电镜下可以见到明显的肌纤维断裂,线粒体结构受到不同程度的破坏。而美托洛尔组和艾司洛尔组大鼠心肌细胞排列恢复有序,电镜下可见线粒体、肌浆网形态恢复接近正常形态。美托洛尔组和艾司洛尔组心肌组织ANT mRNA和蛋白表达水平均显著高于模型组(均P < 0.05),表明β受体拮抗剂对脓毒症大鼠心肌细胞线粒体的损伤具有一定缓解或者保护作用。
革兰阴性杆菌感染是引起脓毒症的主要原因,细菌内毒素是革兰阴性细菌的细菌壁成分,在败血症、多脏器功能衰竭(multiple organ failure,MOF)发生发展中起关键作用。脓毒症、感染性休克患者的心肌存在Toll样受体(Toll-like receptor,TLR)表达,内毒素可引起心肌细胞产生IL-1β和TNF-α增加,上调TLR mRNA水平,并降低心肌的收缩性[14]。相反心肌TLR4表达缺乏的动物则对内毒素反应减弱,心肌功能影响减少[15],敲除TLR4基因的大鼠注射内毒素后也可观察到心脏功能障碍弱于野生型[15]。此外TLR4可还可以通过激活MyD88和IFN-β,调节PI3K/Akt信号转导[16],而PI13K/Akt信号转导通路可调整心肌细胞的生长和生存,该通路的活化可抑制心肌细胞凋亡。TLR介导的信号转导导致血清TNF-α、IL-1β浓度增加,并引起心肌线粒体功能障碍。另一方面,TNF-α与心肌细胞膜特异受体结合,促进内质网释放过多钙离子,心肌线粒体钙离子内流增加,钙离子在线粒体内积聚、钙超负荷,最终可导致线粒体肿胀、破坏,在肺血管内皮细胞中观察到存在相似的过程[17]。TNF-α还可通过启动心肌线粒体凋亡信号,使患者心肌线粒体通透性转换孔呈高通透状态,H+内流,导致线粒体膜电位缺失,线粒体肿胀、破裂[18]。以上研究表明心肌细胞线粒体可能在脓毒症心脏功能损伤中发挥重要作用,与本研究结果一致。
美托洛尔、艾司洛尔是常用的β受体拮抗剂,研究[19]发现β受体拮抗剂可以促进重度脓毒症患者心率控制、降低死亡率并有效调节酸碱常数。另外一项近期的基于医疗护理数据的回顾性研究[9]表明β受体拮抗剂可以降低脓毒症患者31%医院死亡率以及41%的30 d死亡率。以上研究说明β受体拮抗剂有利于缓解脓毒症患者的心脏功能损伤。本研究发现应用美托洛尔和艾司洛尔可以缓解脓毒症大鼠的心肌细胞线粒体形态损伤,使ANT的表达水平增高,表明β受体拮抗剂对于脓毒症心肌细胞线粒体的损伤有保护作用。这可能的机制包括:(1)慢性心力衰竭患者可出现心肌细胞肌浆网Ca2+-ATP酶(SERCA)和Na+/Ca2+泵(NCX)表达异常,可能影响摄取和释放Ca2+,导致心肌收缩、舒张功能异常,而β受体拮抗剂可以调节心肌细胞Ca2+调整蛋白的表达,从而改善心肌细胞Ca2+动力学,提高心肌细胞功能[18];针对脓毒症大鼠心肌细胞,β受体拮抗剂也有可能通过对SERCA和NCX的保护作用来减少线粒体Ca2+超负荷的发生,从而达到保护线粒体的作用;(2)β受体拮抗剂可以降低脓毒症心肌线粒体的不饱和脂肪酸指数以及氧化应激,从而影响线粒体功能[20-21]。
综上所述,β受体拮抗剂对脓毒症大鼠心肌细胞线粒体损伤具有一定保护作用,这将为脓毒症大鼠心肌细胞线粒体损伤的预防和治疗提供新的研究方向。本研究不足之处:(1)β受体拮抗剂对于脓毒症大鼠心肌细胞线粒体的保护作用的分子机制未进一步深入阐明;(2)本实验观察周期较短。因此,以后将进一步探索β受体拮抗剂对于脓毒症大鼠心肌细胞线粒体的长期保护作用以及具体的分子机制。
| [1] |
VAN DER POLL T, VAN DE VEERDONK FL, SCICLUNA BP, et al. The immunopathology of sepsis and potential therapeutic targets[J]. Nat Rev Immunol, 2017, 17(7): 407-420. DOI:10.1038/nri.2017.36 |
| [2] |
POLAT G, UGAN RA, CADIRCI E, et al. Sepsis and septic shock:current treatment strategies and new approaches[J]. Eurasian J Med, 2017, 49(1): 53-58. DOI:10.5152/eurasianjmed.2017.17062 |
| [3] |
FATTAHI F, WARD PA. Complement and sepsis-induced heart dysfunction[J]. Mol Immunol, 2017, 84: 57-64. DOI:10.1016/j.molimm.2016.11.012 |
| [4] |
CELES MR, PRADO CM, ROSSI MA. Sepsis:going to the heart of the matter[J]. Pathobiology, 2013, 80(2): 70-86. DOI:10.1159/000341640 |
| [5] |
RUDIGER A, SINGER M. The heart in sepsis:from basic mechanisms to clinical management[J]. Curr Vascular Pharmacol, 2013, 11(2): 187-195. DOI:10.2174/1570161111311020008 |
| [6] |
ACUNA-CASTROVIEJO D, RAHIM I, ACUNA-FERNANDEZ C, et al. Melatonin, clock genes and mitochondria in sepsis[J]. Cell Mol Life Sci, 2017, 74(21): 3965-3987. DOI:10.1007/s00018-017-2610-1 |
| [7] |
SANFILIPPO F, SANTONOCITO C, MORELLI A, et al. Beta-blocker use in severe sepsis and septic shock:a systematic review[J]. Cur Med Res Opinion, 2015, 31(10): 1817-1825. DOI:10.1185/03007995.2015.1062357 |
| [8] |
BALIK M, RULISEK J, LEDEN P, et al. Concomitant use of beta-1 adrenoreceptor blocker and norepinephrine in patients with septic shock[J]. Wiener klin Wochenschr, 2012, 124(15/16): 552-556. DOI:10.1007/s00508-012-0209-y |
| [9] |
SINGER KE, COLLINS CE, FLAHIVE JM, et al. Outpatient beta-blockers and survival from sepsis:results from a national cohort of medicare beneficiaries[J]. Am J Surg, 2017, 214(4): 577-582. DOI:10.1016/j.amjsurg.2017.06.007 |
| [10] |
秦延军, 于悦卿, 闫雁, 等. 艾司洛尔对早期脓毒症大鼠炎症因子及心功能的影响[J]. 中国现代医学杂志, 2014, 24(1): 13-19. DOI:10.3969/j.issn.1005-8982.2014.01.004 |
| [11] |
温妙云, 郑侠, 邓医宇, 等. 内毒素诱导大鼠建立脓毒症脑损伤模型[J]. 广东医学, 2014, 35(2): 198-200. DOI:10.13820/j.cnki.gdyx.2014.02.011 |
| [12] |
李志强, 张印纲, 程爱斌, 等. 美托洛尔对脓毒症大鼠心肌细胞凋亡的影响[J]. 实用医学杂志, 2011, 27(3): 399-402. DOI:10.3969/j.issn.1006-5725.2011.03.015 |
| [13] |
张璐瑶, 聂垚, 柯路, 等. 艾司洛尔对脓毒症大鼠肠黏膜屏障的影响[J]. 肠外与肠内营养, 2014, 21(5): 305-308. DOI:10.16151/j.1007-810x.2014.05.036 |
| [14] |
AVLAS O, FALLACH R, SHAINBERG A, et al. Toll-like receptor 4 stimulation initiates an inflammatory response that decreases cardiomyocyte contractility[J]. Antioxidants Redox Signal, 2011, 15(7): 1895-1909. DOI:10.1089/ars.2010.3728 |
| [15] |
PARACHA RZ, AHMAD J, ALI A, et al. Formal modelling of toll like receptor 4 and JAK/STAT signalling pathways:insight into the roles of SOCS-1, interferon-beta and proinflammatory cytokines in sepsis[J]. PLoS One, 2014, 9(9): e108466. DOI:10.1371/journal.pone.0108466 |
| [16] |
BAUERFELD CP, RASTOGI R, PIROCKINAITE G, et al. TLR4-mediated AKT activation is MyD88/TRIF dependent and critical for induction of oxidative phosphorylation and mitochondrial transcription factor A in murine macrophages[J]. J Immunol, 2012, 188(6): 2847-2857. DOI:10.4049/jimmunol.1102157 |
| [17] |
DADA LA, SZNAJDER JI. Mitochondrial Ca (2) + and ROS take center stage to orchestrate TNF-alpha-mediated inflammatory responses[J]. J Clin Invest, 2011, 121(5): 1683-1685. DOI:10.1172/JCI57748 |
| [18] |
CHAGNON F, METZ CN, BUCALA R, et al. Endotoxin-induced myocardial dysfunction:effects of macrophage migration inhibitory factor neutralization[J]. Circulation Res, 2005, 96(10): 1095-1102. DOI:10.1161/01.RES.0000168327.22888.4d |
| [19] |
CHACKO CJ, GOPAL S. Systematic review of use of beta-blockers in sepsis[J]. J Anaesthesiol Clin Pharmacol, 2015, 31(4): 460-465. DOI:10.4103/0970-9185.169063 |
| [20] |
GOMEZ A, SANCHEZ-ROMAN I, GOMEZ J, et al. Lifelong treatment with atenolol decreases membrane fatty acid unsaturation and oxidative stress in heart and skeletal muscle mitochondria and improves immunity and behavior, without changing mice longevity[J]. Aging Cell, 2014, 13(3): 551-560. DOI:10.1111/acel.12205 |
| [21] |
SANCHEZ-ROMAN I, GOMEZ A, NAUDI A, et al. Independent and additive effects of atenolol and methionine restriction on lowering rat heart mitochondria oxidative stress[J]. J Bioenergetics Biomembranes, 2014, 46(3): 159-172. DOI:10.1007/s10863-013-9535-7 |
 2018, Vol. 47
2018, Vol. 47