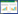文章信息
- 张雷, 邢静, 李润玖
- ZHANG Lei, XING Jing, LI Runjiu
- 转化生长因子β1对脓毒症大鼠模型免疫功能的影响
- Effect of Transforming Growth Factor β1 on Immunologic Function in Rat Model of Sepsis
- 中国医科大学学报, 2018, 47(12): 1111-1115
- Journal of China Medical University, 2018, 47(12): 1111-1115
-
文章历史
- 收稿日期:2018-05-25
- 网络出版时间:2018-11-28 16:36
脓毒症是一种全身炎症反应综合征,通常由感染因素引起,疾病严重时可导致器官功能障碍和(或)循环障碍,是严重创伤、烧伤、休克、感染和外科大手术等常见的并发症。尽管如今医疗技术逐步提升,脓毒症死亡率仍居高不下[1-2]。因此,脓毒症演变的关键环节及病理生理机制值得深入研究,以期探索新的干预手段或措施。研究[3-4]表明,在脓毒症患者体内,促炎-抗炎的平衡状态遭到破坏,炎症反应受控失调,出现全身炎症反应,进一步可发展为多器官功能障碍综合征。或者抗炎症反应过度亢进,使炎性细胞因子生成受到抑制,引起机体免疫功能低下,导致机体处于失衡状态。转化生长因子β1(transformation growth factor β1,TGF-β1)在先天性和获得性免疫中均发挥重要的作用[5-6],然而TGF-β1参与调节脓毒症的发病是否与免疫调节作用有关仍需进一步深入探讨。
为了探讨TGF-β1在脓毒症炎症反应中的作用及机制,本研究在盲肠结扎穿孔术(cecal ligation and puncture,CLP)大鼠模型中,给予外源性TGF-β1因子处理,检测TGF-β1干预后CLP大鼠外周血炎性相关因子水平和免疫器官重要蛋白的变化,并进一步在体外细胞水平研究对免疫细胞增殖、凋亡的影响,为今后研究脓毒症的发病机制提供理论和实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物选取雄性健康清洁级Wistar大鼠,6月龄,体质量200~240 g,购自大连医科大学动物实验中心。
1.1.2 细胞系人急性单核细胞白血病细胞系THP-1购自中国科学院上海细胞所。
1.1.3 主要试剂MEM培养基和胎牛血清购自美国GIBCO公司;重组TGF-β因子购自中国Bio-Swamp公司,兔抗鼠核因子E2相关因子2(nuclear factor E2-related factor 2,Nfr2)多克隆抗体购自美国Abcam公司;RNA提取试剂盒、PrimeScript逆转录试剂盒和SYBR PCR Master Mix均购自日本TaKaRa公司;MTT试剂购自美国BioAssay公司;凋亡检测试剂盒购自北京博奥森科技有限公司。
1.2 方法 1.2.1 制备大鼠CLP模型常规麻醉,消毒腹部,皮肤正中切开,暴露盲肠,丝线结扎盲肠根部,避免肠梗阻,用无菌4号丝线紧紧结扎盲肠远端1.5 cm处(长度很重要,决定脓毒症的严重程度),并用无菌18号针头在已结扎的盲肠远端中央处贯通穿刺,然后把盲肠推回腹腔,关闭腹腔,逐层缝合。CLP术后0.5 h尾静脉注射TGF-β1(20 ng/mL)。
1.2.2 动物分组根据体质量将大鼠随机分为空白对照组、CLP组、CLP+TGF-β1组,每组15只。
1.2.3 ELISA收集大鼠血清样本。采用双抗体夹心ELISA法测定相关炎性细胞因子血清浓度,具体操作步骤参见试剂盒说明书。
1.2.4 Western blotting取大鼠肝、脾组织,裂解、蛋白提取、变性,SDS-PAGE浓缩胶及分离胶电泳,转膜1 h,封闭1 h,一抗孵育过夜(稀释倍数均为1:500),PBS洗膜3次,二抗(1:200)孵育,显色。GAPDH为内参照,采用Quantity One 4.0分析软件分析蛋白条带,计算光密度,目的蛋白与内参光密度比值代表目的蛋白相对表达水平。
1.2.5 MTT方法检测细胞增殖细胞消化后,以5×103/孔的密度接种于96孔板,常规培养贴壁后无血清饥饿24 h,给予TGF-β1处理不同时间,加入MTT(5 mg/mL)15 μL/孔,继续培养,去除孔中培养基,加入DMSO溶液150 μL/孔,振荡至结晶溶解。酶标仪检测各孔吸光度值(490 nm波长)。
1.2.6 流式细胞仪检测细胞凋亡收集THP-1细胞,4×104/mL的密度接种于6孔板,给予TGF-β1处理,离心收集细胞,PBS洗涤2次,缓冲液重悬细胞,调整浓度为1×106;然后将100 μL的细胞悬液加入流式管中,加入10 μL Annexin-V-FITC,随后加入10 μL碘化丙啶,室温下避光孵育10 min,流式细胞仪检测凋亡率。
1.3 统计学分析采用SPSS 18.0统计学软件分析数据,数据用x±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 TGF-β1对CLP脓毒症大鼠促炎/抗炎相关细胞因子水平的影响采用ELISA法检测各组大鼠血清中不同炎性细胞因子和抗炎细胞因子水平。炎性细胞因子的检测结果显示,空白对照组大鼠血清中炎性细胞因子TNF-α和白细胞介素6(interlukin-6,IL-6)的释放水平均较低,CLP组大鼠TNF-α和IL-6的释放水平增高,CLP+TGF-β1组大鼠给予TGF-β1处理后血清中炎性细胞因子TNF-α和IL- 6水平增高(P < 0.05)。抗炎细胞因子的检测结果显示,CLP+TGF-β1组大鼠血清中抗炎细胞因子IL-4、IL-10水平下降(P < 0.05),即降低CLP脓毒症大鼠释放抗炎细胞因子的能力。见图 1。上述结果表明,TGF-β1具有一定的免疫调节作用。
|
| A, TNF-α; B, IL-6;C, IL-4;D, IL-10. * P < 0.05 vs blank control group; # P < 0.05 vs CLP group. 图 1 ELISA法检测CLP大鼠血清中炎性细胞因子和抗炎细胞因子水平 Fig.1 The level of proinflammatory and anti-inflammatory cytokines in the serum of CLP rats detected by ELISA |
2.2 TGF-β1对CLP脓毒症大鼠肝、脾组织中Nrf2蛋白表达的影响
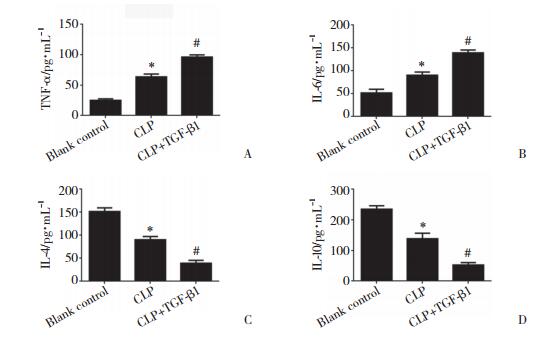
Western blotting结果显示,与空白对照组比较,CLP组大鼠肝、脾组织中Nrf2蛋白表达水平明显降低,CLP+TGF-β1组在给予TGF-β1处理后,大鼠肝、脾组织中Nrf2蛋白表达水平低于CLP组,差异有统计学意义(P < 0.05)。见图 2。
|
| A, representative Nrf2 blots in the liver; B, representative Nrf2 blots in the spleen; C, densitometric analysis for Nrf2 expression in the liver; D, densitometric analysis for Nrf2 expression in the spleen. * P < 0.05 vs blank control group; # P < 0.05 vs CLP group. 图 2 Western blotting检测CLP大鼠肝、脾组织中Nrf2蛋白表达 Fig.2 Nrf2 protein in the spleen and liver of CLP rats detected by Western blotting |
2.3 TGF-β1对THP-1细胞增殖的影响
通过MTT检测给予TGF-β1处理后单核细胞THP-1增殖水平的变化,结果发现,与空白对照组比较,TGF-β1组的THP-1细胞增殖活性降低,差异有统计学意义(P < 0.05)。见图 3。结果表明,TGF-β1参与THP-1细胞增殖活性的调控。

|
| *P < 0.05 vs blank control group. 图 3 TGF-β1对THP-1细胞增殖的影响 Fig.3 The effect of TGF-β1 on cell proliferation in THP-1 cells |
2.4 TGF-β1对THP-1细胞凋亡的影响
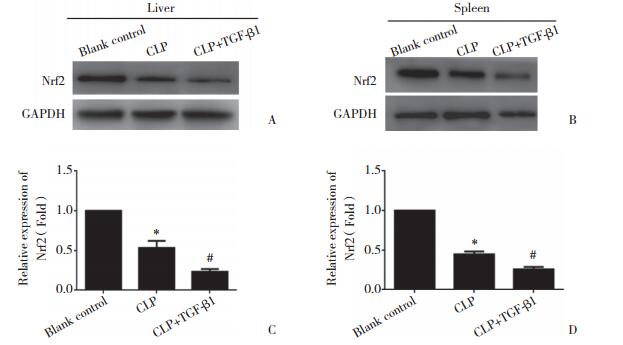
流式细胞仪检测给予TGF-β1处理后细胞凋亡率的改变,结果发现,空白对照组和TGF-β1组THP-1细胞凋亡率分别为(9.2±1.2)%和(26.7±6.6)%,与空白对照组比较,TGF-β1组THP-1细胞的凋亡率明显增加,差异有统计学意义(P < 0.05)。见图 4。
|
| A, blank control group; B, TGF-β1 group. 图 4 流式细胞仪检测TGF-β1对THP-1细胞凋亡水平的影响 Fig.4 Apoptosis of cells after TGF-β1 treatment in the THP-1 cells detected by FACScan |
3 讨论
脓毒症是宿主对感染的反应紊乱,其根本是免疫失衡,这直接决定了感染的发展过程。感染与免疫失衡的影响因素众多,包括:(1)宿主问题(儿童、成人、老年人、免疫正常、免疫低下及合并症);(2)病原体的问题(病毒、细菌、真菌、原虫等);(3)环境和季节的问题(不同环境和季节中,患者感染的发展过程也不尽相同)。病原微生物侵入时,炎症相关因子呈现瀑布式释放,诱发机体免疫反应亢进,从而导致由于过于强大的炎症反应诱发免疫原性损伤。脓毒症患者的具体表现是出现大量免疫细胞凋亡,从而制约机体免疫抑制效果[7-8]。机体免疫系统具备的调控功能在脓毒症发生发展中发挥着至关重要的作用。
TGF-β具有多种生物学作用,可调控细胞的生长、分化和多种生理、病理过程,如参与细胞周期、血管及胚胎的形成、细胞凋亡以及免疫等过程的调控。有研究[9]表明,TGF-β1是具有多效免疫调节作用的炎性细胞因子,TGF-β1参与脓毒症炎症反应的调控,通过抑制炎性细胞因子释放从而抵御机体出现过度的炎症反应。但也有报道[10]指出,TGF-β1可增加TNF-α炎性细胞因子的生成,促进肝急性期反应蛋白合成,使动物发展为脓毒症休克甚至死亡。TGF-β1在脓毒症炎症反应中发挥重要作用。CLP模型具备更好地模拟临床感染和脓肿形成病程、与脓毒症相似度更高的优点。本研究为了阐明TGF-β1在脓毒症免疫抑制发生中的作用,故采用了与临床感染和脓毒症相似度更高的CLP模型。采用CLP制备大鼠脓毒症模型,观察TGF-β1对脓毒症大鼠外周血TNF-α及IL-10等因子水平的调节作用,探讨TGF-β1在脓毒症炎症反应中的作用及机制。本研究结果表明,脓毒症大鼠尾静脉注射TGF-β1后,炎性细胞因子TNF-α和IL- 6水平增高,抗炎细胞因子IL-4、IL-10水平下降,提示TGF-β1参与脓毒症炎症反应的调节,但其作用机制复杂,难以绝对用促炎或抗炎的结论对其进行归类。
Nrf-2由2.2 kb的碱基编码,相对分子量为66 000 [11],Nrf2是最原始的调节细胞抗氧化基因,能调控多个基因表达,是内源性抗氧化系统的关键转录调节因子。当氧化物、炎症介质等损伤因素刺激引起细胞内氧化还原状态改变时,Nrf2发生磷酸化改变,与Keapl解离后进入细胞核[12]。研究[13]显示,Nrf2可以减弱急性期炎症反应;实验大鼠敲除Nrf2基因,炎症反应加重,易发生腹膜炎和脓毒性休克,死亡率增加。有研究表明,Nrf2在脾、肺组织中丰富,其次为肝脏,主要集中在相应的免疫器官中。本研究中,空白对照组中大鼠的肝、脾组织中可检测到Nrf2蛋白的表达。CLP组Nrf2表达明显降低,提示强烈的氧化应激反应可损害机体内源性保护系统,破坏组织和细胞,引起Nrf2水平降低、转录活性下降,机体抗氧化应激反应和自然免疫反应抑制。进一步研究还发现,TGF-β1能够抑制单核细胞增殖,促进凋亡。因此推断TGF-β1可能对脓毒症发展后期的免疫抑制过程起到促进作用,但具体的作用机制尚不清楚。
总之,本研究结果提示TGF-β1参与脓毒症大鼠的免疫抑制,可抑制免疫器官中Nrf2表达、抑制单核细胞增殖和促进凋亡。
| [1] |
DE BACKER D, DORMAN T. Surviving sepsis guidelines:a continuous move toward better care of patients with sepsis[J]. JAMA, 2017, 317(8): 807-808. DOI:10.1001/jama.2017.0059 |
| [2] |
SEYMOUR CW, LIU VX, IWASHYNA TJ, et al. assessment of clinical criteria for sepsis:for the third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(1): 762-674. DOI:10.1001/jama.2016.0288 |
| [3] |
KIM SJ, PARK JS, LEE DW, et al. Trichostatin a protects liver against septic injury through inhibiting Toll-like receptor signaling[J]. Biomol Ther (Seoul), 2016, 24(4): 387-394. DOI:10.4062/biomolther.2015.176 |
| [4] |
KAUKONEN KM, BAILEY M, PILCHER D, et al. Systemic inflammatory response syndrome criteria in defining severe sepsis[J]. N Engl J Med, 2015, 372(17): 1629-1638. DOI:10.1056/NEJMoa1415236 |
| [5] |
FUJIO K, KOMAI T, INOUE M, et al. Revisiting the regulatory roles of the TGF-β family of cytokines[J]. Autoimmun Rev, 2016, 15(9): 917-922. DOI:10.1016/j.autrev.2016.07.007 |
| [6] |
KOMAI T, OKAMURA T, YAMAMOTO K, et al. The effects of TGF-βs on immune responses[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2016, 39(1): 51-58. DOI:10.2177/jsci.39.51 |
| [7] |
JENSEN IJ, SJAASTAD FV, GRIFFITH TS, et al. Sepsis-induced T cell immunoparalysis:the ins and outs of impaired T cell immunity[J]. J Immunol, 2018, 200(5): 1543-1553. DOI:10.4049/jimmunol.1701618 |
| [8] |
RYAN T, COAKLEY JD, MARTIN-LOECHES I. Defects in innate and adaptive immunity in patients with sepsis and health care associated infection[J]. Ann Transl Med, 2017, 5(22): 447-449. DOI:10.21037/atm.2017.09.21 |
| [9] |
ZHANG Y, XING J. Effect of transforming growth factor-β1 on monocyte Toll-like receptor 4 expression in septic rats[J]. World J Emerg Med, 2011, 2(3): 228-231. DOI:10.5847/wjem.j.1920-8642.2011.03.013 |
| [10] |
GARCIA-LAZARO JF, THIERINGER F, LUTH S, et al. Hepatic over-expression of TGF-beta1 promotes LPS-induced inflammatory cytokine secretion by liver cells and endotoxemic shock[J]. Immunol Lett, 2005, 101(2): 217-222. DOI:10.1016/j.imlet.2005.06.003 |
| [11] |
CHAN JY, CHEUNG MC, MOI P, et al. Chromosomal localization of the human NF-E2 family of bZIP transcription factors by fluorescence in situ hybridization[J]. Hum Genet, 1995, 95(3): 265-269. |
| [12] |
ZHAO X, SUN G, ZHANG J, et al. Dimethyl fumarate protects brain from damage produced by intracerebral hemorrhage by mechanism involving Nrf2[J]. Stroke, 2015, 46(3): 1923-1928. DOI:10.1161/STROKEAHA.115.009398 |
| [13] |
YU Y, YANG Y, BIAN Y, et al. Hydrogen gas protects against intestinal injury in wild type but not NRF2 knockout mice with severe sepsis by regulating HO-1 and HMGB1 release[J]. Shock, 2017, 48(3): 364-370. DOI:10.1097/SHK.0000000000000856 |
 2018, Vol. 47
2018, Vol. 47