文章信息
- 曲慧玲, 赵传胜
- QU Huiling, ZHAO Chuansheng
- 强制性运动疗法结合抗抑郁治疗对脑梗死大鼠神经功能的影响
- Effects of Constraint-Induced Movement Therapy Combined with Antidepressant Treatment on Recovery after Cerebral Infarction in Rats
- 中国医科大学学报, 2018, 47(12): 1085-1088
- Journal of China Medical University, 2018, 47(12): 1085-1088
-
文章历史
- 收稿日期:2018-05-22
- 网络出版时间:2018-11-29 14:35
2. 中国医科大学附属第一医院神经内科, 沈阳 110001
2. Department of Neurology, The First Hospital, China Medical University, Shenyang 110001, China
目前我国脑梗死患病率持续增长,尽管有很多药物治疗和康复手段,但效果有限,进而给家庭和社会造成沉重的负担[1]。强制性运动疗法(constraint-induced movement therapy,CIMT)是脑梗死后康复的重要手段,能够促进梗死后瘫痪侧肢体康复和中枢神经系统重塑[2]。CIMT是固定患者的健康一侧肢体,强制患者使用瘫痪侧肢体的一种康复训练,但强制固定患者健康侧肢体会引起紧张,长期处于紧张压力中机体内环境会受到影响。机体内环境严重损害能够导致精神和行为改变,继而引发抑郁症等疾病,从而不利于神经发生[3-4]。如果能够对脑梗死后患者CIMT治疗同时给予预防性抗抑郁治疗,则有可能进一步促进脑梗死后神经发生。本研究探讨CIMT结合抗抑郁治疗对脑梗死大鼠神经发生及运动功能的影响,旨在为脑梗死的临床康复提供了新的理论基础及治疗靶点。
1 材料与方法 1.1 实验动物、试剂及分组成年雄性Wistar大鼠(200~250 g)购自辽宁长生生物技术有限公司。所有动物实验操作程序符合中国医科大学伦理委员会管理条例要求。内皮素1(endothelin-1,ET-1)、3,3’-二氨基联苯胺(3,3’-diaminobenzidine,BrdU)购自美国Sigma公司;DCX抗体购自美国Millipore公司;BrdU抗体购自美国Abcam公司;Alexa 594、Alexa488免疫荧光二抗购自美国Invitrogen公司。大鼠随机分为4组:假手术组(Sham组)、梗死组、梗死后CIMT组(CIMT组)、梗死后CIMT结合抗抑郁治疗组(CIMT+FLUO组),每组6只。脑梗死模型后7 d CIMT组大鼠、CIMT+FLUO组进行CIMT,持续3周;同时CIMT+FLUO组大鼠氟西汀(16 mg/kg)口服,持续3周。
1.2 方法 1.2.1 大鼠脑梗死模型制备[2]采用大鼠颅内立体定向注射ET-1的方法制作脑梗死模型。参照大鼠脑解剖图谱,使用立体定位仪将ET-1注射到大鼠大脑皮质的运动区及纹状体区域以形成局部脑梗死模型。使用微量注射器将ET-1(0.5 μL/min)注入3处[前囟为中心向前(anteroposterior,AP)、前囟为中心向侧方(mediolateral,ML)、前囟为中心向下方(dorsoventral,DV)] [5],(1)AP=0.7 mm,ML=2.2 mm,DV=-2.0 mm;(2)AP=2.3 mm,ML=2.5 mm,DV=-2.3 mm;(3)AP=0.7 mm,ML=3.8 mm,DV=-5.8 mm。每处注ET-1 2 μL,总量6 μL。每次注药1 μL后停留1 min。每处注射完需将注射器针头停留在针道内3 min,并缓慢拔出针头。假手术组在相同的位点注射等量生理盐水。
1.2.2 大鼠强制运动模型参照以往实验[6-7],将大鼠上部躯干及同侧前肢紧靠胸骨在石膏绷带内放置于自然回缩姿势,将石膏绷带捆绑于肢体和躯干外面,进而能够有效地限制大鼠健侧肢体(梗死病灶同侧)前肢活动,强制运动模型建立成功。
1.2.3 BrdU标记脑梗死模型建立后第5天、第6天,分别于早晚向大鼠腹腔内注射BrdU(100 mg/kg)以标记新生细胞。
1.2.4 免疫荧光染色脑梗死模型建立4周后采用免疫荧光双染来检测侧脑室旁新生神经细胞数量。冰冻切片0.01 mol/L PBS漂洗3次,每次10 min,37 ℃水浴30 min,阻断缓冲液(PBS/0.4%TritonX-100/5%羊血清)孵育90 min后加一抗,在抗体稀释液(PBS/0.4% Triton X-100/3% BSA)中4 ℃过夜。一抗过夜后使用0.01 mol/L PBS漂洗3次,每次5 min,荧光共轭二抗室温中避光孵育2 h。用0.01 mol/L PBS再次漂洗3次,每次5 min。最后使用抗荧光淬灭封片液封片。
1.2.5 梯形平衡木行走实验应用梯形平衡木测试脑梗死大鼠的肢体运动功能[2]。梯形平衡木由1个窄的梯形木条叠加在1个宽的梯形木条上构成。大鼠从宽的一侧走到窄的一侧过程中,观察大鼠前爪是否能准确搭在窄的木条上,通过计算错误步伐步数来评估运动功能损伤情况。大鼠从宽的那面走到窄的那面,如果前爪或后爪放在了下面宽的梯形木条,为1个错误脚步。如果前爪或后爪搭在了上面窄的梯形木条的边缘上,为0.5个错误脚步。前爪或后爪放在了上面窄的梯形木,为1个正确脚步。计数大鼠通过平衡木所需的脚步总数(正确与错误脚步数总和),计算错误百分率(错误脚步数/脚步总数)。错误百分率越大说明运动功能受损越严重。
1.3 统计学分析采用SPSS 16.0软件进行统计分析。数据以x±s表示,多组间比较采用单向方差分析,2组间比较采用Post Hoc检验中LSD法,P < 0.05为差异有统计学意义。
2 结果 2.1 大鼠脑梗死模型制备及梗死体积比较结果显示,注射ET-1能引起明显的梗死灶(图 1),大鼠脑梗死模型制备成功。梗死组、CIMT组及CIMT+FLUO组脑梗死体积分别为(135.6±16.28)mm3、(130.3±14.54)mm3、(148.6±10.91)mm3,3组比较没有统计学差异(P > 0.05)。
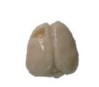
|
| 图 1 大鼠脑梗死模型 Fig.1 General model of cerebral infarction |
2.2 3组大鼠侧脑室下区新生神经细胞比较
结果显示,脑梗死模型建立后4周,与Sham组(16.5±1.8)比较,脑梗死组侧脑室下区新生神经细胞(28.4±2.4)在脑梗死后明显增多(P < 0.01)。与脑梗死组比较,CIMT组侧脑室下区新生神经细胞(53.6±3.5)增殖明显(P < 0.01)。但CIMT+FLUO组(56.2±2.8)与CIMT组比较无统计学差异(P > 0.05),见图 2。
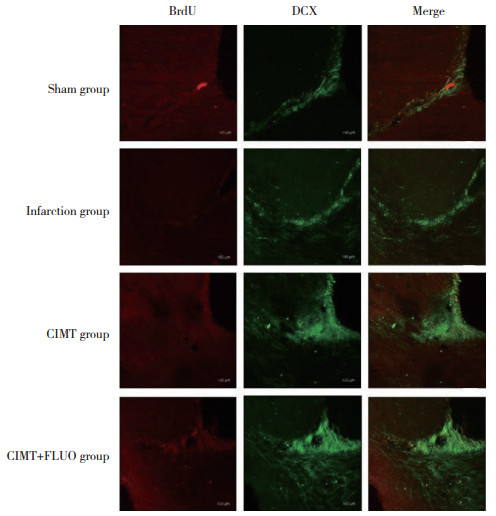
|
| 图 2 脑梗死后4周大鼠侧脑室下区新生神经细胞增殖情况×20 Fig.2 Proliferation of new neurons in the subventricular zone at 4 weeks after cerebral infarction×20 |
2.3 各组大鼠运动神经功能恢复比较
采用梯形平衡木行走测试来检测大鼠运动神经功能恢复情况。结果显示,与假手术组[(8.44±4.3)%]比较,梗死组大鼠平衡木的错误百分率明显增高[(24.83±2.7)%,P < 0.01];CIMT组[(12.91±3.6)%]较梗死组大鼠平衡木的错误百分率明显降低(P < 0.05);CIMT+FLUO组[(11.92±5.2)%]平衡木错误百分率与CIMT组比较没有统计学差异(P > 0.05)。说明CIMT能够显著降低脑梗死后运动障碍,而氟西汀联合CIMT并没有进一步增加这种有益作用。
3 讨论CIMT来源于习得性废用理论,有研究[8]使用神经影像学技术(功能磁共振、正电子发射技术或经颅磁刺激)证实CIMT可以增大患侧半球皮层代表区的面积,激活受损皮层及附近的脑组织,促进脑梗死患者患侧肢体功能的恢复。以往研究[2]表明脑梗死后侧脑室下区会产生大量的神经前体细胞,本研究使用BrdU/DCX双染方法证实了脑梗死后有大量的新生神经前体细胞产生,与以往研究结果一致。结果显示,大鼠脑梗死后进行CIMT可能通过改善脑梗死后的微环境促进了侧脑室下区新生神经细胞的增殖,揭示了CIMT在临床促进功能康复的分子机制。
强制固定患者健侧肢体会引起紧张,长期处于紧张压力中机体内环境会发生改变,紧张压力也是一种慢性应激,目前,国内外已有许多关于慢性应激可损害学习记忆功能并影响神经发生的研究[3-4],患者固定健侧肢体势必会引发慢性应激状态。已经证实应激是一种潜在的神经发生抑制因素。氟西汀是一种五羟色胺再摄取抑制剂,临床用来治疗抑郁及焦虑[9]。长期氟西汀治疗可以促进脑梗死大鼠海马新生神经细胞增殖、存活以及分化,并增强突触的可塑性[10]。
然而动物模型相关实验[11-13]显示氟西汀对侧脑室的神经发生是否有促进作用存在争议。有研究[14]认为氟西汀对侧脑室的神经发生没有影响。本研究显示CIMT能够促进脑梗死大鼠后侧脑室新生的神经前体细胞增殖及运动功能恢复,但氟西汀联合CIMT对大鼠侧脑室的神经发生没有促进作用。一项临床随机对照研究[15]显示氟西汀能够促进脑梗死后康复,但是动物研究[13, 16]显示氟西汀对脑梗死后运功功能恢复并没有产生很明确的积极影响,本研究梯形平衡木行走实验也没有发现脑梗死后大鼠给予CIMT并用氟西汀治疗对运动功能恢复有积极的影响。究其原因可能是脑梗死患者抑郁情绪改善能够使他们更主动地参与功能康复训练,然而在动物脑梗死模型中,可能这种抑郁情绪很少存在[17],因此,CIMT能够促进大鼠运动功能恢复,而并用氟西汀对运动功能恢复并没有改善作用。
综上所述,CIMT促进神经发生,从而促进了运动功能恢复,而CIMT结合氟西汀治疗对侧脑室神经发生并没有进一步促进作用,同时对运动功能恢复也没有进一步改变。但本研究仅是动物实验,需要进一步探讨CIMT结合氟西汀治疗对脑梗死患者预后的作用,以期为脑梗死患者康复提供新的干预靶点。
| [1] |
赵丹, 徐传伟, 李敏, 等. 强化康复护理对脑梗死患者运动功能日常生活能力及负性情绪的影响[J]. 山西医药杂志, 2018, 7(3): 842-844. DOI:10.3969/j.issn.0253-9926.2018.07.046 |
| [2] |
ZHAO S, ZHAO M, XIAO T, et al. Constraint-induced movement therapy overcomes the intrinsic axonal growth-inhibitory signals in stroke rats[J]. Stroke, 2013, 44(6): 1698-1705. DOI:10.1161/STROKEAHA.111.000361 |
| [3] |
DANZER SC. Depression, stress, epilepsy and adult neurogenesis[J]. Exp Neurol, 2012, 233(1): 22-32. DOI:10.1016/j.expneurol.2011.05.023 |
| [4] |
PERERA TD, DWORK AJ, KEEGAN KA, et al. Necessity of hippocampal neurogenesis for the therapeutic action of antidepressants in adult nonhuman primates[J]. PLoS One, 2011, 6(4): e17600. DOI:10.1371/journal.pone.0017600 |
| [5] |
SOLEMAN S, YIP P, LEASURE JL, et al. Sustained sensorimotor impairments after endothelin-1 induced focal cerebral ischemia (stroke) in aged rats[J]. Exp Neurol, 2010, 222(1): 13-24. DOI:10.1016/j.expneurol.2009.11.007 |
| [6] |
MULLER HD, HANUMANTHIAN KM, DIEDERERICH K, et al. Brain-derived neurotrophic factor but not forced arm use improves long-term outcome after photothrombotic stroke and transiently upregulates binding densities of excitatory glutamate receptors in the rat brain[J]. Stroke, 2008, 39(3): 1012-1021. DOI:10.1161/STROKEAHA.107.495069 |
| [7] |
ISHIDA A, UEDA Y, ISHIDA K, et al. Minor neuronal damage and recovered cellular proliferation in the hippocampus after continuous unilateral forelimb restraint in normal rats[J]. J Neurosci Res, 2011, 89(3): 457-465. DOI:10.1002/jnr.22566 |
| [8] |
TARKKA IM, KÖNONEN M, PITKÄNEN K, et al. Alterations in cortical excitability in chronic stroke after constraint-induced movement therapy[J]. Neurol Res, 2008, 30(5): 504-510. DOI:10.1179/016164107X252519 |
| [9] |
GIACOMINI ACVV, ABREU MS, GIACOMINI LV, et al. Fluoxetine and diazepam acutely modulate stress induced-behavior[J]. Behav Brain Res, 2016, 296: 301-310. DOI:10.1016/j.bbr.2015.09.027 |
| [10] |
KHODANOVICH M, KISEL A, KUDABAEVA M, et al. Effects of fluoxetine on hippocampal neurogenesis and neuroprotection in the model of global cerebral ischemia in rats[J]. Int J Mol Sci, 2018, 19(1): E162. DOI:10.3390/ijms19010162 |
| [11] |
OHIRA K, MIYAKAWA T. Chronic treatment with fluoxetine for more than 6 weeks decreases neurogenesis in the subventricular zone of adult mice[J]. Mol Brain, 2011, 4(1): 10. DOI:10.1186/1756-6606-4-10 |
| [12] |
OHIRA K, TAKEUCHI R, SHOJI H, et al. Fluoxetine-induced cortical adult neurogenesis[J]. Neuropsychopharmacology, 2013, 38(6): 909-920. DOI:10.1038/npp.2013.2 |
| [13] |
SUN X, LIU T, ZHAO M, et al. Fluoxetine enhanced neurogenesis is not translated to functional outcome in stroke rats[J]. Neurosci Lett, 2015, 603: 31-36. DOI:10.1016/j.neulet.2015.06.061 |
| [14] |
MAHEU ME, DEVORAK J, FREIBAUER A, et al. Increased doublecortin (DCX) expression and incidence of DCX-immunoreactive multipolar cells in the subventricular zone-olfactory bulb system of suicides[J]. Front Neuroanat, 2015, 9: 74. DOI:10.3389/fnana.2015.00074 |
| [15] |
CHOLLET F, TARDY J, ALBUCHER JF, et al. Fluoxetine for motor recovery after acute ischaemic stroke (FLAME):a randomised placebo-controlled trial[J]. Lancet Neurol, 2011, 10(2): 123-130. DOI:10.1016/S1474-4422(10)70314-8 |
| [16] |
TONI N, LAPLAGNE DA, ZHAO C, et al. Neurons born in the adult dentate gyrus form functional synapses with target cells[J]. Nat Neurosci, 2008, 11(8): 901-907. DOI:10.1038/nn.2156 |
| [17] |
WINDLE V, CORBETT D. Fluoxetine and recovery of motor function after focal ischemia in rats[J]. Brain Res, 2005, 1044(1): 25-32. DOI:10.1016/j.brainres.2005.02.060 |
 2018, Vol. 47
2018, Vol. 47