文章信息
- 王冰, 黄宝俊, 解大龙, 赵丹懿
- WANG Bing, HUANG Baojun, XIE Dalong, ZHAO Danyi
- 沉默长链非编码RNA浆细胞瘤可变易位1基因提高胃癌细胞对阿霉素的化疗敏感性
- Knockdown of Long Noncoding RNA Plasmacytoma Variant Translocation 1 Enhances Chemosensitivity of Gastric Cancer Cells to Adriamycin
- 中国医科大学学报, 2018, 47(12): 1081-1084, 1106
- Journal of China Medical University, 2018, 47(12): 1081-1084, 1106
-
文章历史
- 收稿日期:2018-04-05
- 网络出版时间:2018-11-28 16:33
2. 中国医科大学附属第一医院肿瘤外科, 沈阳 110004;
3. 中国医科大学基础医学院解剖学教研室, 沈阳 110122
2. Department of Surgical oncology, The First Hospital, China Medical University, Shenyang 110004, China;
3. Department of Anatomy, College of Basic Medical Science, China Medical University, Shenyang 110122, China
胃癌是起源于胃黏膜上皮的恶性肿瘤,是最常见的恶性肿瘤之一,在我国其发病率居各类肿瘤之首,且发病率及死亡率呈逐年上升趋势[1-2]。胃癌的治疗策略是手术结合放化疗的综合治疗,化疗能够显著改善胃癌的预后,降低胃癌的转移和复发。但化疗耐药降低了胃癌对化疗药物的敏感性,限制了化疗的临床应用[3]。因此,深入研究胃癌化疗耐药发生的分子机制,寻找新的治疗靶点是胃癌研究的方向和重点。
长链非编码RNA(long non-coding RNA,lncRNA)是近年来生命科学特别是肿瘤学研究的热点,因其缺少或没有开放阅读框而无蛋白编码功能,通常以RNA形式通过表观遗传调控或转录调控等方式调控功能基因的表达水平[4-5]。目前,肿瘤中差异表达lncRNA已经为肿瘤的预后判断和治疗提供了新的方向[6-7]。近期研究[8-11]发现,浆细胞瘤可变易位1(lncRNA-plasmacytoma variant translocation 1,lncRNA-PVT1)基因在包括胃癌的多种肿瘤中均存在表达和功能的异常,并作为潜在的癌基因发挥作用。本研究拟探讨PVT1基因对胃癌细胞化疗敏感性的调控作用。
1 材料与方法 1.1 材料 1.1.1 研究对象胃癌阿霉素耐药细胞SGC7901/ADR由本课题组构建并保存[12-13]。
1.1.2 主要试剂胎牛血清及DMEM高糖培养基购自美国Gibco公司;PrimeScriptTM RT Master Mix反转录试剂盒购自北京宝日医生物技术公司;扩增引物由上海生工生物工程公司合成;RNA提取试剂TRNzol及lnRcute lncRNA荧光定量检测试剂盒购自北京天根生化科技公司;PVT1抑制物SmartSilencer-PVT1(ss-PVT1)及其对照ss-NC由广州锐博生物科技公司合成;转染试剂HiPerFect购自德国QIAGEN公司;阿霉素和碘化丙啶(propidium iodide,PI)为美国Sigma-aldrich公司产品;增强型CCK8试剂盒购自上海碧云天生物技术公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自南京建成生物工程研究所。
1.2 方法 1.2.1 实时定量PCR应用TRNzol试剂按照说明书指导提取待测细胞的总RNA,反转录成cDNA。以β-actin为内参基因,应用lnRcute lncRNA荧光定量检测试剂盒扩增PVT1基因。PVT1的上游引物为5’- BUCCCCTTCTATGGGAATCACTA -3’,下游引物为5’- GGGBUCAGAGATGAAATCGTAAT -3’;β-actin的上游引物为5’- GCACCACACCTTCTACAATGAG-3’,下游引物为5’- ACAGCCTGGATGGCTACGT -3’。反应体系为:2倍浓度lnR预混液12.5 μL,50倍浓度ROX参比染料0.5 μL,上游/下游引物(10 μmol/L)各0.625 μL,cDNA模板1 μL,加无核酸酶水至25 μL。反应条件为95 ℃ 30 s,然后按95 ℃ 5 s,60 ℃ 30 s进行40个循环。应用比较CT值法对PVT1的表达量进行相对定量分析。
1.2.2 细胞转染在转染之前,将5×104个待测细胞接种在6孔板中,常规培养24 h。应用HiPerFect转染试剂按照说明书指导,将ss-PVT1及ss-NC分别转染待测细胞,常规培养5~6 h,更换培养基后继续常规培养48 h。转染ss-NC的细胞为阴性对照组,转染ss-TUG1的细胞为PVT1沉默组。
1.2.3 增强型CCK8法检测细胞增殖活力将待测细胞进行常规消化后,离心并重悬于无血清培养基中(密度为1×105/mL)。将100 μL细胞悬液接种于96孔板中,然后加入10 μL CCK-8试剂,37 ℃孵育2 h,应用酶标仪处测定吸光度值(450 nm)。
1.2.4 单标流式细胞术检测细胞周期待测细胞经胰酶消化处理为单个细胞,冰乙醇固定,RNaseA(终浓度为0.1 g/L)消化30 min;然后用250 μL PI(0.05 g/L)室温避光染色30 min;流式细胞仪(FACScan,BectonDickison)检测,激发波长为488 nm,发射波长为635 nm;CELLQuest3.0软件分析细胞周期。
1.2.5 双标流式细胞术检测细胞凋亡待测细胞经不含EDTA的胰酶消化、离心;PBS清洗,离心后弃掉上清,加入500 µL结合液轻轻重悬细胞;加入5 µL Annexin V-FITC,轻轻混匀;再加入5 μL PI,轻轻混匀。室温避光孵育10 min,流式细胞仪检测凋亡率,位于右下象限的FITC-Annexin V阳性/PI阴性的细胞为凋亡细胞。
1.2.6 药物敏感性检测将待测细胞接种于96孔板,常规培养12 h。然后,应用不同浓度(0.1 μg/mL、0.5 μg/mL、1 μg/mL、5 μg/mL、10 μg/mL和50 μg/mL)的阿霉素处理待测细胞[12-13]。48 h后应用增强型CCK8法检测各组细胞的OD值。采用Probit回归模型计算半数抑制浓度(half maximal inhibitory concentration,IC50)。
1.3 统计学分析应用SPSS 21.0统计软件对数据进行统计分析。每组实验重复5次,计量资料以x±s表示。阴性对照组与PVT1沉默组中PVT1的表达以及细胞增殖活力、细胞周期和细胞凋亡的比较分析采用t检验。P < 0.05为差异有统计学意义。
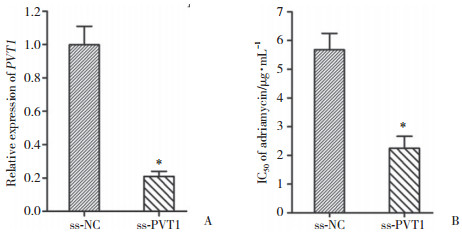
2 结果 2.1 PVT1沉默提高SGC7901/ADR细胞对阿霉素的敏感性将ss-PVT1转染SGC7901/ADR细胞后,应用实时定量PCR检测PVT1基因的沉默效果,结果显示,转染ss-PVT1能够显著降低SGC7901/ADR细胞中PVT1基因的表达(图 1A,P < 0.05)。
|
| A,expression of PVT1 gene in SGC7901/ADR cells;B,IC50 of adriamycin in SGC7901/ADR cells. * P < 0.05 compared with ss-NC group. 图 1 PVT1沉默提高SGC7901/ADR细胞对阿霉素的敏感性 Fig.1 Silencing of PVT1 enhances the chemosensitivity of SGC7901/ADR cells to adriamycin |
然后,检测PVT1基因沉默的SGC7901/ADR细胞对阿霉素的敏感性。结果发现,PVT1沉默的SGC7901/ADR细胞中阿霉素的半数抑制浓度为(2.25±0.42)μg/mL,而在转染ss-NC的SGC7901/ADR细胞中,阿霉素的IC50为(5.68±0.57)μg/mL(图 1B,P < 0.05)。PVT1沉默显著抑制了阿霉素在SGC7901/ADR细胞中IC50,增强了SGC7901/ADR细胞对阿霉素的化疗敏感性。
2.2 PVT1沉默显著增强了阿霉素对SGC7901/ADR细胞的细胞毒性效应应用0.5 μg/mL的阿霉素处理SGC7901/ADR细胞,结果发现,与转染ss-NC的SGC7901/ADR细胞相比,PVT1沉默的SGC7901/ADR细胞的增殖活力显著降低(图 2A,P < 0.05),细胞阻滞于G1期(图 2B,P < 0.05),而且细胞凋亡率明显增加(图 2C,P < 0.05)。

|
| A,the proliferation of SGC7901/ADR cells;B,the cell cycle of SGC7901/ADR cells;C,the cell apoptosis of SGC7901/ADR cells under influence of 0.5 μg/mL adriamycin. * P < 0.05 compared with ss-NC group. 图 2 PVT1沉默显著增强了阿霉素对SGC7901/ADR细胞的细胞毒性效应 Fig.2 Silencing of PVT1 enhances adriamycin-induced cytotoxicity to SGC7901/ADR cells |
3 讨论
近年来的研究显示,非编码RNA特别是lncRNA与肿瘤化疗耐药的发生密切相关,多种lncRNA的异常表达和功能促进了化疗耐药的发生和进展,某些lncRNA能够作为恶性肿瘤特别是胃癌化疗效果不佳以及预后不良的分子标志物。例如,FANG等[14]报道尿路上皮癌相关1(urothelial carcinoma associated 1,UCA1)基因能够通过下调miR-27b促进胃癌细胞对化疗药物阿霉素、顺铂和5-氟尿嘧啶的耐药性;前期研究[12]发现,核富集丰富转录物1(nuclear-enriched abundant transcript 1,NEAT1)基因高表达与胃癌患者对阿霉素的低反应密切相关,敲除NEAT1能够抑制胃癌对阿霉素的耐药性。
PVT1与肿瘤化疗相关的研究较少,近期的研究[15-17]发现,PVT1与结直肠癌、卵巢癌和胰腺癌的化疗耐药相关。而且ZHANG等[18-19]研究发现,PVT1在顺铂耐药的胃癌组织和细胞系中表达上调,PVT1的高表达能够促进胃癌对顺铂的耐药。但PVT1是否参与恶性肿瘤特别是胃癌对阿霉素的耐药尚无报道。
在前期的研究工作中,建立了阿霉素耐药的SGC7901/ADR细胞,其显示出了对阿霉素明显的耐药性,耐药指数为4.28[13]。阿霉素属于抗肿瘤抗生素,抗瘤谱较为广泛,对包括胃癌的多种肿瘤均有较强的治疗作用。阿霉素主要通过嵌入DNA进而抑制核酸的合成,具有较强的细胞毒性作用,对各种生长周期的肿瘤细胞都有杀灭作用。
本研究发现,应用RNA干扰技术可以靶向沉默SGC7901/ADR细胞中PVT1的表达。药物敏感性实验发现,PVT1沉默能够显著降低阿霉素在SGC7901/ADR细胞中IC50,提高SGC7901/ADR细胞对阿霉素的化疗敏感性。同时,在0.5 μg/mL的阿霉素的作用下,PVT1沉默能够抑制SGC7901/ADR细胞的增殖活力,阻滞细胞于G1期,促进细胞凋亡。PVT1沉默能够提高SGC7901/ADR细胞对阿霉素的化疗敏感性,并提高阿霉素诱导的细胞毒性作用。但PVT1基因在胃癌化疗耐药中分子机制尚不清楚,还需要进一步的深入研究。ZHANG等[19]报道PVT1能够逆转康莱特胶囊对多药耐药蛋白1(multidrug resistance protein 1,MDR1)基因的抑制作用。MDR1基因编码P糖蛋白,其位于细胞膜上,具有药物泵作用,能够将进入细胞的药物泵出细胞外进而使肿瘤细胞对化疗药物产生耐药。因此,可以推测PVT1可能通过上调MDR1的表达促进胃癌细胞对阿霉素的耐药。
综上所述,本研究首次发现lncRNA-PVT1与胃癌的化疗耐药相关,PVT1沉默能够提高胃癌耐药细胞对阿霉素的化疗敏感性。这有助于明确胃癌化疗耐药的发生机制,为胃癌的分子治疗提供新的靶点。
| [1] |
INOKUCHI M, OTSUKI S, FUJIMORI Y, et al. Clinical significance of MET in gastric cancer[J]. World J Gastrointest Oncol, 2015, 7(11): 317-327. DOI:10.4251/wjgo.v7.i11.317 |
| [2] |
SONG Z, WU Y, YANG J, et al. Progress in the treatment of advanced gastric cancer[J]. Tumour Biol, 2017, 39(7): 1010428317714626. DOI:10.1177/1010428317714626 |
| [3] |
YANG W, MA J, ZHOU W, et al. Molecular mechanisms and theranostic potential of miRNAs in drug resistance of gastric cancer[J]. Expert Opin Ther Targets, 2017, 21(11): 1063-1075. DOI:10.1080/14728222.2017 |
| [4] |
MARCHESE FP, RAIMONDI I, HUARTE M. The multidimensional mechanisms of long noncoding RNA function[J]. Genome Biol, 2017, 18(1): 206. DOI:10.1186/s13059-017-1348-2 |
| [5] |
SUN W, YANG Y, XU C, et al. Regulatory mechanisms of long noncoding RNAs on gene expression in cancers[J]. Cancer Genet, 2017(216/217): 105-110. DOI:10.1016/j.cancergen.2017.06.003 |
| [6] |
MAO H, WANG K, FENG Y, et al. Prognostic role of long non-coding RNA XIST expression in patients with solid tumors:a meta-analysis[J]. Cancer Cell Int, 2018, 18: 34. DOI:10.1186/s12935-018-0535-x |
| [7] |
ZHOU R, CHEN KK, ZHANG J, et al. The decade of exosomal long RNA species:an emerging cancer antagonist[J]. Mol Cancer, 2018, 17(1): 75. DOI:10.1186/s12943-018-0823-z |
| [8] |
CHANG Z, CUI J, SONG Y. Long noncoding RNA PVT1 promotes EMT via mediating microRNA-186 targeting of Twist1 in prostate cancer[J]. Gene, 2018, 654: 36-42. DOI:10.1016/j.gene.2018.02.036 |
| [9] |
GUO D, WANG Y, REN K, et al. Knockdown of lncRNA PVT1 inhibits tumorigenesis in non-small-cell lung cancer by regulating miR-497 expression[J]. Exp Cell Res, 2018, 362(1): 172-179. DOI:10.1016/j.yexcr.2017.11.014 |
| [10] |
HUANG T, LIU HW, CHEN JQ, et al. The long noncoding RNA PVT1 functions as a competing endogenous RNA by sponging miR-186 in gastric cancer[J]. Biomed Pharmacother, 2017, 88: 302-308. DOI:10.1016/j.biopha.2017.01.049 |
| [11] |
YUAN CL, LI H, ZHU L, et al. Aberrant expression of long noncoding RNA PVT1 and its diagnostic and prognostic significance in patients with gastric cancer[J]. Neoplasma, 2016, 63(3): 442-449. DOI:10.4149/314_150825N45 |
| [12] |
ZHANG J, ZHAO B, CHEN X, et al. Silence of long noncoding RNA NEAT1 inhibits malignant biological behaviors and chemotherapy resistance in gastric cancer[J]. Pathol Oncol Res, 2018, 24(1): 109-113. DOI:10.1007/s12253-017-0233-3 |
| [13] |
SHANG C, GUO Y, ZHANG J, et al. Silence of long noncoding RNA UCA1 inhibits malignant proliferation and chemotherapy resistance to adriamycin in gastric cancer[J]. Cancer Chemother Pharmacol, 2016, 77(5): 1061-1067. DOI:10.1007/s00280-016-3029-3 |
| [14] |
FANG Q, CHEN X, ZHI X. Long non-coding RNA (LncRNA) urothelial carcinoma associated 1(UCA1) increases multi-drug resistance of gastric cancer via downregulating miR-27b[J]. Med Sci Monit, 2016, 22: 3506-3513. DOI:10.12659/MSM.900688 |
| [15] |
PING G, XIONG W, ZHANG L, et al. Silencing long noncoding RNA PVT1 inhibits tumorigenesis and cisplatin resistance of colorectal cancer[J]. Am J Transl Res, 2018, 10(1): 138-149. |
| [16] |
LIU E, LIU Z, ZHOU Y, et al. Overexpression of long non-coding RNA PVT1 in ovarian cancer cells promotes cisplatin resistance by regulating apoptotic pathways[J]. Int J Clin Exp Med, 2015, 8(11): 20565-20572. |
| [17] |
YOSHIDA K, TODEN S, RAVINDRANATHAN P, et al. Curcumin sensitizes pancreatic cancer cells to gemcitabine by attenuating PRC2 subunit EZH2, and the lncRNA PVT1 expression[J]. Carcinogenesis, 2017, 38(10): 1036-1046. DOI:10.1093/carcin/bgx065 |
| [18] |
ZHANG XW, BU P, LIU L, et al. Overexpression of long non-coding RNA PVT1 in gastric cancer cells promotes the development of multidrug resistance[J]. Biochem Biophys Res Commun, 2015, 462(3): 227-232. DOI:10.1016/j.bbrc.2015.04.121 |
| [19] |
ZHANG XW, LIU L, ZHANG XZ, et al. Kanglaite inhibits the expression of drug resistance genes through suppressing PVT1 in cisplatin-resistant gastric cancer cells[J]. Exp Ther Med, 2017, 14(2): 1789-1794. DOI:10.3892/etm.2017.4650 |
 2018, Vol. 47
2018, Vol. 47