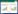文章信息
- 田玉楼, 于默, 史娅婕, 张薇
- TIAN Yulou, YU Mo, SHI Yajie, ZHANG Wei
- OTX2基因表达下调对MC3T3-E1细胞增殖分化和自噬的影响
- Effect of OTX2 Downregulation on Proliferation and Autophagy in MC3T3-E1 Cells
- 中国医科大学学报, 2018, 47(11): 1015-1020
- Journal of China Medical University, 2018, 47(11): 1015-1020
-
文章历史
- 收稿日期:2018-05-09
- 网络出版时间:2018-11-01 14:08
骨性反牙合是临床中常见的错牙合畸形,下颌骨发育过度是其主要发病机制,目前虽尚未有明确的易感基因,但口腔颌面发育相关基因表达水平的变化会影响其发生。OTX2属于邻位齿状同源盒(orthodentielehomeo-box,OTX)基因家族的一员,在颅面和脑前结构的生长发育中起关键作用,参与第一鳃弓和第二鳃弓的形成。OTX基因家族是骨性反牙合的候选基因,参与调控下颌骨的生长发育[1]。OTX2基因的缺失可能引起口腔、下颌骨、脊椎等的发育缺陷,引发眼-耳-脊椎综合征[2]。
自噬是一种广泛存在于真核细胞中的高度保守的过程,是骨形成和发育过程中不可缺少的调节因子[3-4]。自噬可增强颅颌面骨骨髓间充质干细胞的增殖和抗凋亡能力,调控其向成骨细胞分化[5-6],还可以帮助处于应激条件下的成骨细胞抵御环境变化,维持其增殖和正常生理功能[7]。通过抑制成骨细胞自噬水平可以抑制该细胞增殖[8],提示自噬与成骨细胞的形成和细胞增殖有密切关系,降低成骨细胞的自噬水平可以引起成骨细胞的增殖减少。
本研究应用小干扰RNA(small inteference RNA,siRNA)技术下调小鼠成骨细胞系MC3T3-E1中OTX2的表达水平,检测其对成骨细胞增殖、分化的影响,观察自噬水平的改变,为阐明骨性反牙合的分子遗传机制奠定实验基础。
1 材料与方法 1.1 主要试剂αMEM培养基(美国Hyclone公司),胎牛血清(美国CLARK公司),抗OTX2抗体(英国Abcam公司),siRNA-mate转染试剂和化学合成的OTX2-siRNA(苏州吉玛公司),SABC试剂盒及DAB显色试剂(武汉博士德公司),碱性磷酸酶(alkaline phosphatase,ALP)测试盒(南京建成生物工程研究所),MTT细胞增殖及细胞毒性检测试剂盒、细胞周期检测试剂盒、AnnexinV-FITC/PI细胞凋亡检测试剂盒、自噬染色检测试剂盒(MDC法)均购自江苏凯基生物技术股份有限公司。
1.2 方法 1.2.1 细胞培养和转染小鼠成骨细胞系MC3T3-E1购自中科院细胞库,在含10%胎牛血清、1%双抗的αMEM中于37 ℃、5%CO2培养箱中培养。3~4 d传代1次,当细胞生长为对数期时进行实验。设计3对靶向的OTX2-siRNA序列,用于转染MC3T3-E1细胞系。OTX2-siRNA合成序列如下,OTX2-mus-868,5’-GCAGUGCUCCAGUGUCUAU TT-3’,5’-AUAGACACUGGAGCACUGCTT-3’;OTX2-mus-1027,5’-GCAUGGACUGUGGAUCUUAT T-3’,5’-UAAGAUCCACAGUCCAUGCTT-3’;OTX2-mus-1225,5’-CCUCUUGGAAGCUUAACUUTT-3’,5’-AAGUUAAGCUUCCAAGAGGTT-3’;阴性对照siRNA,5’-UUCUCCGAACGUGUCACGUTT-3’,5’-ACGUGACACGUUCGGAGAATT-3’。将MC3T3- E1细胞随机分为OTX2-mus-868组、OTX2-mus-1027组、OTX2-mus-1225组、阴性对照组及空白对照组。将MC3T3-E1接种在无菌6孔板中(2×105/孔),待细胞融合达80%左右,参照siRNA-mate说明书进行转染,48 h收集细胞。
1.2.2 免疫细胞化学法检测各组细胞OTX2蛋白表达消化MC3T3-E1,并调整细胞浓度至1×106/mL,分别取100 μL单细胞悬液滴加在预先放置无菌盖玻片的6孔板内,细胞培养24 h后转染。转染48 h后,取出细胞爬片,冷丙酮固定30 min,用30%过氧化氢+纯甲醇混合液浸泡35 min,PBS冲洗,再用5%BSA封闭30 min,滴加1:400稀释的一抗,4 ℃反应16 h,PBS冲洗,再滴加二抗37 ℃孵育20 min,PBS冲洗,SABC试剂继续孵育20 min,最后用加入含0.015%Tween20的PBS洗涤切片,DAB显色3 min,封片,观察。20倍物镜下,随机选取5个视野,计数100个细胞中的阳性细胞数,计算各组阳性细胞所占百分比,并进行统计分析。选取免疫细胞化学检测后干扰效果最好的一组OTX2-siRNA进行后续实验。
1.2.3 MTT法检测细胞增殖消化转染后细胞,以2×104/mL浓度接种于96孔板,每孔200 μL混匀。设立不含细胞的空白组,共4组,每组设4个平行孔。转染48 h后,每孔中加入1×MTT 50 μL,置培养箱中继续培养4 h,吸出上清液,加入DMSO150 μL,平板摇床摇匀5 min,使其充分溶解,利用酶标仪在550 nm处读取光密度(optical density,OD)值。计算比较各组细胞抑制率[细胞抑制率(%)=1-(OD实验组-OD空白组)/(OD对照组-OD空白组)×100]。
1.2.4 流式细胞术检测细胞周期无EDTA的胰酶消化转染后48 h细胞,取1 mL单细胞悬液(浓度为1×106/mL),离心去上清,70%冷乙醇4 ℃过夜,冲洗离心后加入100 μL RNase A,37 ℃水浴30 min,加入400 μL碘化丙啶(propidium iodide,PI)避光染色,4 ℃静置30 min,上机检测,激发波长488 nm处红色荧光,计算各组细胞S期细胞比例和增殖指数。
1.2.5 AnnexinV-EGFP/PI双标记法检测细胞凋亡转染48 h细胞消化后,2 000 r/min离心5 min收集,用预冷PBS洗涤细胞2次,离心收集细胞,加入500 μL Binding Buffer重新悬浮细胞,再依次加入5 μL AnnexinV-EGFP混匀,5 μL PI混匀,室温避光反应15 min,流式细胞仪检测。
1.2.6 化学比色法检测ALP合成情况吸取转染后48 h的细胞培养液,2 500 r/min离心10 min,取上清液进行测定。按照ALP检测试剂盒说明配制反应液,分别设空白孔、标准孔和测定孔,充分混匀并置于37 ℃水浴15 min,轻轻振摇孔板混匀,于波长520 nm,酶标仪检测各孔OD值。培养液中ALP活力(金氏单位/100 mL)=[(测定OD值-空白OD值)/(标准OD值-空白OD值)]×酚标准品浓度(0.1 mg/mL)× 100 mL×样品测定前稀释倍数。
1.2.7 MDC检测细胞自噬水平细胞爬片转染48 h后,弃掉原培养基,加入300 μL 1×wash buffer洗涤,每孔加入100 μL配置好的MDC染色工作液,室温避光染色20 min。300 μL 1×wash buffer清洗3次,滴加100 μL collection buffer,加盖玻片。荧光显微镜下用紫外光激发,观察、拍照。高倍镜(×40)下计数100个细胞,计算绿色荧光细胞占细胞总数的百分比。
1.3 统计学分析实验数据用x±s表示,采用SPSS 21.0统计软件对多组间参数进行单因素方差分析,P < 0.05为差异有统计学意义。
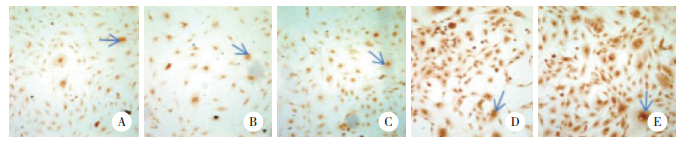
2 结果 2.1 各组转染细胞OTX2蛋白表达情况与阴性对照组和空白对照组相比,3个OTX2- siRNA转染组细胞染色明显变浅,OTX2蛋白表达水平下调。阳性细胞百分率计数结果显示,OTX2-mus- 868组为(37.0±2.0)%、OTX2-mus-1027组为(49.2± 1.9)%、OTX2-mus-1225组为(45.0±1.6)%,阴性对照组为(96.4±2.0)%、空白对照组为(96.6±1.1)%,3个OTX2转染组与阴性对照组之间阳性细胞百分比的差异有统计学意义(P < 0.05),其中OTX2-mus-868组表达水平最低,故后续实验选用OTX2-mus-868转染细胞作为实验组;阴性对照组与空白对照组之间差异无统计学意义(P > 0.05),见图 1~2。
|
| A, OTX2-mus-868 group; B, OTX2-mus-1027 group; C, OTX2-mus-1225 group; D, negative control group; E, control group. Arrows indicate OTX2 positive cells. 图 1 转染48 h后各组细胞OTX2免疫细胞化学染色结果×200 Fig.1 Immunocytochemical staining results of OTX2 in each group after 48 h of transfection ×200 |
|
| A, OTX2-mus-868 group; B, OTX2-mus-1027 group; C, OTX2-mus-1225 group; D, negative control group; E, control group. 图 2 转染48 h后各组细胞OTX2阳性细胞百分率 Fig.2 Percentage of OTX2 positive cells in each group after 48 h of transfection |
2.2 OTX2抑制对MC3T3-E1细胞增殖活性的影响
MTT结果显示,实验组、阴性对照组、空白对照组OD值分别为0.28±0.02,0.34±0.04,0.34±0.03。实验组细胞增殖抑制率为(47.04±7.02)%,与阴性对照组比较差异有统计学意义(P < 0.05),而阴性对照组与空白对照组比较差异无统计学意义(P > 0.05),见表 1。
| Group | OD value | Proliferation inhibition rate(%) |
| Blank group | 0.20±0.01 | - |
| Negative control group | 0.34±0.04 | 0.20±12.6 |
| Control group | 0.34±0.03 | 0 |
| Experimental group | 0.28±0.02 | 47.04±7.021) |
| P < 0.05,compared with negative control group. | ||
2.3 OTX2抑制对MC3T3-E1细胞周期的影响
流式细胞术分析结果显示,转染OTX2-siRNA后S期细胞比率和增殖指数明显减小,与阴性对照组相比,差异有统计学意义(P < 0.05),而阴性对照组和空白对照组比较差异无统计学意义(P > 0.05)。见表 2。
| Group | Ratio of cells in S phase(%) | Proliferation index |
| Negative control group | 26.50±1.95 | 34.96±2.43 |
| Control group | 26.80±1.95 | 35.80±4.46 |
| Experimental group | 21.84±2.631) | 28.41±2.151) |
| P < 0.05,compared with negative control group. | ||
2.4 流式细胞术检测细胞凋亡结果
转染48 h后,AnnexinV-FITC/PI双标记法检测细胞凋亡,实验组、阴性对照组和空白对照组总凋亡率差异比较无统计学意义(P > 0.05),见图 3、表 3。
|
| A, experimental group; B, negative control group; C, control group. 图 3 转染48 h后MC3T3-E1细胞凋亡情况 Fig.3 Apoptosis of MC3T3-E1 cells transfected for 48 h |
| Group | Total apoptotic rate | Early apoptotic rate |
| Experimental group | 9.26±2.05 | 4.88±1.38 |
| Negative control group | 8.97±4.51 | 5.05±0.63 |
| Control group | 6.95±2.91 | 2.62±1.92 |
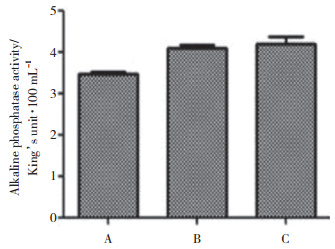
2.5 OTX2抑制对细胞ALP合成的影响
与空白对照组及阴性对照组比较,实验组细胞ALP活性明显下降(P < 0.05);而空白对照组和阴性对照组相比,则无明显变化(P > 0.05),表明OTX2表达下调后MC3T3-E1细胞的分化能力明显减弱。见表 4、图 4。
| Group | OD | ALP vitality(King’s unit/100 mL) |
| Experimental group | 0.51±0.01 | 3.47±0.121) |
| Negative control group | 0.54±0.01 | 4.10±0.11 |
| Control group | 0.59±0.03 | 4.20±0.30 |
| 1)P < 0.05 vs negative group and control group. | ||
|
| A, experimental group; B, negative control group; C, control group. 图 4 转染48 h后MC3T3-E1细胞ALP合成情况 Fig.4 ALP synthesis of MC3T3-E1 cells after transfection for 48 h |
2.6 转染后成骨细胞自噬水平改变
MDC荧光染色可以观察细胞的自噬水平。如图 5所示,实验组MDC染色荧光强度低,点状结构少,阴性对照组和空白对照组染色强度高,点状结构多。实验组荧光细胞百分比为(3.11±0.07)%,阴性对照组为(9.36±1.25)%,空白对照组为(10.54±2.89)%。实验组荧光细胞比例低于阴性对照组,差异有统计学意义(P < 0.05)。

|
| A, experimental group; B, negative control group; C, control group. Arrows indicate autophagic bodies. 图 5 MDC荧光染色转染后的MC3T3-E1细胞×400 Fig.5 MDC fluorescent staining of MC3T3-E1 cells after transfection ×400 |
3 讨论
自噬是一种溶酶体介导的降解途径,在基础条件和压力条件下降解细胞内的长寿蛋白质或受损伤细胞器,使其成为细胞所需的三磷酸腺苷和营养物质,用来维持细胞内的稳态[9-10]。目前,研究证实自噬对于骨细胞、成骨细胞、破骨细胞的形成和分化起着不可缺少的调节作用。在氟或铅的应激环境下,可以引起小鼠成骨细胞MC3T3-E1的凋亡增加,增殖减少,并诱导其发生自噬,而发生自噬后的成骨细胞,增殖能力反而增强[11-12],表明自噬可作为一种保护机制,减轻外界环境对成骨细胞的损伤,减少成骨细胞凋亡。
OTX2基因最早出现在胚胎形成初期的内胚层和外胚层,在间脑、中脑等区域中有表达,对于眼、颌骨及神经系统的发育具有重要作用[13]。敲除OTX2基因的纯合子小鼠胚胎致死率明显升高且出现无下颌畸形,小鼠的第三菱脑结构不能正常发育,说明OTX2在颅脑前部的发育中具有重要作用[14-15],而中脑和菱脑的形成与颅颌面骨的发育密切相关。OTX2在下颌骨远中区域和下颌骨前部发育的中脑神经嵴细胞中有表达[16-17],提示OTX2对于颌骨的发育可能起重要作用。本研究通过下调MC3T3-E1中OTX2基因的表达,研究其对成骨细胞的增殖以及自噬的影响,为研究下颌骨过度发育的机制奠定基础。
本研究结果表明,OTX2-siRNA能下调MC3T3-E1细胞中OTX2基因的表达,抑制MC3T3-E1增殖,而对其凋亡水平无明显影响。ALP是骨形成的特异性酶,具有促进骨矿化的能力,常常通过其活性高低来表示成骨细胞的分化水平[18]。本研究结果显示,转染后成骨细胞上清液OD值明显减小,ALP活力单位降低,表明OTX2基因表达下调可以明显降低MC3T3-E1细胞的分化水平。MDC是一种嗜酸性染液,可以选择性地结合到细胞内自噬小体的囊泡膜上,是一种用来检测自噬水平的荧光染色剂。本研究中,MDC染色结果显示,转染后的MC3T3-E1细胞染色强度弱,点状结构少,提示OTX2基因表达下调后,MC3T3-E1自噬水平降低。本研究组将进一步通过体外实验建立OTX2差异表达的成骨细胞模型,通过诱导和抑制细胞自噬水平来观察其对细胞增殖、分化、凋亡等生物学性征的影响,探讨可能存在的信号调控通路。
| [1] |
陈彦泽, 史册. 调控下颌骨发育的转录因子家族的研究进展[J]. 国际口腔医学杂志, 2012, 39(6): 751-755. DOI:10.3969/j.issn.1673-5749.2012.06.014 |
| [2] |
BALLESTA-MARTÍNEZ MJ, LÓPEZ-GONZÁLEZ V, DULCET LA, et al. Autosomal dominant oculoauriculovertebral spectrum and 14q23.1 microduplication[J]. Am J Med Genet A, 2013, 161(8): 2030-2035. DOI:10.1002/ajmg.a.36007 |
| [3] |
SONG C, TONG F. Autophagy induction is a survival response against oxidative stress in bone marrow-derived mesenchymal stromal cells[J]. Cytotherapy, 2014, 16(10): 563-565. DOI:10.1016/j.jcyt.2014.04.006 |
| [4] |
CARAMES B, HASEGAWA A, TANIGUCHI N, et al. Autophagy activation by rapamycin reduces severity of experimental osteoarthritiss[J]. Ann Rheum Dis, 2012, 71(4): 575-581. DOI:10.1136/annrheumdis-2011-200557 |
| [5] |
WU J, NIU J, LI X, et al. Hypoxia induces autophagy of bone marrow-derived mesenchymal stem cells via activation of ERK1/2[J]. Cell Physiol Biochem, 2014, 33(5): 1467-1474. DOI:10.1159/000358711 |
| [6] |
DONG W, GE J, ZHANG P, et al. Phenotypic characterization of craniofacial bone marrow stromalcells:unique properties of enhanced osteogenesis, cell recruitment, autophagy, and apoptosis resistance[J]. Cell Tissue Res, 2014, 358(1): 165-175. DOI:10.1007/s00441-014-1927-4 |
| [7] |
MENG HZ, ZHANG WL, LIU F, et al. Advanced glycation end products affect osteoblast proliferation and function by modulating autophagy via the receptor of advanced glycation end products/raf protein/mitogen-activated protein kinase/extracellular signal-regulated kinase kinase/extracellular signal-regulated kinase (RAGE/Raf/MEK/ERK) pathway[J]. J Biol Chem, 2015, 290(47): 28189-28199. DOI:10.1074/jbc.M115.669499 |
| [8] |
WEI M, DUAN D, LIU Y, et al. Autophagy may protect MC3T3-E1 cell from fluoride-induced apoptosis[J]. Mol Med Rep, 2014, 9(6): 2309-2315. DOI:10.3892/mmr.2014.2079 |
| [9] |
LÜ XH, ZHAO DH, CAI SZ, et al. Autophagy plays a protective role in cell death of osteoblasts exposure to lead chloride[J]. Toxicol Lett, 2015, 239(2): 131-140. DOI:10.1016/j.toxlet.2015.09.014 |
| [10] |
王雅雯. 自噬基因Beclin1在肿瘤中的作用及其与口腔癌的关系[J]. 中国实用口腔科杂志, 2011, 4(6): 374-376. DOI:10.3969/j.issn.1674-1595.2011.06.019 |
| [11] |
GREENHILL C. Bone:autophagy regulates bone growth in mice[J]. Nat Rev Endocrinol, 2016, 12(1): 4. DOI:10.1038/nrendo.2015.214 |
| [12] |
SHAPIRO IM, LAYFIELD R, LOTZ M, et al. Boning up on autophagy:the role of autophagy in skeletal biology[J]. Autophagy, 2014, 10(1): 7-19. DOI:10.4161/auto.26679 |
| [13] |
MAHEU ME, RESSLER KJ. Developmental pathway genes and neural plasticity underlying emotional learning and stress-related disorders[J]. Learn Mem, 2017, 24(9): 492-501. DOI:10.1101/lm.044271.116 |
| [14] |
TAKENOUCHI T, NISHINA S, KOSAKI R, et al. Concurrent deletion of BMP4 and OTX2 genes, two master genes in ophthalmogenesis[J]. Eur J Med Genet, 2013, 56(1): 50-53. DOI:10.1016/j.ejmg.2012.10.007 |
| [15] |
SU Z, ZHANG Y, LIAO B, et al. Antagonism between the transcription factors NANOG and OTX2 specifies rostral or caudal cell fate during neural patterning transition[J]. J Biol Chem, 2018, 293(12): 4445-4455. DOI:10.1074/jbc.M117.815449 |
| [16] |
ZHENG M, JIAO L, TANG X, et al. Tau haploin sufficiency causes prenatal loss of dopaminergic neurons in the ventral tegmental area and reduction of transcription factor orthodenticle homeobox 2 expression[J]. FASEB J, 2017, 31(8): 3349-3358. DOI:10.1096/fj.201601303R |
| [17] |
LEE HHC, BERNARD C, YE Z, et al. Genetic Otx2 mis-localization delays critical period plasticity across brain regions[J]. Mol Psychiatry, 2017, 22(5): 680-688. DOI:10.1038/mp.2017.1 |
| [18] |
谢丽敏, 刘丹丹, 宗菲, 等. 不同浓度的抗菌肽RISE-AP12对体外培养成骨细胞生物活性的影响[J]. 口腔医学, 2017, 37(2): 114-120. DOI:10.13591/j.cnki.kqyx.2017.02.005 |
 2018, Vol. 47
2018, Vol. 47