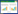文章信息
- 王俊江, 周天羽, 张扬, 刘明欣
- WANG Junjiang, ZHOU Tianyu, ZHANG Yang, LIU Mingxin
- 结肠癌组织中miR-98的表达及作用机制
- Expression and Action Mechanism of miR-98 in Colon Cancer Tissues
- 中国医科大学学报, 2018, 47(1): 9-12
- Journal of China Medical University, 2018, 47(1): 9-12
-
文章历史
- 收稿日期:2017-04-19
- 网络出版时间:2017-12-20 14:25
结肠癌是最常见的消化道恶性肿瘤,随着医疗水平的进步,结肠癌治疗取得了很大的进展,但复发率始终居高不下,Ⅲ~Ⅳ期大肠癌患者的5年生存率较低[1-3]。因此,结肠癌的早期诊断和特异性治疗尤为重要。
microRNA (miRNAs)是一组非编码RNA。miRNAs参与多种生理活动和病理进程。很多miRNAs在结肠癌中异常表达,miR-31和miR-182在结肠癌中低表达,对结肠癌细胞的生长迁移有一定的抑制作用[4]。在SW480细胞中过表达miR-143或miR-145可以促进细胞程序化死亡[5]。结肠癌细胞中过表达miR-126可以降低细胞的增殖率[4]。所有研究均提示miRNAs可能成为结肠癌治疗的潜在靶点[6]。实验研究[7]表明miR-98在结肠癌中可以调节Warburg效应,抑制乳酸生成,但是具体机制尚不清楚。
本研究分析40例结肠癌患者癌组织标本miR-98表达情况,MTT实验和Hochest 33258染色判断miR-98对HCT116细胞增殖、凋亡的影响,旨在探讨结肠癌组织中miR-98的表达及作用机制。
1 材料与方法 1.1 材料选取辽宁中医药大学附属医院2010年至2015年40例术前未接受过放化疗的结肠癌患者的肿瘤组织及癌旁组织,组织取下后置于-180 ℃液氮中备用。其中 < 60岁7例,≥60岁33例;TNM分期Ⅰ期7例、Ⅱ期25例、Ⅲ期8例。其他材料包括HCT116细胞(实验室冻存),DMEM培养基(美国HyClone公司),胎牛血清(天津灏洋公司),四甲基偶氮唑蓝、MTT、DMSO (上海碧云天公司),Trizol、异丙醇、氯仿(上海生工公司)。
1.2 方法 1.2.1 细胞培养使用含体积分数10%胎牛血清的DMEM培养基培养HCT116细胞,置37 ℃5%CO2培养箱中培养。
1.2.2 MTT实验将处于对数生长期的细胞以1×104/孔的密度接种于96孔板中,细胞培养12 h后分别转染miR-98 mimic或miR-98 inhibitor (广州锐博生物公司),每组每个时间点设3个复孔。转染后分别在0,12,24,36,48 h添加MTT (5 mg/mL) 10 μL,孵育4 h,弃去培养基,使用100 μL DMSO溶解MTT-甲臜结晶,15 min后在490 nm处记录吸光度(optical density,OD)值。
1.2.3 Hochest 33258染色将处于对数生长期的细胞以1×105/孔的密度接种于6孔板中,细胞培养12 h后分别转染miR-98 mimic或miR-98 inhibitor,每组设3个复孔。转染24 h后分别添加PBS洗3次后,Hochest 33258染色20 min,PBS清洗3次,荧光显微镜下观察。
1.2.4 实时PCR检测1 mL Trizol裂解组织后,加0.2 mL氯仿,振摇15 s,室温静置2~3 min。离心15 min。吸取上层水相,加入0.5 mL异丙醇,混匀。离心10 min弃上清。加入75 %乙醇,振摇。离心5 min干燥后,用DEPC处理水溶解沉淀,55~60 ℃孵育10~15 min。所用引物为miR-98,F,5’-ACACTCCCUAUACAACUUAC-3’;R,5’-GGGAAAGUAGUGAGGCCTCAG-3’;U6,F,5’-CTCGCTTCGGCAGCACA-3’;R,5’-AACGCTTCACGAATTTGCGT-3’。
1.2.5 细胞周期分析将对数生长期的细胞制成1×106/L浓度的细胞悬液接种于6孔板中,贴壁培养24 h后,加入不同处理因素。作用24 h后收集细胞,PBS洗涤后胰酶消化,制成单细胞悬液。70%的冰乙醇4 ℃固定1 h,PI染液避光染色30 min,流式细胞仪测定细胞周期。
1.3 统计学分析采用SPSS 17.0软件进行统计学分析,OD值比较采用非配对t检验;40例肠癌组织与相应癌旁组织比较采用非配对t检验,利用对数秩检验理论对数据进行生存分析。P < 0.05为差异有统计学意义。
2 结果 2.1 miR-98在结肠癌中的表达实时PCR结果显示,结肠癌组织与癌旁组织中miR-98的含量分别为(1.064±0.052)和(0.645±0.039),癌组织中表达明显低于癌旁组织,差异有统计学意义(P = 0.022)。miR-98的表达与患者的生存期密切相关,miR-98高表达患者的生存期更长,见图 1。
|
| 图 1 miR-98与肠癌患者生存期的关系 Fig.1 Relationship between miR-98 and survival duration of patients with colon cancer |
2.2 miR-98对结肠癌细胞生长的影响
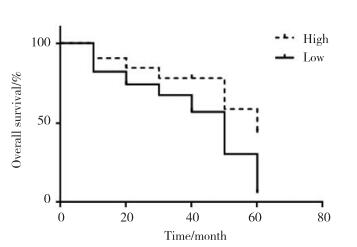
在HCT116细胞中分别过表达或低表达miR-98后,通过MTT实验检测细胞的增殖情况,结果发现转染24 h后可以显著抑制HCT116细胞增殖;miR-98抑制24 h后HCT116细胞增殖开始显著增加,见图 2。
|
| *P < 0.05 vs control group. A, the proliferation of HCT116 cells was inhibited by miR-98;B, the proliferation of HCT116 cells was promoted after miR-98 was inhibited. 图 2 miR-98对HCT116细胞增殖的影响(n = 3) Fig.2 Effect of miR-98 on HCT116 cell proliferation (n = 3) |
在HCT116细胞中分别过表达或低表达miR-98后,通过流式分析技术检测了细胞周期,结果发现miR-98过表达可以抑制G1-S期的转化;miR-98受到抑制后G1向S期进程加快,见表 1。
| Group | HCT116 cell cycle | ||
| G1 | G2 | S | |
| Control | 63.18 | 12.03 | 24.79 |
| miR-98 | 66.40 | 11.82 | 21.78 |
| miR-98 inhibitor | 60.17 | 10.72 | 29.11 |
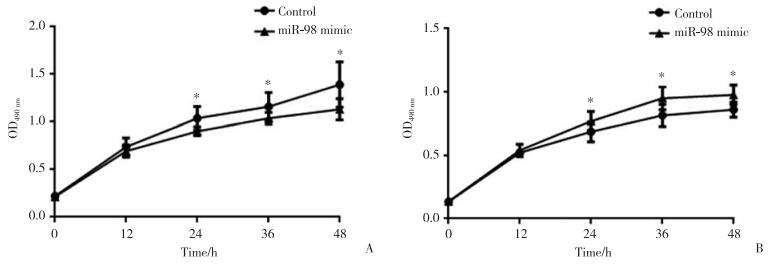
在HCT116细胞中分别过表达或低表达miR-98后,通过Hochest 33258实验检测细胞的凋亡情况,结果发现miR-98过表达可以促进HCT116细胞凋亡;miR-98受到抑制后HCT116细胞凋亡亦受到抑制,见图 3。
|
| A, miR-98 promoted the apoptosis of HCT116 cells; B, the inhibition of miR-98 inhibited the apoptosis of HCT116 cells. 图 3 miR-98对HCT116细胞凋亡的影响×200 Fig.3 Effect of miR-98 on HCT116 cell apoptosis ×200 |
3 讨论
结肠癌发病率以每年超过100万的新增病例迅速增长,在我国也呈现逐年上升的趋势[8]。因此有必要寻找更好的能够诊疗结肠癌的靶点。多种miRNAs在肿瘤的发生发展中发挥重要的调控作用[9]。在结肠癌中有多重miRNAs异常表达的现象。miR-34在肠癌中表达降低可以抑制肠癌细胞的生长与迁移;miR-200可能通过调节细胞周期相关蛋白抑制肠癌细胞的增殖[10]。在肠癌患者的血浆中,miR-92、miR-17-3p、miR-29a表达明显上调,切除肿瘤后,它们的含量下降[11],说明这些miRNA可能会作为肠癌的诊断依据。已经有报道[12]称miR-98可以通过抑制无氧酵解来抑制结肠癌的进展。
本研究发现miR-98在结肠癌组织中的表达显著低于癌旁组织。数据显示miR-98高表达患者的5年生存期较好,这说明miR-98与患者预后密切相关。结肠癌患者的预后与其细胞的增殖及迁移能力密切相关。研究表明miR-98可以抑制HCT116细胞的增殖。细胞周期的进程是调节细胞增殖的关键因素,进一步检测miR-98对细胞周期的调节作用发现,当miR-98过表达时细胞周期G1向S期转化的过程受到阻滞,这说明在一定程度上miR-98是通过对细胞周期阻滞来实现细胞增殖的抑制作用。细胞凋亡也是影响细胞增殖的关键因素,本研究发现miR-98可以促进细胞凋亡。由此可见miR-98不仅与结肠癌的预后相关,也可以抑制结肠癌细胞的增殖。
综上所述,miR-98在肿瘤组织中低表达,miR-98表达可抑制结肠癌细胞增殖、促进结肠癌细胞凋亡。miR-98表达可以抑制结肠癌的发生发展,这为结肠癌的治疗提供了新的方向。
| [1] |
FANTINI S, SALSI V, REGGIANI L, et al. The miR-196b miRNA inhibits the GATA6 intestinal transcription factor and is upregulated in colon cancer patients[J]. Oncotarget, 2017, 8(3): 4747-4759. DOI:10.18632/oncotarget.13580 |
| [2] |
LI C, XU N, LI YQ, et al. Inhibition of SW620 human colon cancer cells by upregulating miRNA-145[J]. World J Gastroenterol, 2016, 22(9): 2771-2778. DOI:10.3748/wjg.v22.i9.2771 |
| [3] |
PRADHAN M, NAGULAPALLI K, LEDFORD L, et al. A system biology approach for understanding the miRNA regulatory network in colon rectal cancer[J]. Int J Data Min Bioinform, 2015, 11(1): 1-30. DOI:10.1504/IJDMB.2015.066332 |
| [4] |
RAMALINGAM S, SUBRAMANIAM D, ANANT S. Manipulating miRNA expression:a novel approach for colon cancer prevention and chemotherapy[J]. Curr Pharmacol Rep, 2015, 1(3): 141-153. DOI:10.1007/s40495-015-0020-3 |
| [5] |
SHA D, LEE AM, SHI Q, et al. Association study of the let-7 miRNA-complementary site variant in the 3' untranslated region of the KRAS gene in stage Ⅲ colon cancer (NCCTG N0147 clinical trial)[J]. Clin Cancer Res, 2014, 20(12): 3319-3327. DOI:10.1158/1078-0432.CCR-14-0069 |
| [6] |
AHMED FE. miRNA as markers for the diagnostic screening of colon cancer[J]. Expert Rev Anticancer Ther, 2014, 14(4): 463-485. DOI:10.1586/14737140.2014.869479 |
| [7] |
WENDLER A, KELLER D, ALBRECHT C, et al. Involvement of let-7/miR-98 microRNAs in the regulation of progesterone receptor membrane component 1 expression in ovarian cancer cells[J]. Oncol Rep, 2011, 25(1): 273-279. |
| [8] |
KUMAZAKI M, NOGUCHI S, YASUI Y, et al. Anti-cancer effects of naturally occurring compounds through modulation of signal transduction and miRNA expression in human colon cancer cells[J]. J Nutr Biochem, 2013, 24(11): 1849-1858. DOI:10.1016/j.jnutbio.2013.04.006 |
| [9] |
KANEMATSU S, TANIMOTO K, SUZUKI Y, et al. Screening for possible miRNA-mRNA associations in a colon cancer cell line[J]. Gene, 2014, 533(2): 520-531. DOI:10.1016/j.gene.2013.08.005 |
| [10] |
LI B, SONG Y, LIU TJ, et al. miRNA-22 suppresses colon cancer cell migration and invasion by inhibiting the expression of T-cell lymphoma invasion and metastasis 1 and matrix metalloproteinases 2 and 9[J]. Oncol Rep, 2013, 29(5): 1932-1938. DOI:10.3892/or.2013.2300 |
| [11] |
FANG Y, XIANG J, CHEN Z, et al. miRNA expression profile of colon cancer stem cells compared to non-stem cells using the SW1116 cell line[J]. Oncol Rep, 2012, 28(6): 2115-2124. DOI:10.3892/or.2012.2054 |
| [12] |
WANG XY, WU MH, LIU F, et al. Differential miRNA expression and their target genes between NGX6-positive and negative colon cancer cells[J]. Mol Cell Biochem, 2010, 345(1/2): 283-290. DOI:10.1007/s11010-010-0582-7 |
 2018, Vol. 47
2018, Vol. 47