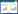文章信息
- 张振文, 张乃文, 刘炀, 韩亮, 毕建斌, 孔垂泽
- 前列腺导管腺癌临床诊治分析3例
- Clinical Analysis of Three Cases Involving Prostatic Ductal Adenocarcinoma
- 中国医科大学学报, 2017, 46(12): 1141-1144
- Journal of China Medical University, 2017, 46(12): 1141-1144
-
文章历史
- 收稿日期:2017-01-20
- 网络出版时间:2017-11-30 18:14
在前列腺癌中,前列腺导管腺癌(prostatic ductal adenocarcinoma,PDA)是一种少见的亚型,通过临床资料难以诊断,至今无标准治疗方案。现回顾中国医科大学附属第一医院2013年12月至2015年4月期间收治的3例PDA患者的诊治及随访资料,总结治疗经验和体会。
1 临床资料 1.1 临床基本情况(表 1)| 病例 | 年龄(岁) | 主诉 | 指诊 | PSA(ng/mL) | 膀胱镜 | 确诊方式 | 治疗 | 临床分期 | 随访结果 |
| 1 | 73 | PSA升高 | 可触及结节 | 54.2 | 未见明显异常 | UTPB | RP | T2aN0M0 | 20个月存活 |
| 2 | 67 | 排尿困难,血尿 | 未触及结节 | 29.4 | 尿道肿物 | TURP | MAB | T4N0M0 | 19个月存活 |
| 3 | 69 | 排尿困难,血尿 | 未触及结节 | 61.7 | 尿道肿物 | TURP | MAB | T4N0MX | 36个月存活 |
| UTPB,超声引导下经直肠前列腺穿刺活检术;TURP,经尿道前列腺电切术;RP,根治性前列腺癌切除术;MAB,最大限度雄激素阻断. | |||||||||
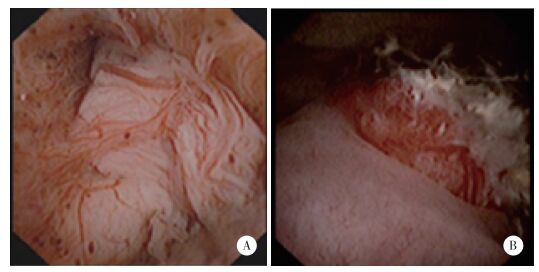
患者年龄67~73岁,平均69岁。病例1在体检时发现前列腺特异性抗原(prostate specific antigen,PSA)升高,无明显自觉症状;病例2和3有明显排尿期症状并伴血尿。病例1因PSA升高已行2次经直肠前列腺穿刺活检术,均未见明确癌细胞。病例3因排尿困难行经尿道前列腺电切术(Transurethral resection of prostate,TURP)后3年,病理为前列腺增生。直肠指诊3例患者前列腺均为Ⅱ度大,病例1可于右侧叶触及直径约1.5 cm的较硬结节;病例1和3前列腺磁共振平扫加增强见可疑结节强化不均,其中,病例3左侧耻骨可疑侵袭;病例2和3在膀胱镜检查中发现前列腺尿道部菜花样或团块样肿物(图 1)。3例患者全身骨显像均未见明显异常。
|
| A,病例2前列腺尿道部菜花样肿物;B,病例3前列腺尿道部肿物出血滤泡样改变. 图 1 前列腺尿道部肿物膀胱镜下所见 |
1.2 治疗经过
病例1先行前列腺穿刺活检后行腹腔镜下前列腺癌根治术,病例2、3行TURP术后给予内分泌治疗,病例2给予比卡鲁胺口服(50 mg,1次/d),醋酸戈舍瑞林(3.6 mg/次,1次/28 d)皮下注射内分泌治疗,病例3因经济条件差行双睾丸切除术,术后给予比卡鲁胺口服(50 mg,1次/d)。
1.3 病理及随访结果3例患者经直肠前列腺穿刺活检术或术后病理均确诊为PDA,且均进一步行免疫组化(表 2)。术后随访19~36个月,病例1术后PSA持续下降,2016年8月PSA < 0.003 ng/mL;病例2于2016年9月检测PSA为0.28 ng/mL;病例3于2015年12月检测PSA为0.41 ng/mL,此后无定期复查。病例2和3近期出现PSA升高趋势,3位患者目前均存活。
| 病例 | 病理描述 | 免疫组化 |
| 1 | 腺腔不规则,排列紊乱,考虑为高分化PDA | CK(H)(-),P63(-),PSA(+),AMACR(P504S)(+),Ki-67(约15%),CDX-2(-) |
| 2 | 肿瘤细胞呈筛状或腺样分布,浸润性生长 | CK(+),CK7(灶状+),CK20(-),CK(H)(±),P63(-),PSA(+),AMACR(P504S)(+),GATA-3(-),Ki-67(30%(+) |
| 3 | 癌细胞呈腺样分布,异型性明显,浸润生长 | CK(+),P53(-),P63(灶状+),Ki-67(30%),CK(H)(灶状+),PSA(灶状+),AMACR(P504S)(+)CEA(-) |
2 讨论 2.1 临床表现
PDA是一类罕见的前列腺癌亚型,单纯的PDA发病率仅为0.4%~0.6%,常与腺泡腺癌混合出现,大部分源自前列腺尿道及尿道周围的导管,少数源于外周带的次级导管[1]。前列腺导管从外周次级导管向中央大导管汇聚至尿道,故PDA的症状与其发病部位有关,若主要累及尿道周围前列腺导管,临床表现为下尿路梗阻症状、血尿等,在前列腺尿道部或精阜周围可见突出的乳头状或菜花样肿物,直肠指检可无阳性发现,因早期排尿症状明显容易误诊或漏诊,部分患者是通过TURP后病理结果才得以确诊;若源于前列腺实质内导管,其临床表现与腺癌相近,病例2、3患者更倾向源于大导管,病例1则倾向于周围导管来源,但临床多为混合型。
2.2 辅助检查特征一般实验室检查结果无特异性,目前多数认为PDA平均PSA值会较腺癌小[2],可能是由于PDA来源于导管上皮,分泌功能差,有研究认为尤其是来源于大导管的PDA,分泌的PSA可随尿液排出,血清PSA可正常或仅轻度升高。
影像学上,PDA在磁共振T2W期表现类似于Gleason评分6分的肿瘤,仅靠单一传统的磁共振成像判断易低估肿瘤分期甚至肿瘤隐匿[3],不过有文献[4]提出运用多参数磁共振成像方法检查的结果显示PDA与高危前列腺癌表现相似。
若肿瘤明显向尿道突出或已突入尿道,膀胱镜检查可能会发现膀胱或前列腺尿道部肿物。
2.3 病理特征及鉴别诊断PDA最终确诊需依靠病理,PDA多以大乳头状生长,也可有筛状,以及前列腺上皮内瘤变(prostatic intraepithelial neoplasia,PIN)样或实体状,癌细胞呈高假复层柱状上皮并伴有高级别的细胞核[5-6],以侵袭性生长为主。
PDA主要与以下疾病相鉴别:(1)源于前列腺以外的病变,如消化道恶性肿瘤、尿路上皮癌、精囊腺癌、尿道乳头状炎性改变等,当病变累及尿道或前列腺时,患者的症状与前列腺导管癌相似,且PSA也可正常,大多可通过病理分析鉴别,来源于前列腺的肿瘤细胞PSA、前列腺特异性酸性磷酸酶、前列腺特异性膜抗原、雄激素受体多为阳性表达[7],转移瘤不表达前列腺相关标记物;(2)前列腺来源肿瘤,如高级别上皮内瘤变(High grade intraepithelial neoplasia,HGPIN)、导管内癌(intraductal carcinoma,IDC)、腺癌、良性增生等,其中主要是与腺癌、HGPIN、IDC的鉴别,形态上PDA通常有真性乳头结构伴有纤维血管轴心,瘤细胞核大,多数为伸展的卵圆形,裂隙样筛状结构。但特殊情况下,PDA出现易损血管和粉刺样坏死时与分化较低的腺癌相似[8];PDA与微乳头状、筛状HGPIN相似;PDA与IDC都可以沿导管侵袭;在有多种成分混合时诊断更加困难,需要进一步结合免疫组化,通常PDA表达PTEN及ERG,并且无基底细胞相关标记物P63表达,少数HMWCK、Villin阳性;AC可表达PTEN及ERG但不表达HMWCK及Villin[9];HGPIN通常基底细胞层不连续,但很少腺体缺乏P63表达,另外在HGPIN中无PTEN缺失,且并不表达ERG[10]。IDC中PTEN缺失,EGR多数阳性[7, 10],且基底细胞一般完整。
2.4 治疗及预后在2005年国际泌尿病理协会共识中建议将PDA Gleason评分定为4分,若出现粉刺样坏死则为5分,PIN样PDA则被认为是Gleason 3分[5, 11],研究[3, 12]表明,当AC混合的导管成分≥10%时,Gleason 3分AC的比无前列腺导管成分的Gleason 7分AC更具有侵袭性,生存期更短,总体来说PDA的生存时间与Gleason8~10分的患者相近,虽然传统的内分泌治疗和放射治疗有一定效果,但总体效果不及相同评分的腺癌。局部PDA目前以根治手术治疗为主,且采取根治手术的患者预后更好[2, 12],但与腺癌相比PDA患者Gleason评分 > 8的比例更多,更易生化复发[8]。
回顾性多样本及个案研究报道,进展期的PDA患者采取积极的化疗或手术治疗可能更大获益[13-15],本研究中2例患者未出现远处转移,1例可疑骨转移。根据患者临床分期及综合情况制定治疗方案,病例1给予长期随诊复查,多次行前列腺穿刺活检,因病灶局限,最后行根治手术治疗,预后良好;病例2及病例3 PSA均升高,根据辅助检查结果,考虑前列腺恶性肿瘤可能性大,但病例2因心功能不全、心脏支架植入术后,基础状态不佳,病例3因精囊及左侧耻骨怀疑受侵,血尿症状重,两者均未行前列腺穿刺活检术,仅行经尿道肿瘤切除术、减瘤手术治疗,术中将肿瘤切至周边1 cm,送病理明确诊断,现均未见明显复发或转移。
总之,PDA多数早期表现为排尿症状,若此时不伴有PSA升高,缺乏筛查项目,容易被忽略或误诊,故应加强对PDA的认识和诊断,做到早期发现并治疗,必要时完善病理活检,应避免错过最佳治疗时机。一经确诊即应采取积极治疗方案,并做好随访和复查工作,但PSA及直肠指诊不能完全体现PDA的病情,需要结合其他检查结果,以及时发现病情发展。
| [1] |
SEIPEL AH, DELAHUNT B, SAM ARATUNGA H, et al. Ductal adenocarcinoma of the prostate:histogenesis, biology and clinicopathological features[J]. Pathology, 2016, 48(5): 398-405. DOI:10.1016/j.pathol.2016.04.001 |
| [2] |
PACKIAM VT, PATEL SG, PARISER JJ, et al. Contemporary population-based comparison of localized ductal adenocarcinoma and high-risk acinar adenocarcinoma of the prostate[J]. Urology, 2015, 86(4): 777-782. DOI:10.1016/j.urology.2015.07.009 |
| [3] |
SCHIEDA N, COFFEY N, GULAVITA P, et al. Prostatic ductal adenocarcinoma:an aggressive tumour variant unrecognized on T2 weighted magnetic resonance imaging (MRI)[J]. Eur Radiol, 2014, 24(6): 1349-1356. DOI:10.1007/s00330-014-3150-9 |
| [4] |
COFFEY N, SCHIEDA N, CRON G, et al. Multi-parametric (mp) MRI of prostatic ductal adenocarcinoma[J]. J Magn Reson Imaging, 2015, 41(6): 1639-1645. DOI:10.1002/jmri.24694 |
| [5] |
LIU T, WANG Y, ZHOU R, et al. The update of prostatic ductal adenocarcinoma[J]. Chin J Cancer Res, 2016, 28(1): 50-57. DOI:10.3978/j.issn.1000-9604.2016.02.02 |
| [6] |
LI J, WANG Z. The pathology of unusual subtypes of prostate cancer[J]. Chin J Cancer Res, 2016, 28(1): 130-43. DOI:10.3978/j.issn.1000-9604.2016.01.06 |
| [7] |
SEIPEL AH, SAMARATUNGA H, DELAHUNT B, et al. Immunohistochemistry of ductal adenocarcinoma of the prostate and adenocarcinomas of non-prostatic origin:a comparative study[J]. APMIS, 2016, 124(4): 263-270. DOI:10.1111/apm.12504 |
| [8] |
KIM A, KWON T, YOU D, et al. Clinicopathological features of prostate ductal carcinoma:matching analysis and comparison with prostate acinar carcinoma[J]. J Korean Med Sci, 2015, 30(4): 385-389. DOI:10.3346/jkms.2015.30.4.385 |
| [9] |
SEIPEL AH, SAMARATUNGA H, DELAHUNT B, et al. Immunohistochemical profile of ductal adenocarcinoma of the prostate[J]. Virchows Arch, 2014, 465(5): 559-565. DOI:10.1007/s00428-014-1636-0 |
| [10] |
MORAIS CL, HAN JS, GORDETSKY J, et al. Utility of PTEN and ERG immunostaining for distinguishing high-grade PIN from intraductal carcinoma of the prostate on needle biopsy[J]. Am J Surg Pathol, 2015, 39(2): 169-178. DOI:10.1097/PAS.0000000000000348 |
| [11] |
CAO D. Gleason's score in prostate adenocarcinoma and its application[J]. Chin J Pathol, 2014, 43(3): 145-148. DOI:10.3760/cma.j.issn.0529-5807.2014.03.001 |
| [12] |
MEEKS JJ, ZHAO LC, CASHY J, et al. Incidence and outcomes of ductal carcinoma of the prostate in the USA:analysis of data from the surveillance, epidemiology, and end results program[J]. BJU Int, 2012, 109(6): 831-834. DOI:10.1111/j.1464-410X.2011.10520.x |
| [13] |
FUJIWARA R, KAGEYAMA S, TOMITA K, et al. Metastatic prostatic ductal adenocarcinoma successfully treated with docetaxel chemotherapy:a case report[J]. Case Rep Oncol, 2015, 8(2): 339-344. DOI:10.1159/000438785 |
| [14] |
JI C, ZHOU M, GAN W, et al. Advanced prostatic ductal carcinoma in a patient with a long survival time following a total pelvis exenteration:a case report[J]. Oncol Lett, 2016, 11(2): 1509-1511. DOI:10.3892/ol.2016.4098 |
| [15] |
KAMIYAMA Y, MITSUZUKA K, WATANABE M, et al. Chemotherapy with gemcitabine and cisplatin for advanced ductal adenocarcinoma of the prostate:clinical courses of two patients[J]. Tohoku J Exp Med, 2015, 237(4): 317-321. DOI:10.1620/tjem.237.317 |
 2017, Vol. 46
2017, Vol. 46