文章信息
- 贺政, 李光, 张宏伟, 张硕
- HE Zheng, LI Guang, ZHANG Hongwei, ZHANG Shuo
- 1H磁共振波谱在非小细胞肺癌脑转移放疗疗效评价中的预测价值
- Predictive Value of Proton Magnetic Resonance Spectroscopy in the Evaluation of Radiotherapy for Patients with Brain Metastases from Non-small Cell Lung Cancer
- 中国医科大学学报, 2017, 46(12): 1095-1100
- Journal of China Medical University, 2017, 46(12): 1095-1100
-
文章历史
- 收稿日期:2017-09-15
- 网络出版时间:2017-11-30 18:05
随着恶性肿瘤系统性治疗的进步和神经影像诊断技术水平的提高,脑转移瘤的发生率及检出率明显增高。非小细胞肺癌(non-small cell lung cancer,NSCLC)是较容易发生脑转移的实体瘤,文献[1]报道脑转移的发生率在28.2%~39.2%之间。由于手术治疗的局限性和血脑屏障的存在,使得包括全脑照射(whole brain radiotherapy,WBRT)和立体定向放射治疗(stereotactic radiotherapy,SRT)在内的放射治疗成为脑转移瘤的主要治疗手段[2]。1H磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)能够定量反映中枢神经系统内主要代谢物的水平,常用于颅内肿瘤的分级以及颅内病变的鉴别诊断等方面[3-4]。但1H-MRS在NSCLC脑转移放疗疗效评价中是否具有预测价值尚无研究报道。本研究以接受SRT联合WBRT的NSCLC脑转移患者为研究对象,在治疗前应用1H-MRS进行检查,测量胆碱(choline,Cho)峰/肌酸(creatine,Cr)峰的比值,比较治疗前Cho/Cr比值高组与Cho/Cr比值低组间疗效的差异,旨在分析1H-MRS在NSCLC脑转移放疗疗效评价中的预测价值。
1 材料与方法 1.1 一般资料选择2010年1月至2012年1月在我院接受SRT联合WBRT的NSCLC脑转移患者56例。所有患者肺部原发病灶均经病理学诊断为NSCLC,脑部病灶经增强磁共振(magnetic resonance image,MRI)检查临床诊断为脑转移。临床资料及随访资料完整。其中男37例,女19例,年龄(54.36±6.25)岁。所有患者每例选取一个较大的非囊性病灶行1H-MRS检查。本研究经中国医科大学附属第一医院伦理委员会批准,患者及家属均知情同意。
1.2 1H-MRS检查方法及数据处理所有患者在治疗前采用1.5T超导磁共振机(美国GE公司)行1H-MRS扫描检查。采用Function Tool 2000软件对采集的波谱数据进行处理,对相位、频率编码、基线进行自动校正后,把代谢图和定位MRI图像融合,测量肿瘤区域的Cho峰、Cr峰的峰下面积,计算Cho/Cr比值。
1.3 治疗方法SRT采用立体定向治疗计划系统(Brain LAB,SCAN4.0版本),无创面膜进行固定,置定位框后以3 mm间距进行全脑连续计算机体层成像(computed tomography,CT)及MRI增强扫描。图像数据传入治疗计划系统,进行CT与MRI图像融合,勾画大体肿瘤体积(gross tumor volume,GTV)靶区(不包括水肿带),GTV外扩2 mm为计划靶体积(planning target volume,PTV)。采用6 MV X线进行非共面旋转照射,剂量率2 Gy/min,准直器直径7.5~40.0 mm,80%等剂量曲线包绕98%以上的肿瘤体积,6 Gy/F或8 Gy/F,隔日1次,4次完成,肿瘤周边剂量24~32 Gy。SRT治疗前或治疗后间隔1周时间给予WBRT,剂量率2 Gy/min,2 Gy/次,5次/周,中平面剂量40 Gy。
1.4 随访所有患者放疗后接受随访,随访截至2016年7月。生存时间的始点为放疗开始日期,每3个月门诊或电话随访1次。生存时间的终点为患者死亡。截尾数据为患者存活或死于其他疾病或失访。以Cho/Cr比值中位值为临界值,采用Kaplan-Meier法分析Cho/Cr比值高组与Cho/Cr比值低组2组的预后情况。
1.5 统计学分析采用SPSS 20.0统计软件进行统计学分析。生存率估计采用Kaplan-Meier法,治疗前Cho/Cr比值高组与Cho/Cr比值低组平均生存时间的差异采用Log-rank检验进行比较,预后因素检验采用COX模型,P < 0.05为差异有统计学意义。
2 结果 2.1 根据治疗前Cho/Cr比值进行分组及各组临床特点分析治疗前全部56例患者Cho/Cr比值的平均值为2.011±0.866,中位值为1.989。根据治疗前的Cho/Cr比值进行分组,将患者分为Cho/Cr比值大于中位值的高组( > 1.989)和Cho/Cr比值小于中位值的低组( < 1.989),治疗前Cho/Cr比值高组与Cho/Cr比值低组在性别、年龄、卡式评分(Karnofsky performance status,KPS)、原发肿瘤控制情况、是否只有脑转移、脑转移数目、原发灶病理类型、递归分区分析(recursive partitioning analysis,RPA)分级、治疗模式以及SRT放疗剂量各个因素上的分布情况一致(P均 > 0.05)。见表 1。
| Clinical characteristics | n | Patients with higher pretreatment Cho/Cr (n = 28) |
Patients with lower pretreatment Cho/Cr (n = 28) |
χ2 | P |
| Gender | 0.717 | 0.397 | |||
| Male | 37 | 20 | 17 | ||
| Female | 19 | 8 | 11 | ||
| Age(year) | 0.820 | 0.365 | |||
| < 65 | 41 | 22 | 19 | ||
| ≥65 | 15 | 6 | 9 | ||
| KPS(%) | 0.381 | 0.537 | |||
| < 70 | 14 | 8 | 6 | ||
| ≥70 | 42 | 20 | 22 | ||
| Primary tumor | 0.000 | 1.000 | |||
| Controlled | 38 | 19 | 19 | ||
| Uncontrolled | 18 | 9 | 9 | ||
| Other metastases | 1.400 | 0.237 | |||
| Brain only | 43 | 22 | 18 | ||
| With other metastases | 13 | 6 | 10 | ||
| Number of brain metastases | 0.487 | 0.485 | |||
| 2-3 | 46 | 24 | 22 | ||
| ≥4 | 10 | 4 | 6 | ||
| Pathological type of primary tumor | 0.731 | 0.694 | |||
| Adenocarcinoma | 35 | 16 | 19 | ||
| Squamous cell carcinoma | 19 | 11 | 8 | ||
| Other | 2 | 1 | 1 | ||
| RPA classification | 0.923 | 0.630 | |||
| 1 | 15 | 6 | 9 | ||
| 2 | 27 | 14 | 13 | ||
| 3 | 14 | 8 | 6 | ||
| Treatment modality | 1.198 | 0.274 | |||
| WBRT+SRT | 34 | 15 | 19 | ||
| SRT+WBRT | 22 | 13 | 9 | ||
| Dose of SRT | 0.717 | 0.397 | |||
| 24 Gy/4 F | 19 | 11 | 8 | ||
| 32 Gy/4 F | 37 | 17 | 20 |
2.2 Cho/Cr比值高组和Cho/Cr比值低组的预后差异
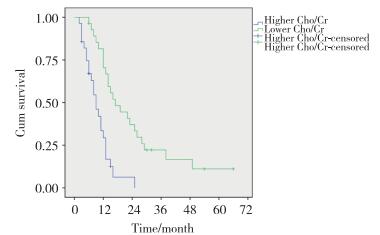
患者随访时间为3~66个月(中位随访时间为14个月),随访率为100%。死亡55例,死亡率为98.2%。患者的1、3、5年生存率分别为50.7%(95%CI:37.2%~64.2%)、12.4%(95%CI:3.2%~21.6%)、1.8%(95%CI:0%~8.1%),平均生存时间为17.82个月(95% CI:13.35~22.28个月)。治疗前Cho/Cr比值高组1、3、5年生存率分别为29.3%(95%CI:11.3%~47.3%)、0%、0%,平均生存时间为9.77个月(95%CI:7.50~12.04个月);治疗前Cho/Cr比值低组1、3、5年生存率分别为70.5%(95%CI:53.3%~87.7%)、22.3%(95%CI:6.6%~38.0%)、1.8%(95%CI:0%~8.1%),平均生存时间为24.67个月(95%CI:17.69~31.66个月)。2组比较平均生存时间的差异有统计学意义(χ2=17.706,P < 0.05)。生存曲线见图 1。
|
| 图 1 治疗前Cho/Cr比值高组与Cho/Cr比值低组的生存曲线 Fig.1 Survival curves for patients with higher or lower pretreatment Cho/Cr |
2.3 单因素及多因素预后分析
将患者的性别、年龄、KPS评分、原发肿瘤的控制情况、是否伴有其他部位转移、脑转移的数目、原发灶的病理类型、RPA分级、治疗模式、SRT的放疗剂量以及治疗前Cho/Cr比值分组进行COX单因素分析,结果显示,性别、KPS评分、原发灶的病理类型、RPA分级、治疗前Cho/Cr比值与预后相关(P均 < 0.05),而患者的年龄、原发肿瘤的控制情况、是否伴有其他部位转移、脑转移的数目、治疗模式、SRT的放疗剂量与预后不相关(P均 > 0.05)。见表 2。COX多因素分析结果显示,KPS评分、RPA分级和治疗前Cho/Cr比值是NSCLC脑转移患者的独立预后因素(P均 < 0.05)。见表 3。
| Item | HR | 95%CI | P |
| Gender | 2.315 | 1.029-5.206 | 0.042 |
| KPS | 0.105 | 0.018-0.610 | 0.012 |
| Pathological type of primary tumor | 8.882 | 1.303-60.554 | 0.026 |
| RPA classification | 36.507 | 7.816-170.530 | < 0.001 |
| Pretreatment Cho/Cr | 0.186 | 0.075-0.461 | 0.000 |
| Item | HR | 95%CI | P |
| KPS | 0.250 | 0.070-0.895 | 0.003 |
| RPA classification | 8.168 | 3.122-21.367 | < 0.001 |
| Pretreatment Cho/Cr | 0.267 | 0.130-0.550 | < 0.001 |
3 讨论
NSCLC是最常见的肺癌病理类型,预后不佳,5年生存率在15%以下[5]。NSCLC在诊治过程中,较容易发生远处转移。BAJARD等[6]发现Ⅰ~Ⅲ期的305例NSCLC患者诊治过程中有77例(25.2%)发生了脑转移,并且诊断脑转移后的中位生存时间仅为6个月。GASPAR等[7]回顾了西南肿瘤协作组的统计数据,在所有入组的422例Ⅲ期NSCLC患者的诊治过程中共有268例出现疾病进展,其中71例(26.5%)发生了脑转移,43例(60.6%)脑转移发生在确诊肺癌的6个月以内。由此可见,NSCLC恶性程度极高,对人类健康危害巨大。
脑转移发生后,放射治疗作为最主要的治疗手段,发挥重要作用。放射治疗方式包括WBRT和SRT 2种。WBRT是针对整个脑组织给予照射,控制已经发生、临床可见的转移灶以及潜在的、临床不可见的亚临床转移灶。WBRT的剂量分割方式有多种,包括30 Gy/10 F、25 Gy/10 F、40 Gy/20 F、20 Gy/5 F等,但具体哪种剂量分割模式能够使患者最大程度获益,目前暂无定论[8]。但RADES等[9]研究认为,对于年龄超过65岁的老年脑转移患者,20 Gy/5 F的短疗程放疗分割方案患者更容易接受。SRT针对脑转移瘤局部给予大剂量照射,能获得类似手术切除病变的治疗效果。对于可手术切除的单发脑转移瘤,AUCHTER等[10]的研究取得了令人欣喜的结果,他们证实SRT联合WBRT取得了86%的局部控制率、56周的中位生存时间、53%的1年生存率和30%的2年生存率。治疗结果与手术联合WBRT治疗单发脑转移瘤的结果相当。SPERDUTO等[11]认为,AUCHTER等[10]的研究为单发可手术切除的脑转移瘤建立了无需手术、更加经济的金标准。另外,SRT不受转移瘤部位的限制,脑干转移是手术治疗的绝对禁忌,但SRT可以作为有效的治疗手段,并且能够取得不错的治疗效果[12]。对于WBRT后是否需要针对局部病变给予SRT推量治疗,美国肿瘤放射治疗协作组(radiation therapy oncology group,RTOG)9508号试验的结论是WBRT加用SRT推量治疗能够延长不可手术切除单发脑转移瘤患者的生存期,而2~3个脑转移瘤的患者WBRT后是否加用SRT需要谨慎考虑[13]。然而10年之后,RTOG 9508号试验的补充分析认为,分级预后评估(graded prognostic assessment,GPA)分级是影响NSCLC脑转移患者生存的独立预后因素,而与患者脑转移的数目无关[14]。脑转移一旦发生,患者即进展至临床Ⅳ期,总体生存率急剧降低。MA等[15]研究认为,影响脑转移瘤患者预后的因素包括患者的年龄、KPS评分、原发肿瘤的控制情况、从诊断原发病变到脑转移发生的时间间隔、RPA分级和GPA分级等。本研究结果显示,KPS评分、RPA分级和治疗前Cho/Cr比值是NSCLC脑转移患者的独立预后因素,首次发现1H-MRS的检测指标在评价NSCLC脑转移的放疗疗效中具有预测价值。为治疗前筛选出预后不佳的患者,从而给予更加积极有效的治疗奠定了基础。
1H-MRS是目前唯一可以用在活体检测细胞代谢水平、生化改变和进行化合物定量分析的一种非侵袭性核磁成像技术。1H-MRS能够检测多种微量代谢物的浓度,主要包括Cho、Cr、N-乙酰-天门冬氨酸(N-Acetyl-aspartic acid,NAA)等,并根据这些代谢物的含量变化来评价肿瘤的生物学行为[16-17]。其中Cho波峰位于3.22 ppm,代表脑内总胆碱量,参与细胞膜的合成与分解,反映细胞膜的转运功能,通常认为它是恶性肿瘤的标志物之一;Cr波峰位于3.03 ppm,存在于神经元和胶质细胞中,是能量储存和利用的重要化合物,在脑组织中相对稳定,因此经常被作为计算比值的标准[18]。1H-MRS的检测指标在治疗后早期就能够发生变化,CHERNOV等[19]对81例脑转移瘤患者伽马刀治疗后早期行单体素MRS检查,发现在治疗后16~18 h,病灶体积无变化,但NAA/Cr比值、Cho/Cr比值均降低,在不均匀强化的病灶中,Cho/Cr比值下降更明显。脑转移瘤患者接受放疗后,随着时间的延长,病变体积会逐渐缩小。病变体积的缩小表明治疗有效。鞠蓉晖等[20]研究证实,治疗前后病变区域的Cho的数值、Cho/Cr的比值的变化与病变体积的变化呈非线性相关,提示Cho的数值、Cho/Cr的比值有可能作为预后预测的指标。但Cho的数值、Cho/Cr的比值与患者总生存率是否相关,文中并未提及。
脑转移的发生、发展过程中伴随着肿瘤血管的生成和细胞的增殖,而Cho的含量可以有效反映细胞的增殖活性[21]。由于肿瘤的血管生成为肿瘤提供了营养,当肿瘤生长迅速、肿瘤细胞的密度增高、细胞的合成和降解加快、细胞膜转换加速时,Cho的数值会明显升高[22]。本研究发现,治疗前肿瘤区域Cho/Cr比值高组的NSCLC患者预后不佳,反映了治疗前Cho/Cr的比值越高,肿瘤的恶性程度越高,对治疗的反应性就越差。
本研究初步发现治疗前的1H-MRS检查对评价NSCLC脑转移患者的放疗疗效具有预测价值,未来还需要大规模的随机对照试验来进一步验证。
| [1] |
HSU F, DE CALUWE A, ANDERSON D, et al. Patterns of spread and prognostic implications of lung cancer metastasis in an era of driver mutations[J]. Curr Oncol, 2017, 24(4): 228-233. DOI:10.3747/co.24.3496 |
| [2] |
TRIFILETTI DM, SHEEHAN JP, GROVER S, et al. National trends in radiotherapy for brain metastases at time of diagnosis of non-small cell lung cancer[J]. J Clin Neurosci, 2017, 45: 48-53. DOI:10.1016/j.jocn.2017.08.028 |
| [3] |
SJØBAKK TE, VETTUKATTIL R, GULATI M, et al. Metabolic profiles of brain metastases[J]. Int J Mol Sci, 2013, 14(1): 2104-2118. DOI:10.3390/ijms14012104 |
| [4] |
TSOUGOS I, SVOLOS P, KOUSI E, et al. Differentiation of glioblastoma multiforme from metastatic brain tumor using proton magnetic resonance spectroscopy, diffusion and perfusion metrics at 3 T[J]. Cancer Imaging, 2012, 12(3): 423-436. DOI:10.1102/1470-7330.2012.0038 |
| [5] |
CHEN W, ZHENG R, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [6] |
BAJARD A, WESTEEL V, DUBIEZ A, et al. Multivariate analysis of factors predictive of brain metastases in localised non-small cell lung carcinoma[J]. Lung Cancer, 2004, 45(3): 317-323. DOI:10.1016/j.lungcan.2004.01.025 |
| [7] |
GASPAR LE, CHANSKY K, ALBAIN KS, et al. Time from treatment to subsequent diagnosis of brain metastases in stageⅢ non-small-cell lung cancer:a retrospective review by the Southwest Oncology Group[J]. J Clin Oncol, 2005, 23(13): 2955-2961. DOI:10.1200/JCO.2005.08.026 |
| [8] |
TSAO MN, LLOYD N, WONG RK, et al. Whole brain radiotherapy for the treatment of newly diagnosed multiple brain metastases[J]. Cochrane Database Syst Rev, 2012(4): CD003869. DOI:10.1002/14651858.CD003869.pub3 |
| [9] |
RADES D, EVERS JN, VENINGA T, et al. Shorter-course whole-brain radiotherapy for brain metastases in elderly patients[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): e469-e473. DOI:10.1016/j.ijrobp.2011.01.058 |
| [10] |
AUCHTER RM, LAMOND JP, ALEXANDER E, et al. A multiinstitutional outcomeand prognostic factor analysis of radiosurgery for resectable single brainmetastasis[J]. Int J Radiat Oncol Biol Phys, 1996, 35(1): 27-35. DOI:10.1016/S0360-3016(96)85008-5 |
| [11] |
SPERDUTO PW, HALL WA. Radiosurgery, cost-effectiveness, gold standards, the scientific method, cavalier cowboys, and the cost of hope[J]. Int J Radiat Oncol Biol Phys, 1996, 36(2): 511-513. DOI:10.1016/S0360-3016(96)00347-1 |
| [12] |
VOONG KR, FARNIA B, WANG Q, et al. Gamma knife stereotactic radiosurgery in the treatment of brainstem metastases:The MD Anderson experience[J]. Neurooncol Pract, 2015, 2(1): 40-47. DOI:10.1093/nop/npu032 |
| [13] |
ANDREWS DW, SCOTT CB, SPERDUTO PW, et al. Whole brain radiation therapy with or without stereotactic radiosurgery boost for patients with one to three brain metastases:phaseⅢ results of the RTOG 9508 randomised trial[J]. Lancet, 2004, 363(9422): 1665-1672. DOI:10.1016/S0140-6736(04)16250-8 |
| [14] |
SPERDUTO PW, SHANLEY R, LUO X, et al. Secondary analysis of RTOG 9508, a phase 3 randomized trial of whole-brain radiation therapy versus WBRT plus stereotactic radiosurgery in patients with 1-3 brain metastases; poststratified by the graded prognostic assessment (GPA)[J]. Int J Radiat Oncol Biol Phys, 2014, 90(3): 526-531. DOI:10.1016/j.ijrobp.2014.07.002 |
| [15] |
MA LH, LI G, ZHANG HW, et al. Hypofractionated stereotactic radiotherapy with or without whole-brain radiotherapy for patients with newly diagnosed brain metastases from non-small cell lung cancer[J]. J Neurosurg, 2012, 117(Suppl): 49-56. DOI:10.3171/2012.7.GKS121071 |
| [16] |
NAKAMURA H, DOI M, SUZUKI T, et al. The significance of lactate and lipid peaks for predicting primary neuroepithelial tumor grade with proton MR spectroscopy[J]. Magn Reson Med Sci, 2017. DOI:10.2463/mrms.mp.2017-0042 |
| [17] |
BRANDAO LA, CASTILLO M. Adult brain tumors:clinical applications of magnetic resonance spectroscopy[J]. Magn Reson Imaging Clin N Am, 2016, 24(4): 781-809. DOI:10.1016/j.mric.2016.07.005 |
| [18] |
KIROV Ⅱ, WU WE, SOHER BJ, et al. Global brain metabolic quantification with whole-head proton MRS at 3 T[J]. NMR Biomed, 2017, 30(10): e3754. DOI:10.1002/nbm.3754 |
| [19] |
CHERNOV MF, HAYASHI M, IZAWA M, et al. Early metabolic changes in metastatic brain tumors after Gamma knife radiosurgery:1H-MRS study[J]. Brain Tumor Pathol, 2004, 21(2): 63-67. DOI:10.1007/s10014-004-0153-2 |
| [20] |
鞠蓉晖, 徐克, 李松柏, 等. MRS与脑转移瘤放射治疗后体积变化相关性的初步分析[J]. 中国冶金工业医学杂志, 2010, 27(2): 134-136. DOI:10.13586/j.cnki.yjyx1984.2010.02.108 |
| [21] |
LI J, ZHAO C, RAO JS, et al. Structural and metabolic changes in the traumatically injured rat brain:high-resolution in vivo proton magnetic resonance spectroscopy at 7 T[J]. Neuroradiology, 2017. DOI:10.1007/s00234-017-1915-y |
| [22] |
TIAN HL, ZU YL, WANG CC, et al. Major metabolite levels of preoperative proton magnetic resonance sectroscopy and intraoperative fluorescence intensity in glioblastoma[J]. Chin Med Sci J, 2017, 39(4): 511-517. DOI:10.3881/j.issn.1000-503X.2017.04.009 |
 2017, Vol. 46
2017, Vol. 46