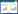文章信息
- 孟雪, 齐晓宇, 刘维贤, 王瑶, 王秋旭
- MENG Xue, QI Xiaoyu, LIU Weixian, WANG Yao, WANG Qiuxu
- 乙肝病毒X蛋白结合蛋白对腺样囊性癌细胞株ACC-2生物学行为的影响
- Effect of HBXIP Expression on the Biological Behavior of the Adenoid Cystic Carcinoma Cell Line ACC-2
- 中国医科大学学报, 2017, 46(12): 1082-1086
- Journal of China Medical University, 2017, 46(12): 1082-1086
-
文章历史
- 收稿日期:2017-03-31
- 网络出版时间:2017-11-30 18:05
2. 辽宁省铁法煤业集团总医院口腔科, 辽宁 铁岭 112000;
3. 沈阳农业大学畜牧兽医学院预防兽医学教研室, 沈阳 110866
2. Department of Stomatology, Liaoning Province Tiefa Coal Group General Hospital, Tieling 112000, China;
3. Teaching & Research Section of Preventive Veterinary Medicine, College of Animal Science & Veterinary Medicine, Shenyang Agricultural University, Shenyang 110866, China
腺样囊性癌(adenoid cystic carcinoma,ACC)是最常见的唾液腺恶性肿瘤之一,约占所有唾液腺恶性肿瘤的22%[1],早期即侵犯神经和血管,容易发生远处肺部转移[2]。目前ACC的治疗多采用手术联合放化疗,但效果不佳。乙肝病毒X蛋白结合蛋白(hepatitis B X-interacting protein,HBXIP)通过与乙肝病毒X(hepatitis B-virus X,HBX)蛋白C末端特异性结合降低其活性,从而影响乙肝病毒的复制周期[3-4]。HBX蛋白被认为是一种多功能癌蛋白,既可以激活信号转导通路,又可以直接作用于细胞转录因子,抑制肝癌细胞凋亡[5]。研究[6]发现,在唾液腺恶性肿瘤细胞中,HBX的表达水平升高,乙型肝炎病毒与唾液腺恶性肿瘤存在相关性。目前尚无文献报道HBXIP与唾液腺ACC的相关性,因此,本研究拟探讨HBXIP对唾液腺ACC细胞株ACC-2[7]增殖、迁移和侵袭功能的影响及其可能的作用机制。
1 材料与方法 1.1 材料真核表达载体HBXIP-siRNA由沈阳万类科技有限公司构建,ACC-2细胞株购自武汉大学细胞保藏中心。主要试剂:DMEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),Super M-MLV反转录酶(中国BioTeke公司),RNA simple Total RNA Kit和总RNA提取试剂盒(中国TIANGEN公司),MTT试剂(美国Sigma公司),NP-40裂解液、BCA蛋白浓度测定试剂盒、PMSF(中国碧云天生物技术有限公司),ECL发光液(中国七海复泰生物科技有限公司)和脂质体2000(美国Invitrogen公司)。
引物设计:针对HBXIP的核酸序列(NM_006402)设计引物,HBXIP-F,GGAGCAGCACTTGGAAGACA;HBXIP-R,TCAGTGGGGTCAGAGGTTAG。β-actin-F,CTTAGTTGCGTTACACCCTTTCTTG;β-actin-R,CTGTCACCTTCACCGTTCCAGTTT。引物均由沈阳万类科技有限公司合成。
1.2 方法 1.2.1 细胞株的培养及传代用含10%胎牛血清的RPMI-1640培养基培养ACC-2细胞,在37 ℃、5%CO2条件下培养,细胞生长至90%融合时传代,接种密度为1:3,每2 d传代1次,最后接种于T25培养瓶中(4×105/瓶),待细胞密度达90%,收集细胞。
1.2.2 细胞分组及处理将ACC-2细胞随机分为实验组(瞬时转染HBXIP-siRNA质粒),阴性对照组(转染无意义序列,NC组)和未转染组(空白细胞),后2组为对照组。转染方法参照Lipofectamine2000说明书,转染前24 h将细胞传代,待细胞密度至50%~60%,更换为无血清的基础培养基处理1 h后进行转染。应用电镜及免疫荧光方法检测细胞是否转染成功。转染48 h后分别收集6孔培养板中各组细胞,进行基因和蛋白的检测。
1.2.3 反转录PCR用Trizol法分别提取3组细胞的总RNA,用SuperM-MLV反转录酶合成cDNA第一链,以此为模板进行PCR反应。取PCR产物行琼脂糖凝胶电泳,Gold View染料混匀染色,利用凝胶成像系统拍照。实验重复3次,Quantity One软件分析电泳条带灰度,比较3组细胞中HBXIP mRNA和蛋白的表达情况。
1.2.4 MTT实验转染24 h后,计数3组细胞并接种于96孔培养板中(2×103/孔)。每组设计5个复孔,同时加入调零孔(只加培养基、MTT、DMSO)。置于37 ℃、5% CO2培养箱中分别培养24、48、72、96 h后,加入0.2 mg/mL MTT,置于37 ℃培养箱中孵育4 h,弃上清,加入200 μL DMSO,在酶标仪上测定其在490 nm处OD值。重复5次,取平均值。
1.2.5 划痕实验细胞转染24 h后,计数3组细胞并接种于6孔培养板中(2×103/孔)。每组设3个复孔,200 μL枪头垂直划痕,加入无血清培养基,置于37 ℃、5% CO2培养箱中培养16 h。于划痕前(0 h)和划痕后16 h分别照相、测距,重复3次,取平均值。
1.2.6 transwell小室实验转染24 h后,计数实验组(转染组)和对照组(NC组,未转染组)细胞,用无血清培养液1:10稀释,24孔板的transwell小室每个孔铺100 μL胶,加入100 μL细胞悬液,于37 ℃、5% CO2培养箱中培养24 h后,擦去膜上层细胞,将膜取下并进行检测。实验重复5次,取平均值。
1.2.7 Western blotting向3组细胞中加入相应体积的NP-40裂解液,吹散至单细胞悬液,置于冰上静置5 min,4 ℃下12 000 r/min离心10 min,收集上清行定量分析。取40 μg总蛋白行10%SDS-PAGE电泳,电转移至PVDF膜,5%脱脂奶粉封闭,室温培育2 h。加入一抗,4 ℃培育过夜,TTBS洗膜,分别加入驴抗山羊IgG-HRP(HBXIP)和羊抗兔IgG-HRP(Akt、p-Akt、PI3K、p-PI3K及S100A4),37 ℃孵育45 min,TTBS洗膜,应用增强型ECL显色剂,试剂盒于暗室曝光显影,实验均重复3次,扫描胶片,用凝胶图像处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.3 统计学分析采用SPSS 18.0统计软件进行分析,数据以x±s表示,组间比较采用Student’s-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 3组细胞中HBXIP的表达细胞成功转染48 h后,实时PCR和Western blotting结果显示,3组细胞中均可检测到HBXIP mRNA和蛋白表达,且实验组表达水平较对照组明显下降,差异有统计学意义(P < 0.01),见图 1、2。
|
| A, β-actin expression in each group; B, HBXIP expression in each group; C, the histogram of HBXIP gene expression in each group. ACC-2:control group (non transfection group); NC:blank control group (nonsense sequence group, negative control); HBXIP-siRNA:experimental group (transfection group). 图 1 实时PCR检测3组中HBXIP基因的表达 Fig.1 Expression of the HBXIP gene in experimental and control groups measured via RT-PCR |

|
| 图 2 蛋白印迹法检测3组HBXIP蛋白的表达 Fig.2 Expression of HBXIP protein in experimental and control groups measured via Western blotting |
2.2 siRNA-HBXIP对ACC-2细胞增殖的影响
MTT结果显示,转染24、48、72、96 h后,实验组OD值(0.355±0.062,0.697±0.071,1.020±0.111,1.086±0.122)低于未转染组(0.402±0.068,0.907±0.112,1.354±0.138,1.414±0.144)和NC组(0.407±0.046,0.893±0.092,1.313±0.133,1.363±0.143)。在这4个时间点,实验组细胞增殖率(100.000±17.359,196.282±19.914,287.211±31.313,305.915±34.506)较对照组降低,在48、72、96 h时差异有统计学意义(P < 0.05),见图 3。

|
| *P < 0.05 vs NC group and ACC-2 group. 图 3 MTT法检测3组细胞的增殖情况 Fig.3 Proliferation of cells in the experimental and control groups measured via MTT method |
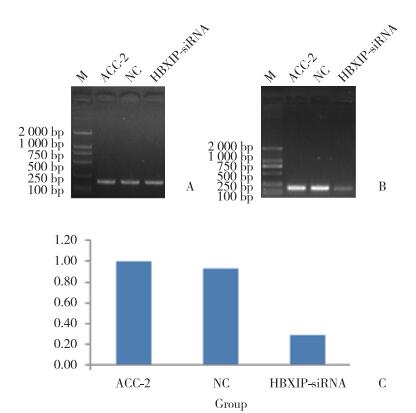
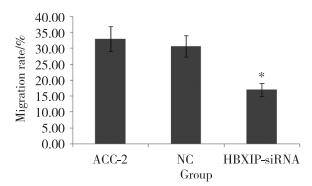
2.3 siRNA-HBXIP对ACC-2迁移的影响
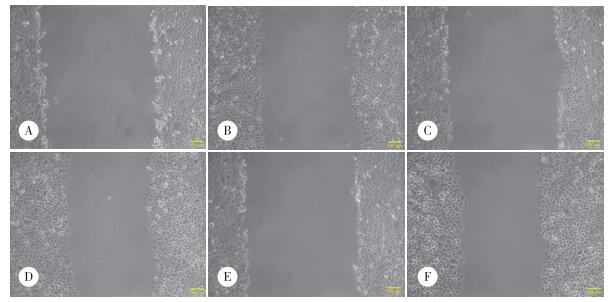
划痕实验结果显示,划痕后16 h,实验组、NC组和未转染组细胞迁移率分别为17.00%±2.00%,30.72%±3.37%,33.01%±3.93%,差异有统计学意义(P < 0.01),见图 4、5。
|
| *P < 0.01 vs NC group and ACC-2 group. 图 4 划痕实验法检测16 h时3组细胞的迁移率 Fig.4 Migration rate of cells in the experimental and control groups over 16 h measured via the scratch test |
|
| A and B, experimental group (transfected with plasmid); C and D, blank control group (transfected with nonsense sequence plasmid); E and F, control group (non-transfected). A, C, E, 0 h; B, D, F, 16 h. 图 5 光镜下实验组及对照组迁移情况的比较×100 Fig.5 Comparison of cell migration patterns between the experimental and control groups under the microscope ×100 |
2.4 siRNA-HBXIP对ACC-2侵袭能力的影响
transwell检测结果提示,观察24 h后,实验组、NC组、未转染组细胞侵袭数分别为45.00±4.64,81.00±9.03,83.60±8.35,差异有统计学意义(P < 0.01)。
2.5 siRNA-HBXIP对PI3K/Akt通路的影响Western blotting结果显示,HBXIP基因沉默后,实验组HBXIP蛋白的相对表达量(0.30±0.04)明显低于NC组(0.97±0.02)和未转染组(1.00±0.01)。HBXIP基因沉默后,实验组中p-Akt、p-PI3K和S100A4蛋白的表达降低(0.64±0.02,0.40±0.01,0.64±0.02),差异有统计学意义(P < 0.05),见图 6。
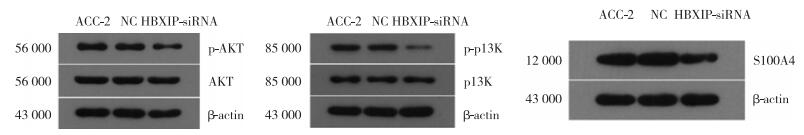
|
| 图 6 Western blotting法检测3组细胞中p-Akt、Akt、p-PI3K、PI3K及S100A4蛋白的表达情况 Fig.6 Expression of p-Akt, Akt, p-PI3K, PI3K and S100A4 protein in the three groups measured via Western blotting |
3 讨论
癌基因蛋白HBXIP是一种调节蛋白,可在动物肌肉组织以及恶性肿瘤组织中过表达。近年来,也有研究[5]发现它能与人体多种蛋白结合。在唾液腺恶性肿瘤细胞中可检测到HBX的表达,表达阳性率高于对照组,提示乙型肝炎病毒与唾液腺恶性肿瘤存在相关性[7]。HBXIP还可促进乳腺癌细胞和肝癌细胞的增殖及迁移[8-11],也能够刺激Skp2基因启动子的活性,并通过转录因子Sp1促进卵巢癌细胞迁移[12]。最新研究[13]发现,HBXIP过度表达与宫颈癌进展有关联,并可能作为早期诊断宫颈癌的生物标志物。
PI3K/Akt信号通路是新发现的一条酪氨酸激酶级联信号通路,是国内外学者公认的癌细胞存活的重要通路,在恶性肿瘤的发生、发展中发挥重要作用。该信号通路可以在多种恶性肿瘤中过度活化[14]。有研究[15]发现HBXIP能诱导HepG2细胞增殖,激活PI3K/Akt信号通路。LIU等[16]发现过表达HBXIP可激活PI3K/Akt通路,HBXIP可能通过PI3K/Akt通路间接促进S100A4的表达,从而促进乳腺癌细胞的生长和迁移。也有研究[17]发现,HBXIP可下调PCK1的表达,通过下调肝癌细胞转录因子FOXO1和上调miR-135a,抑制靶向细胞中FOXO1 mRNA的3’UTR端,通过激活PI3K/Akt通路FOXO1蛋白的磷酸化水平,导致该蛋白从细胞核向细胞质转移。
本研究组在前期实验中对ACC细胞ACC-2中HBXIP蛋白的表达情况进行了检测,发现其在ACC-2中有较多表达,为进一步阐明HBXIP对ACC细胞株ACC-2的影响,选择对HBXIP基因沉默,并研究其对ACC-2增殖、迁移和侵袭以及PI3K/Akt信号通路的影响。
RNA干涉(RNA intergerence,RNAi)是指在进化过程中高度保守的、双链RNA诱发的、同源mRNA高效特异性降解的现象,它能诱导序列特异的目标基因沉默,是由FIRE等[18]于1998年发现的迄今最有效的封闭基因表达方法之一。siRNA是RNAi途径的中间产物,在RNA沉默通路中起核心作用,因此,本研究中构建了siRNA-HBXIP真核表达载体。本研究结果显示,HBXIP基因沉默能够抑制ACC细胞株ACC-2的增殖、迁移和侵袭,并有可能是通过抑制S100A4蛋白的表达及PI3K和Akt磷酸化来实现的。本研究中所用HBXIP抑制剂有可能成为有效的化疗药物,其可能的机制是通过下调PI3K/Akt信号通路PI3K和Akt靶点蛋白的磷酸化和S100A4的蛋白表达,从而抑制唾液腺细胞的恶性转化,同时抑制肿瘤细胞的增殖、迁移和侵袭。
总之,HBXIP可能通过激活PI3K/AKT信号通路关键蛋白,在ACC细胞株ACC-2的增殖、迁移和侵袭中发挥重要作用,有关具体途径和机制有待进一步研究。
| [1] |
BRADLEY PJ. Adenoid cystic carcinoma of the head and neck:a review[J]. Curr Opin Otolaryngol Head Neck Surg, 2004, 12(2): 127-132. DOI:10.1097/MOO.0000000000000347 |
| [2] |
TIAN Z, LI L, WANG L, et al. Salivary gland neoplasms in oral and maxillofacial regions:a 23-year retrospective study of 6982 cases in an eastern Chinese population[J]. Int J Oral Maxillofac Surg, 2010, 39(3): 235-242. DOI:10.1016/j.ijom.2009.10.016 |
| [3] |
MELEGARI M, SCAGLIONI PP, WANDS JR. Cloning and characterization of a novel hepatitis B virus x binding protein that inhibits viral replication[J]. J Virol, 1998, 72(3): 1737-1743. |
| [4] |
刘剑平, 申杰, 蓝文贤, 等. 乙肝病毒X蛋白结合蛋白最新研究进展[J]. 基因组学与应用生物学, 2012, 31(2): 192-196. DOI:10.3969/gab.031.000192 |
| [5] |
KIM KH. Pro-apoptotic function of hepatitis B virus X protein[J]. Korean J Hepatol, 2010, 16(2): 112-122. DOI:10.3350/kjhep.2010.16.2.112 |
| [6] |
谢玲. HBX蛋白在涎腺恶性肿瘤中表达的相关性研究[D]. 昆明: 昆明医科大学口腔医学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10678-1012410784.htm
|
| [7] |
何荣根, 张晓珊, 周晓健, 等. 涎腺腺样囊性癌ACC-2和ACC-3细胞系的建立及其形态学观察[J]. 华西口腔医学杂志, 1988, 6(1): 1-3. |
| [8] |
LI H, LIU Q, WANG Z, et al. The oncoprotein HBXIP modulates the feedback loop of MDM2/p53 to enhance the growth of breast cancer[J]. J Biol Chem, 2015, 290(37): 22649-22661. DOI:10.1074/jbc.M115.658468 |
| [9] |
LIU F, ZHANG W, YOU X, et al. The oncoprotein HBXIP promotes glucose metabolism reprogramming via downregulating SCO2 andPDHA1 in breast cancer[J]. Oncotarget, 2015, 6(29): 27199-27213. DOI:10.18632/oncotarget.4508 |
| [10] |
WANG Y, FANG R, CUI M, et al. The oncoprotein HBXIP up-regulates YAP through activation of transcription factor c-Myb to promote growth of liver cancer[J]. Cancer Lett, 2017, 385: 234-242. DOI:10.1016/j.canlet.2016.10.018 |
| [11] |
LI L, LIU B, ZHANG X, et al. The oncoprotein HBXIP promotes migration of breast cancer cells via GCN5-mediated microtubule acetylation[J]. Biochem Biophys Res Commun, 2015, 458(3): 720-725. DOI:10.1016/j.bbrc.2015.02.036 |
| [12] |
XU F, ZHU X, HAN T, et al. The oncoprotein hepatitis B X-interacting protein promotes the migration of ovarian cancer cells through the upregulation of S-phase kinase-associated protein 2 by Sp1[J]. Int J Oncol, 2014, 45(1): 255-263. DOI:10.3892/ijo.2014.2411 |
| [13] |
LI N, WANG Y, CHE S, et al. HBXIP over expression as an independent biomarker for cervical cancer[J]. Exp Mol Pathol, 2017, 102(1): 133-137. DOI:10.1016/j.yexmp.2017.01.009 |
| [14] |
MICHL P, DOWNWARD J. Mechanisms of disease:PI3K/AKT signa-ling in gastrointestinal cancers[J]. Z Gastroenterol, 2005, 43(10): 1133-1139. DOI:10.1055/s-2005-858638 |
| [15] |
WANG FZ, FEI HR, LIAN LH, et al. Hepatitis B X-interacting protein induces HepG2 cell proliferation through activation of the phosphatidylinositol 3-kinase/Akt pathway[J]. Exp Biol Med (Maywood), 2011, 236(1): 62-69. DOI:10.1258/ebm.2010.010179 |
| [16] |
LIU S, LI L, ZHANG Y, et al. The concoprotein HBXIP uses two pathways to up-regulate S100A4 in promotion of growth and migration of breast cancer cells[J]. J Biol Chem, 2012, 287(36): 30228-30239. DOI:10.1074/jbc.M112.343947 |
| [17] |
SHI H, FANG R, LI Y, et al. The oncoprotein HBXIP suppresses gluconeogenesis through modulating PCK1 to enhance the growth of hepatoma cells[J]. Cancer Lett, 2016, 382(2): 147-156. DOI:10.1016/j.canlet.2016.08.025 |
| [18] |
FIRE A, XU S, MONTGOMERY MK, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J]. Nature, 1998, 391(6669): 411-417. DOI:10.1016/j.jconrel.2012.12.023 |
 2017, Vol. 46
2017, Vol. 46