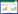文章信息
- 房超, 尹晶, 于秋爽, 陈云云, 黄瑛
- FANG Chao, YIN Jing, YU Qiushuang, CHEN Yunyun, HUANG Ying
- 慢病毒介导的靶向干扰MEX3A基因膀胱癌稳定细胞株的建立
- Establishment of a Bladder Cancer Cell Line with Stable Knockdown of MEX3A Gene via Lentiviral-mediated Interference
- 中国医科大学学报, 2017, 46(12): 1057-1061, 1066
- Journal of China Medical University, 2017, 46(12): 1057-1061, 1066
-
文章历史
- 收稿日期:2017-02-23
- 网络出版时间:2017-11-30 17:58
膀胱癌的发病率和死亡率均占泌尿系统肿瘤的首位,是十大常见肿瘤之一。2009年,我国肿瘤登记地区膀胱癌发病率为6.61/10万,其中男性发病率为9.78/10万,约为女性发病率的3倍[1]。膀胱癌具有治愈率低、复发率高、耐药性强、易转移的特点,患者的5年生存率仅为50%[2]。据文献[3]报道,低中级别膀胱癌患者术后1年复发率为20%~40%,高级别尿路上皮癌术后复发率可高达90%。膀胱癌的治疗方法主要有根治性膀胱切除、放射治疗、化疗、膀胱灌注等,但治疗效果和预后不甚理想[4]。
MEX3A基因是4种人类同源MEX3基因之一[5],编码的蛋白参与RNA的代谢调节[6]。研究[5]显示,MEX3A蛋白与MEX3B是新发现的P小体的组成部分。P小体又称细胞质处理小体,是mRNA转录后调控过程中的一个重要场所,在基因表达过程中起至关重要的调控作用,主要参与mRNA降解、翻译抑制、mRNA监视以及RNA介导基因沉默等重要的生命活动过程[7-8]。研究[9]发现,MEX3蛋白中的环指结构域是泛素E3连接酶的特征结构域,推测MEX3蛋白可能通过泛素化作用参与了mRNA的降解。有文献[10]报道MEX3A基因与胃癌细胞的增殖、凋亡及转移有密切联系,癌组织中该基因的表达量远高于正常组织。目前,膀胱癌的具体发病机制尚未明确,因此,寻找一种新的相关靶基因将为膀胱癌的诊断、靶向药物治疗、预后评估提供新的思路。
本研究拟以MEX3A基因为模板,设计RNA干扰靶点序列,构建目的基因RNA干扰慢病毒载体,包装完成后转染膀胱癌细胞,旨在建立能够稳定干扰MEX3A基因表达的细胞株。
1 材料与方法 1.1 材料人膀胱癌细胞株5637、T24(中国科学院上海生物所细胞库);慢病毒载体及包装系统(GV115载体、pHelper1.0载体、pHelper2.0载体)、293T细胞、感染增强液(ENi.S.)、polybrene、含无义shRNA序列及GFP标记的对照慢病毒(上海吉凯基因技术有限公司);TOP10大肠杆菌感受态细胞、质粒提取试剂盒(EndoFree Maxi Plasmid Kit)、DNA凝胶回收试剂盒(TIANgel Midi Purification Kit)(北京TIANGEN公司);Age Ⅰ、EcoRⅠ、CutSmart Buffer9(美国NEB公司);T4 DNA Ligase(美国Fermentas公司);Lipofectamine2000(美国Invitrogen公司);RPMI-1640培养基、胎牛血清(美国GIBCO公司);氨苄青霉素(上海Genebase公司);总RNA提取试剂盒、逆转录试剂盒、SYBR Real-time PCR试剂盒(日本TaKaRa公司)。
实时荧光定量PCR仪(lightcycler 480,瑞士罗氏公司);荧光显微镜N-STORM(日本尼康公司);数显式稳压电泳仪、凝胶成像仪(上海天能公司);分光光度计Nanodrop 2000(美国Thermo Scientific公司)。
MEX3A及GAPDH上下游引物由上海生工生物公司设计并合成,dsDNA oligo、鉴定引物(R & F)由捷瑞公司提供,DNA测序委托美季公司完成。
1.2 MEX3A-shRNA慢病毒载体的构建 1.2.1 RNA干扰靶点设计根据RNA干扰序列设计原则,以GenBank中的MEX3A基因序列为模板,设计多个19~21nt RNA干扰靶点序列。经设计软件评估测定后,选取合适序列作为干扰靶点,靶点序列为GCAAGGCTGCAAGATTAAG。
1.2.2 DNA oligo序列合成与制备根据已选靶点序列设计shRNA干扰序列,并在两端添加合适的限制性内切酶酶切位点。除此之外,在正义链3’端添加TTTTT终止信号,而反义链5’端添加终止信号互补序列(表 1)。设计完成后,送捷瑞公司合成单链DNA oligo。将合成的单链DNA oligo干粉溶解于退火缓冲液中(终浓度20 μmol/L),90 ℃水浴15 min。自然冷却至室温后,形成带黏性末端的双链。
| Nucleic acid chain | 5’ additional base | STEM | Loop | STEM | 3’ additional base |
| Justice chain | CCGG | AGGCAAGGCTGCAAGATTAAG | CTCGAG | CTTAATCTTGCAGCCTTGCCT | TTTTTG |
| Antisense strand | AATTCAAAAA | AGGCAAGGCTGCAAGATTAAG | CTCGAG | CTTAATCTTGCAGCCTTGCCT | |
| CCGG,Age Ⅰ restriction site;AATTC,EcoR Ⅰ restriction site;G,EcoR Ⅰ restriction site complementary sequence. | |||||
1.2.3 线性化载体制备
按照NEB说明书配制50 μL反应体系,使用AgeⅠ和EcoRⅠ双酶切GV115载体使其线性化。37 ℃(最适温度)反应1 h后,切胶回收目的片段。
1.2.4 dsDNA oligo与线性化载体连接按照Fermentas T4 DNA Ligase说明书配制20 μL反应体系,将双链DNA oligo与线性化的载体相连。于16 ℃反应1~3 h,之后行转化实验。
1.2.5 连接产物转化将10 μL连接产物加至100 μL大肠杆菌感受态细胞中,冰浴30 min,42 ℃热激90 s,冰浴2 min;加入无抗生素的LB液体培养基,于37 ℃震荡培养1 h;取菌液均匀涂抹在含有氨苄青霉素的LB固体培养基上,于37 ℃培养箱中过夜培养。
1.2.6 阳性克隆的PCR鉴定与测序配制20 μL PCR反应体系,用无菌枪头挑取单个菌落为模板,进行PCR扩增,反应条件为94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,循环22次;72 ℃ 5 min。鉴定引物-F序列:5’-CCTATTTCCCATGATTCCTTCATAPCR-3’,鉴定引物-R序列:5’-GTAATACGGTTATCCACGC G-3’。结束后,取5 μL产物,1%琼脂糖凝胶电泳检测。以鉴定引物-F进行阳性克隆测序,挑选测序结果与目标序列完全一致的克隆用于下一步实验。
1.2.7 质粒提取将测序正确的菌液转接于含氨苄青霉素的LB液体培养基中,37 ℃摇床震荡培养过夜。按照EndoFree Maxi Plasmid Kit说明书提取质粒,取样电泳,用分光光度计测定质粒浓度,将合格的质粒进行病毒包装。
1.3 慢病毒载体的包装及滴度测定将提取的GV115质粒与pHelper1.0质粒、pHelper2.0质粒用脂质体瞬时转染包装细胞293T,于24 h和48 h收集病毒上清,观察细胞形态和GFP表达,将提取的病毒纯化和浓缩,采用梯度稀释法测定病毒滴度,将制备完成的病毒浓缩液分装于-80 ℃保存。
1.4 MEX3A基因在5637和T24细胞株中的表达5637细胞和T24细胞均用含有10%胎牛血清的RPMI-1640培养基于37 ℃、5%CO2条件下培养。将2种细胞分别接种于6孔板中(2×105/孔)培养,1 d后收集细胞。提取总RNA,反转录获得cDNA,行实时PCR。MEX3A引物序列:5’-CGGAGTGGACTCTGGCTTTGAG-3’(上游引物),5’-CAGAGGAGAAGAGCACGGAGGT-3’(下游引物)。以GAPDH基因为内参,PCR引物序列:5’-TGACTTCAACAGCGACACCCA-3’(上游引物),5’-CACCCTGTTGCTGTAGCCAAA-3’(下游引物)。PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,40个循环;65 ℃ 15 s。实时PCR采用ΔΔCt法进行相对定量分析。选取目的基因表达量较高者进行慢病毒转染实验。
1.5 慢病毒转染及稳定表达MEX3A-shRNA的细胞株筛选感染前1 d将细胞接种于6孔板中(2×105细胞/孔),培养24 h后加入病毒稀释液:实验组(shMEX3A组)加入含MEX3A-shRNA慢病毒的病毒稀释液,6.68 μL/孔,病毒滴度为3×108 TU/mL(预实验确定最佳感染复数为10);对照组(shCtrl组)加入含阴性对照慢病毒的病毒稀释液(5.00 μL/孔),病毒滴度为4×108 TU/mL。培养12 h后更换培养基,继续培养72 h后荧光显微镜下观察绿色荧光蛋白的表达情况。当转染效率≥70%时,加入含氨苄青霉素(2 μg/mL)的培养基进行筛选。选用正常癌细胞作为对照,48 h后,可见阳性克隆,继续氨苄青霉素筛选2周,挑出单细胞克隆扩大培养即可获得稳定细胞株。
1.6 实时PCR检测MEX3A基因敲减效率收集转染慢病毒的实验组和对照组细胞,按照1.4中的步骤进行操作。实时PCR采用ΔΔCt法进行相对定量分析。
1.7 统计学分析采用SPSS 19.0软件进行统计学分析,采用t检验比较2组间差异,P < 0.05为差异有统计学意义。同一实验重复3次以上,取其平均值。
2 结果 2.1 MEX3A-shRNA慢病毒载体的鉴定及测序dsDNA oligo与线性化载体连接后进行PCR扩增,扩增结束后凝胶电泳检测,结果(图 1)显示,连接入shRNA片段的阳性克隆PCR片段大小为341 bp,未连接入shRNA片段的空载体克隆PCR片段大小为307 bp,与预期值相符。鉴定完成后,送交上海美季公司以鉴定引物-F进行阳性克隆测序,测序结果表明重组的慢病毒载体与参考序列相一致,说明合成的MEX3A-shRNA核苷酸序列插入正确,慢病毒载体构建成功。
|
| 1,negative control(ddH2O);2,empty vector control(307 bp);3,250 bp marker;4-8,positive clones(341 bp). 图 1 重组MEX3A-shRNA慢病毒载体PCR电泳图 Fig.1 Electrophoresis of the PCR products obtained from the recombinant lentiviral vector MEX3A-shRNA |
2.2 慢病毒载体的包装及滴度测定
将慢病毒载体包装系统的3个质粒共转染293T细胞24 h后,显微镜下可见细胞生长良好,形态规则,细胞碎片少,继续培养72 h后荧光视野下细胞内有明显的绿色荧光,说明绿色荧光蛋白表达正常。将收集的病毒液纯化浓缩后,用梯度稀释法测定病毒滴度为2×109 TU/mL,病毒包装成功。
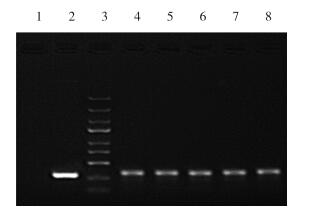
2.3 MEX3A基因在膀胱癌细胞的表达实时PCR检测显示MEX3A基因在人膀胱癌5637细胞株和T24细胞株中均有表达,且5637细胞的表达量高于T24细胞(图 2),因此,选择5637细胞进行慢病毒转染和筛选。
|
| GAPDH was used as an internal standard,the gene expression abundance in ΔCt relatively large cells is relatively low. 图 2 MEX3A基因在膀胱癌细胞的表达 Fig.2 Expression of MEX3A gene in bladder cancer cells |
2.4 慢病毒转染5637细胞株及MEX3A基因的敲减效率
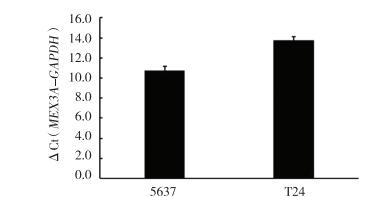
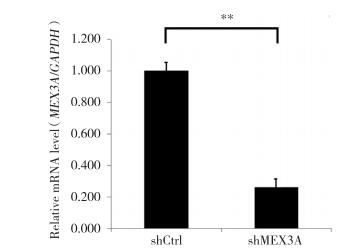
慢病毒转染5637细胞3 d后,荧光显微镜下观察发现细胞内可见明显的绿色荧光,荧光强度良好、均匀一致,与白光图谱对比显示,慢病毒的转染效率≥70%(图 3)。实时PCR结果显示,与转染空载慢病毒的对照组(shCtrl)相比,实验组(shMEX3A)5637细胞中MEX3A mRNA的表达水平受到抑制,敲减效率达74%(图 4)。
|
| A,optical microscope;B,fluorescence microscope. 图 3 慢病毒转染后荧光图×100 Fig.3 Fluorescence observed after lentiviral transfection ×100 |
|
| **P < 0.05. 图 4 实时PCR检测MEX3A基因mRNA的表达量 Fig.4 Detection of MEX3A mRNA expression by real-time PCR |
3 讨论
MEX3蛋白最早于1996年在秀丽隐杆线虫(Caenorhabditis elegans,C.elegans)中被发现,该线虫中只含有1种MEX3同源蛋白,MEX3基因的突变会导致胚胎的前后不对称,从而使其死于囊胚期[11]。人类MEX3蛋白是一类在进化中高度保守的RNA结合蛋白,与秀丽隐杆线虫中的MEX3蛋白高度相似,但这4种蛋白在组织中分布并不一致,hMEX3D蛋白在全身的表达较为均一,而另外3种蛋白在不同组织的表达水平不同。4种MEX3蛋白都主要集中在细胞质内,并能通过CRM1通道在胞质与胞核之间穿梭[5]。有文献[12]报道hMEX3A和3B蛋白是2种新发现的P小体的组成部分,P小体是储存和降解mRNA的场所,聚集了大量无法进行翻译的mRNA链,而MEX3A和3B蛋白在P小体集中并能与hDcpla脱帽因子相互作用,由此可见MEX3同源基因参与了某些mRNA的调节。除此之外,MEX3A和3B蛋白也与Ago蛋白存在联系,Ago1和Ago2是RNA诱导沉默复合体的关键成分,这类蛋白已被证实参与了癌症的发生发展。然而,到目前为止MEX3蛋白在癌症中的作用仍然未知。
有研究者[10]通过RNAi技术沉默胃癌细胞的hMEX3A基因,发现癌细胞增殖明显受到抑制,且抑制作用主要出现于细胞分裂的G1/M期。同时,还发现hMEX3A基因沉默后,胃癌细胞在软琼脂的集落形成能力明显降低,提示hMEX3A基因参与了细胞转化。此外transwell chamber和wound healing assays检测显示,hMEX3A基因敲除显著影响了癌细胞的转移能力,临床相关分析显示癌组织的hMEX3A基因表达量显著高于正常组织,这些都表明MEX3A基因可能参与了癌症的发展与转化。尾型同源盒转录因子CDX2在肠细胞的正常发育以及癌化方面起至关重要的作用,但其调节机制非常复杂,PEREIRA等[13]研究发现MEX3A基因抑制了CDX2的表达,并由此介导了肠细胞的分化,说明该基因可能参与了癌症的转化。此外,KREPISCHI等[14]通过微阵列比较基因组杂交技术(Array-CGH)发现,MEX3A基因在肾母细胞瘤中呈过表达,提示MEX3A基因同样与泌尿系统肿瘤存在关联。
RNA干扰(RNAi)技术是近几年发展起来的一种基因阻断技术,其本质是由双链RNA(double-stranded RNA,dsRNA)诱发的同源mRNA高效特异性降解,目前公认的作用机制为生物体内的核酸内切酶Dicer将dsRNA切割成多个具有特定长度和结构的小片段RNA(约21~23 bp),即siRNA。siRNA在细胞内解链成正义链和反义链,反义siRNA再与体内一些酶结合形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)。RISC与外源性基因表达的mRNA同源区进行特异性结合,RISC具有核酸酶的功能,在结合部位切割mRNA,切割位点即是与siRNA中反义链互补结合的两端。被切割后的断裂mRNA随即降解,从而诱发宿主细胞针对这些mRNA的降解反应[15]。本研究采用慢病毒载体进行RNA干扰,相对于其它载体,慢病毒具有转染效率高、安全性高、可感染非分裂期细胞的特点,但其最主要的优势在于能够将目的基因整合到宿主基因组,实现稳定转染,从而能进一步筛选出所需细胞株[16]。
本研究应用GV115质粒成功构建了针对MEX3A基因的shRNA慢病毒表达载体,PCR鉴定及测序结果均显示目的基因正确插入至质粒载体中,经包装后产生了较高滴度的病毒悬液。此外,还验证了MEX3A基因在膀胱癌细胞的表达,同时发现目的基因在5637细胞和T24细胞的表达量有较大差异,但造成这种差异的分子机制及其影响还有待进一步研究。本研究选取MEX3A基因表达量较高的5637细胞株进行慢病毒感染,荧光显微镜下可见转染效率较高,实时PCR结果也显示MEX3A的表达受到显著抑制,经抗生素筛选及培养后,获得了能稳定干扰MEX3A基因表达的细胞株,为进一步研究MEX3A基因对肿瘤细胞的影响及其作用机制奠定了实验基础。
| [1] |
温登瑰, 张思维, 郑荣寿, 等. 中国2009年膀胱癌发病和死亡资料分析[J]. 中国肿瘤, 2013, 22(7): 521-527. DOI:10.11735/j.issn.1004-0242.2013.07.A002 |
| [2] |
HO PL, LAY EJ, JIAN W, et al. Stat3 activation in urothelial stem cells leads to direct progression to invasive bladder cancer[J]. Cancer Res, 2012, 72(13): 3135. DOI:10.1158/0008-5472.CAN-11-3195 |
| [3] |
SHELLEY MD, MASON MD, KYNASTON H. Intravesical therapy for superficial bladder cancer:a systematic review of randomised trials and meta-analyses[J]. Cancer Treat Rev, 2010, 36(3): 195-205. DOI:10.1016/j.ctrv.2009.12.005 |
| [4] |
SUN Y, CHENG MK, GRIFFITHS TR, et al. Inhibition of STAT signalling in bladder cancer by diindolylmethane:relevance to cell adhesion, migration and proliferation[J]. Cur Cancer Drug Targets, 2012, 13(1): 57-68. DOI:10.2174/156800913804486610 |
| [5] |
BUCHETPOYAU K, COURCHET J, LE HH, et al. Identification and characterization of human Mex-3 proteins, a novel family of evolutionarily conserved RNA-binding proteins differentially localized to processing bodies[J]. Nucleic Acids Res, 2007, 35(4): 1289-1300. DOI:10.1093/nar/gkm016 |
| [6] |
VALVERDE R, EDWARDS L, REGAN L. Structure and function of KH domains[J]. FEBS J, 2008, 275(11): 2712-2726. DOI:10.1111/j.1742-4658.2008.06411.x |
| [7] |
SHETH U, PARKER R. Decapping and decay of messenger RNA occur in cytoplasmic processing bodies[J]. Science, 2003, 300(5620): 805-808. DOI:10.1126/science.1082320 |
| [8] |
TEIXEIRA D, SHETH U, VALENCIASANCHEZ MA, et al. Processing bodies require RNA for assembly and contain nontranslating mRNAs[J]. RNA, 2005, 11(4): 371-382. DOI:10.1261/rna.7258505 |
| [9] |
CANO F, MIRANDA-SAAVEDRA D, LEHNER PJ. RNA-binding E3 ubiquitin ligases:novel players in nucleic acid regulation[J]. Biochem Soc Trans, 2010, 38(6): 1621-1626. DOI:10.1042/BST0381621 |
| [10] |
JIANG H, ZHANG X, LUO J, et al. Knockdown of hMex-3A by small RNA interference suppresses cell proliferation and migration in huhuman gastric cancer cells[J]. Mol Med Rep, 2012, 6(3): 575-580. DOI:10.3892/mmr.2012.943 |
| [11] |
DRAPER BW, MELLO CC, BOWERMAN B, et al. MEX-3 is a KH domain protein that regulates blastomere identity in early C. elegans embryos[J]. Cell, 1996, 87(2): 205-216. DOI:10.1016/s0092-(00)81339-2 |
| [12] |
PARISI C, GIORGI C, BATASSA EM, et al. Ago1 and Ago2 differentially affect cell proliferation, motility and apoptosis when overexpressed in SH-SY5Y neuroblastoma cells[J]. FEBS Lett, 2011, 585(19): 2965-2971. DOI:10.1016/j.febslet.2011.08.003 |
| [13] |
PEREIRA B, SOUSA S, BARROS R, et al. CDX2 regulation by the RNA-binding protein MEX3A:impact on intestinal differentiation and stemness[J]. Nucleic Acids Res, 2013, 41(7): 3986-3999. DOI:10.1093/nar/gkt087 |
| [14] |
KREPISCHI ACV. Genomic imbalances pinpoint potential oncogenes and tumor suppressors in Wilms tumors[J]. Mol Cytogenet, 2016, 9(1): 1-10. DOI:10.1186/s13039-016-0227-y |
| [15] |
ZAMORE PD, TUSCHL T, SHARP PA, et al. RNAi:double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals[J]. Cell, 2000, 101(1): 25-33. DOI:10.1016/S0092-8674(00)80620-0 |
| [16] |
梁艳. 慢病毒载体在RNA干扰中的应用进展[J]. 国际检验医学杂志, 2010, 31(11): 1282-1284. DOI:10.3969/j.issn.1673-4130.2010.11.035 |
 2017, Vol. 46
2017, Vol. 46