文章信息
- 郜娇娇, 杨树林.
- GAO Jiao-jiao, YANG Shu-lin.
- 微生物发酵法生产高分子量透明质酸的研究进展
- Advances in the Production of High Molecular Weight Hyaluronic Acid by Microbial Fermentation
- 中国生物工程杂志, 2017, 37(5): 118-125
- China Biotechnology, 2017, 37(5): 118-125
- http://dx.doi.org/DOI:10.13523/j.cb.20170515
-
文章历史
- 收稿日期: 2017-01-16
- 修回日期: 2017-03-01
透明质酸(hyaluronic acid,HA),又称为玻尿酸,被认为是唯一几乎存在于从细菌到人类及所有动物体之中的黏多糖。HA是由N-乙酰氨基葡萄糖和D-葡萄糖醛酸通过β-1, 4和β-1, 3糖苷键反复交替连接而成的高分子聚合物,是目前发现的自然界中保湿性最好的物质。HA因其高度的黏弹性、可塑性、渗透性和良好的生物相容性,在医药、化妆品、食品领域中广泛应用,全球市场超过十亿美元[1]。微生物发酵法是目前HA产品的主要生产方法。
HA是链球菌荚膜的主要成分,产HA菌种主要为A、C组链球菌,如C组的兽疫链球菌(Streptococcus zooepidemicus)、马疫链球菌(Streptococcus equi)、乳链球菌(Streptococcus uberis)、类马链球菌(Streptococcus equisimilis)等,A组的酿脓链球菌(Streptococcus pyogenes)等。目前主要使用致病性较弱的C组链球菌进行发酵生产HA。除链球菌外,多杀性巴氏杆菌(Pasteurella multocida)也可产HA。
对于商业化HA产品,分子量是一个重要的质量参数,高分子量HA更具市场吸引力:高分子量HA才能形成高黏度、内聚型的黏弹剂,才能用于眼科手术(大于2MDa);化妆品、美容保健品,要求分子量为1×105 Da ~2MDa,才具有良好的保护、活化细胞的作用;分子量为2~3MDa的HA才有利于缓解关节病病情;HA作为药物载体,要求分子量在3MDa左右;分子量越高,HA与受体的亲和力就越强,高分子量HA分子与多个相邻细胞的受体进行多价交联后,才能促使细胞凝聚;体外试验中,只有高分子量HA的黏弹性溶液能抑制细胞的移动以及有丝分裂[2]。
传统的大量研究通过优化发酵生产HA的产量已达到相当高的水平,趋于达到上限,如何提高HA的质量而不是产量现已成为菌株筛选和过程优化的重点。目前,在高分子量HA形成的机制、高分子量HA生产菌的筛选等问题的研究上存在不足。一些制造商声称能够获得目标分子量,然而其实存在很多不确定的关键因素。高分子量HA在医药中的应用是中、低分子量HA不可替代的,优质的高分子量HA在市场上一直供不应求。而且中、低分子量HA可通过物理、化学或酶等降解方法将大分子HA降解为低分子HA得到。
目前,国外已有多家公司可生产医药级HA,如美国Hyvisc、澳大利亚Etamucin、瑞典Healon、丹麦Novozymes等[3]。我国生产的HA多为食品级或化妆品级,国际上急需的医药级HA在我国仅山东福瑞达等少数公司生产,生产高品质的HA已成为我国HA生产企业急需攻破的瓶颈。目前微生物发酵法生产HA缺乏有效调控分子量的方案,高分子量HA占总发酵产物的比例不高。所以,综合利用基因工程和代谢工程方法,建立提高发酵产物中高分子量HA所占比例的有效方法,不仅具有重要的理论意义,更蕴含巨大的市场价值。
1 HA的分子量调控机制充分了解HA的分子量调控机制是明确提高HA分子量研究方向的前提。目前,对HA分子量的调控机制尚无统一结论,关于链终止机制,以及链的跨膜转运仍存在争议,但主要与以下因素有关。
1.1 HAS催化活性与HAS-底物结合力的相对强度HA在细胞内的合成需要多种酶的参与,其中透明质酸合成酶(hyaluronic acid synthase,HAS)是关键酶,HAS以两种前体:UDP-葡萄糖醛酸(UDP-GlcUA)和UDP-N-乙酰氨基葡萄糖(UDP-GlcNAc)为底物合成HA。典型的HAS包括来源于S.equisimilis的seHAS,S.zooepidemicus的szHAS,S.pyogenes的spHAS,非洲爪蟾(Xenopus laevis)的xlHAS,乳房链球菌(Streptococcus uberis)的suHAS,小球藻病毒(Chlorella virus)的cvHAS,人(Homo sapiens)细胞的hsHAS1、2、3,小家鼠(Musmusculus)细胞的mmHAS1、2、3,多杀性巴氏杆菌的pmHAS[4]。1999年,DeAngelis[5]基于氨基酸序列、膜拓扑结构及反应机制的差异,将HAS划分为两类:来源于链球菌和脊椎动物的属于Ⅰ类HAS,而来源于P.multocida的HAS是目前发现唯一属于Ⅱ类的HAS;2007年,Weigel和DeAmgelis[6]将Ⅰ类HAS进一步分为两类:I-R(reducing,还原端聚合)、I-N(nonreducing,非还原端聚合),见表 1。脊椎动物有3种HAS,而且不同物种、不同组织,甚至同一组织在不同状态下合成的HA的分子量也不完全相同,从而介导、发挥不同的生理学功能[7];在酵母中重组表达的spHAS和xlHAS在相同的条件下,spHAS催化产生更高分子量的HA[8]。可见,生物体内存在某种机制来调控HA的分子量。
| Class Ⅰ | Class Ⅱ | ||
| R | N | ||
| 成员 | spHAS、seHAS、suHAS、(mmHAS、hsHAS)1) | xlHAS1、(cvHAS) | pmHAS |
| GT2①模块数量 | 1 | 1 | 2 |
| 预测的拓扑结构 | 内在膜蛋白 | 内在膜蛋白 | 外周膜蛋白 |
| HA链延伸方向 | 还原端 | 非还原端 | 非还原端 |
| 聚合方式 | 连续 | 连续 | 非连续 |
| UDP-糖位点数量 | ?② | ? | 2 |
| HA聚合位点数量 | ? | ? | (2)③ |
| Note: ① GT2: Glycosyl transferase family 2; ②"?" represents no further study; ③ The data in parentheses are for further confirmation | |||
Pummill和DeAngelis[9]利用基因定点突变技术改变了来自xlHAS的第77位Trp、107位Tyr,以及117、239和337位Cys,然后将突变的各xlHAS在酵母中重组表达。通过与未突变xlHAS的相关数据相比对,发现HA的分子量都发生了改变。分析其原因可能是由于重要氨基酸残基的突变,改变了HAS的催化活性以及HAS与底物的结合能力,这二者之间相对比率的变化改变了HA的分子量。
1.2 HA前体浓度及其与HAS浓度的比率Jing和DeAngelis[7]利用从基因工程菌中纯化得到的pmHAS,通过体外模拟的HA合成体系证明了HA的分子量受前体浓度及其与HAS浓度的比率的影响;Sheng等[10]分别在nisA启动子和lacA启动子控制下,将来源于S.zooepidemicus的szHASA(HAS基因)和szHASB(UDP-葡萄糖脱氢酶基因)导入乳酸乳球菌(Lactococcus lactis),得到双质粒控制表达系统,发现HA分子量和HAS表达水平与UDP-GlcUA浓度的相对比率呈负相关。当szHASA和szHASB拷贝数之比较高时,活细胞内每个HAS分子能够分配到的用来合成HA的前体UDP-GlcUA就相对较少,合成的HA糖链就相对较短;反之则合成较长糖链的HA。然而近期许多研究发现[11-13],相比于前体UDP-GlcUA,前体UDP-GlcNAc的浓度才是HA分子量的限制因素。Chen等[14]发现在S.zooepidemicus中,当两种前体达到平衡时,超表达与UDP-GlcUA合成有关的基因会降低HA分子量,超表达与UDP-GlcNAc合成有关的基因可增加HA分子量。HA前体与分子量之间的具体关系尚待完善。
1.3 HA的跨膜运输跨膜结构域(membrane domain,MD)与磷脂形成磷脂-HAS复合体,稳定UDP-HA-HAS复合体构象,参与HA的跨膜运输。seHAS跨膜结构域有两个保守的极性氨基酸:第二MD上的Lys(居第48位,MD248) 和第四MD上的Glu(居第327位, MD4327),是形成UDP-HA-HAS复合体的关键氨基酸残基,这两个氨基酸残基的突变将直接导致UDP-HA-HAS结构的不稳定,导致HA链在聚合度很低时即被释放。Kumari等[15]发现,通过使seHAS链上Lys48和Glu327发生突变,然后在大肠杆菌中表达,可导致HA合成受阻,由此证实HA的跨膜运输是决定HA分子量的因素之一。
HAS存在典型的跨膜结构域,并围绕成一个跨膜蛋白孔隙,2003年,Pummill和DeAngelis[9]推测该孔隙正是HA的跨膜运输通道;2007年,Schulz等[16]利用RNA干扰技术使多药耐药相关蛋白5(ABCC5 multidrug resistance associated protein,ABCC5/MRP5) 沉默后,发现HA的分泌受阻,说明ABC转运系统与HA的跨膜运输相关;2007年,Weigel和DeAngelis[6]提出在S.equisimilis中,HA的跨膜运输可能是由seHAS孔隙与细胞膜上的ABC转运系统共同完成的,并提出如图 1所示的HA合成及分泌模型;2012年,Medina等[17]构建了由seHAS与预载荧光染料的脂质体组成的体外模拟跨膜运输系统,证明了seHAS具有独立运输小分子染料物质的功能;2014年Vigetti等[18]排除了ABC转运系统参与HA跨膜运输的可能性,认为seHAS具有独立完成催化HA合成与跨膜运输的功能。HA的跨膜运输机制-究竟是通过HAS孔隙还是ABC转运系统又或是二者的组合,仍是需要深入探讨的问题。
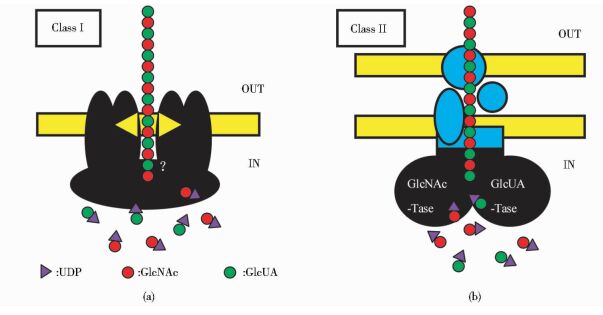
|
|
图 1
HAS合成及分泌模型
Figure 1
Synthesis and secretion model of HAS
(a)The Class Ⅰ enzymes (black) are lipid-dependent integral membrane proteins with multiple MDs embedded in the lipid bilayer that catalyze sugar addition and may transport the hydrophilic HA polymer across the cell membrane of eukaryotes or Gram-positive bacteria. Associated lipid molecules ( |
另一种对HA跨膜运输机制的解释是,当HA受到的膜外释放力(剪切力、范德华力、膜流动产生推力等)超过HA-HAS复合物内的对HA链的保持力时,HA即释放[19]。此外,近期研究发现,增加体外xlHAS1反应的离子强度会产生糖链较长的HA[9],说明疏水力(如疏水氨基酸侧链与HA中糖的疏水面之间)也涉及HA链的长短;hsHAS3可被磷酸化[20]以及哺乳动物HAS的催化和分泌是动态变化的[21]。这些研究进一步增加了HAS跨膜运输机制的复杂性。
这些针对分子量调控机制的探索,为改良现有HA生产技术提高HA分子量提供了理论依据和技术支持。
2 高分子量HA的生产方法 2.1 诱变筛选冯建成等[22]以S.equi为出发菌,以NTG为诱变剂进行化学诱变,选育出无溶血性,产高分子量HA的突变菌,其摇瓶发酵生产HA的分子量达2.06MDa;张容鹄等[23]以S.equi为出发菌,用紫外线、5-溴尿嘧啶和NTG为诱变剂进行复合诱变,选育出产高分子量HA的突变菌,分子量达4.36MDa;陈奕涵等[24]采用亚硝基甲基脲和15keV低能氮离子对S.zooepidemicus进行复合诱变,得到溶血素和透明质酸分解酶双缺陷型突变株,分子量达2.42Mu。
2.2 改善发酵培养条件发酵培养条件是影响HA分子量的关键因素。对于影响HA分子量的发酵条件,如发酵模式、初糖浓度、温度、pH、氮源浓度、通气率和搅拌转速等,得到了广泛的研究。
刘金龙等[25]探讨了培养条件对S.equisimilis合成HA分子量的影响:在发酵模式上,葡萄糖补料培养不利于高分子量HA的合成,利用葡萄糖间歇和连续补料培养的模式得到HA分子量分别为1.53MDa和1.42MDa,比分批培养下降了19.9%和25.7%;高初始浓度葡萄糖有利于长链HA的合成,当发酵体系中葡萄糖初始浓度从20g/L上升至80g/L时,分子量从1.24MDa提高到2.02MDa;在33~39℃时,较低温度有利于高分子量HA的合成,在33℃条件下HA分子量最高可达2.54MDa;发酵液pH显著影响HA的分子量,在pH为8时,达到了最高分子量2.38MDa。
Jagannath和Ramachandron[26]发现,提高有机氮源酵母粉的浓度以及流加氨水均不利于S.zooepidemicus高分子量HA的合成,维持低水平的复合氮源可以防止细菌快速增长,利于高分子量HA的合成。Kim等[27]在S.equi突变株中发现,当通气率在0.5~2.0vvm时,分子量随通气率的增加先增后减,在1.0vvm时达最大值。通气率较高时能增加NADH氧化酶的表达量,提高NADH/NAD+值,解除3-磷酸甘油醛脱氢酶的抑制作用,从而增大糖酵解途径的流量,产生更多的ATP,利于合成较高聚合度的HA;但通气率过大时NADH氧化酶产生的活性氧簇会降解HA链[28]。
分批发酵中搅拌转速对HA分子量的影响目前仍存在争议,见表 2。这些数据相互冲突,可能是由于使用的菌株以及具体的实验条件有所不同。这一问题还有待进一步研究。
2.3 异源宿主
HA已在GRAS认证安全的异源宿主中得以成功克隆和表达。凌敏等[32]克隆S.equi的HAS基因,构建质粒转化E.coli,诱导培养,利用携带该酶的细胞膜体外合成了分子量为3.6MDa的HA;Widner等[33]将seHASA基因导入Bacillus subtilis中,重组的Bacillus subtilis生产的HA分子量达1.1~1.2MDa;Jeong等[34]将xlHASA2(编码HAS)和xlHASB(编码UDP-葡萄糖脱氢酶)基因在毕赤酵母菌中表达,分子量达2.1MDa;此外,Yu和Stephanopoulos[35]还同时证明了磷酸葡萄糖异构酶基因pgi在重组大肠杆菌中高分子量HA的生产中起着重要作用。现在利用重组菌株生产HA成为热点,近期研究见表 3。
2.4 不同的添加剂 2.4.1 改善细胞通透性
HAS孔隙与HA糖链的跨膜运输相关,因此改变细胞通透性可能会对HA的分泌产生影响。在微生物发酵中常用的改善细胞通透性的物质主要有表面活性剂、溶菌酶及磷脂类物质等。李志敏[42]对S.zooepidemicus发酵HA的研究表明,阳离子表面活性剂CPC的添加以及阴离子表面活性物质SDS的添加不利于高分子量HA的形成;另外,添加5g/L非离子表面活性物质吐温-60对HA的分子量无明显影响;并且发现在发酵的第8h添加150mg/L的磷脂酰胆碱可以使HA分子量达到2.54MDa。Swaminathan和Ramachandran[11]发现,在S.zooepidemicus发酵液中将添加的溶菌酶浓度从20 000U/L提高到60 000U/L,HA的分子量提高了46%,达到3.2MDa。
2.4.2 抑制与HA竞争碳源及能量的其他途径链球菌生产HA的过程中竞争碳源和能量的包括三个过程:生物质的合成、磷酸戊糖途径和乳酸合成(通过糖酵解途径)。抑制糖酵解途径使更多的碳源转移到HA合成可以增加HA分子量。Shah等[43]的S.zooepidemicus分批发酵结果显示,通过添加不同的糖酵解抑制剂:25μmol/L碘乙酸钠、5g/L色氨酸、10g/L丙酮酸盐,HA的分子量从2.4MDa分别增加到了3.2MDa、3.2MDa和3.1MDa。另外,李志敏[42]发现多数细菌可在机体内将多聚磷酸盐的高能磷酸键转移至ADP、AMP分子上,使之转化形成ATP,通过向S.zooepidemicus发酵体系中添加多聚磷酸盐[(NaPO3)6]可以弱化菌体生长与HA合成的能量竞争,当(NaPO3)6添加量为3g/L时,分子量可达2.27MDa。
2.4.3 氧化胁迫Cleary和Larkin[44]的研究表明,当菌体所处环境中存在H2O2时,细胞通过加强HA的分泌,增加胞外荚膜的黏度和厚度来降低氧自由基的进入。管世敏等[45]在发酵罐水平上,在S.zooepidemicus发酵第7h时添加3.0ml/L的30% H2O2溶液,分子量由1.8MDa提高到2.1MDa。
2.4.4 提高发酵液溶氧在HA发酵过程中,发酵液黏度逐渐增加,限制氧的传递。添加氧载体可改善氧传递,有利于较高聚合度的HA的合成。Lai等[46]在S.zooepidemicus分批发酵中发现,通过添加0.5%(V/V)的正十六烷和1%(V/V)的正十二烷,HA的分子量从5.2MDa分别增加到了15.4MDa和9.27MDa。
3 总结与展望生产适应人类社会各种需求的特定分子量的HA尚存在诸多困难,进展缓慢,直到我们彻底了解HA的链终止机制以及跨膜运输机制才能明确研究方向。为了了解链终止的机制,我们需要深入探究不同类别HAS的体内动力学,并研究细胞内的代谢物浓度、酶的活性和HA分子量三者之间的具体联系。以上这些研究多是通过使用不同的菌株和发酵条件,缺乏一个针对HA分子量的全面系统的策略;而且不同的研究在检测HA分子量时所使用的检测方法及对照品不同,可能导致HA分子量的检测结果存在差异。此外,HA分子量与产量呈负相关关系,如何平衡HA产量与分子量之间的关系也是以后生产需要考虑的问题之一;控制下游分离纯化操作条件,减少HA的降解,是产品最终分子量的保证。现在利用异源宿主生产HA已大行其道,Novozymes的成功便是最好的证明。提高HA产量的研究已趋于上限,综合运用基因工程和代谢工程学方法,进一步开展对异源宿主生产HA的研究,建立一套高效、稳定且安全的微生物发酵方案来生产能够更好服务于社会的高分子量、低多分散性、高纯度的HA,是今后的研究重点。
| [1] | Chong B F, Blank L M, Mclaughlin R, et al. Microbial hyaluronic acid production. Appl Microbiol Biotechnol, 2005, 66(4) : 341–351. DOI:10.1007/s00253-004-1774-4 |
| [2] |
张云开. 透明质酸生产菌代谢工程研究. 南宁: 广西大学, 生命科学与技术学院, 2002. Zhang Y K. Metabolic Engineering Research of Hyaluronic Acid-Producing Bacterium Streptococcus equi. Nanning:Guangxi University, College of Life Science and Technology, 2002. |
| [3] |
张延良. 发酵法生产医用级透明质酸的工艺研究. 上海: 上海交通大学, 生命科学技术学院, 2010. Zhang Y L. Study on the Technology of Producing Medical Grade Hyaluronic Acid by Fermentation. Shanghai:Shanghai Jiaotong University, College of Life Science and Technology, 2010. |
| [4] |
生举正, 凌沛学, 王凤山.
透明质酸生物合成的研究进展. 中国生化药物杂志, 2009, 30(2) : 135–138.
Sheng J Z, Ling P X, Wang F S. Research advances of hyaluronic acid biosynthesis. Chinese Journal of Biochemical Pharmaceutics, 2009, 30(2) : 135–138. |
| [5] | DeAngelis P L. Hyaluronan synthases:fascinating glycosyltransferases from vertebrates, bacterial pathogens, and algal viruses. Cell Mol Life Sci, 1999, 56(7-8) : 670–682. DOI:10.1007/s000180050461 |
| [6] | Weigel P H, DeAngelis P L. Hyaluronan synthases:a decade-plus of novel glycosyltransferases. J Biol Chem, 2007, 282(51) : 36777–36781. DOI:10.1074/jbc.R700036200 |
| [7] | Jing W, DeAngelis P L. Synchronized chemoenzymatic synthesis of monodisperse hyaluronan polymers. J Biol Chem, 2004, 279(40) : 42345–42349. DOI:10.1074/jbc.M402744200 |
| [8] | Pummill P E, Achyuthan A M, DeAngelis P L. Enzymological characterization of recombinant xenopus DG42, a vertebrate hyaluronan synthase. J Biol Chem, 1998, 273(9) : 4976–4981. DOI:10.1074/jbc.273.9.4976 |
| [9] | Pummill P E, DeAngelis P L. Alteration of polysaccharide size distribution of a vertebrate hyaluronan synthase by mutation. J Biol Chem, 2003, 278(22) : 19808–19814. DOI:10.1074/jbc.M301097200 |
| [10] | Sheng J, Ling P, Zhu X, et al. Use of induction promoters to regulate hyaluronan synthase and UDP-glucose-6-dehydrogenase of Streptococcus zooepidemicus expression in Lactococcus lactis:a case study of the regulation mechanism of hyaluronic acid polymer. J Appl Microbiol, 2009, 107(1) : 136–144. DOI:10.1111/jam.2009.107.issue-1 |
| [11] | Swaminathan J, Ramachandran K B. Influence of competing metabolic processes on the molecular weight of hyaluronic acid synthesized by Streptococcus zooepidemicus. Biochemical Engineering Journal, 2010, 48(2) : 148–158. DOI:10.1016/j.bej.2009.09.003 |
| [12] | Chen W, Marcellin E, Hung J, et al. Hyaluronan molecular weight is controlled by UDP-N-acetylglucosamine concentration in Streptococcus zooepidemicus. J Biol Chem, 2009, 284(27) : 18007–18014. DOI:10.1074/jbc.M109.011999 |
| [13] | Jokela T A, Jauhiainen M, Auriola S, et al. Mannose inhibits hyaluronan synthesis by down-regulation of the cellular pool of UDP-N-acetylhexosamines. J Biol Chem, 2008, 283(12) : 7666–7673. DOI:10.1074/jbc.M706001200 |
| [14] | Chen W, Marcellin E, Steen J A, et al. The role of hyaluronic acid precursor concentrations in molecular weight control in Streptococcus zooepidemicus. Mol Biotechnol, 2013, 56(2) : 147–156. |
| [15] | Kumari K, Baggenstoss B A, Parker A L, et al. Mutation of two intram embrane polar residues conserved with in the hyaluronan synthase family alters hyaluronan product size. J BiolChem, 2006, 281(17) : 11755–11760. |
| [16] | Schulz T, Schumacher U, Prehm P. Hyaluronan export by the ABC transporter MRP5and its modulation by in tracellular cGMP. J Biol Chem, 2007, 282(29) : 20999–21004. DOI:10.1074/jbc.M700915200 |
| [17] | Medinal A P, Lin J L, Weigel P H. Hyaluronan synthase mediates dye translocation across liposomal membranes. BMC Biochem, 2012, 13(1) : 2–10. DOI:10.1186/1471-2091-13-2 |
| [18] | Vigetti D, Viola M, Karousou E, et al. Metabolic control of hyaluronan synthases. Matrix Biology, 2014, 35 : 8–13. DOI:10.1016/j.matbio.2013.10.002 |
| [19] | Weigel P H. Functional characteristics and catalytic mechanisms of the bacterial hyaluronan synthases. IUBMB Life, 2002, 54(4) : 201–211. DOI:10.1080/15216540214931 |
| [20] | Goentzel B J, Weigel P H, Steinberg R A. Recombinant human hyaluronan synthase 3is phosphorylated in mammalian cells. Biochem J, 2006, 396(2) : 347–354. DOI:10.1042/BJ20051782 |
| [21] | Rilla K, Siiskonen H, Spicer A P, et al. Plasma membrane residence of hyaluronan synthase is coupled to its enzymatic activity. J Biol Chem, 2005, 280(36) : 31890–31897. DOI:10.1074/jbc.M504736200 |
| [22] |
冯建成, 冯浩, 牛成, 等.
高分子量透明质酸生产菌SH0201的诱变选育. 中国酿造, 2011, 30(3) : 45–47.
Feng J C, Feng H, Niu C, et al. Mutation of SH0201for high molecular weight hyaluronic acid production. China Brewing, 2011, 30(3) : 45–47. |
| [23] |
张容鹄, 冯建成, 张剑韵, 等.
高分子量透明质酸产生菌选育及发酵条件优化. 中国酿造, 2008, 27(19) : 17–21.
Zhang R H, Feng J C, Zhang J Y, et al. Screening of Streptococcus equi strain for the production of hyaluronic acid with high molecular weight and optimization of related fermentation conditions. China Brewing, 2008, 27(19) : 17–21. |
| [24] |
陈奕涵, 钱悦, 侯永泰, 等.
复合诱变选育大分子量透明质酸高产菌株. 中国酿造, 2012, 31(9) : 98–101.
Chen Y H, Qian Y, Hou Y T, et al. Compound mutation screening strain for molecular weight and high-yield hyaluronic acid. China Brewing, 2012, 31(9) : 98–101. |
| [25] |
刘金龙, 赵国群, 李志敏, 等.
培养条件对Streptococcus equisimilis合成透明质酸相对分子质量的影响. 食品与生物技术学报, 2015, 34(2) : 209–214.
Liu J L, Zhao G Q, Li Z M, et al. Effect of culture condition on the molecular weight of hyaluronic acid synthesized by Streptococcus equisimilis. Journal of Food Science and Biotechnology, 2015, 34(2) : 209–214. |
| [26] | Jagannath S, Ramachandran K B. Influence of competing metabolic processes on the molecular weight of hyaluronic acid synthesized by Streptococcus zooepidemicus. Biochemical Engineering Journal, 2010, 48(2) : 148–158. DOI:10.1016/j.bej.2009.09.003 |
| [27] | Kim J H, Yoo S J, Oh D K, et al. Selection of a Streptococcus equi mutant and optimization of culture conditions for the production of high molecular weight hyaluronic acid. Enzyme and Microbial Technology, 1996, 19(6) : 440–445. DOI:10.1016/S0141-0229(96)00019-1 |
| [28] |
成霞, 刘登如, 陈坚, 等.
高产量、高分子量透明质酸发酵条件优化. 过程工程学报, 2006, 6(5) : 809–813.
Cheng X, Liu D R, Chen J, et al. Optimization of fermentation conditions for high yield and high molecular weight hyaluronic acid. The Chinese Journal of Process Engineering, 2006, 6(5) : 809–813. |
| [29] | Armstrong D C, Johns M R. Culture conditions affect the molecular weight properties of hyaluronic acid produced by Streptococcus zooepidemicus. Appl Environ Microbiol, 1997, 63(7) : 2759–2764. |
| [30] | Gao H J, Chen J, Du G C, et al. Effect of agitation and mixing on hyaluronic acid production by Streptococcus zooepidemicus. Journal of Chemical Industry and Engineering, 2003, 54(3) : 350–356. |
| [31] | Zhang X, Duan X, Tan W. Mechanism for the effect of agitation on the molecular weight of hyaluronic acid produced by Streptococcus zooepidemicus. Food Chemistry, 2010, 119(4) : 1643–1646. DOI:10.1016/j.foodchem.2009.09.014 |
| [32] |
凌敏, 黄日波, 黄鲲, 等.
马链球菌透明质酸合成酶基因的分子克隆及表达. 工业微生物, 2003, 33(2) : 4–8.
Ling M, Huang R B, Huang K, et al. Cloning and expression of hyaluronan synthase gene from Streptococcus equi. Industrial Microbiology, 2003, 33(2) : 4–8. |
| [33] | Widner B, Behr R, Von Dollen S, et al. Hyaluronic acid production in Bacillus subtilis. Appl Environ Microbiol, 2005, 71(7) : 3747–3752. DOI:10.1128/AEM.71.7.3747-3752.2005 |
| [34] | Jeong E, Shim W Y, Kim J H. Metabolic engineering of Pichia pastoris for production of hyaluronic acid with high molecular weight. J Biotechnol, 2014, 185 : 28–36. DOI:10.1016/j.jbiotec.2014.05.018 |
| [35] | Yu H, Stephanopoulos G. Metabolic engineering of Escherichia coli for biosynthesis of hyaluronic acid. Metab Eng, 2008, 10(1) : 24–32. DOI:10.1016/j.ymben.2007.09.001 |
| [36] | Jia Y N, Zhu J, Chen X F, et al. Metabolic engineering of Bacillus subtilis for the efficient biosynthesis of uniform hyaluronic acid with controlled molecular weights. Bioresour Technol, 2013, 132 : 427–431. DOI:10.1016/j.biortech.2012.12.150 |
| [37] | Mao Z, Shin H D, Chen R. A recombinant E. coli bioprocess for hyaluronan synthesis. Appl Microbiol Biotechnol, 2009, 84(1) : 63–69. DOI:10.1007/s00253-009-1963-2 |
| [38] | Prasad S B, Jayaraman G, Ramachandran K B. Hyaluronic acid production is enhanced by the additional co-expression of UDP-glucose pyrophosphorylase in Lactococcus lactis. Appl Microbiol Biotechnol, 2010, 86(1) : 273–283. DOI:10.1007/s00253-009-2293-0 |
| [39] | Chauhan A S, Badle S S, Ramachandran K B, et al. The P170 expression system enhances hyaluronan molecular weight and production in metabolically-engineered Lactococcus lactis. Biochem Eng J, 2014, 90 : 73–78. DOI:10.1016/j.bej.2014.05.012 |
| [40] | Hmar R V, Prasad S B, Jayaraman G, et al. Chromosomal integration of hyaluronic acid synthesis (has) genes enhances the molecular weight of hyaluronan produced in Lactococcus lactis. Biotechnol J, 2014, 9(12) : 1554–1564. DOI:10.1002/biot.201400215 |
| [41] | Mao Z, Chen R R. Recombinant synthesis of hyaluronan by Agrobacterium sp.. Biotechnol Prog, 2007, 23(5) : 1038–1042. |
| [42] |
李志敏. 高分子量透明质酸发酵工艺的研究. 石家庄: 河北科技大学, 生命科学与工程学院, 2015. Li Z M. Study on fermentation process of high-molecular-weight hyaluronic acid. Shijazhuang:Hebei University of Science and Technology, College of Bioscience & Bioengineering, 2015. |
| [43] | Shah M V, Badle S S, Ramachandran K B. Hyaluronic acid production and molecular weight improvement by redirection of carbon flux towards its biosynthesis pathway. Biochemical Engineering Journal, 2013, 80 : 53–60. DOI:10.1016/j.bej.2013.09.013 |
| [44] | Cleary P P, Larkin A. Hyaluronic acid capsule:strategy for oxygen resistance in group A streptococci. J Bacteriol, 1979, 140(3) : 1090–1097. |
| [45] |
管世敏, 荣绍丰, 陈奕涵.
外源氧化胁迫提高透明质酸分子量. 中国医药工业杂志, 2013, 44(1) : 27–31.
Guan S M, Rong S F, Chen Y H. Oxidative stress to increase hyaluranic acid molecule. Chinese Journal of Pharmaceuticals, 2013, 44(1) : 27–31. |
| [46] | Lai Z W, Rahim R A, Ariff A B, et al. Biosynthesis of high molecular weight hyaluronic acid by Streptococcus zooepidemicus using oxygen vector and optimum impeller tip speed. Journal of Bioscience and Bioengineering, 2012, 114(3) : 286–291. DOI:10.1016/j.jbiosc.2012.04.011 |
 2017, Vol. 37
2017, Vol. 37




