文章信息
- 陈振, 陈献忠, 张利华, 王均华, 沈微, 樊游.
- CHEN Zhen, CHEN Xian-zhong, ZHANG Li-hua, WANG Jun-hua, SHEN Wei, FAN You.
- 代谢改造热带假丝酵母发酵木糖母液生产木糖醇
- Metabolic Engineering of Candida tropicalis for Xyltiol Production from Xylose Mother Liquor
- 中国生物工程杂志, 2017, 37(5): 66-75
- China Biotechnology, 2017, 37(5): 66-75
- http://dx.doi.org/DOI:10.13523/j.cb.20170509
-
文章历史
- 收稿日期: 2016-11-11
- 修回日期: 2017-01-05
2. 江南大学生物工程学院 生物资源与生物能源研究中心 无锡 214122;
3. 粮食发酵工艺与技术国家工程实验室 无锡 214122
2. Center of Bioresource & Bioenergy, School of Biotechnology, Jiangnan University, Wuxi 214122, China;
3. National Engineering Laboratory for Creal Fermention Technology, Jiangnan University, Wuxi 214122, China
木糖醇是一种在水果及蔬菜中广泛存在的五碳糖醇[1],但含量极低,直接从其中提取不经济。木糖醇在食品、医药、轻工等领域具有广泛用途,如作为糖尿病患者的辅助治疗剂[2]、防龋齿、改善肝功能、调节肠道等[3]。目前工业化的木糖醇生产方法主要是化学生产法[4],即将富含多缩戊糖的玉米芯、棉籽壳、甘蔗渣等材料经酸水解后分离纯化获得木糖,再经氢化得到木糖醇。木糖分离纯化过程中会产生大量的浓缩废液(木糖母液),其中仍含有一定量的木糖,但从中进一步分离纯化木糖成本较高。木糖母液的主要成分有葡萄糖、木糖、阿拉伯糖等糖类[5],以及糠醛、乙酸等抑制菌体生长的物质。目前,国内木糖醇的产量在13万吨/年,每年有大量的木糖母液未被利用。利用微生物法发酵木糖母液生产木糖醇不仅可以变废为宝、节约资源,而且可以保护环境。
目前发现可以利用木糖的微生物有一百多种,大多数研究限于念珠菌的某些种类。其中热带假丝酵母的木糖转化能力较强[5],并且对木糖母液中的糠醛、乙酸和酚类等抑制物具有较高的耐受能力。热带假丝酵母菌株中的木糖代谢途径如图 1所示[5]:木糖在木糖还原酶(xylose reductase,XR)的作用下还原为木糖醇,再经过木糖醇脱氢酶(xylitol dehydrogenase,XDH)氧化生成D-木酮糖。D-木酮糖经过木酮糖激酶(xylulokinase,XK)磷酸化后生成D-木酮糖-5磷酸,再通过磷酸戊糖途径和糖酵解途径降解为丙酮酸。最后,丙酮酸进入TCA循环完全氧化供能或者在细胞质中不完全氧化生成乙醇。

|
| 图 1 热带假丝酵母木糖代谢途径 Figure 1 The xylose metabolic pathway of Candida tropicalis |
微生物法生产木糖醇的报道很多,大多数研究是利用基因工程手段对热带假丝酵母进行代谢改造。Woo等在热带假丝酵母BSXDH-3(删除了双拷贝的木糖醇脱氢酶基因)中表达了来自于粗糙脉孢菌(Neurospora crassa)的木糖还原酶基因,获得工程菌株L10。该菌株能够以葡萄糖为辅助底物转化木糖生产木糖醇,木糖醇的比生产速率达1.44g/(L·h),转化率达到96%,相对于出发菌株BSXDH-3分别提高了62%和73%[6]。而Ahmad等则在BSXDH-3菌株的基础上表达两个涉及磷酸戊糖途径的关键酶基因(zwf和gnd),从而增加了胞内的NADPH供应,使得工程菌在以甘油为辅助基质时的木糖醇的比生产速率比出发菌株提高了21%[7]。此外,他们还敲除了L10菌株的甘油激酶基因(GK),然后通过表达来源于树干毕赤酵母(Scheffersomyces stipites)的NADP+依赖的甘油脱氢酶基因来恢复甘油代谢途径,促进NADPH的再生,使得工程菌株(GK)在发酵16h和24h后木糖醇的比生产速率分别达到0.85g/(L·h)和1.28g/(L·h),比BSXDH-3菌株分别提高了30%和18%[8]。由于他们利用化学纯木糖作为转化底物,不可避免导致了木糖醇成本的升高[6-8]。
对于木糖母液生物利用的研究,邓子新团队分别通过热带假丝酵母X828和枯草芽孢杆菌Bs12在含有400g/L木糖母液的培养基中发酵,木糖醇产量达到95g/L,转化率达到0.75g/g。同时,培养基中的葡萄糖、L-阿拉伯糖和半乳糖均消耗完[9]。他们还通过重组大肠杆菌发酵木糖母液生产琥珀酸,最大产量为(52.09±0.21) g/L[10]。此外,邓子新团队还利用毕赤酵母Y161菌株消耗掉木糖母液中的葡萄糖、木糖和半乳糖等糖类,使发酵液中L-阿拉伯糖的含量达到总糖的86.1%,便于木糖母液中L-阿拉伯糖的回收[11]。汪东升等用Klebsiella pneumoniae CICC10011菌株发酵木糖母液生产2,3-丁二醇,72h 2,3-丁二醇浓度达到35.7g/L[12]。
本文利用基因删除技术敲除热带假丝酵母的木糖醇脱氢酶基因,阻断木糖醇的代谢,在此基础上对工程菌株发酵木糖母液生产木糖醇的工艺进行了初步优化。结果表明该菌株能够利用木糖母液中的葡萄糖作为碳源进行生长繁殖,同时将木糖母液中的木糖转化为木糖醇,简化了后续的产物分离工艺,具有一定的社会价值及经济价值。
1 材料与方法 1.1 菌株、质粒与培养条件大肠杆菌(Escherichia coli)JM109由本实验室保藏,热带假丝酵母XZX(尿嘧啶缺陷型)由本实验室诱变获得[13]。质粒pMD19-T Simple购自宝生物工程(大连)有限公司,质粒dpl-URA3-Tm由本实验室前期构建[14]。MM培养基:6.7g/L YNB,10g/L硫酸铵,20g/L葡萄糖。SM培养基:6.7g/LYNB,10g/L硫酸铵,20g/L葡萄糖,0.06g/L尿嘧啶。种子液培养基:10g/L酵母粉,20g/L蛋白胨,20g/L葡萄糖。初始发酵培养基:200g/L木糖母液,5g/L酵母浸膏。初始发酵条件:30℃,200r/min。功能鉴定培养基:50g/L木糖,10g/L(葡萄糖或甘油),10g/L酵母粉,5g/L KH2PO4,0.2g/L MgSO4·7H2O。浓缩木糖母液由山东福田药业馈赠,其组成经HPLC测定分析,主要糖类有98.36g/L葡萄糖,512.31g/L木糖,96.28g/L阿拉伯糖。
1.2 XYL2基因敲除突变盒的构建根据NCBI中热带假丝酵母的木糖醇脱氢酶基因(XYL2)(GenBabnk登录号:DQ201637) 设计引物XYL2-F、XYL2-R、rXYL2-F和rXYL2-R。提取热带假丝酵母XZX菌株的基因组,以此为模板使用引物XYL2-F和XYL2-R PCR扩增1.3kb的XYL2片段。插入pMD19-T Simper载体中,获得重组质粒XYL2-Ts。以质粒XYL2-Ts为模板,使用引物rXYL2-F和rXYL2-R通过反向PCR扩增获得含两段同源臂的线性化载体UDXYL2-Ts-UDXYL2。通过Xba Ⅰ与Pst Ⅰ消化质粒dpl-URA3-Tm回收dpl-URA3片段,然后与经过相同酶切处理的线性化载体UDXYL2-Ts-UDXYL2片段连接,获得重组质粒Ts-UDXYL2-dpl-URA3,最后以XYL2-F和XYL2-R为引物PCR扩增出第一个XYL2基因删除突变盒UDXYL2-dpl-URA3-UDXYL2。以同样的方法构建携带第二个XYL2基因删除盒的重组质粒Ts-U2D2XYL2-dpl-URA3,并通过引物2XYL2-F和2XYL2-R扩增出第二个XYL2基因删除突变盒U2D2XYL2-dpl-URA3-U2D2XYL2。本文所用引物(表 1)由上海生工生物工程技术服务有限公司合成,分子操作所使用的工具酶从宝生物(大连)有限公司购买。
| Primer name | Primer sequence (5′-3′) |
| XYL2-F | TAAATAGAACCCACGAATCCCT |
| XYL2-R | TTTACTCGTACTATGCACTCC |
| rXYL2-F | AACTGCAGAGTAGTGAATATCGGAACCACA |
| rXYL2-R | GCTCTAGAAACTTCCCAATTTCCGACT |
| 2XYL2-F | CTAAATCCGGCCACTACCAC |
| 2XYL2-R | CCAGCGTTACCAATTTGCAC |
| rXYL2-F | AACTGCAGTCACCGAACTTCAAATCAGC |
| rXYL2-R | GCTCTAGATGCCGTTGCCAGAACCAT |
1.3 热带假丝酵母的转化
氯化锂(LiCl)转化法[13]。将宿主菌培养至OD600为1.0~1.5,收集菌体,用TE溶液(10mmol/L Tris-HCl、pH7.4、1mmol/L EDTA)清洗菌体,重悬在1ml 100mmol/L LiCl中,30℃、200r/min孵育1h。取90μl细胞,与10μl DNA片段及2μl鲑鱼精混匀,30℃孵育30min。再加入900μl PEG3350溶液(40% PEG3350、100mmol/L氯化锂),30℃、200r/min孵育1h。然后42℃热激5min,快速冷却至室温,离心收集细胞,并用无菌水清洗1次,涂布MM平板,30℃培养2~3天。
1.4 XYL2基因敲除与URA3基因的重复利用参考前期本实验室建立的多基因删除技术[14],敲除XYL2基因。其双拷贝基因敲除流程如图 2所示,将基因删除表达盒转入热带假丝酵母XZX中,提取所得到的转化子基因组DNA,进行PCR验证。将鉴定正确的转化子接种到SM培养基中,30℃、200r/min摇瓶培养。待菌体达到一定浓度时收集菌体并涂布FOA平板(SM+0.02g/L的5-氟乳清酸),30℃培养3~5天,转接单菌落至SM液体培养基,提取基因组进行PCR验证,获得URA3基因弹出的突变菌株,保存或用于第二轮基因敲除。

|
| 图 2 热带假丝酵母双拷贝的XYL2基因敲除流程 Figure 2 Procedure of gene knockout of xyl2 in C. tropicalis |
发酵培养基初始pH对木糖醇产量的影响:采用相同的发酵培养基,保持其他发酵条件相同,将初始pH分别调整为4.0、5.0、6.0和7.0,进行摇瓶发酵,考察不同初始pH对木糖醇产量的影响。
接种量对木糖醇产量的影响:采用相同的发酵培养基,其他发酵条件相同,分别按5%、10%、15%(V/V)的接种量接入液体种子,考察不同接种量对木糖醇产量的影响。
发酵温度对木糖醇产量的影响:采用相同的发酵培养基,其他发酵条件相同,分别在30℃、33℃、35℃下进行摇瓶发酵,考察发酵温度对木糖醇产量的影响。
1.6 摇瓶发酵培养基的优化不同浓度的木糖母液对木糖醇产量的影响:分别配制木糖母液浓度为100g/L、150g/L、200g/L、250g/L、300g/L的发酵培养基,在相同的发酵条件下进行摇瓶发酵,考察木糖母液浓度对木糖醇产量的影响。
在木糖母液浓度优化的基础上考察氮源种类对木糖醇产量的影响:分别在发酵培养基中添加5g/L酵母浸膏、5g/L蛋白胨、2.5g/L酵母浸膏加2.5g/L蛋白胨、5g/L玉米浆作为氮源,在相同的发酵条件下进行摇瓶发酵,考察氮源种类对木糖醇产量的影响。
1.7 木糖母液的预处理木糖母液中含有糠醛、乙酸、四氢呋喃等抑制菌体生长的物质,在配制培养基之前将木糖母液进行简单的预处理:先用氢氧化钙将pH调至10.0,然后使用磷酸将pH调回5.0,这样可以除去部分抑制菌体生长的物质,使得发酵液的发酵性能得以提升[15]。分别使用未处理的、调整过pH的、调整pH并过滤的木糖母液配置发酵培养基,在优化后的发酵条件下,进行摇瓶发酵,考察木糖母液预处理对木糖醇产量的影响。
1.8 木糖醇含量的测定使用高效液相色谱(HPLC)。色谱条件如下:HPLC色谱柱为Aminox ® HPX-87H Column(300mm×7.8mm)。流动相为5mmol/L的H2SO4,柱温为50℃,示差检测器,流速设置为0.5ml/min[16]。流动相需用0.22μm孔径的水系膜进行真空抽滤,使用前超声10min除去气泡。样品处理:取发酵液100ml,12 000r/min离心5min收集上清,经0.22μm孔径滤膜过滤后加入HPLC样品瓶对发酵液中的木糖及木糖醇的含量进行测定。
2 结果讨论 2.1 木糖醇脱氢酶基因的删除及突变株的功能验证分别构建重组质粒Ts-UDXYL2-dpl-URA3和Ts-U2D2XYL2-dpl-URA3,经酶切鉴定正确以后从质粒Ts-UDXYL2-dpl-URA3中扩增出第一个XYL2基因敲除盒,将其转化进入XZX菌株中,并以XYL2-F和XYL2-R为引物对转化子进行PCR验证,结果如图 3(a)所示,其中泳道1为阳性转化子,命名为XZX B1,2.4kb的片段为UDXYL2-dpl-URA3-UDXYL2,1.3kb的DNA片段是XYL2基因的原始片段。测序分析发现XZX B1菌株中的一个XYL2基因位点被敲除盒UDXYL2-dpl-URA3-UDXYL2替换(测序结果未列出)。
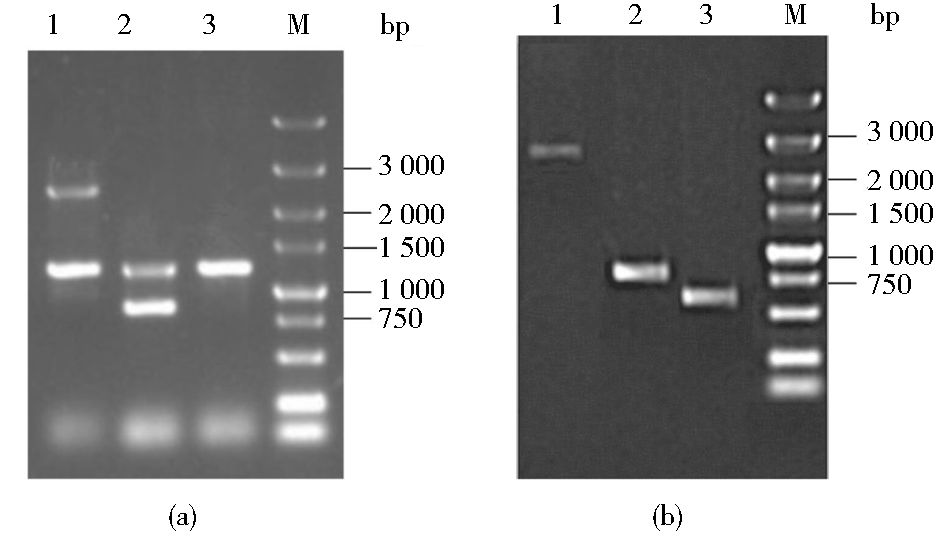
|
| 图 3 突变株的PCR鉴定 Figure 3 Identification of mutant strains by PCR (a) Lane 1: PCR products using XYL2-F and XYL2-R as primers and XZX B1 as template; Lane 2: PCR products using XYL2-F and XYL2-R as primers and XZX B2 as template; Lane3: PCR products using XYL2-F and XYL2-R as primers and XZX as template; M: DL5000 DNA marker (b) Lane 1:PCR products using 2XYL2-F and 2XYL2-R as primers and XZX B3 as template; 2: PCR products using 2XYL2-F and 2XYL2-R as primers and XZX B4 as template; 3: PCR products using 2XYL2-F and 2XYL2-R as primers and XZX as template; M: DL5000 DNA marker |
为重复利用URA3作为筛选标记,将XZX B1菌株涂布于FOA平板上,筛选弹出URA3基因的突变菌株。然后使用引物XYL2-F和XYL2-R进行PCR验证,结果如图 3(a)中2泳道所示,其中0.8kb片段为UDXYL2-dpl-UDXYL2,1.3kb的DNA片段为XYL2基因的原始片段。XZX B1菌株弹出URA3标记基因的突变菌株命名为XZX B2。测序分析进一步验证URA3基因丢失。
转化第二个XYL2基因删除盒进入XZX B2菌株,然后以2XYL2-F和2XYL2-R为引物对转化子进行PCR验证,阳性转化子的鉴定结果如图 3(b)泳道1所示,电泳条带与理论值相符,突变菌株命名为XZX B3。XZX B3菌株弹出标记基因后获得XZX B4菌株,鉴定结果如图 3(b)泳道2所示。测序分析结果进一步验证XZX B4菌株中双拷贝的XYL2基因均被删除,且URA3标记基因从该基因位点弹出。
将XZX、XZX B2和XZX B4菌株分别接种于木糖为唯一碳源的培养基中培养,结果发现XZX、XZX B2菌株能够正常生长,而XZX B4由于木糖醇脱氢酶基因的缺失导致菌体无法生长(数据未列出)。为进一步考察突变株的木糖醇合成能力,分别使用XZX、XZX B2、XZX B4在功能鉴定培养基中发酵,以葡萄糖为碳源时的发酵情况如图 4所示,突变株XZX B4的生长速率最慢,消耗木糖的速率也相对较慢。XZX B2菌株的木糖醇产量最高,但该菌株的木糖醇转化率仅为50%,而XZX B4菌株的木糖醇转化率接近100%。由此可见,敲除热带假丝酵母木糖醇脱氢酶基因可以阻断木糖醇的消耗。

|
| 图 4 不同菌株在葡萄糖鉴定培养基中的生长 Figure 4 Growth of different strains in glucose identification medium (a) The growth of different strains (b) Influences of different strains on xylose concentration (c) Influences of different strains on xylitol concentration |
保持发酵培养基组分不变,分别将培养基的初始pH设定为4.0、5.0、6.0、7.0,接种量10%(V/V)(种子液:接种单菌落于种子液培养基中30℃培养48h,此时菌体处于对数生长后期),在相同的发酵条件下,进行摇瓶发酵,考察初始pH对菌体生长和木糖醇产量的影响。实验结果如图 5所示。

|
| 图 5 不同初始pH对木糖醇发酵的影响 Figure 5 Effect of different initial pH on the fermentation process of xylitol (a) Effect of different initial pH on growth (b) Effect of different Initial pH on xylose concentration (c) Effect of different Initial pH on xylitol concentration |
图 5(a)表明在一定的初始pH范围内,pH越高菌体生长越好,当pH达到7.0时,菌株生长状况最好,菌体量最高。由图 5(b)、(c)可知,pH 5.0时发酵液中木糖转化速率最快,木糖醇产量最高,发酵136h后,木糖醇产量为37g/L;当pH超过5.0时,木糖醇产量会随pH升高而下降,所以5.0是木糖醇发酵的最优初始pH。
2.3 接种量对木糖醇产量的影响接种量是影响发酵产量的关键因素之一。接种量较小会延长菌体延迟期,导致发酵周期延长;接种量较大时,虽有利于缩短延迟期,但是菌体的生长速率过快,从而加快pH的下降,影响木糖还原酶的活性,不利于代谢产物的累积。
为了研究接种量对木糖醇产量的影响,分别按照接种量为5%(V/V)、10%(V/V)、15%(V/V),保持培养基其他组分不变,在相同的发酵条件下进行摇瓶发酵,考察接种量对菌体生长和木糖醇产量的影响。实验结果如图 6所示。

|
| 图 6 不同接种量对木糖醇发酵的影响 Figure 6 Effect of different inoculation amount on the fermentation process of xylitolr (a) Effect of different inoculation amount on growth (b) Effect of different inoculation amount on xylose concentration (c) Effect of different inoculation amount on xylitol concentration |
结果表明,随着接种量增加,发酵前期的菌体生长情况不断改善,木糖醇产量也不断增加,但是后期菌体量与接种量呈负相关[图 6(a)、(b)]。由图 6c可知,当接种量为15%(V/V)时木糖醇产量最高,达到50g/L。因此,选定种子液的最优接种量为15%(V/V)。
2.4 发酵温度对木糖醇产量的影响热带假丝酵母菌体的生长和木糖的转化过程都是在多种酶及辅酶的作用下进行的,而温度是影响酶活性的重要因素。因此必须在稳定且适宜的培养温度下进行发酵。保持培养基组分不变,接种量15%(V/V),分别在30℃、33℃、35℃下进行摇瓶发酵,考察温度对菌体生长及木糖醇产量的影响。实验结果如图 7所示。

|
| 图 7 不同发酵温度对木糖醇发酵的影响 Figure 7 Effect of different fermentation temperature on the fermentation process of xylitol (a) Effect of different fermentation temperature on growth (b) Effect of different fermentation temperature on xylose concentration (c) Effect of different fermentation temperature on xylitol concentration |
结果显示,在30℃时菌体的生长速率最高,但木糖醇终产量最低(25g/L左右);在35℃时菌体生长状况最差,但在发酵110h后木糖醇产量最高,为45g/L。从酶学性质来看,随着温度的升高,反应速率加大,菌体生长代谢加快,木糖醇产量增加,但是酶自身很容易因为温度过高而失活,且温度越高失活也越快;发酵温度过低时,同样会影响木糖醇的生产速率和产率[17]。图 7(a)所示,当温度处于30℃时,菌体生长最好,但是木糖醇产量最低[图 7(c)],这是由于30℃不是木糖还原酶的最适温度,所以选择35℃作为热带假丝酵母的木糖醇发酵温度。
2.5 木糖母液浓度对木糖醇产量的影响木糖母液中,除了木糖、葡萄糖、阿拉伯糖等单糖之外,还含有乙酸、糠醛、四氢呋喃等有毒物质[18]。为考察不同浓度的木糖母液对XZX B4菌株生长及木糖醇产量的影响,将发酵培养基中木糖母液浓度分别控制为100g/L、150g/L、200g/L、250g/L和300g/L,发酵条件及培养基其他组分不变,接种量为15%,进行摇瓶发酵。所得实验结果如图 8所示。

|
| 图 8 不同浓度木糖母液对木糖醇发酵的影响 Figure 8 Effect of different concentration of mother liquor on the fermentation process of xylitol (a) Effect of different concentration of mother liquor on growth (b) Effect of different concentration of mother liquor on xylose concentration (c) Effect of different concentration of mother liquor on xylitol concentration |
发酵起始阶段,菌体在低浓度的木糖母液(100g/L、150g/L)中生长较快[图 8(a)],这是由发酵液中的菌体生长抑制物较少,但用于菌体生长的葡萄糖、果糖等碳源也少,且其中的木糖含量较低,所得最终的木糖醇产量不高[图 8(c)]。在木糖母液浓度较高(如300g/L)时,由于在发酵培养基中所含的抑制菌体生长的物质浓度也较高,菌体的生长速率较慢,使整个发酵周期延长,发酵120h后木糖醇产量仍较木糖母液浓度为250g/L的培养基低。因此采用250g/L作为发酵培养基的最适宜木糖母液添加量[图 8(c)]。
2.6 氮源对木糖醇产量的影响为了考察可溶性氮源对XZX B4菌株生长及木糖醇发酵的影响,分别以酵母浸膏、蛋白胨、酵母浸膏加蛋白胨、玉米浆作为氮源,控制培养基中其他成分及发酵条件不变,接种量15%,进行摇瓶发酵,结果如图 9所示。

|
| 图 9 不同氮源对木糖醇发酵的影响 Figure 9 Effect of different nitrogen source on the fermentation process of xylitol (a) Effect of different nitrogen source on growth (b) Effect of different nitrogen source on xylose concentration (c) Effect of different nitrogen source on xylitol concentration |
由图 9(a)可知,在发酵的前期XZX B4菌株利用酵母浸膏或酵母浸膏与蛋白胨组合作为氮源的生长速率较以玉米浆或蛋白胨作为氮源时快,这是由于酵母浸膏属于可溶性速效氮源,有利于前期菌体的生长。但是随着菌体的生长,菌体会分泌出相应的蛋白酶,加快迟效性氮源的利用。因此,玉米浆和蛋白胨分别作为氮源时菌体在发酵后期的生长速率相对加快。最终,在以玉米浆作为氮源的培养基中OD600最高达到18.1。此外,在以酵母浸膏作为氮源时发酵液中木糖的残留量最多,而玉米浆与酵母浸膏加蛋白胨作为氮源时的发酵液中的木糖残余量相差不大,二者的木糖醇产量最高,达到67g/L左右[图 9(c)]。综上所述,采用玉米浆或者酵母浸膏加蛋白胨作为氮源,木糖醇的生产效果最好。
虽然使用蛋白胨加酵母浸膏作为混合氮源与单独以玉米浆为补充氮源发酵生产木糖醇的效果相当,但前者价格较高,不适合在工业上大规模的应用。因此选用玉米浆作为较优的氮源进行木糖醇发酵。
2.7 木糖母液预处理对木糖醇产量的影响在木糖制备过程中需要进行酸处理,因此木糖母液中含有一定量的酸性发酵抑制物,最主要是少量的硫酸和乙酸[16],要提高木糖母液的发酵性能,就需要尽可能的除去这些发酵抑制物。为了考察木糖母液预处理对XZX B4菌株生长和木糖醇产量的影响,先使用Ca(OH)2将木糖母液pH调至10.0,然后使用磷酸将pH调回至5.0,或者在pH处理的基础上过滤除去其中的磷酸钙沉淀,培养基中其他成分不变,以未经预处理的木糖母液作为对照组,接种量15%,进行摇瓶发酵。结果如表 2所示。
| Xylose residues(g/L) | Xylitol production(g/L) | |
| Not pretreated | 10.56 | 78.76 |
| Adjusted pH | 5.85 | 83.01 |
| Adjusted pH and filtered | 8.61 | 79.63 |
由表 2可知,调整过木糖母液pH的培养基与未预处理的培养基相比较,在发酵结束后前者的发酵液中木糖残余量更低,木糖醇产量更高。而利用调整pH并过滤处理的木糖母液配制的培养基的发酵效果较仅调整过pH的培养基略差。所以选择仅调整pH的作为木糖母液的最适宜预处理方案,此时木糖醇的产量达到83.01g/L,相对于未处理的发酵培养基产量增加了5.4%,木糖转化率达到83.16%。
3 结论目前,木糖醇的主要来源是通过化学方法获得。考虑到工业生物技术的发展和可持续发展的需要,生物转化法生产木糖醇可能是未来发展的方向。论文以热带假丝酵母为出发菌株,敲除了双拷贝的XYL2基因获得木糖醇代谢阻断的突变株XZX B4,该突变株在代谢木糖时会积累木糖醇。进一步,我们利用木糖母液作为底物,优化并建立了该菌株发酵木糖母液生产木糖醇的发酵工艺,为利用XZX B4菌株发酵木糖母液生产木糖醇工艺的研究提供了的理论依据和实践指导。
| [1] |
冯永强, 王江星.
木糖醇的特性及在食品中的应用. 食品科学, 2004, 25(11) : 379–381.
Feng Y Q, Wang J X. Property of xylitol and its application in food industry. Food Science, 2004, 25(11) : 379–381. DOI:10.3321/j.issn:1002-6630.2004.11.102 |
| [2] | Islam M S. Effects of xylitol as a sugar substitute on diabetes-related parameters in nondiabetic rats. J Med Food, 2011, 14(5) : 505–511. DOI:10.1089/jmf.2010.0015 |
| [3] |
尤新.
木糖醇及其功能. 食品工业科技, 2003, 24(8) : 87–88.
You X. Xylitol and its function. Science and Technology of Food Industry, 2003, 24(8) : 87–88. |
| [4] |
张厚瑞, 何成新, 梁小燕, 等.
半纤维素水解物生物转化生产木糖醇. 生物工程学报, 2000, 16(3) : 304–307.
Zhang R H, He C X, Liang X Y, et al. Production of xylitol by biotransformation of hemicellulose hydrolyzate. Chinese Journal of Biotechnology, 2000, 16(3) : 304–307. |
| [5] | de Albuquerque T L, da Silva I J, de Macedo G R, et al. Biotechnological production of xylitol from lignocellulosic wastes:a review. Process Biochem, 2014, 49(11) : 1779–1789. DOI:10.1016/j.procbio.2014.07.010 |
| [6] | Jeon W Y, Yoon B H, Ko B S, et al. Xylitol production is increased by expression of codon-optimized Neurospora crassa xylose reductase gene in Candida tropicalis. Bioproc Biosyst Eng, 2012, 35(1-2) : 191–198. DOI:10.1007/s00449-011-0618-8 |
| [7] | Ahmad I, Shim W Y, Jeon W Y, et al. Enhancement of xylitol production in Candida tropicalis by co-expression of two genes involved in pentose phosphate pathway. Bioproc Biosyst. Eng, 2012, 35(1-2) : 199–204. DOI:10.1007/s00449-011-0641-9 |
| [8] | Ahmad I, Shim W Y, Kim J H. Enhancement of xylitol production in glycerol kinase disrupted Candida tropicalis by co-expression of three genes involved in glycerol metabolic pathway. Bioproc Biosyst Eng, 2013, 36(9) : 1279–1284. DOI:10.1007/s00449-012-0872-4 |
| [9] | Wang H, Li L, Zhang L, et al. Xylitol production from waste xylose mother liquor containing miscellaneous sugars and inhibitors:one-pot biotransformation by Candida tropicalis and recombinant Bacillus subtilis. Microb Cell Fact, 2016, 15(1) : 1. DOI:10.1186/s12934-015-0402-6 |
| [10] | Wang H, Pan J, Wang J, et al. Succinic acid production from xylose mother liquor by recombinant Escherichia coli strain. Biotechnol Biotechnol Equip, 2014, 28(6) : 1042–1049. DOI:10.1080/13102818.2014.952501 |
| [11] | Cheng H, Wang H, Lv J, et al. A novel method to prepare L-Arabinose from xylose mother liquor by yeast-mediated biopurification. Microb Cell Fact, 2011, 10(1) : 1–8. DOI:10.1186/1475-2859-10-1 |
| [12] |
汪东升, 张翠英, 彭晓培, 等.
木糖母液发酵生产2, 3-丁二醇的研究. 食品研究与开发, 2012, 33(7) : 132–135.
Wang D S, Zhang C Y, Peng X P, et al. 2, 3-butanediol production using xylose mother liquor. Food Research and Development, 2012, 33(7) : 132–135. |
| [13] |
项峥, 陈献忠, 张利华, 等.
利用可重复使用的URA3标记基因建立热带假丝酵母基因敲除系统. 遗传, 2014, 36(10) : 1053–1061.
Xiang Z, Chen X Z, Zhang L H, et al. Development of a genetic transformation system for Candida tropicalis based on a reusable selection marker of URA3 gene. Hereditas, 2014, 36(10) : 1053–1061. |
| [14] | Zhang L, Chen X, Chen Z, et al. Development of an efficient genetic manipulation strategy for sequential gene disruption and expression of different heterologous GFP genes in Candida tropicalis. Appl Microbiol Biot, 2016, 100(22) : 9567–9580. DOI:10.1007/s00253-016-7762-7 |
| [15] |
方祥年. 玉米芯半纤维素水解液发酵生产木糖醇的关键技术研究. 杭州: 浙江大学, 化学工程与生物工程学系, 2011. Fang N X. Study on the Key Technique of Xylitol Fermentation from Corn Cob Hemicellulosic Hydrolysate. Hangzhou:Zhejiang University, Department of Chemical Engineering and Bioengineering, 2011. |
| [16] | Wang H, Pan J, Wang J, et al. Succinic acid production from xylose mother liquor by recombinant Escherichia coli strain. Biotechnoi Biotec Eq, 2014, 28(6) : 1042–1049. DOI:10.1080/13102818.2014.952501 |
| [17] |
曾琦锴, 林影, 陈璐菲, 等.
热带假丝酵母木糖还原酶的酶学性质研究. 食品与发酵工业, 2006, 32(7) : 16–18.
Zeng Q K, Lin Y, Chen L F, et al. The characterizations of xylose reductase in Candida tropicalis. Food and Fermentation Industries, 2006, 32(7) : 16–18. |
| [18] |
方祥年, 黄炜, 夏黎明.
假丝酵母发酵玉米芯半纤维素水解液生产木糖醇. 生物工程学报, 2004, 20(2) : 295–299.
Fang N X, Huang W, Xia L M. Xylitol production from corn cob hemicellulosic hydrolysate by Candida sp. Chinese Journal of Biotechnology, 2004, 20(2) : 295–299. |
 2017, Vol. 37
2017, Vol. 37




