文章信息
- 王得华, 马义, 韩磊, 肖兴, 李艳伟, 党诗莹, 范志勇, 文涛, 洪岸.
- WANG De-hua, MA Yi, HAN Lei, XIAO Xing, LI Yan-wei, DANG Shi-ying, FAN Zhi-yong, WEN Tao, HONG An.
- 新型基因重组PACAP衍生物MPL-2的制备及其抗2型糖尿病作用研究
- Preparation of Novel Recombinant PACAP Derivative MPL-2 and Its Effect on Anti-type 2 Diabetes Mellitus
- 中国生物工程杂志, 2017, 37(5): 59-65
- China Biotechnology, 2017, 37(5): 59-65
- http://dx.doi.org/DOI:10.13523/j.cb.20170508
-
文章历史
- 收稿日期: 2017-01-03
- 修回日期: 2017-04-17
2. 广州中医药大学第二附属医院(广东省中医院) 广州 510405
2. The Second Affiliated Hospital of Guangzhou University of Chinese Medicine(Guangdong Provincial Hospital of Traditional Chinese Medicine), Guangzhou 510405, China
1989年Miyata等从羊的下丘脑中分离出一种新型的神经多肽,其由38个氨基酸组成,并具有激活腺苷酸环化酶、催化ATP形成cAMP的活性,因此, 此新型神经多肽被命名为垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase-activating polypeptide, PACAP)[1]。PACAP在体内分布广泛,不仅分布在中枢及周围神经系统,而且在胰腺、肝脏、肾脏、脂肪组织、肌肉组织、眼角膜等组织器官中也大量存在。PACAP序列在从低等动物到哺乳动物的进化过程中具有非常明显的保守性,其同源性达80%以上,表明PACAP参与生物体重要生理功能的调节[2-5]。现有研究表明,PACAP通过G蛋白偶联受体VPAC2介导可有效促进葡萄糖依赖的胰岛素分泌,提高机体葡萄糖耐受能力,在维持能量代谢平衡及糖脂代谢中发挥重要的调节作用。本课题组的前期研究表明,作为VPAC2受体特异激动剂的PACAP衍生物可有效改善糖尿病小鼠的胰岛素抵抗、提高机体胰岛素敏感性、葡萄糖依赖性促胰岛素分泌、保护和修复胰岛β细胞的功能,且不会引起肾上腺素分泌和糖原分解[2, 4-6],有望成为抗2型糖尿病的新型候选药物。
本研究利用基因重组技术制备新型VPAC2受体特异激动剂MPL-2,并利用2型糖尿病模型db/db小鼠研究基因重组PACAP衍生物MPL-2用于2型糖尿病治疗、改善胰岛素抵抗的生物学作用。
1 材料与方法 1.1 实验材料Chitin-Beads购自美国New England Biolabs公司;限制性内切核酸酶NdeⅠ和SapⅠ购自New EnglandBiolabs公司;T4 DNA连接酶购自TaKaRa公司;PCR Purification Kit、Gel Extraction Kit和Plasmid Miniprep Kit购自德国Qiagen公司;高效质粒表达载体pKYB-MCS购自New England Biolabs公司;大肠杆菌ER2566为本实验室自备;2型糖尿病模型db/db小鼠(BKS.Cg-m+/+Leprdb/J)及同品系正常对照db/m小鼠购于南京大学模式动物研究所。
1.2 主要仪器设备二氧化碳培养箱(德国Healforce公司);高速冷冻离心机(Sigma 3K30, 德国西格马公司);生化酶标仪(美国Bio-Rad公司);倒置相差显微镜(美国sigma公司);高速冷冻离心机(Sigma 3K30, 德国);微量移液器(0.1~1 000μl Biohit芬兰);核酸蛋白分析仪(Gene SpecV, Hitachi NaKa instruments Co.Ltd.日本);带C18反相柱的高效液相色谱系统(HPLC)和液相色谱-质谱联用系统(LC-MASS)(美国Agilent公司);JN-Multi T2.0温控超高压连续流细胞破碎仪(中国广州聚能生物科技有限公司);PCR仪(美国Bio-Rad公司)。
1.3 方法 1.3.1 重组质粒pKY-MPL-2的构建与鉴定选用大肠杆菌偏爱密码子设计PCR引物,以重叠延伸PCR方法合成MPL-2基因序列,并插入高效表达的质粒载体pKYB的NdeⅠ和SapⅠ酶切位点之间,从而构建重组质粒pKY-MPL-2,构建示意图见图 1。构建的表达载体pKY-MPL-2转化大肠杆菌表达菌ER2566,转化菌涂布到含有卡那霉素的平板上,待长出菌落后挑取单菌落培养并抽取质粒,用T7启动子通用引物进行DNA测序验证。构建成功的表达载体pKY-MPL-2转化大肠杆菌表达菌ER2566,在含有50mg/ml卡那霉素的LB培养基中,37℃摇菌至菌液OD600nm为0.7,加入IPTG至终浓度为0.7mmol/L,37℃诱导表达8h。离心收集菌体,用含有20mmol/L Tris-HCl、500mmol/L NaCl、1mmol/L EDTA的Buffer 1溶解,用JN-Multi T2.0温控超高压连续流细胞破碎仪进行破碎,破碎产物4℃、10 000r/min离心20min,上清液过Chitin-Beads柱纯化,用含有20mmol/L Tris-HCl、500mmol/L NaCl、1mmol/L EDTA、100mmol/L β-巯基乙醇的切割缓冲液快速过柱,剩留适量的切割缓冲液与结合融合蛋白的Chitin-Beads 25℃共孵育12h,然后收集切割缓冲液,利用HPLC系统制备的重组肽MPL-2。分析及制备条件为:流动相A(3% CNCH3,97% H2O,0.1%TFA),流动相B(100% CNCH3, 0.1% TFA),体积流量0.5ml/min,20min线性梯度洗脱B相至55%,光吸收检测波长为218nm。制备的重组多肽MPL-2用HPLC分析其纯度,并用ESI-MASS鉴定其分子质量。

|
| 图 1 重组质粒pKY-MPL-2的构建 Figure 1 Construction of the recombinant plasmid pKY-MPL-2 |
24只10周龄雄性2型糖尿病模型db/db小鼠室温下培养于12h昼夜循环的无特定病原体(SPF)级房间内,适应性喂养2周后,根据体重将小鼠随机分为4组:MPL-2处理组、生理盐水(NS)处理组、BAY55-9837处理组和Exendin-4处理组(阳性对照组),每组6只。小鼠饥饿过夜,给药前尾静脉收集血样,罗氏ACCU-CHEK血糖仪测定各小鼠的血糖值。MPL-2、BAY55-9837及Exendin-4处理组以30nmol/(kgB.W.)的剂量腹腔注射给药(多肽MPL-2、BAY55-9837及Exendin-4分别溶于200μl生理盐水);NS处理组腹腔注射200μl生理盐水作为空白对照。给药15min后测定各组实验小鼠的血糖值(定为0min时间点),迅速以2g/(kgB.W.)的剂量腹腔注射D-葡萄糖,在给糖后的5min、10min、15min、30min、60min、90min和120min时间点,小鼠尾静脉采血测定各组实验小鼠的血糖值,绘制葡萄糖耐量曲线。
1.3.3 MPL-2对2型糖尿病模型db/db小鼠长期药效学作用研究24只6周龄雄性2型糖尿病模型db/db小鼠室温下培养于12h昼夜循环的SPF级房间内,适应性喂养2周后,根据体重将小鼠随机分为4组:MPL-2处理组、生理盐水(NS)处理组、BAY55-9837处理组和Exendin-4处理组(阳性对照组),每组6只。MPL-2、BAY55-9837及Exendin-4处理组以30nmol/(kgB.W.)的剂量腹腔注射给药(多肽MPL-2、BAY55-9837及Exendin-4分别溶于200μl生理盐水)每天一次,NS处理组腹腔注射200μl生理盐水每天一次作为空白对照;连续给药8周,于实验开始前一天和开始后每周末当天检测各组小鼠的血糖值、体重、饮食量、饮水量,以db/m小鼠(n=6) 作为正常对照。
连续给药8周后,进行胰岛素耐量实验:将小鼠饥饿过夜,测定小鼠初始血糖值(0min),然后以1U/kg的剂量腹腔注射人重组胰岛素,在注射后的20min、40min、60min、80min、100min和120min时间点尾静脉收集血样,测定各组小鼠的血糖值,检测治疗8周后db/db小鼠胰岛素敏感性。
连续给药8周末,称量各处理组小鼠白色脂肪组织重量;同时收集小鼠血液,室温放置1h,4 000r/min离心10min,收集上清即为血清。检测血清中的血脂四项指标:总胆固醇(CHOL)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C),检测各实验组治疗8周后对糖尿病模型db/db小鼠血脂水平的改善作用[2, 7]。
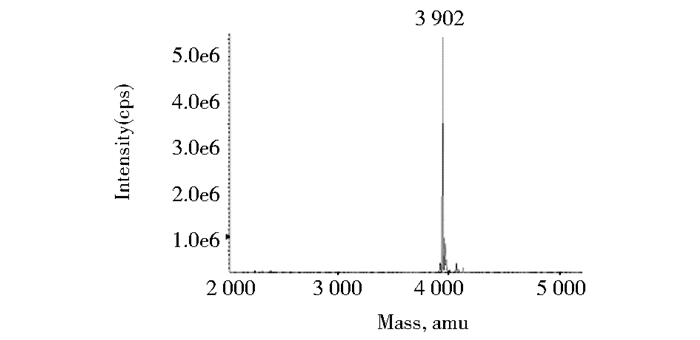
2 结果 2.1 重组肽MPL-2的表达与制备成功构建的重组质粒pKY-MPL-2转化大肠杆菌表达菌ER2566,表达的融合蛋白MPL-2-intein-CBD经Chitin-Beads柱纯化后,由β-巯基乙醇诱导intein自剪切而释放重组多肽MPL-2,用带C18反相柱的HPLC系统制备目的肽MPL-2。如图 2所示,利用高效液相色谱分析制备的目的肽MPL-2,纯度达97%,蛋白质出峰时间为12.325min,利用本研究确立的表达、纯化策略,重组肽MPL-2的产率为29.3mg/L发酵产物。制备的重组肽MPL-2利用ESI-MASS进行质谱鉴定,如图 3所示,其分子质量为3 902Da,与其分子质量理论值一致。

|
| 图 2 制备的重组多肽MPL-2的HPLC分析 Figure 2 HPLC analysis of the prepared recombinant peptide MPL-2 |
|
| 图 3 制备的重组多肽MPL-2的质谱鉴定 Figure 3 Mass spectrometry identification of recombinant peptide MPL-2 |
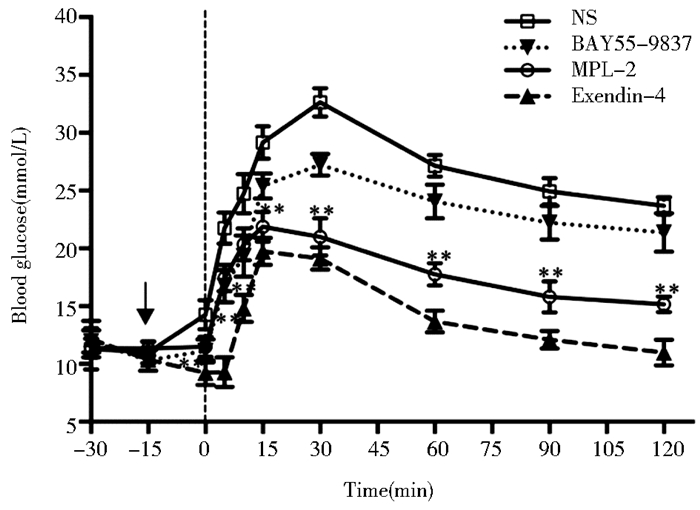
如图 4所示,注射葡萄糖后,生理盐水(NS)处理组的2型糖尿病模型db/db小鼠的第一相(5~15min)胰岛素分泌功能低下,表现出严重的葡萄糖不耐受,其血糖值在给糖后30min达到峰值(32.64mmol/L)。而MPL-2给药组的db/db小鼠的一相胰岛素分泌明显改善,糖耐量明显增加,血糖值明显低于NS处理组,其血糖值在给糖后15min达到峰值(21.88mmol/L),表明重组多肽MPL-2具有显著地葡萄糖依赖性促胰岛素分泌的生物学作用。VPAC2受体特异激动剂BAY55-9837由于其体内稳定性差、体内的半衰期不足5min,因而其生物利用度低,致使其无明显改善db/db小鼠急性糖耐量的生物学功能。临床用药Exendin-4通过激活GLP-1受体,表现出良好改善db/db小鼠急性糖耐量的生物学效应。
|
| 图 4 db/db小鼠的腹腔内注射葡萄糖耐量试验 Figure 4 Intraperitoneal glucose tolerance test (IPGTT) of db/db mice *P < 0.05, **P < 0.01:MPL-treated group versus NS-treated group |
在MPL-2长期药效学作用研究中,以30nmol/(kgB.W.)的剂量腹腔注射给药每天一次,连续用药8周后,胰岛素耐量实验结果显示:在120min内的各时间点,MPL-2处理组db/db小鼠的血糖水平均明显低于NS处理组db/db小鼠,在胰岛素注射60min时,MPL-2处理组db/db小鼠的血糖水平降至初始值的63.52%,比NS处理组db/db小鼠的血糖水平低22.60%;实验结果表明,与NS处理组相比较,MPL-2可显著改善db/db小鼠的胰岛素敏感性,从而有效改善db/db小鼠的胰岛素抵抗。BAY55-9837由于其体内稳定性差、生物利用度低的原因,连续用药8周后未明显改善db/db小鼠的胰岛素敏感性。Exendin-4通过激活GLP-1受体,表现出良好改善db/db小鼠胰岛素敏感性的生物学作用(图 5)。

|
| 图 5 连续用药8周db/db小鼠的胰岛素耐量实验 Figure 5 Insulin tolerance test (ITT) of db/db mice after 8-week treatment *P < 0.05, **P < 0.01:MPL-treated group versus NS-treated group |
以30nmol/(kgB.W.)的剂量腹腔注射给药MPL-2、BAY55-9837、Exendin-4或等体积生理盐水,每天一次,连续给药8周,于实验开始前一天和开始后每周末当天检测各实验组小鼠的体重、空腹血糖值、饮食量、饮水量;并在连续给药8周末收集小鼠血液,检测其血脂四项指标的变化。如图 6所示,实验结果显示,MPL-2处理组db/db小鼠体重的增长明显低于NS处理组,连续给药第4周和第8周MPL-2处理组db/db小鼠体重分别为NS处理组小鼠体重的19.11%和21.98%[图 6(a)];MPL-2处理组db/db小鼠的空腹血糖水平在连续给药第3周开始明显低于NS处理组小鼠,第4周和第8周MPL-2处理组db/db小鼠空腹血糖水平分别为NS处理组小鼠的18.32%和21.46%[图 6(b)];MPL-2对db/db小鼠的饮食量、饮水量也具有明显的调节作用,与NS处理组小鼠相比较,在连续给药第4周和第8周,MPL-2处理组db/db小鼠的饮食量分别为NS处理组小鼠的18.06%和22.20%[图 6(c)],而饮水量分别为NS处理组小鼠的44.07%和60.07%[图 6(d)]。BAY55-9837的连续用药未明显改善db/db小鼠的体重、空腹血糖值、饮食量和饮水量。临床用药Exendin-4的连续用药可显著改善db/db小鼠的体重、空腹血糖值和饮食量,其中对db/db小鼠的体重及饮食量的影响与MPL-2相近。如表 1所示,与正常对照小鼠db/m相比,NS处理组db/db小鼠的血清总胆固醇(CHOL)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)水平明显升高,而高密度脂蛋白胆固醇(HDL-C)则显著降低;经过MPL-2的连续8周给药,与NS处理组db/db小鼠相比,MPL-2处理组小鼠的CHOL和TG水平分别降低14.93%和69.67%,LDL-C和HDL-C水平则趋于正常。而MPL-2处理后db/db小鼠白色脂肪组织含量虽略有降低,但与NS处理组无显著性差异,表明MPL-2处理组db/db小鼠体重减少的主要原因是饮食饮水摄入的减少。实验结果表明,MPL-2连续给药8周可明显调节和改善db/db小鼠的体重、空腹血糖、饮食量、饮水量及血脂水平。

|
| 图 6 MPL-2连续给药8周对db/db小鼠体重、空腹血糖、饮食、饮水的影响 Figure 6 Effect of MPL-2 on body weight (a), fast glucose(b), food consumption (c), water consumption (d) during 8-week treatment for db/db mice *P < 0.05, **P < 0.01:MPL-treated group versus NS-treated group |
| Parameters | db/m | db/db | |||
| NS | BAY55-9837 | MPL-2 | Exendin-4 | ||
| CHOL(mmol/L) | 2.27±0.12 | 5.76±0.13 | 7.06±0.23 | 4.90±0.24** | 4.78±0.02** |
| TG(mmol/L) | 0.86±0.03 | 3.89±0.11 | 4.06±0.26 | 1.18±0.12** | 1.24±0.12** |
| HDL-C(mmol/L) | 1.23±0.17 | 1.04±0.12 | 1.22±0.07 | 1.32±0.07* | 1.37±0.05* |
| LDL-C(mmol/L) | 0.18±0.23 | 0.58±0.15 | 0.46±0.12 | 0.21±0.11** | 0.43±0.05* |
| Whole white fat(g) | 0.5±0.10 | 18.3±1.79 | 17.5±1.23 | 16.6±1.37 | 16.0±1.55 |
| Note: *P < 0.05,**P < 0.01:MPL-or Exendin-4-treated group versus NS-treated group | |||||
3 讨论
糖尿病是一类以长期高血糖症为主要特征的代谢性疾病,目前全球约有4亿糖尿病患者,其中95%以上为2型糖尿病患者,2型糖尿病主要是由于胰岛素敏感性降低造成胰岛素抵抗及胰岛功能障碍,致使血糖及能量代谢紊乱[8]。目前治疗2型糖尿病的临床用药主要针对胰岛素抵抗进行设计,但长期使用大多造成胰岛β细胞的功能损伤,因此,研发作用机制新颖、不良反应低的新型药物已成为科研及临床研究的热点。
PACAP是由脑垂体分泌的一种具有重要生理功能的新型神经多肽,其在调节糖脂代谢和维持机体能量平衡中发挥重要作用[9-11]。Tomimoto等发现PACAP基因敲除小鼠表现出低胰岛素血症、食物摄入量减少、体重下降[11-12];而高脂饮食诱导的肥胖小鼠或GK大鼠每天注射PACAP,其葡萄糖耐量水平显著升高,血糖水平明显降低[13]。日本科研人员的相关研究也发现,PACAP基因敲除小鼠糖摄取异常[10]。Akesson等研究显示,在有胰岛素参与的条件下,PACAP可促进脂肪的合成[14-15]。
作为VPAC2受体特异激动剂的PACAP衍生物具有葡萄糖依赖性促胰岛素分泌、保护胰岛β细胞功能及有效降低血液葡萄糖水平的生物学作用,且无低血糖症风险,有望成为抗2型糖尿病的新型候选多肽药物。GLP-1类似物Exendin-4虽具有较好的降血糖作用,但其半衰期仍较短,且在临床应用上常导致患者使用后出现恶心、呕吐及腹泻等肠胃不良反应,也在一定程度上限制了其临床应用。而PACAP衍生物MPL-2的降血糖效果虽在一定程度上弱于Exendin-4,但本课题组在前期的动物实验及2型糖尿病志愿者试验中证实,MPL-2无明显的肠胃不良反应及其他主要组织器官的毒副作用。作为改造结构后新型的PACAP衍生多肽不仅在体内具有高稳定性和高生物学活性,而且作为VPAC2受体特异激动剂的MPL-2具有葡萄糖依赖性促胰岛素分泌、保护和修复胰岛β细胞等功能,且无明显毒副作用,不失为一种治疗2型糖尿病的新型候选药物。糖尿病患者表现出,肝糖原分解增加、合成减少;糖异生增加;肝脏及外周组织摄取、利用葡萄糖的能力下降;肝糖的输出增加,同时血中游离脂肪酸和甘油三酯浓度增高,脂代谢紊乱。如表 1实验结果所示,NS处理组db/db小鼠的血清总胆固醇(CHOL)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)水平明显升高,而高密度脂蛋白胆固醇(HDL-C)则显著降低。因此,经过连续8周给药处理,可通过抑制胆固醇的合成和储存,降低血甘油三酯及总胆固醇的水平,MPL-2可明显改善db/db小鼠的体重、空腹血糖血脂水平等生化、生理指标。
MPL-2通过VPAC2受体对胰岛素分泌及胰岛素信号转导通路影响的分子机制,可能与促进胰岛细胞的增殖,或与促进胰岛素信号转导通路有关。MPL-2与受体VPAC2结合后,激活Gs蛋白,通过激活PI3K-Akt/PKB信号通路,进一步激活Wnt信号通路的下游靶基因Cyclin D、Pitx2等转录和表达,继而促进胰岛β细胞的增殖和功能[16]。也可能通过与VPAC2结合,通过激活Gs蛋白,Gs蛋白通过AC蛋白产生cAMP并激活PKA,然后通过激活CREB促进胰岛素基因的转录和表达。或者激活Gq/G11,进一步激活PLCγ,通过IP3及DAG、PKC,促进Ca2+释放和胰岛素分泌。但这种改善的机制仍有待进一步深入研究[17]。
本研究在课题组前期研究的基础上,利用基因重组技术表达、纯化及制备了新型PACAP衍生物MPL-2,建立了重组多肽MPL-2的高效制备技术。制备的重组多肽MPL-2通过特异激活VPAC2受体,可显著改善2型糖尿病db/db小鼠的葡萄糖耐量、胰岛素敏感性、血脂常数, 可通过减少饮食饮水的摄入显著降低db/db小鼠的体重,同时降低空腹血糖等生理参数,从而发挥治疗2型糖尿病的生物学作用。本研究可为新型PACAP衍生物MPL-2用于2型糖尿病治疗的更深入的药理学研究提供实验基础。
| [1] | Miyata A, Arimura A, Dahl R R, et al. Isolation of a novel 38 residue-hypothalamic polypeptide which stimulates adenylate cyclase in pituitary cells. Biochemical and Biophysical Research Communications, 1989, 164(1) : 567–574. DOI:10.1016/0006-291X(89)91757-9 |
| [2] | Ma Y, Luo T, Xu W, et al. A new recombinant pituitary adenylate cyclase-activating peptide-derived peptide efficiently promotes glucose uptake and glucose-dependent insulin secretion. Acta Biochimica et Biophysica Sinica, 2012, 44(11) : 978–956. |
| [3] | Vaudry D, Falluel-Morel A, Bourgault S, et al. Pituitary adenylate cyclase-activating polypeptide and its receptors:20 years after the discovery. Pharmacological Reviews, 2009, 61(3) : 283–357. DOI:10.1124/pr.109.001370 |
| [4] | Pan C Q, Li F, Tom I, et al. Engineering novel VPAC2-selective agonists with improved stability and glucose-lowering activity in vivo. Journal of Pharmacology and Experimental Therapeutics, 2007, 320(2) : 900–906. |
| [5] | Yu R J, Xie Q L, Dai Y, et al. Intein-mediated rapid purification and characterization of a novel recombinant agonist for VPAC2. Peptides, 2006, 27(6) : 1359–1366. DOI:10.1016/j.peptides.2005.11.026 |
| [6] | Sakurai Y, Shintani N, Hayata A, et al. Trophic effects of PACAP on pancreatic islets:a mini-review. Journal of Molecular Neuroscience, 2011, 43(1) : 3–7. DOI:10.1007/s12031-010-9424-z |
| [7] | Tang C, Ahmed K, Gille A, et al. Loss of FFA2 and FFA3 increases insulin secretion and improves glucose tolerance in type 2 diabetes. Nature Medicine, 2015, 21(2) : 173–177. DOI:10.1038/nm.3779 |
| [8] | Association A D. Diagnosis and classification of diabetes mellitus. Diabetes Care, 2012, 35(Supplement 1) : S64–S71. |
| [9] | Gray S L, Cummings K J, Jirik F R, et al. Targeted disruption of the pituitary adenylate cyclase-activating polypeptide gene results in early postnatal death associated with dysfunction of lipid and carbohydrate metabolism. Molecular Endocrinology, 2001, 15(10) : 1739–1747. DOI:10.1210/mend.15.10.0705 |
| [10] | Nakata M, Kohno D, Shintani N, et al. PACAP deficient mice display reduced carbohydrate intake and PACAP activates NPY-containing neurons in the rat hypothalamic arcuate nucleus. Neuroscience Letters, 2004, 370(2) : 252–256. |
| [11] | Tomimoto S, Ojika T, Shintani N, et al. Markedly reduced white adipose tissue and increased insulin sensitivity in adcyap1-deficient mice. Journal of Pharmacological Sciences, 2008, 107(1) : 41–48. DOI:10.1254/jphs.FP0072173 |
| [12] | Green B D, Irwin N, Flatt P R. Direct and indirect effects of obestatin peptides on food intake and the regulation of glucose homeostasis and insulin secretion in mice. Peptides, 2007, 28(5) : 981–987. DOI:10.1016/j.peptides.2007.02.003 |
| [13] | Yada T, Sakurada M, Filipsson K, et al. Intraperitoneal PACAP administration decreases blood glucose in GK rats, and in normal and high fat diet mice. Annals of the New York Academy of Sciences, 2000, 921(1) : 259–263. |
| [14] | Akesson L, Ahrén B, Manganiello V C, et al. Dual effects of pituitary adenylate cyclase-activating polypeptide and isoproterenol on lipid metabolism and signaling in primary rat adipocytes. Endocrinology, 2003, 144(12) : 5293–5299. DOI:10.1210/en.2003-0364 |
| [15] | Åkesson L, Ahrén B, Edgren G, et al. VPAC2-R mediates the lipolytic effects of pituitary adenylate cyclase-activating polypeptide/vasoactive intestinal polypeptide in primary rat adipocytes. Endocrinology, 2005, 146(2) : 744–750. DOI:10.1210/en.2004-0504 |
| [16] | Elghazi L, Balcazar N, Bernal-Mizrachi E. Emerging role of protein kinase B/Akt signaling in pancreatic β-cell mass and function. The international journal of biochemistry & cell biology, 2006, 38(2) : 157–163. |
| [17] | Prentki M, Matschinsky F M. Ca2+, cAMP, and phospholipid-derived messengers in coupling mechanisms of insulin secretion. Physiological Reviews, 1987, 67(4) : 1185–1248. |
 2017, Vol. 37
2017, Vol. 37




