文章信息
- 张晶晶, 刘克东, 钱凯, 缪亚娜, 蔡燕飞, 李成媛, 陈蕴, 金坚.
- ZHANG Jing-jing, LIU Ke-dong, QIAN Kai, MIAO Ya-na, CAI Yan-fei, LI Cheng-yuan, CHEN Yun, JIN Jian.
- 稳定表达GLP-1类似物的CHO细胞株的构建及培养工艺研究
- Construction of CHO Cell Tably Expressing GLP-1 Analogue and Study of Its Culture Process
- 中国生物工程杂志, 2017, 37(5): 52-58
- China Biotechnology, 2017, 37(5): 52-58
- http://dx.doi.org/DOI:10.13523/j.cb.20170507
-
文章历史
- 收稿日期: 2016-11-29
- 修回日期: 2017-03-07
2. 温州大学 温州 325000;
3. 上海药明生物技术有限公司 上海 200131
2. Wenzhou University, Wenzhou 325000, China;
3. WuXi Biologics(Shanghai) Co., Ltd, Shanghai 200131, China
胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1) 是1984年发现的由肠道黏膜的L细胞分泌的糖调节激素[1]。GLP-1的主要生理作用是在血糖较高时刺激β胰腺细胞分泌胰岛素,在血糖正常时不刺激分泌胰岛素,从而避免引发低血糖[2]。但因其在体内半衰期短使应用受到限制,将其突变二联体与人血清白蛋白(HSA)融合后在毕赤酵母中表达的融合蛋白GGH,成功提高了其在体内的半衰期[3]。但在后续研究中发现分泌的蛋白质批次间不稳定,这可能是由N端的不均一性造成的。本课题组在融合蛋白GGH的N端添加了6×His标签,并在其后添加肠激酶(enterokinase,EK)的蛋白酶酶切位点,通过Ni柱的分离纯化调取N端有His-tag的蛋白,再利用肠激酶的酶切获得N端均一的GLP-1与HSA融合蛋白GGH[4]。CHO细胞自身很少分泌内源蛋白, 且表达的药物蛋白的糖基化修饰和空间结构折叠等与人体的天然蛋白相似[5],因此,CHO表达系统得到了广泛的应用[6]。本课题组前期对GGH进行改造后,成功构建了pMH3/NGGH重组质粒并在CHO细胞中表达出NGGH[6×His-tag+Ek+2×GLP-1(A2G)+HSA]融合蛋白。这一设计研究不但提高了GLP-1在体内的半衰期,而且通过体外剪切解决了胞内N端剪切不齐的问题,从而提高了其成药性。
为大规模制备融合蛋白NGGH,构建稳定表达的工程细胞株和其培养工艺的研究显得尤为重要。而在大规模培养过程中,培养工艺的研究,如在线监测的DO、pH、温度等条件的控制成为研究的重点[7]。此外,本课题组前期利用pMH3质粒构建表达融合蛋白的重组CHO细胞时,采用铺平皿后肉眼观察的方法挑选单克隆细胞群落[8],此法需经历至少3轮筛选,耗时久,且克隆纯度及稳定性不能保证。因此,此细胞株作为后续大规模培养的工程菌株并不理想。
故本研究选择另一种新型质粒pcDNA3.1重新构建表达,采用有限稀释法并辅以Celigo细胞成像分析仪观察并快速挑选出单克隆细胞株,确保出发细胞株的绝对单一性。细胞经悬浮驯化后,对其在5L AP20激流式生物反应器上的培养工艺进行优化,以期获取高产蛋白质。
1 材料与方法 1.1 材料 1.1.1 质粒与菌株质粒pMH3/NGGH,大肠杆菌DH5α由本实验室保藏,pcDNA3.1质粒购自General Biosystems公司。中国仓鼠卵巢上皮细胞(CHO-S)由AmProtein公司赠送。
1.1.2 试剂与仪器质粒提取试剂盒,胶回收试剂盒、PCR产物回收试剂盒等购自天根(北京)生化科技公司;T4 DNA连接酶、限制性内切酶Not Ⅰ、EcoR Ⅰ、DNA聚合酶等购自TaKaRa公司;DMEM/F12培养基购自Gibco公司;无血清基础培养基B001和补料培养基F001购自AmpProtein公司;G418购自Sigma公司;尿微量白蛋白(检测)试剂盒购自上海名典试剂有限公司。抗体购自Abcam公司。其余化学试剂均为分析纯。
Celigo细胞成像分析仪购自美国Nexcelom Bioscience公司,AP20生物反应器购自杭州AmpProtein公司。
1.2 方法 1.2.1 重组质粒构建以pMH3/NGGH为模板,进行PCR扩增。引物序列如下,former primer:gcgaattccaccatggagacagacacactcctgctatgggtactgctgctc,reverse primer:ataagaatgcggccgcttataagcctaaggcagcttgacttgcagc。获得的基因片段经EcoR Ⅰ和Not Ⅰ酶切,纯化后与pcDNA3.1质粒片段连接,构建重组载体。然后转化到大肠杆菌DH5α,涂抗性平板后筛选获得的阳性质粒经PCR、双酶切验证和测序验证正确后用于下一步实验。
1.2.2 重组细胞构建与高表达单克隆细胞株的筛选将20μg验证正确的质粒、10μg鲑鱼精DNA和200μl细胞悬浮液(3×106 cells)混匀,加入2mm预冷的无菌电极杯中,500V,500μS电击后冰浴1min,反复4次。将电转液加入含10ml D/F12全培养基(含10%FBS)的平皿中,于CO2培养箱中培养24h后换成压力培养基(D/F12全培养基+3mg/ml G418) 继续培养3天。3天后用PBS洗去死细胞后,消化贴壁细胞,运用有限稀释法将细胞按照每孔一个铺于96孔板,共铺10块。铺板后的细胞置于CO2培养箱,待细胞沉降于板底部后,利用Celigo细胞成像分析仪进行扫描,扫描完成后继续将孔板置于培养箱培养,隔天再次取出扫描,观察每孔克隆的形成过程。依此类推,连续扫描10天后利用Celigo软件分析所拍摄的细胞图片。取单克隆对应的每孔上清液进行Dot-blot检测, 挑选出表达量相对较高的亚克隆,经24孔板Dolt-blot筛选和6孔板WB筛选,将表达量相对较高的克隆株消化扩增至T75培养瓶中,进行后期悬浮驯化和批次实验。
Dot-blot检测:5μl细胞培养上清点到NC膜上,37℃烘箱内放置10min,5%脱脂奶粉37℃摇床封闭2h,TBST冲洗掉封闭液,鼠抗人HSA(HRP)直标抗体(1μg/ml)37℃孵育1h,TBST漂洗3次,每次10min,ECL显色成像。
Western blot检测:收集上清液,80V,20min;120V,60min跑SDS-PAGE蛋白电泳,100V、70min转至NC膜后使用5%脱脂牛奶37℃封闭2h,GLP-1单抗37℃孵育1h,TBST漂洗3次,用羊抗小鼠的二抗孵育。TBST漂洗3次,每次15min,ECL显色成像。
1.2.3 CHO细胞悬浮驯化和批次实验将稳定表达的细胞株扩增到T75培养瓶,待细胞长至汇合度80%以上,消化细胞后加入无血清培养基B001继续在培养箱悬浮静置培养,2天后离心细胞,用新鲜B001培养基重悬后转入150ml摇瓶中,密度调至1.5×106 cells/ml,于100r/min、37℃摇床中培养。24h后取样,利用全自动细胞计数仪(Nexclom, Auto 2000) 计数,通过离心换液逐渐调整细胞状态。直到细胞基本不成团,密度隔天翻倍,且活率在98%以上。则认为悬浮细胞状态较好,悬浮驯化成功。
批次实验:150ml摇瓶中接种细胞,调整初始细胞密度为1.0×106 cells/ml。在100r/min,37℃摇床中培养,每天取样后台盼蓝染色,利用全自动细胞计数仪测细胞密度和活率,尿微量白蛋白试剂盒检测白蛋白含量,通过分子质量比例计算融合蛋白产量。最后选取生长好和表达量高的亚克隆细胞用于后续实验。
1.2.4 重组CHO细胞在5L一次性生物反应器中扩大培养扩大培养选用5L AP20激流式生物反应器。细胞以2×106 cells/ml接种于基础培养基B001,接种体积2L。使用7.5%的NaHCO3和CO2自动控制pH,pH分别设置为全程6.8~7.4或生长期7.0,稳定期6.8;空气、氮气和氧气自动控制DO,DO分别设置为全程不控制或生长期不控制,稳定期40%。初始温度37℃,细胞达到最大密度后降为34℃。当培养液中葡萄糖消耗至3g/L以下后,添加补料培养基F001,其体积按照使糖浓度保持在3.0g/L计算。每天取样,利用生化分析仪检测葡萄糖和乳酸浓度,全自动细胞计数仪计算细胞密度和死亡率。
2 实验结果 2.1 重组质粒pcDNA3.1/NGGH的构建以pMH3/NGGH为模板,进行PCR扩增获得NGGH的基因片段。经EcoR Ⅰ、Not Ⅰ双酶切后连接至pcDNA3.1上[图 1(a)]。经菌落PCR鉴定,其中1号、3号、4号克隆在2 000bp(目的基因片段2 024bp)处有阳性条带[图 1(b)]。将3号克隆质粒进行双酶切鉴定,结果与预期的相符[图 1(c)]。将3号重组质粒送至上海生工测序,结果与理论序列一致(测序结果未给出)。证明经筛选获得的3号重组质粒的构建成功。
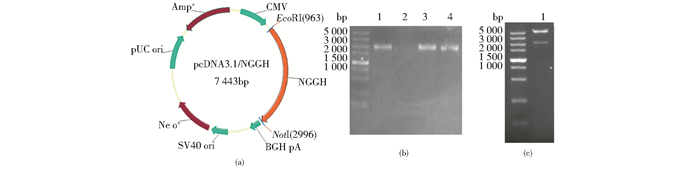
|
| 图 1 重组质粒的构建 Figure 1 Construction of the recombinant plasmid (a) Schematic of the recombinant plasmid of pcDNA3.1-NGGH (b)Identification of recombinant plasmid pcDNA3.1-NGGH by PCR Lane 1, 2, 3, 4:Sample of PCR product of different clones (c)Identification of recombinant plasmid pcDNA3.1-NGGH by enzyme digestion Lane 1: Sample of enzyme digestion |
G418可以和真核生物的核糖体作用抑制蛋白质的合成,从而将细胞杀死[9],成功转入重组质粒的细胞因质粒上含有Neo+抗性,所以生长良好。在压力培养基培养3天后,细胞死亡40%以上,留下存活的细胞铺板后,运用Celigo细胞成像分析仪每天扫描可观察到单克隆细胞由一个变成多个,再长至一群的过程,图 2为某孔中单克隆第1天,第3天,第5天和第8天的细胞形态。依次观察96孔板成像情况并挑选出所有单克隆。

|
| 图 2 96孔板中单克隆细胞的形成过程 Figure 2 Single-clony cells in 96-well plate |
96孔板单克隆细胞培养上清经Dot-blot检测后,结果[图 3(a)]显示,在约120个单克隆中,克隆株表达能力并不均一,挑选其中20株表达相对较高的细胞至24孔板继续培养,用相同方法检测表达量,结果见图 3(b),继续挑选表达相对较高的六株细胞至6孔板,经Western blot检测,结果[图 3(c)]显示,除去A1,其他5株细胞表达能力相当,其中A3略高,选取D4、D3、D2、C2、A3 5株细胞进行批次实验。

|
| 图 3 重组CHO细胞的单克隆筛选 Figure 3 Selection of single-clony recombinant CHO cells (a) Dot blot selection of high expression single-clones from 96-well plates (b) Dot blot selection of high expression single-clones from 24-well plate (c) WB selection of high expression single-clones from 6-well plate |
为进一步考察上述5株细胞的生长和表达能力,取六孔板中表达较高的5株细胞D4、D3、D2、C2、A3,以下依次命为Clone1、Clone2、Clone3、Clone4、Clone5,按照1.2.3中方法进行悬浮驯化。悬浮驯化成功的细胞株,通过批次实验来筛选获得生长状态良好且表达量较高的细胞株,结果显示,以1.0×106 cells/ml密度接种后,培养至第4天,5株细胞的细胞密度为5.8~6.7×106 cells/ml[图 4(a)],其中,表达量最高的细胞株是Clone3,表达量为58mg/L[图 4(b)],且细胞状态最好,最终以Clone3细胞株作为后续实验的出发重组细胞株。

|
| 图 4 悬浮状态下细胞株筛选 Figure 4 Under suspension of recombinant cell lines screened (a)The time course of different clone (b)Select recombinant CHO cells by protein yield |
AP20激流式生物反应器采用一次性塑料反应袋,通过摇床式搅拌来达到传氧和传质的效果,相较于一般的搅拌式生物反应器,它可以在保证较高溶氧的同时减少因搅拌而对细胞造成损伤[10]。
2.4.1 pH控制方式的优化设置两组实验,一组生长期pH7.0,稳定期pH6.8;另一组全程控制pH6.8~7.4。其他条件不变。结果显示,生长期pH控制在7.0时,细胞产生较多乳酸[图 5(a)],这可能是由于pH控制范围较窄的情况下,系统自动补碱来维持pH,而细胞对碱会产生应激反应从而刺激细胞产生更多乳酸,乳酸是细胞培养过程中产生的主要代谢副产物,它的积累会对细胞产生一定毒害作用[11],从而影响细胞生长[图 5(b)],细胞密度只达到6.1×106 cells/ml。而扩大pH控制范围后,补碱的量减少,乳酸产量也相应减少,细胞最大密度可达到8.2×106 cells/ml。所以,在后期培养过程中采用pH6.8~7.4的控制方式进行下一步实验。
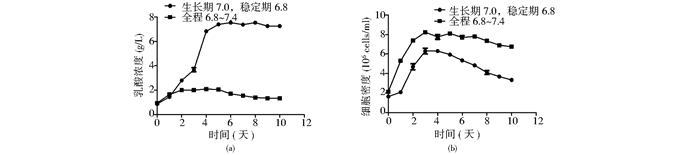
|
| 图 5 不同pH控制方式下的培养情况 Figure 5 Culture under different pH control mode (a) Lactic acid concentration changes during culture time with different pH control mode (b) Cell density changes during culture time with different pH control mode |
设置两组实验,一组全程不控制DO,只依靠匀速通入空气和摇床旋转来维持DO;另一组在生长期不控制DO,表达期逐渐降低至40%。其他条件不变。结果显示,两组控制方式下DO值见图 6(a),两组实验在生长期DO都不控制,细胞生长情况相似[图 6(b)],达到最大细胞密度7.2×106 cells/ml左右。进入稳定期后,两相控制组逐渐降低DO至40%,而另一组不做任何控制。两组细胞在稳定期并没有表现出明显的生长差异,说明后期适当降低DO并不影响细胞正常生长。而从蛋白质最终积累量来看[图 6(c)],稳定期降低DO后,最终蛋白质积累较多,可达148mg/L,约是另一组的2倍。这可能是因为,在细胞表达期,相对较低的DO在一定程度上可以降低细胞代谢水平,使得更多的能源物质用于蛋白质表达而非细胞生长[12]。
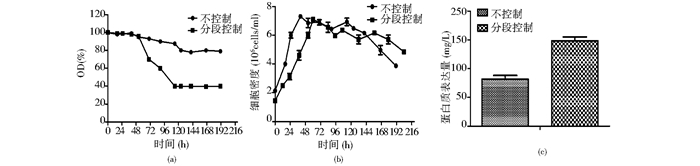
|
| 图 6 不同DO控制方式下的培养情况 Figure 6 Culture under different DO control mode (a) Do changes during culture time with different DO control mode (b) Cell density changes during culture time with different DO control mode (c) Protein yield with different DO control mode |
最终确定工艺条件如下,温度:生长期37℃,稳定期34℃;DO:生长期不控制,稳定期逐渐降低至40%;pH:6.8~7.4;转速:60r/min。结果如图 7,对数生长期细胞生长快速,当细胞密度达到7×106 cells/ml时,降温至34℃。第2天后,开始每天按照使糖浓度保持在3g/L的原则补料,并控制活细胞密度水平维持了7天,随后开始下降,当培养至9天时,细胞的总密度降为5.5×106 cells/ml,此时细胞死亡率高达15%,停止培养,融合蛋白表达量达到148mg/L。
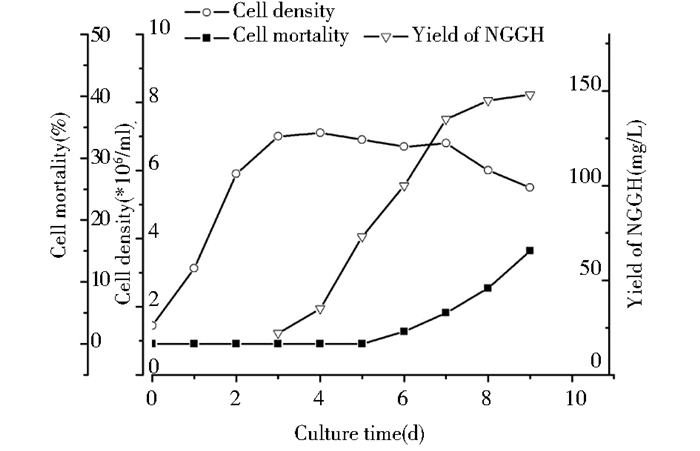
|
| 图 7 5L生物反应器放大培养 Figure 7 Cell Culture in 5L bioreactor |
哺乳动物细胞中的CHO细胞表达系统因其分泌内源蛋白少,翻译后修饰完善等优点在药物表达中得到了广泛的应用。为提高GLP-1在体内的半衰期,构建其类似物成为研究的热门。窦文芳等研究设计了GLP-1的突变体即GLP-1(A2G),可以将GLP-1的小鼠体内半衰期从2min提高至30min[13]。再将GLP-1(A2G)的二联体与人血清白蛋白(HSA)融合合成GGH,半衰期进一步提高至8h左右[14]。本研究中的NGGH在GGH的N端添加组氨酸标签和肠激酶位点,延长单体蛋白体内半衰期的同时,成功避免了N端剪切不齐的问题,保证蛋白质批次的稳定性。
细胞单克隆筛选技术已经走向机器代替人工的时代,利用仪器辅助的筛选方法与传统方法比较,首先可以保证单克隆纯度,避免人工挑选时造成的克隆不纯而导致后期工业化生产过程中细胞株的不稳定性[15]。其次,此法相较于人工挑选克隆,可节约2/3的时间,整个过程只需要一轮筛选,不需二次、三次铺板筛选。这大大提高了单克隆筛选的效率,节约了时间成本。
研究动物细胞大规模培养技术的目的在于解决培养过程控制复杂等问题,迅速扩大动物细胞培养的产能。因此针对CHO细胞培养过程的工艺研究,建立高效的控制条件,是NGGH实现其产业化的一项必不可少的工作。本研究通过对5L一次性生物反应器控制参数的优化,成功对表达NGGH的工程细胞扩大培养,为解决糖尿病病患日益增长的药物需求做出贡献。
本研究通过构建pcDNA3.1/NGGH质粒,转入CHO细胞后筛选出一株可稳定表达NGGH蛋白的工程细胞株。成功完成无血清培养基悬浮驯化,为后期大规模高密度培养奠定基础。在5L一次性生物反应器中扩大培养,并对其工艺参数进行优化,最终获得高产融合蛋白NGGH。这为制备NGGH融合蛋白走向工业化道路奠定了坚实的基础,且在治疗Ⅱ型糖尿病的道路迈出了一大步。
| [1] | Gromada J, Brock B, Schmitz O, et al. Glucagon-like peptide-1:regulation of insulin secretion and therapeutic potential. Basic & clinical pharmacology & toxicology, 2004, 95(6) : 252–262. |
| [2] | Doyle M E, Egan J M. Mechanisms of action of glucagon-like peptide 1 in the pancreas. Pharmacology & Therapeutics, 2007, 113(3) : 546–593. |
| [3] | Dou W F, Lei J Y, Zhang L F, et al. Expression, purification, and characterization of recombinant human serum albumin fusion protein with two human glucagon-like peptide-1 mutants in Pichia pastoris. Protein Expression and Purification, 2008, 61(1) : 45–49. DOI:10.1016/j.pep.2008.04.012 |
| [4] |
钱凯. 胰高血糖素样肽-1与人血清白蛋白融合蛋白的设计与改造. 无锡: 江南大学, 生物工程学院, 2015. Kai Q. Drug Design and Reconstruction of Glucagon-like Peptide-1. Wuxi:Jiangnan University, School of Biotechnology, 2015. |
| [5] | Kim J, Kim Y G, Lee G. CHO cells in biotechnology for production of recombinant proteins:current state and further potential. Applied Microbiology & Biotechnology, 2012, 93(3) : 917–930. |
| [6] | Okumura T, Masuda K, Watanabe K, et al. Efficient enrichment of high-producing recombinant Chinese hamster ovary cells for monoclonal antibody by flow cytometry. Journal of Bioscience & Bioengineering, 2015, 120(3) : 340–346. |
| [7] |
赵虎. 成骨细胞在新型生物反应器内的大规模扩增. 大连: 大连理工大学, 化工学院, 2006. Hu Z. Large-scale Expansion of Osteoblasts in a NoVel Bioreactor. Dalian:Dalian University of Technology, School of Chemical Engineering, 2006. |
| [8] |
李成媛, 张晶晶, 钱凯, 等.
人血清白蛋白-干扰素α2b融合蛋白在CHO细胞中的表达. 中国生物工程杂志, 2016, 36(7) : 7–14.
Li C Y, Zhang J J, Qian K, et al. Expression of human serum albumin-interferon α2b fusion protein in Chinese hamster ovary cells. China Biotechnology, 2016, 36(7) : 7–14. |
| [9] | Vicens Q, Westhof E. Crystal structure of geneticin bound to a bacterial 16S ribosomal RNA a site oligonucleotide. Journal of Molecular Biology, 2003, 326(4) : 1175. DOI:10.1016/S0022-2836(02)01435-3 |
| [10] |
谢波, 李峦峰, 杜春玲, 等.
利用新型一次性激流灌注式生物反应器培养动物细胞. 过程工程学报, 2011, 11(6) : 1050–1054.
Xie B, Li L F, Du C L, et al. Scale-up cultivation of animal cells in a novel disposable perfusion and current bioreactor. The Chinese Journal of Process Engineering, 2011, 11(6) : 1050–1054. |
| [11] |
孙祥明, 张元兴.
乳酸对重组CHO细胞生长代谢EPO表达的影响. 化工学报, 2002, 53(10) : 1034–1039.
Sun X M, Zhang Y X. Effect of lactate on growth and metabolism and EPO expression of recombinant CHO cells. Journal of Chemical Industry and Engineering(China), 2002, 53(10) : 1034–1039. DOI:10.3321/j.issn:0438-1157.2002.10.008 |
| [12] | Yoon S K, Hong J K, Choo S H, et al. Adaptation of Chinese hamster ovary cells to low culture temperature:Cell growth and recombinant protein production. Journal of Biotechnology, 2006, 122(4) : 463–472. DOI:10.1016/j.jbiotec.2005.09.010 |
| [13] |
窦文芳, 张莲芬, 雷楗勇, 等.
人胰高糖素样肽-1及其突变体在大肠杆菌BL21中的表达与生物活性研究. 生物技术通报, 2008, 24(6) : 139–143.
Dou W F, Zhang L F, Lei J Y, et al. Expression of human glucagon-like peptide-1 and human glucagon-like peptide-1 mutant gene in BL21. Biotechnology Bullttin of China, 2008, 24(6) : 139–143. |
| [14] | Dou W F, Lei J Y, Zhang L F, et al. Expression, purification, and characterization of recombinant human serum albumin fusion protein with two human glucagon-like peptide-1 mutants in Pichia pastoris. Protein Expression & Purification, 2008, 61(1) : 45–49. |
| [15] | Lee J S, Kallehauge T B, Pedersen L E, et al. Site-specific integration in CHO cells mediated by CRISPR/Cas9 and homology-directed DNA repair pathway. Scientific Reports, 2015, 5 : 8572. DOI:10.1038/srep08572 |
 2017, Vol. 37
2017, Vol. 37




