文章信息
- 李敏, 吴日伟.
- LI Min, WU Ri-wei.
- 国内外单抗药物市场概述
- The Market Overview of Monoclonal Antibodies in Both Domestic and Abroad
- 中国生物工程杂志, 2017, 37(3): 106-114
- China Biotechnology, 2017, 37(3): 106-114
- http://dx.doi.org/DOI:10.13523/j.cb.20170315
-
文章历史
- 收稿日期: 2016-07-26
- 修回日期: 2016-08-23
2. 江西省南昌市高新技术产业开发区管理委员会 南昌 330096
2. Nanchang National High-Tech Industrial Development, Nanchang 330096, China
抗体 (antibody) 是指由抗原 (一般为外来蛋白质) 刺激后由免疫细胞产生的能与抗原发生特异性反应的免疫球蛋白 (immunoglobulin,Ig),分为IgG、IgA、IgM、IgD和IgE五类。抗原上的抗原决定族会引起机体产生相应的抗体,一个抗原上可能存在几个不同的抗原决定簇,从而导致人体免疫系统产生几种不同的抗体。只针对某一特定抗原决定簇起作用的抗体称为单克隆抗体 (monoclonal antibody,简称单抗或mab)。按照结构的不同抗体药物可以分为裸抗体、抗体片段、抗体偶联物、抗体融合蛋白4种类型[1-2],按照人源化程度可以分为鼠源抗体、嵌合抗体、人源化抗体和全人源化抗体4类[3-5](表 1)。单抗药物具有特异性强、不良反应小等临床优势,已经广泛应用于肿瘤、免疫类疾病、心血管及感染性疾病的治疗[6-8]。本文主要就国内外单抗药物市场情况作一概述。
| 类别 | 鼠源单抗 | 嵌合单抗 | 人源化单抗 | 全人源化单抗 |
| 生产技术 | 使用小鼠细胞生产抗体 | 用人源C区代替鼠源C区 | CDR、SDR移植技术 | 基于噬菌体展示技术的全人单抗技术平台 |
| 鼠源比例 (%) | 100 | 30~40 | 5~10 | 0 |
| 首个药物上市 | 1986年 | 1994年 | 1997年 | 2006年 |
| 不良反应比例 (%) | 50~80 | 1~57 | 0.1~8 | — |
| 说明 | 不良反应大,特异性好,常带放射性元素 | 不良反应较小,保留其与抗体结合的特异性 | 不良反应小,但与抗原结合能力通常下降 | 基本没有不良反应,与人体免疫系统相容性好,功效好 |
| 通用名中文尾缀 | -莫单抗 | -苷单抗 | -组单抗/-单抗 | -木 (人) 单抗/-单抗 |
| 通用名英文尾缀 | -momab | -ximab | -zumab | -umab/-mumab |
1 国外单抗市场 1.1 国外单抗上市品种及市场情况
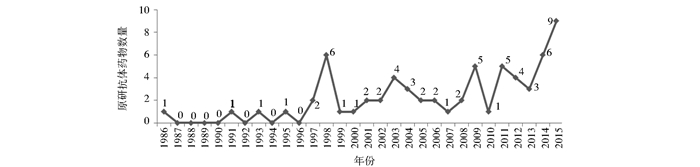
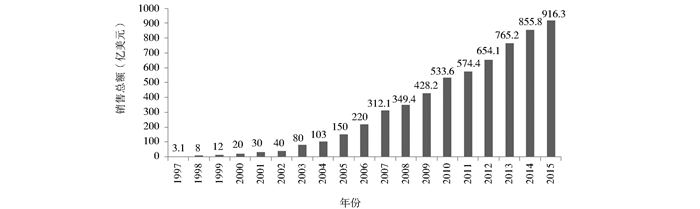
1986年,世界上首个单克隆抗体药物——用于治疗器官移植出现的排斥反应的抗CD3单抗OKT3获得美国食品和药物管理局 (FDA) 的上市批准[9],由此拉开了单抗药物发展的序幕。在1986~2015年的这30年里,国外共批准了64个原研抗体药物,其中2015年获批9个,达到历史新高 (图 1)。除去9个撤市品种,现有上市抗体药物共55个。2015年全球抗体药物销售总额达916.3亿美元,2006~2015年这10年的年均增长率达31.65%(图 2)。
|
| 图 1 1986~2015年国外年度批准的原研抗体药物数量 Figure 1 The number of antibody drugs approved in abroad between 1986 and 2015 Data sources: Official website of FDA |
|
| 图 2 1997~2015年抗体药物年度销售总额 Figure 2 Annual sales of antibody drugs between 1997 and 2015 Data sources: Annual report of antibody manufacturers |
现有上市的55个抗体药物包括49个单抗产品和6个具有抗体功能的Fc融合蛋白。49个单抗产品中,全人源化单抗17个、人源化单抗21个、嵌合单抗8个、鼠源单抗3个,依次占比34.7%、42.9%、16.3%和6.1%。2015年,全人源化单抗、人源化单抗、嵌合单抗及鼠源单抗的销售额依次为258.00亿美元、318.48亿美元、188.44亿美元和0.83亿美元,其中全人源化单抗占单抗药物总销售额的33.7%。
55个上市抗体药物主要针对36种靶标,其中抗肿瘤坏死因子α(TNF-α) 的抗体药物最多,有5个;其次是抗CD20、表皮生长因子受体 (EGFR) 和血管内皮生长因子 (VEGF) 的抗体药物,各有4个;抗人表皮生长因子2(HER2) 的抗体药物有3个;抗白细胞介素1(IL-1)、前蛋白转化酶枯草溶菌素9(PCSK9)、程序性死亡受体-1(PD-1) 和α4/β1/7整合素的抗体药物各2个;其它靶标,如VEGFR2、CD52、炭疽PA抗原等的抗体药物各1个 (表 2)。其中2015年新批准的靶标有7种:PCSK9、GD2、CD38、IL-17A、IL-5、达比加群酯、SLAMF7。
| 靶标 | 抗体药物数量 (个) | 靶标 | 抗体药物数量 (个) |
| 肿瘤坏死因子α(TNFα) | 5 | CD6 | 1 |
| CD20 | 4 | CD25 | 1 |
| 表皮生长因子受体 (EGFR) | 4 | CD30 | 1 |
| 血管内皮生长因子 (VEGF) | 4 | CD38 | 1 |
| 人表皮生长因子2(HER2) | 3 | CD80/CD86 | 1 |
| 白细胞介素1(IL-1) | 2 | 血小板糖蛋白GPIIb/IIIa | 1 |
| 前蛋白转化酶枯草溶菌素9(PCSK9) | 2 | 细胞核因子κB受体活化因子配体 (RANK-L) | 1 |
| 程序性死亡受体-1(PD-1) | 2 | IgE | 1 |
| α4/β1/7整合素 | 2 | IL12/23 | 1 |
| VEGFR2 | 1 | IL-17A | 1 |
| CD52 | 1 | IL-5 | 1 |
| 炭疽PA抗原 | 1 | IL-6 | 1 |
| B淋巴细胞刺激因子 (BLyS) | 1 | IL-6R | 1 |
| C5补体 | 1 | RSV病毒F蛋白A抗原 | 1 |
| 趋化因子受体4(CCR4) | 1 | 达比加群酯 | 1 |
| 双唾液酸神经节苷脂 (GD2) | 1 | 信号淋巴细胞激活分子7(SLAMF7) | 1 |
| 细胞毒性T淋巴细胞相关抗原4(CTLA-4/CD152) | 1 | 抗CD19/CD3和抗EpCAM/CD3双特异靶标 | 1 |
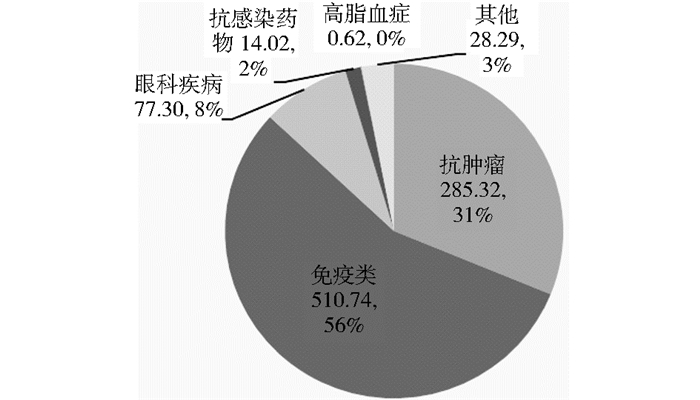
55个抗体药物中有23个针对肿瘤治疗、21个针对自身免疫疾病、2个针对眼科疾病、2个针对感染性疾病、2个针对高脂血症、5个针对其他适应证 (如移植排斥反应及绝经后妇女骨质疏松症、骨伤预防等)。高脂血症和多发性骨髓瘤为2015年新批准的适应证。2015年,上述6类适应证抗体药物对应的销售额依次为285.32亿美元、510.74亿美元、77.30亿美元、14.02亿美元、0.62亿美元和28.29亿美元 (图 3)。
|
| 图 3 2015年不同适应证抗体药物对应的销售额 Figure 3 Sales of antibodies for different indications in 2015 |
抗体生产公司中,Roche一直是全球抗体药物的领头羊,拥有上市抗体药物最多,共9个。其次是Novartis和Johnson & Johnson,各有6个;再次为Amgen和BMS,各有5个;Eli Lilly、Merck和GSK各有4个;Regeneron和Sanofi-Aventis各有3个。2015年,抗体药物年销售额超过50亿美元的公司有4个:Roche、AbbVie、Johnson & Johnson和Amgen,销售额依次为279.1亿美元、140.12亿美元、103.63亿美元和87.32亿美元,其中Roche占全球抗体市场的份额达到30.5%,较之前占半壁江山的地位略有下降。AbbVie则仅凭一个抗体产品——阿达木单抗 (Adalimumab),近3年来一直稳居销售排行榜的第二位。
1.2 国外单抗单品销售情况2015年阿达木单抗以140.12亿美元的销售额蝉联全球抗体排行榜第一位,也是全球药物排行榜的第一位,从2013年开始阿达木单抗的销售额就已经超过100亿美元,是迄今为止全球唯一一个销售额超过100亿美元的产品。2015年全球年销售额为50亿~100亿美元的“重磅炸弹级”单抗产品有5个,分别为依那西普、英夫利普单抗、利妥昔单抗、贝伐珠单抗和曲妥珠单抗,近年来它们与阿达木单抗一起一直居于全球医药销售排行榜的前10位 (表 3)。年销售额10亿~50亿美元的单抗产品共有13个,1亿~10亿美元的共有11个,1亿美元以下的共有12个 (表 4)。
| 排名 | 商品名 | 通用名 | 原研厂商 | 适应证 | 2015年销售额 | 2014年销售额 | 2013年销售额 |
| 1 | Humira | 阿达木单抗 (Adalimumab) | Abbvie | 自身免疫疾病 | 140.12 | 125.43 | 106.59 |
| 2 | Enbred | 依那西普 (Etanercept) | Amgen | 自身免疫疾病 | 86.97 | 85.38 | 83.25 |
| 3 | Remicade | 英夫利普单抗 (Infliximab) | Johnson & Johnson | 自身免疫疾病 | 83.55 | 92.40 | 89.44 |
| 4 | Rituxan | 利妥昔单抗 (Rituximab) | Roche | 肿瘤、自身免疫疾病 | 70.45 | 86.78 | 86.31 |
| 5 | Avastin | 贝伐珠单抗 (Bevacizumab) | Roche | 实体瘤 | 66.97 | 69.57 | 67.77 |
| 6 | Herceptin | 曲妥珠单抗 (Trastuzumab) | Roche | Her2乳腺癌 | 65.5 | 67.93 | 64.75 |
| 排序 | 商品名 | 2015年销售额 (亿美元) | 排序 | 商品名 | 2015年销售额 (亿美元) |
| 7 | Leucentis | 35.40 | 21 | Kadeyla | 8.09 |
| 8 | Soliris | 25.9 | 22 | Synagis | 7.04 |
| 9 | Stelara | 24.74 | 23 | Enlyvio | 6.54 |
| 10 | Simponi | 21.22 | 24 | Keytruda | 5.66 |
| 11 | Xolair | 20.32 | 25 | Cyramza | 3.84 |
| 12 | Erbitux | 19.96 | 26 | Lemtrada | 2.73 |
| 13 | Tysalbri | 18.86 | 27 | Cosentyx | 2.61 |
| 14 | Actemra | 16.17 | 28 | Benlysta | 2.59 |
| 15 | Xgeva | 15.13 | 29 | Ilaris | 2.36 |
| 16 | Perjeta | 14.95 | 30 | Vectibix | 1.56 |
| 17 | Prolia | 14.01 | 31 | Reopro | 0.98 |
| 18 | Cimzia | 12.79 | 32 | Zevalin | 0.18 |
| 19 | Yervoy | 11.26 | 33 | Poteligeo | 0.16 |
| 20 | Opdivo | 9.71 | 34 | Praluent | 0.1 |
1.3 国外单抗专利到期情况
相对于原研药来说,仿制药价格低廉,市场竞争力强。在需求潜力巨大的当下,对很多消费者来说,价格高是导致单抗不能成为治疗肿瘤或自身免疫疾病及其他一些疾病主流药物的限制因素。目前,国外大公司在抗体药物市场中占据垄断地位,不仅拥有绝对的技术优势,还通过精心的专利布局,形成专利壁垒,限制竞争对手,提高新企业进入行业的门槛。2016~2020年,美国有6个单抗产品专利将到期,欧洲及其他国家有4个单抗产品专利将到期 (表 5)。随着这些单抗药物专利的到期,大批仿制药即将上市,单抗将走下神坛,虽短时间内难以实现平民化,但市场规模的大幅度增长已基本可以确定。
| 商品名 | 通用名 | 靶点 | 原研厂商 | 专利到期时间 | |
| 美国 | 欧洲及其他 | ||||
| Humira | 阿达木单抗 (Adalimumab) | TNF | Abbvie | 2016年 | 2018年 |
| Rituxan | 利妥昔单抗 (Rituximab) | CDC20 | Roche | 2018年 | 2015年 |
| Avastin | 贝伐珠单抗 (Bevacizumab) | VEGF | Roche | 2019年 | 2016年 |
| Herceptin | 曲妥珠单抗 (Trastuzumab) | HER2 | Roche | 2019年 | 2014年 |
| Lucentis | 雷珠单抗 (ranibizumab) | VEGF | Novartis; Roche | 2019年 | 2018年 |
| Xolair | 奥马珠单抗 (omalizumab) | IgE | Novartis; Roche | 2020年 | 2017年 |
2 国内单抗市场 2.1 国内单抗上市品种及市场情况
截至2016年3月,CFDA共批准生产抗体药物22种[10],其中中国企业自主研发的抗体药物有10个,包括6个单抗 (4个鼠源型、1个嵌合型、2个人源化单抗) 和4个Fc融合蛋白;进口产品有12个,包括7个单抗和5个Fc融合蛋白,主要涉及抗肿瘤、抗排斥反应以及自身免疫疾病治疗等领域 (表 6)。国产抗体药物中市场表现较好的有中信国健的益赛普、成都康弘的朗沐以及百泰药业的泰欣生等。2015年只批准了一个抗体产品,即浙江海正的安佰诺,2015年没有新获批的进口产品。
| 类型 | 公司名称 | 通用名 | 商品名 | 获批年份 | 靶点 | 类型 | 适应证 | 2015年国内销售额 (亿元) |
| 非上市公司 | 中信国建 | 注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白 | 益赛普 | 2005 | TNF-α | 融合蛋白 | 类风湿性关节炎和强直性脊柱炎 | 8.3 |
| CD25人源化单抗注射液 | 健尼哌 | 2011 | CD25 | 人源化 | 脊髓抑制和肾移植排斥 | |||
| 上海赛金生物 | 注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白 | 强克 | 2011 | TNF-α | 融合蛋白 | 类风湿性关节炎和强直性脊柱炎 | ||
| 百泰生物 | 尼妥珠单抗注射液 | 泰欣生 | 2008 | EGFR | 人源化 | 鼻咽癌 | 5 | |
| 康弘药业 | 康柏西普眼药注射液 | 朗沐 | 2013 | VEGF-A/VEGF-B | 人源化 | 治疗AMD-湿性年龄相关性黄斑变性 | 2.7 | |
| 上海美恩生物 | 碘[131Ⅰ肿瘤细胞核人鼠嵌合单抗注射液 | 唯美生 | 2003 | 融合蛋白 | 首个肺癌放射免疫治疗药物 | |||
| 武汉生物制品研究所 | 注射用抗人T细胞CD3鼠单抗 | 2002 | CD3 | 鼠源 | 肾移植、器官移植排斥 | |||
| 大连亚维、东莞宏逸士 | 抗人白细胞介素-8鼠单抗乳膏 | 恩博克 | 2005 | IL-8 | 人源化 | 银屑病、恶急性湿疹 | ||
| 上市公司 | 华神药业 | 碘[131Ⅰ美托普单抗皮试制剂 (美托普单抗) | 利卡汀 | 2011 | HAb18G/CD147 | 人源化 | 肝癌靶向治疗 | 0.06 |
| 海正药业 | 注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白 | 安百诺 | 2015 | TNF-α | 融合蛋白 | 类风湿性关节炎和强直性脊柱炎 | ||
| 进口品种 | 强生 | 注射用英夫利昔单抗infliximab | 类克 | 2006 | TNF-α | 融合蛋白 | 类风湿、克罗病治疗 | 3.5 |
| 罗氏 (基因泰克) | 托珠单抗注射液Tocilizumab | 雅美罗 | 2013 | IL-6 | 人源化 | 类风湿性关节炎 | 0.35 | |
| 利妥昔单抗 | 美罗华 | 2000 | CD20 | 融合蛋白 | 非霍金森淋巴瘤 | 24 | ||
| 曲妥珠单抗 | 赫赛汀 | 2003 | Her2 | 人源化 | 乳腺癌 | 21 | ||
| 达利珠单抗 | 赛尼哌 | 2000 | IL-2 | 人源化 | 器官移植抗排斥 | |||
| 贝伐珠单抗 | 安维汀 | 2010 | VEGF | 人源化 | 器官移植抗排斥 | 12 | ||
| 诺华 | 雷珠单抗注射液 | 诺迷得 | 2012 | VEGF-A | 融合蛋白 | 湿性 (新生血管性) 年龄相关性黄斑变性 (AMD) | 10.2 | |
| 巴利普单抗 | 舒莱 | 2004 | IL-2 | 融合蛋白 | 器官移植抗排斥 | 2.8 | ||
| 雅培 | 阿达木单抗 | 修美乐 | 2010 | TNF-α | 人源化 | 类风湿性关节炎 | 0.8 | |
| 默克 | 西妥昔单抗 | 爱必妥 | 2006 | EGFR | 融合蛋白 | 结直肠癌 | 6.5 | |
| 安进 | 依那西普 | 恩利 | 2010 | TNF-α | 人源化 | 类风湿性关节炎 | ||
| 古巴分子免疫学中心 | 抗CD3单抗 | 爱欧山 | 1999 | CD3 | 鼠源 | 器官移植抗排斥 |
国内从事单抗生产的企业有100余家,除中信国健、海正药业、赛金生物、百泰生物等老牌企业外,近年还涌现了一批新兴企业,如嘉和生物、丽珠单抗、百济神州、信达生物及恒瑞医药等。研发环节中,众企业申报的仿制药靶点集中、同质化严重,如TNF-α拮抗剂有16个品种、13个厂家申报,CD20、VEGF也是申报集中的靶点[11]。
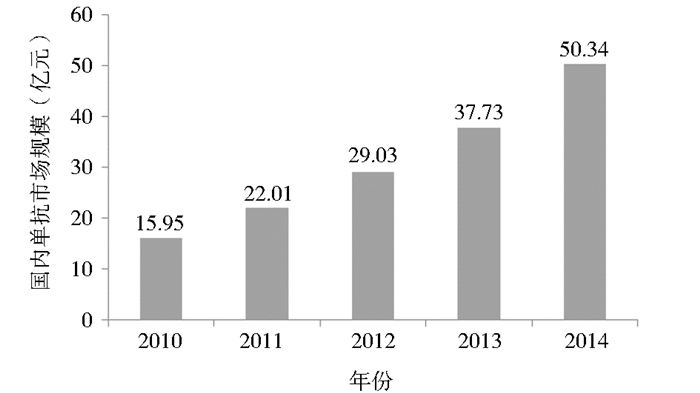
国内抗体药物产业起步较晚,单抗药物市场规模较小,2014年国内单抗药物市场规模仅50.34亿元 (图 4),主要集中在肿瘤治疗领域,在自身免疫疾病治疗及其他领域使用比例较低。随着全球单抗重磅品种专利期的临近,未来国内单抗药物发展空间巨大。
|
| 图 4 2010~2014年国内单抗市场规模 Figure 4 The market scale of domestic monoclonal antibodies between 2010 and 2014 |
近年来单抗药物研发投入逐渐加大,研发技术日趋成熟,中国单抗药物的申报数量也在逐渐增多,越来越多的国产单抗即将问世。2001年中国单抗药物申报数量仅1个,到2015年已经增加到41个 (图 5)。
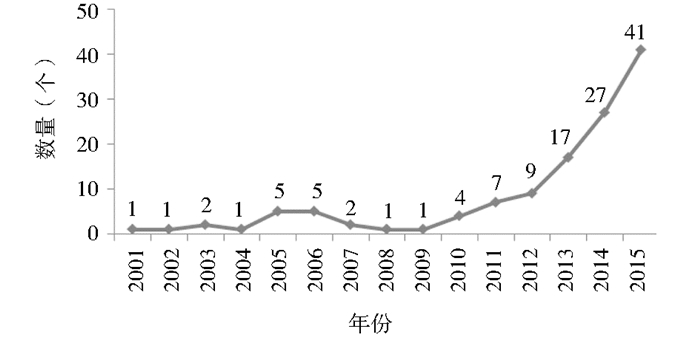
|
| 图 5 2001~2015年国内单抗药物申报情况 Figure 5 The application of domestic monoclonal antibodies between 2001 and 2015 |
目前多种国外单抗产品专利即将到期,国内单抗仿制药品的申报也加快了步伐 (表 7)。阿达木单抗在美国的专利期至2016年年底、欧洲专利至2018年4月 (表 5)。目前,国内共有两家企业-华兰基因工程有限公司和正大天晴药业集团股份有限公司在申请阿达木单抗注射液临床试验。利妥昔单抗、贝伐珠单抗和曲妥珠单抗是制药巨头罗氏制药的重磅产品,利妥昔单抗在美国的专利期至2018年、欧洲专利至2015年,贝伐珠单抗在美国的专利期至2019年、欧洲专利至2016年,曲妥珠单抗在美国的专利期至2019年、欧洲专利至2018年 (表 5)。目前,这三种单抗药物在国内均有两家企业申请,其中,上海恒瑞医药有限公司已获发贝伐珠单抗注射液临床批件。PD1和PDL1单抗是目前申报的热点,国内已有多家企业正在申报,其他申报靶点集中在CD20、VEGF、EGFR等。
| 名称 | 受理号 | 注册分类 | 承办日期 | 企业名称 | 办理状态 | |
| 阿达木单抗 | CXSL1400139 | 治疗用生物制品2 | 2015.02.03 | 华兰基因 | 在评审 | |
| CXSL1500037 | 治疗用生物制品2 | 2015.05.12 | 正大天晴 | 在评审 | ||
| 利妥昔单抗 | CXSL1400096 | 治疗用生物制品2 | 2014.11.17 | 华兰基因 | 在评审 | |
| CXSL1500056 | 治疗用生物制品2 | 2015.07.09 | 正大天晴 | 在评审 | ||
| 贝伐珠单抗 | CXSL1300107 | 治疗用生物制品2 | 2014.01.22 | 上海恒瑞医药 | 制证完毕,已发批件 | |
| CXSL1400137 | 治疗用生物制品2 | 2015.02.05 | 正大天晴 | 在评审 | ||
| 曲妥珠单抗 | CXSL1400013 | 治疗用生物制品2 | 2014.04.30 | 正大天晴 | 在评审 | |
| CXSL1400077 | 治疗用生物制品2 | 2014.09.12 | 华兰基因 | 在评审 | ||
| 重组抗CD20人鼠嵌合单抗注射液 | CXSL1500074 | 治疗用生物制品2 | 2015.08.20 | 嘉和生物 | 在评审 | |
| PD1单抗 | 重组人源化抗PD1单抗注射液 | CXSL1400138 | 治疗用生物制品2 | 2015.01.21 | 泰州君实生物 | 批准临床 |
| 注射用SHR-1210 | CXSL1400153 | 治疗用生物制品2 | 2015.01.19 | 上海恒瑞医药 | 批准临床 | |
| BGB-A317注射液 | CXSL1500096 | 治疗用生物制品1 | 2015.11.11 | 百济神州 | 在评审 | |
| 杰诺单抗注射液 | CXSL1600016 | 治疗用生物制品1 | 2016.04.07 | 嘉和生物 | 在评审 | |
| GLS-010注射液 | CXSL1600045 | 治疗用生物制品1 | 2016.04.25 | 誉衡药业/药明康德 | 在评审 | |
| PDL1单抗KN035注射液 | CXSL1600033 | 治疗用生物制品2 | 2016.04.28 | 康宁杰瑞 | 在评审 | |
| 重组人源化抗VEGF单抗注射液 | CXSL1600034 | 治疗用生物制品2 | 2016.06.15 | 中信国建 | 在评审 | |
| CXSL1600035 | 治疗用生物制品2 | 2016.06.15 | 中信国建 | 在评审 | ||
| 重组全人源化抗EGFR单抗注射液 | CXSL1500134 | 治疗用生物制品1 | 2016.02.23 | 重庆智翔金泰 | 在评审 | |
| 金妥昔单抗注射液 | CXSL1600013 | 治疗用生物制品2 | 2016.03.30 | 长春竞赛药业 | 在评审 | |
| 重组全人源化单抗MIL62注射液 | CXSL1500117 | 治疗用生物制品1 | 2016.02.23 | 北京天广实生物 | 在评审 | |
2.3 未来国内单抗药物的发展机遇
中国上市单抗产品的种类和数量都与世界市场存在一定的差距,现有产品多为仿制型,自主研发型产品极少,研发工艺不完善、技术不成熟、原材料质量不达标、保存条件不合格等都限制了单抗新产品的研制。
随着单抗药物产业的飞速发展,国家对单抗药物产业的重视程度进一步加大,未来国内单抗行业仍将保持快速增长势头。首先从产业政策来看,近年来国家在生物制药方面出台了一系列政策 (表 8),支持生物药自主创新研发,研发投入加大,多个单抗相关的课题获得国家重点资助;其次从人口结构来看,随着人口老龄化的加剧,肿瘤和类风湿患者人数将越来越多,将会进一步拓展以这两类疾病为适用证的单抗药物市场规模;最后从从支付能力和意愿来看,随着居民收入水平的提高和医保药物范围的拓展 (表 9),患者对于单抗药物的支付能力和意愿都极大增强,同时随着医生和患者对单抗疗效认识的逐步深入,目前的用药结构也将得到改善,单抗药物处方所占比例将有进一步上升的空间。
| 时间 | 支持政策 |
| 2011.7 | 《国家“十二五”科学和技术发展规划》 |
| 2011.10 | 《医学科技发展“十二五”规划》 |
| 2011.11 | 《“十二五”生物技术发展规划》 |
| 2012.1 | 《医药工业“十二五”发展规划》 |
| 2012.7 | 《“十二五”国家战略性新兴产业发展规划》 |
| 2012.12 | 《国务院关于印发生物产业发展规划的通知》 |
| 2013.1 | 《生物产业发展十二五规划》 |
| 2014.3 | 2015年重大新药创制科技重大专项启动 |
| 2016.3 | 《关于促进医药产业健康发展的指导意见》 |
| 商品名 | 进入各省医保情况 |
| 巴利普单抗 | 北京、广东、黑龙江、福建、湖北、海南、贵州、陕西、青海、福建、广西、甘肃、新疆13省 (自治区、直辖市) 医保乙类 |
| 英夫利昔单抗 | 吉林、黑龙江、海南、陕西、青海、云南、广西、西藏、甘肃、重庆、湖南11省 (自治区、直辖市) 医保乙类 |
| 利妥昔单抗 | 黑龙江、山东、贵州、青海、江西、广西、西藏、甘肃8省 (自治区) 医保乙类 |
| 曲妥珠单抗 | 广西、江苏2省 (自治区) 医保乙类 |
| 达利珠单抗 | 西藏1自治区医保乙类 |
| 依那西普 | 西藏1自治区医保乙类 |
| 西妥昔单抗 | 西藏1自治区医保乙类 |
| 注射用重组改构人肿瘤坏死因子 | 山西、福建、湖北、湖南、河南、广东、重庆、贵州、甘肃、青海、新疆11省 (自治区、直辖市) 医保乙类 |
| 注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白 | 上海、甘肃、广东、海南、湖南、山西、西藏、黑龙江8省 (自治区、直辖市) 医保乙类 |
3 结语
作为一种高技术含量的处方药,单抗药物本身的技术水平决定了其治疗效果和市场价值。随着生物技术的进步,抗体表达系统不断完善,表达细胞培养条件不断改进,表达水平也不断提高,其生产成本也在逐渐降低。伴随着人类后基因组学及代谢组学时代的到来,越来越多的抗体药物新靶点逐渐被发现和研究,抗体药物的市场将会继续扩大[9, 12]。目前国内在动物细胞大规模培养、抗体大规模纯化等技术方面存在壁垒,单抗产业与国际水平还有一定差距。随着国内单抗药物研发投入的加大和生物技术的成熟,加上中国科研人员的努力,这些技术问题终将解决,中国单抗药物产业将取得突飞猛进的发展。
| [1] | 甄永苏. 抗体药物与肿瘤靶向治疗. 医学研究杂志, 2007, 36(2) : 1–2. Zhen Y S. Antibody drugs and tumor targeted therapy. Journal of Medical Research, 2007, 36(2) : 1–2. |
| [2] | 张弢, 陈卫, 浦迪, 等. 抗体药物研究进展与趋势. 中国新药杂志, 2008, 17(9) : 713–718. Zhang T, Chen W, Pu D, et al. The develpoment and trend of antibody drug. Chinese Journal of New Drug, 2008, 17(9) : 713–718. |
| [3] | 刘萍, 陈苗苗, 刘学荣, 等. 单克隆抗体研究进展. 中国畜牧兽医, 2012, 39(1) : 67–70. Liu P, Chen M M, Liu X R, et al. Research progress in monoclonal antibodies. China Animal Husbandry & Veterinary Medicine, 2012, 39(1) : 67–70. |
| [4] | 姚瑞. 单克隆抗体行业研究. 成都: 西南财经大学, 金融学院, 2014. Yao R. The Monoclonal Antibody Industry Analysis. Chengdu:Southwestern University of Finance and Economics, School of Finance, 2014. |
| [5] | 李壮林, 姚雪静. 单克隆抗体药物研究进展. 药物生物技术, 2014, 21(05) : 456–461. Li Z L, Yao X J. Research and development of monoclonal antibody drugs. Pharmaceutical Biotechnology, 2014, 21(05) : 456–461. |
| [6] | Beck A, Wurch T, Reichert T J M. 6th annual report antibody congress 2010. Mabs, 2011, 3(2) : 111–132. DOI:10.4161/mabs.3.2.14788 |
| [7] | Weiner L M, Surana R, Wang S. Monoclonal antibodies:versatile platforms for cancer immunotherapy. Nat Rev Immunol, 2010, 10(5) : 317–327. DOI:10.1038/nri2744 |
| [8] | Chan A C, Carter P J. Therapeutic antibodies for autoimmunity and inflammation. Nat Rev Immunol, 2010, 10(5) : 301–316. DOI:10.1038/nri2761 |
| [9] | 李心, 龚珉, 徐为人, 等. 抗体药物的国内外市场动态. 现代药物与临床, 2012, 27(3) : 185–191. Li X, Gong M, Xu W R, et al. Market dynamics of antibody drugs in both domestic and abroad. Drugs & Clinic, 2012, 27(3) : 185–191. |
| [10] | 马杉姗, 马素永, 赵广荣. 中国抗体药物产业现状与发展前景. 中国生物工程杂志, 2015, 35(12) : 103–108. Ma S S, Ma S Y, Zhao G R. The status and development prospect of Chinese antibody drug industry. China Biotechnology, 2015, 35(12) : 103–108. |
| [11] | Gao K, Wang J Z. The biopharmaceutical industry in China:history and future perspectives. Front Med, 2012, 6(2) : 101–111. DOI:10.1007/s11684-012-0191-9 |
| [12] | 王兰, 朱磊, 徐刚领, 等. 单克隆抗体类生物治疗药物研究进展. 中国药学杂志, 2014, 49(23) : 2058–2064. Wang L, Zhu L, Xu G L, et al. Progress of research and development of antibody-based therapeutics. Chinese Pharmaceutical Journal, 2014, 49(23) : 2058–2064. |
 2017, Vol. 37
2017, Vol. 37




