文章信息
- 陈文杰, 汪建样, 殷明, 殷嫦嫦.
- CHEN Wen-jie, WANG Jian-yang, YIN Ming, YIN Chang-chang.
- 人脐带间充质干细胞抗肿瘤机制的研究进展
- Progress on Anti-cancer Molecule Mechanism of Human Umbilical Cord Mesenchymal Stem Cells
- 中国生物工程杂志, 2017, 37(3): 78-82
- China Biotechnology, 2017, 37(3): 78-82
- http://dx.doi.org/DOI:10.13523/j.cb.20170311
-
文章历史
- 收稿日期: 2016-09-26
- 修回日期: 2016-12-13
2. 南昌大学第二附属医院 南昌 330006;
3. 南昌大学研究生院医学部 南昌 330006;
4. 九江市第一人民医院 九江 332000
2. The Second Hospital Afficiated of Nanchang University, Nanchang 330006, China;
3. Medicine School of Graduate Center, Nanchang University, Nanchang 330006, China;
4. The first hospital of Jiujiang, Jiujiang 332000, China
随着现代细胞免疫学、细胞生物学及分子生物学技术的发展,越来越多的研究者对于肿瘤的治疗不再仅仅局限于传统的手术切除治疗、放射治疗及化疗,而是开始提出基于细胞功能、信号通路和肿瘤趋向性的新型靶向抗肿瘤治疗。肿瘤靶向治疗由于其良好的靶向性及抗肿瘤活性已成为当今肿瘤研究领域的热点[1]。间充质干细胞能靶向迁移至肿瘤所在部位并发挥抗肿瘤作用,因此间充质干细胞可作为肿瘤的细胞载体参与其生物靶向治疗[2]。人脐带是间充质干细胞理想的来源,不同于骨髓间充质干细胞,脐带间充质干细胞取材简单、自我更新快。相比于胚胎干细胞,脐带间充质干细胞的来源没有伦理争议。脐带间充质干细胞能促进组织修复、调节免疫反应及抗肿瘤。对于治疗恶性或良性的实体肿瘤来说,脐带间充质干细胞的应用很有前景[3]。本文主要论述了HUMSCs的3种抗肿瘤的机制。
1 HUMSCs的特性HUMSCs有着MSCs的共性,如自我更新、多向分化潜能、在体外能传40代并保持稳定的表型和多向分化潜能等。体外培养扩增的间充质干细胞作为组织工程的种子细胞,可修复各种组织和器官,可作为基因治疗的载体细胞,利用其免疫抑制、降低移植排斥反应,也可用于器官或组织移植[4]。MSCs在不同的病理条件下能迁移至炎症组织并引起内源性细胞聚集、组织重构及发挥抗炎作用[5-6]。另外,HUMSCs有其独特的优势,如取材简单、细胞增殖迅速、没有伦理问题、连续传代后能维持细胞干性、低免疫原性、在体内不引起畸胎瘤等[7]。与此同时,HUMSCs有靶向迁移至肿瘤所在部位进而杀死肿瘤细胞的特性[8]。
2 HUMSCs对肿瘤的趋向性HUMSCs迁移到肿瘤所在部位的具体机制还不是很清楚。有学者提出了两种可能的机制,一种认为肿瘤释放的驱化因子/细胞因子导致HUMSCs的定向迁移,另一种认为是由于驱化因子/细胞因子与其相应受体的相互作用导致HUMSCs定向迁移。在肿瘤微环境中,局部会产生高浓度的细胞因子,这些细胞因子大都来自肿瘤自分泌或肿瘤周围炎症组织,它们通过自分泌、旁分泌和 (或) 远程分泌的形式将信息传递给HUMSCs,诱导HUMSCs向肿瘤部位迁移[9]。Yan等[10]研究表明,HUMSCs在体外和体内实验中均能显著的迁移到肝癌所在部位,同时不迁移到肝脏其他部位。Rachakatla等[11]将HUMSCs通过静脉注射到乳腺癌SCID小鼠体内,结果在肺转移灶中发现了HUMSCs。上述实验表明,HUMSCs能靶向迁移到肿瘤所在部位。然而其迁移至肿瘤所在部位后也能促进肿瘤生长,胡文龙等[12]研究表明,HUMSCs能向骨肉瘤细胞定向迁移并分泌大量的IL-6,促进骨肉瘤细胞增殖。但间充质干细胞对肿瘤的趋向作用要强于其促进肿瘤生长和转移的作用[13]。HUMSCs对肿瘤的不同作用可能是由于在动物细胞模型中不同细胞群所占比例不同、肿瘤部位不同以及治疗途径不同而造成的。此外,由于HUMSCs在伤口愈合及组织再生中发挥了至关重要的作用,其肿瘤趋向性对临床肿瘤放疗的疗效有一定影响。但是,HUMSCs有着强大的抗肿瘤作用,其在肿瘤临床治疗上利大于弊。
3 HUMSCs通过Entosis机制发挥抗肿瘤作用Entosis是一种细胞侵入另一种细胞细胞质的过程[14]。在肿瘤的发生和发展中,细胞通过Entosis机制吞食另一种细胞,形成一种很独特的细胞结构,即一个形态上没有异常的活细胞存在于另外一个细胞中,这种现象被称为“细胞自食”,即“细胞吃细胞”现象。与我们熟知的吞噬不同的是,“细胞自食”中被吞入的是一个活细胞,执行吞入功能的细胞一般是肿瘤细胞。而吞噬情况下,被吞入细胞一般是死细胞,执行吞入功能的一般是各种巨噬细胞。“细胞自食”有别于目前人们广为熟知的细胞自噬,自噬过程中,细胞包裹的是细胞质的物质,其特点是所有事件发生在一个细胞内部。吞食机制是通过细胞间黏附受体E钙黏蛋白和细胞骨架连接蛋白形成上皮细胞黏附连接[15]。这一黏附连接造成了上皮细胞间的相互压力, 然后在肌动蛋白聚合物和肌球蛋白形成的压力作用下, 一个细胞侵入另一细胞。内化侵入邻近细胞后, 大部分内化细胞会被宿主细胞的溶酶体包裹, 然后经溶酶体途径导致内化细胞死亡。但是, 有小部分内化细胞能在宿主细胞内存活, 一些被重新释放出来, 还有一些在宿主细胞内完成分裂增殖[16]。
Chao等[17]的研究将HUMSCs通过静脉注入荷瘤鼠模型体内,体内生物发光图像表明HUMSCs聚集在乳腺癌细胞所在部位,进而导致了乳腺癌细胞的死亡。首先,乳腺癌细胞吞食HUMSCs,接着被吞食的HUMSCs在肿瘤细胞中分解,从HUMSCs中转移到乳腺癌细胞中的某种细胞因子可能是引起乳腺癌细胞死亡的关键因素。研究表明,内化的HUMSCs细胞导致了肿瘤细胞的死亡,这种方式与吞噬作用不同,这种非凋亡途径的细胞自食现象即为Entosis。此外HUMSCs在与正常细胞共培养时也能产生Entosis现象,但是形成的细胞结构不会导致宿主细胞的死亡,表明HUMSCs只会特定的引起肿瘤细胞的死亡,对正常细胞不起作用。Entosis作为一种新的细胞死亡分子机制,可能在抑制肿瘤发生、发展和转移过程中发挥重要作用。然而, 目前对于HUMSCs在肿瘤中如何通过Entosis机制发挥抗肿瘤作用的具体细节尚不清楚, 包括HUMSCs是如何决定肿瘤细胞最终命运的?肿瘤细胞的溶酶体是如何识别HUMSCs的?HUMSCs是如何启动宿主细胞死亡过程的?特别是HUMSCs异常是否会导致以及如何导致肿瘤的发生和发展?等等。对这些问题的研究, 将有助于我们进一步深入了解HUMSCs抗肿瘤的机制, 并为癌症防治技术提供新途径 (图 1)。

|
| 图 1 细胞自食示意图 Figure 1 Schematic model of entosis |
微囊泡 (MVs) 作为细胞间信号传递分子引起越来越多的关注,它来源于细胞膜,含有与母细胞膜相似的脂类和蛋白质。微囊泡最初在血液系统中发现,1967年,Wolf[18]报道激活的血小板能够释放细胞膜囊泡并称之为“血小板尘埃”。MVs中所包含的蛋白质、质酸和核酸的种类取决于其起源细胞、所处生理环境以及其他影响条件,如癌症或感染[19-22]。MVs在细胞间通信中起着重要的作用,能通过细胞表面受体的相互作用,蛋白质、mRNA及miRNA的转移来改变靶细胞的活性[23]。MVs中研究最多的两种类型是外核体和细胞微粒。当含有多囊小体的细胞膜融合到质膜时,外核体便从细胞膜释放,其直径大小为30~100nm,其在免疫反应调节中发挥重要作用,细胞微粒的直径通常为100~1 000nm [24]。将MSCs来源的MVs作为细胞产物应用于临床能减少将MSCs植入人体的风险,MVs能通过免疫调节减少MSCs的致瘤作用和异位组织的生成。很多学者通过在器官受损的动物模型体内研究MSCs来源的MVs的作用,结果表明,MVs在动物模型体内能抑制肿瘤生长并且调节免疫反应[25]。Wu等[26]成功的从HUMSCs上清液中提取出MVs,通过透视电子显微镜观察发现MVs的直径为30~500nm。体外研究表明,HUMSCs-MVs通过对G0/G1期的阻滞作用终止了肿瘤细胞的增殖,这种作用呈现剂量依赖性。在用HUMSCs-MVs处理的膀胱癌细胞中,p53和p21蛋白均显著表达。除了阻滞肿瘤细胞周期的进展外,HUMSCs-MVs在体内外均有促凋亡的特性,将共培养的HUMSCs-MVs和膀胱癌细胞通过皮下注射入小鼠膀胱癌模型体内,结果表明肿瘤出现的概率变小,肿瘤体积也减小。MVs广泛存在HUMSCs中,其携带的物质在细胞间的信息交流中起着重要作用。HUMSCs来源的MVs富含某些特定的蛋白质和转录因子,有助于损伤组织的修复。然而,MVs所携带的特定遗传物质进入靶细胞后的具体作用机制目前仍不是很清楚。此外,MVs还可以增加活性氧产生并且加强NADPH活性来抑制血管新生[27]。那么来源于HUMSCs的MVs是否具有相同的作用值得进一步的深入研究 (图 2)。
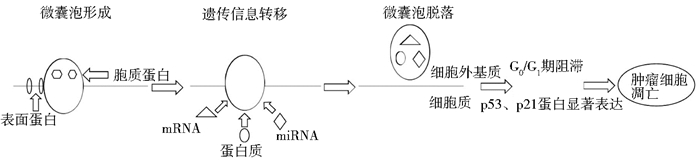
|
| 图 2 微囊泡在肿瘤细胞凋亡中的信号传递 Figure 2 MVs as mediators of intercellular communication in tumor apoptosis |
基于HUMSCs的肿瘤趋向性,基因修饰后的HUMSCs能靶向作用于肿瘤细胞,而不影响正常细胞,修饰后的HUMSCs有抗肿瘤形成和转移的特性。因此,针对不同种类的肿瘤,可以将HUMSCs设计成表达抗增殖、促凋亡等不同载体。将HUMSCs作为携带抗肿瘤基因的载体来减缓肿瘤的生长,这种治疗方式能在体内延长其半衰期并降低细胞毒性。同时由于HUMSCs在体内和体外均能靶向迁移到肿瘤细胞所在部位,因此很多研究将HUMSCs作为表达特异性抗肿瘤物质的载体。IFN-β在体外对不同类型的肿瘤细胞有着显著的抗肿瘤作用[28],然而由于其在体内的半衰期短、人体最大耐受量要低于有效剂量,所以未能成功应用于体内治疗。Shen等[29]的研究表明,转染了IFN-β的hUCMSCs能迁移到肿瘤所在处并能减慢乳腺癌细胞转移到乳腺其他部位。IFNβ-hUCMSCs通过激活JAK/STAT信号通路和Caspase来诱导乳腺癌MDA-MB-231细胞的凋亡。肿瘤坏死因子相关凋亡诱导配体 (TRAIL) 能诱导很多人肿瘤细胞系的凋亡,而对正常细胞不产生影响,因此被用于治疗肿瘤[30]。TRAIL能被特定的蛋白酶分解成一种可溶性分子sTRAIL,其在诱导肿瘤细胞凋亡中起到关键性的作用。但由于其在体内的半衰期短未能应用于临床。Yan等[31]研究表明,通过慢病毒转染后能特异性分泌sTRAIL的HUMSCs能迁移到肝癌细胞并且在体内和体外均能分化为肝细胞。基因修饰后的HUMSCs在原位肝癌移植模型中有着显著的抗肿瘤作用,通过分泌sTRAIL诱导肿瘤细胞凋亡,而对肿瘤周围组织和其他器官没有抑制作用。总而言之,基因编辑后的HUMSCs能有效的表达抑癌基因,从细胞水平抑制肿瘤细胞生长。而如何选择要表达的基因可能取决于肿瘤的种类和生长状态。此外,HUMSCs携带的抗肿瘤载体还包括溶瘤病毒和载药纳米微粒等。
6 结语综上所述,HUMSCs能靶向迁移到肿瘤组织,进而通过Entosis机制或者自身分泌的MVs发挥抗肿瘤作用,此外通过将HUMSCs进行基因改造从而携带抑癌基因也能抑制肿瘤生长。由于现今肿瘤的发病率逐年增加,而肿瘤治疗的手段局限、疗效差,因此研究者提出基于细胞水平的新型靶向抗肿瘤治疗。HUMSCs的肿瘤趋向性使其成为靶向抗肿瘤治疗良好的载体,但如何将HUMSCs的这种优势转化为临床应用还有很多需要解决的问题,如HUMSCs通过Entosis或MVs发挥抗肿瘤作用的具体机制和适用范围、针对不同种类肿瘤如何选择相应的抑癌基因、对HUMSCs进行基因编辑的最佳时间、将基因编辑后的HUMSCs注入体内的具体数量等。HUMSCs的应用有很多优势,但人脐带间充质干细胞是否最适用于临床尚不能下定论。尽管如此,随着对HUMSCs的深入研究,其在靶向抗肿瘤治疗领域的前景将更加广阔。
| [1] | 杨跃梅, 沈倍奋. 靶向抗肿瘤抗体一药物偶联物研究进展. 国际药学研究杂志, 2014, 41(1) : 15–50. Yang Y M, Shen B F. Development of antibody-drug conjugates as targeted cancer therapeutics. Journal of International Pharmaceutical Research, 2014, 41(1) : 15–50. |
| [2] | Li Z, Fan D, Xiong D.Mesenchymal stem cells as delivery vectors for anti-tumor therapy. Stem Cell Investig.[2017-02-14]. http://sci.amegroups.com/article/view/5978/6693. http://sci.amegroups.com/article/download/5978/6692 |
| [3] | Ding D C, Chang Y H, Shyu W C, et al. Human umbilical cord mesenchymal stem cells:a new era for stem cell therapy. Cell Transplant, 2015, 24(3) : 339–347. DOI:10.3727/096368915X686841 |
| [4] | 方洪松, 周建林, 彭昊, 等. 不同来源间充质干细胞生物学特性差异. 中国组织工程研究, 2015, 19(32) : 5243–5248. Fang H S, Zhou J L, Peng H, et al. Biological characteristics of different sources of mesenchymal stem cells. Journal of Clinical Rehabilitative Tissue Engineering Research, 2015, 19(32) : 5243–5248. |
| [5] | Nowakowski A, Walczak P, Janowski M, et al. Genetic engineering of mesenchymal stem cells for regenerative medicine. Stem Cells Dev, 2015, 24(19) : 2219–2242. DOI:10.1089/scd.2015.0062 |
| [6] | Nowakowski A, Walczak P, Lukomska B, et al. Genetic engineering of mesenchymal stem cells to induce their migration and survival. Stem Cell International in press.[2017-02-14]. https://www.hindawi.com/journals/sci/2016/4956063/. |
| [7] | Gauthaman K, Fong C Y, Cheyyatraivendran S, et al. Extra-embryonic human Wharton's jelly stem cells do not induce tumorigenesis, unlike human embryonic stem cells. Reprod Biomed Online, 2012, 24(2) : 235–246. DOI:10.1016/j.rbmo.2011.10.007 |
| [8] | Ganta C, Chiyo D, Ayuzawa R, et al. Rat umbilical cord stem cells completely abolish rat mammary carcinomas with no evidence of metastasis or recurrence 100 days post-tumor cell inoculation. Cancer Res, 2009, 69(5) : 1815–1820. DOI:10.1158/0008-5472.CAN-08-2750 |
| [9] | Ding D C, Shyu W C, Lin S Z. Mesenchymal stem cells. Cell Transplant, 2011, 20(1) : 5–14. DOI:10.3727/096368910X |
| [10] | Yan C H, Yang M, Li Z Z, et al. Suppressionof orthotopically implanted hepatocarcinoma in mice by umbilical cord-derived mesenchymal stem cells with sTRAIL gene expression driven by AFP promoter. Biomaterials, 2014, 35(9) : 3035–3043. DOI:10.1016/j.biomaterials.2013.12.037 |
| [11] | Rachakatla R S, Marini F, Weiss M L, et al. Development of human umbilical cord matrix stem cell-based gene therapy for experimental lung tumors. Cancer Gene Ther, 2007, 14(10) : 828–835. DOI:10.1038/sj.cgt.7701077 |
| [12] | 胡文龙, 吴平平, 耿书国, 等. 人脐带间充质干细胞分泌白细胞介素6促进骨肉瘤细胞增殖和迁移. 中国病理生理杂志, 2016, 32(2): 201-207. Hu W L, Wu P P, Geng S G, et al. Chinese Journal of Pathophysiology, 2016, 32(2):201-207. |
| [13] | Dittmar T, Entschladen F. Migratory properties of mesenchymal stem cells. Adv Biochem Eng Biotechnol, 2013, 129 : 117–136. |
| [14] | Janssen A, Medema R H. Entosis:aneuploidy by invasion. Nat Cell Biol, 2011, 13(3) : 199–201. DOI:10.1038/ncb0311-199 |
| [15] | Wang M, Ning X, Chen A, et al. Impaired formation of homotypic cell-in-cell structures in human tumor cells lacking alpha-catenin expression.[2017-02-14].http://www.nature.com/articles/srep12223. http://www.nature.com/srep/2015/150720/srep12223/fig_tab/srep12223_F6.html |
| [16] | Krishna S, Overholtzer M. Mechanisms and consequences of entosis. Cell Mol Life Sci, 2016, 73(11-12) : 2379–2386. DOI:10.1007/s00018-016-2207-0 |
| [17] | Chao K C, Yang H T, Chen M. Human umbilical cord mesenchymal stem cells suppress breast cancer tumourigenesis through direct cell-cell contact and internalization. J Cell Mol Med, 2012, 16(8) : 1803–1815. DOI:10.1111/jcmm.2012.16.issue-8 |
| [18] | Wolf P. The nature and signifiance of platelet products in human plasma. Br J Haematol, 1967, 13(3) : 269–88. DOI:10.1111/j.1365-2141.1967.tb08741.x |
| [19] | Im H, Shao H, Park Y I, et al. Label-free detection and molecular profiling of exosomes with a nano-plasmonic sensor. Nature Biotechnology, 2014, 32(5) : 490–495. DOI:10.1038/nbt.2886 |
| [20] | Robbins P D, Morelli A E. Regulation of immune responses by extracellular vesicles. Nature Reviews Immunology, 2014, 14(3) : 195–208. DOI:10.1038/nri3622 |
| [21] | Lee J K, Park S R, Jung B K, et al. Exosomes derived from mesenchymal stem cells suppress angiogenesis by downregulating VEGF expression in breast cancer cells. PLoS One, 2013, 8(12) : e84256. DOI:10.1371/journal.pone.0084256 |
| [22] | Roccaro A M, Sacco A, Maiso P, et al. BM mesenchymal stromal cell-derived exosomes facilitate multiple myeloma progression. Journal of Clinical Investigation, 2013, 123(4) : 1542–1555. DOI:10.1172/JCI66517 |
| [23] | Akyurekli C, Le Y, Richardson R B, et al. A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles. Stem Cell Reviews and Reports, 2015, 11(1) : 150–160. DOI:10.1007/s12015-014-9545-9 |
| [24] | 王喜梅. 微囊泡在组织再生中的研究进展. 医学综述, 2012, 18(13) : 1993–1995. Wang X M. Research advances of microvesicles in tissue regeneration. Medical Recapitulate, 2012, 18(13) : 1993–1995. |
| [25] | Akyurekli C, Le Y, Richardson R B, et al. A systematic review of preclinical studies on the therapeutic potential of mesenchymal stromal cell-derived microvesicles. Stem Cell Reviews and Reports, 2015, 11(1) : 150–160. DOI:10.1007/s12015-014-9545-9 |
| [26] | Wu S, Ju G Q, Du T, et al. Microvesicles derived from human umbilical cord wharton's jelly mesenchymal stem cells attenuate bladder tumor cell growth in vitro and in vivo. PLoS One, 2013, 8(4) : e61366. DOI:10.1371/journal.pone.0061366 |
| [27] | Yang C, Mwaikambo B R, Zhu T, et al. Lymphocytic microparticles inhibit angiogenesis by stimulating oxidative stress and negatively regulating VEGF-induced pathways. Am J Physiol Regul Integr Comp Physiol, 2008, 294(2) : R467–R476. |
| [28] | Wong V L, Rieman D J, Aronson L, et al. Growth-inhibitory activity of interferon-beta against human colorectal carcinoma cell lines. Int J Cancer, 1989, 43(3) : 526–530. DOI:10.1002/(ISSN)1097-0215 |
| [29] | Shen C J, Chan T F, Chen C C, et al. Human umbilical cord matrix-derived stem cells expressing interferon-β gene inhibit breast cancer cells via apoptosis. Oncotarget, 2016, 7(23) : 34172–34179. |
| [30] | Walczak H, Miller R E, Ariail K, et al. Tumoricidal activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo. Nat Med, 1999, 5(2) : 157–163. DOI:10.1038/5517 |
| [31] | Yan C, Yang M, Li Z Z, et al. Suppressionof orthotopically implanted hepatocarcinoma in mice by umbilical cord-derived mesenchymal stem cells with sTRAIL gene expression driven by AFP promoter. Biomaterials, 2014, 35(9) : 3035–3043. DOI:10.1016/j.biomaterials.2013.12.037 |
 2017, Vol. 37
2017, Vol. 37




