文章信息
- 姚韧辉, 董卓, 李会.
- YAO Ren-hui, DONG Zhuo, LI Hui.
- Gibberella intermedia C2转化4-雄甾烯-3、17-二酮的研究
- Biotransformation of Androst-4-en-3, 17-dione by Gibberella intermedia C2
- 中国生物工程杂志, 2017, 37(3): 73-77
- China Biotechnology, 2017, 37(3): 73-77
- http://dx.doi.org/DOI:10.13523/j.cb.20170310
-
文章历史
- 收稿日期: 2016-10-11
- 修回日期: 2017-01-16
2. 江南大学药学院 无锡 214122
2. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, China
甾体化合物具有独特生理功能,是维持生命活动的重要活性物质,已被广泛应用于抗炎、利尿、免疫、避孕及抗癌等领域[1]。甾体激素药物是仅次于抗生素的第二大品种,其合成多以化学工艺为主,普遍存在工艺路线长、反应条件苛刻、污染物排放量大、产物收率低等不足。以微生物强大及复杂的酶催化体系特异制备甾体药物中间体,可有效简化工艺路线、减少有机溶剂使用与污染物排放、降低能耗物耗、提高催化选择性和整体的收率[2-3]。同时,有利于缓解甾体半合成原料薯蓣资源的日益短缺及提炼过程中的严重环境污染问题[4]。因此,在甾体药物及其中间体的合成过程中微生物转化法越来越受到关注,逐渐成为甾体药物合成领域的关键生产技术。
近些年,大量微生物被筛选应用于甾体化合物的生物转化[5-9]。微生物转化合成甾体药物及其中间体主要集中在甾醇侧链的降解、甾体羟化及甾体脱氢等方面。其中,微生物羟化反应是使甾体化合物功能化最重要的一类反应之一[10]。甾体化合物引入羟基基团后,其特性,如毒性、极性和跨膜速率等均具有显著变化,进而可以提高甾体药物的治疗效果。综合国内外文献报道,目前甾体微生物羟化反应类型主要包括以下几种:C-7α, C-7β, C-9α, C-11α, C-11β, C-14α, C-15α, C-15β, C-17α, C-7α, 15α和C-7α, 15β等[10-12]。虽然国内外研究在筛选具有甾体羟化能力的菌株方面已有了一定的进展,但具有特定位点羟化的菌株筛选以及合成一些具有潜在价值的新型甾体化合物的研究仍具有重要意义。
目前,已报道的具备甾体转化能力的菌株已超过1 500株,但大部分集中在Curvularia、Colletotrichum、Gibberella、Penicillium、Mycobacterium、Streptomyces和Aspergillus等属[10, 13-14]。4-雄甾烯-3、17-二酮 (简称为雄烯二酮,AD) 是合成众多甾体激素药物的关键中间体,其下游主导产品有炔诺酮、米非司酮等,是甾体类化合物的第一大品种。为了得到更多具有潜在应用价值的甾体药物前体,本研究以雄甾烷中一种有广泛用途的化合物雄烯二酮为底物,采用实验室菌种库中保藏的Gibberella intermedia C2进行微生物转化反应,并进行转化产物的结构鉴定及转化工艺的优化。
1 材料与方法 1.1 材料 1.1.1 菌种G. intermedia C2,本实验室筛选并保藏。
1.1.2 试剂与培养雄烯二酮 (纯度98%) 购自浙江仙居君业药业有限公司;乙腈、乙酸乙酯、乙醇等均为市售分析纯;甲醇为色谱纯,购于国药集团化学试剂有限公司。其他培养基主要成分葡萄糖、酵母粉等均购于国药集团化学试剂有限公司。
斜面培养基 (g/L):葡萄糖10、酵母粉7.5、NaCl 1.5、KH2PO4 2.5、琼脂20,pH 7.0。
种子培养基 (g/L):葡萄糖10、酵母粉7.5、NaCl 1.5、KH2PO4 2.5,pH 7.0。
转化培养基 (g/L):葡萄糖10、酵母粉20、玉米浆9、FeSO4 0.1,pH 7.0。
1.2 方法 1.2.1 G. intermedia C2的种子培养从斜面固体培养基上挑取2~3环菌丝体接入50ml/250ml新鲜种子培养基中,于30℃、220r/min摇床培养24h,获得种子。
1.2.2 G. intermedia C2的生物转化过程新鲜种子液以4%的接种量接入无菌转化培养基 (30ml/250ml),30℃、220r/min条件下培养24h。随后,培养液中一次性加入4g/L的粉状底物雄烯二酮,于30℃、220r/min条件下继续转化72h。
1.2.3 转化产物的提取与分离待转化结束后,抽滤,将菌体与转化液分离。菌体用乙醇反复萃取3次,上清液用等体积乙酸乙酯萃取2次。合并萃取液,于旋转蒸发仪中浓缩。采用硅胶色谱柱对转化产物进行分离,采用二氯甲烷-甲醇梯度洗脱,得到转化产物粗品。继而将粗品浓缩后用乙腈复溶,再利用制备型液相色谱仪进行二次分离,进一步提高产物的纯度。
1.3 分析与检测制备型液相色谱采用Waters C18柱。流动相为乙腈/水,检测波长为206nm,柱温为30℃,流速为5ml/min,进样量为100μl,检测时间为30min。采用梯度洗脱程序:乙腈/水 (30/70),10min;乙腈/水 (80/20),10min;乙腈/水 (80/20),5min;乙腈/水 (30/70),5min。
HPLC检测样品中的底物及产物的浓度。采用UltiMate 3000型液相色谱仪进行测定,色谱柱为Agilent TC-C18柱 (5μm,4.6mm×250mm),柱温30℃,紫外检测器,检测波长为206nm。流动相为V(乙腈):V(水)=7:3,流速为0.5ml/min,进样量为10μl。
转化产物鉴定的氢谱 (1HNMR)、碳谱 (13CNMR) 均使用瑞士Bruker公司的AVANCE Ⅲ型核磁共振仪测定,温度为25℃,溶剂为氘代二甲基亚砜。
2 结果与讨论 2.1 转化产物的结构鉴定以雄烯二酮 (1) 为底物,利用G. intermedia C2对甾体底物进行转化72h后,经提取分离最终得到两种转化产物2和3。利用MS、IR、1HNMR、13CNMR对两个未知化合物进行鉴定,分析结果如下。
化合物2:质谱,MS (ESI)m/z [M+H]+303.1、[M+Na]+325.2。推断该化合物的相对分子质量为302,分子式为C19H26O3。与底物AD (C19H26O2) 的相对分子质量286相比,增加了一个氧原子。1HNMR (DMSO-d6),δ:4.94(1H, d, J=6.4 Hz, 15-OH),4.19(1H, m, 15-H),2.90(1H, dd, J=19.1, 8.0Hz, 16-H)。13CNMR (DMSO-d6),δ:35.08(C-1),33.60(C-2),197.94(C-3),122.93(C-4),170.88(C-5),31.97(C-6),31.12(C-7),34.81(C-8),53.27(C-9),38.27(C-10),19.78(C-11),31.73(C-12),49.52(C-13),56.53(C-14),68.55(C-15),45.95(C-16),216.35(C-17),14.77(C-18),17.00(C-19)。产物2波谱数据与参考文献[15]一致,为AD的15羟转化产物15α-OH-AD。
化合物3:质谱:MS (ESI)m/z[M+H]+319.2、[M+Na]+341.2。推断该化合物的相对分子质量为318,分子式为C19H26O4。与转化产物2的相对分子质量相比,增加了一个氧原子。1HNMR (DMSO-d6),δ:4.90(1H, d, J=6.5Hz, 15-OH),4.44(1H, d, J=6.7Hz, 11-OH),4.16(1H, ddt, J=10.0, 8.1, 6.5Hz, 15-H),3.81(1H, m, 11-H),2.94(1H, dd, J=19.1, 8.0 Hz, 16-H)。13CNMR (DMSO-d6),δ:36.95(C-1),33.85(C-2),198.64(C-3),123.28(C-4),171.68(C-5),32.87(C-6),31.49(C-7), 34.36(C-8),58.65(C-9),39.71(C-10),66.82(C-11),42.36(C-12),49.88(C-13),56.08(C-14),68.12(C-15),46.18(C-16),215.4(C-17),15.75(C-18),18.11(C-19)。产物3的波谱数据与参考文献[15]一致,为AD的11, 15双羟转化产物11α, 15α-OH-AD。
2.2 G. intermedia C2对雄烯二酮的羟化特征分析G. intermedia C2对雄烯二酮的转化反应如图 1所示。由图 1可知,该菌株可以在特定位点羟化雄烯二酮,分别在11位及15位加入羟基。另外,该两种转化产物引入的羟基均为α构型,说明G. intermedia C2对雄烯二酮的转化具有较好的立体选择性。

|
| 图 1 G. intermedia C2对雄烯二酮的转化 Figure 1 Biotransformation of androst-4-en-3, 17-dione by G. intermedia C2 |
根据文献[10, 15]报道,虽然能对4-烯和5-烯甾体化合物进行转化的丝状真菌很多,但能将甾体母核的C-15进行羟化的菌大多为Gelasinospora retispora和Colletotrichum lini。其中,Colletotrichum lini是唯一能将雄烯二酮C11和C15位进行双羟化的菌株。本研究的结果与Colletotrichum lini类似,G. intermedia C2同样能够将雄烯二酮的11位及15位双羟化。该研究拓展了雄烯二酮11位及15位双羟化菌株的范围,同时其转化产物15α-OH-AD及11α, 15α-diOH-AD也为甾体药物及其中间体的生物合成提供了新思路,具有潜在的应用价值。
2.3 G. intermedia C2双羟化雄烯二酮反应过程分析为了进一步分析G. intermedia C2对甾体化合物的羟化反应机制,确定双羟化反应的顺序,本研究在菌株转化雄烯二酮过程中定时取样,分析检测转化液中各底物和产物的浓度,其转化过程曲线如图 2所示。
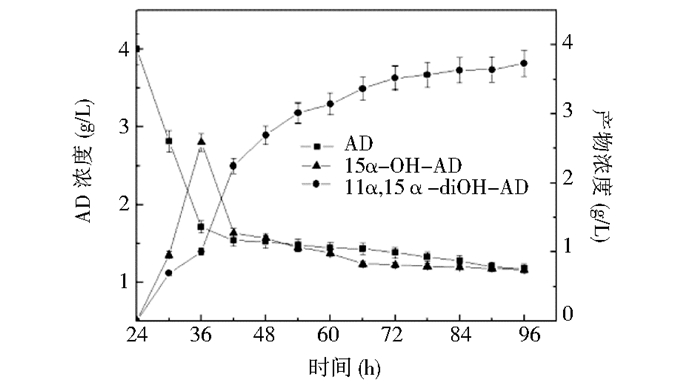
|
| 图 2 雄烯二酮转化过程分析 Figure 2 Time course of biotransformation from androst-4-en-3, 17-dione by G. intermedia C2 |
由图 2可知,在转化前36h,大部分底物转化为15α-OH-AD (2),其底物摩尔转化率约为57.2%。而此时,底物转化为双羟11α, 15α-diOH-AD (3) 的效率则较低。随着时间的延长 (72h),大量的15α-OH-AD进一步转化为11α, 15α-diOH-AD。最终,单羟产物15α-OH-AD的摩尔得率下降到11.7%,双羟产物11α, 15α-diOH-AD的摩尔转化率增加到55.9%。进而得出以下结论:当赤霉菌C2对雄烯二酮进行转化时,首先生成大量的单羟产物,随转化时间的延长,单羟产物逐渐减少而双羟产物逐渐增多。推测可能的原因是菌株对雄烯二酮甾体母核的C11和C15位均具有羟化能力,但由于其对C15位的亲和性更高,故在转化过程中先生成15α单羟产物,然后再在C11引入第二个羟基,进而生成11α, 15α双羟产物。
2.4 转化条件的优化 2.4.1 底物浓度对转化的影响考察了底物浓度对G. intermedia C2转化雄烯二酮的影响 (表 1)。由表 1所知,当底物浓度为2.0~12.0g/L时,随着其浓度的增加, 底物的转化率先上升再下降。在底物浓度为6.0g/L时, 底物的摩尔转化率达到最大为78.2%,此时,产物的总摩尔得率也达到最大。因此, 选择G. intermedia C2转化雄烯二酮的最适底物浓度为6.0g/L。
| AD浓度 (g/L) | 底物摩尔转化率 (%) | 15α-OH-AD摩尔得率 (%) | 11α, 15α-diOH-AD摩尔得率 (%) |
| 2.0 | 68.5±3.6 | 15.6±1.2 | 50.0±3.1 |
| 4.0 | 70.6±2.7 | 11.7±1.0 | 55.9±3.4 |
| 6.0 | 78.2±3.8 | 6.7±0.3 | 68.9±4.5 |
| 8.0 | 59.8±2.1 | 13.4±1.2 | 43.3±3.8 |
| 10.0 | 55.0±1.9 | 16.8±1.4 | 31.5±2.9 |
| 12.0 | 52.4±1.6 | 18.5±1.3 | 27.8±2.5 |
2.4.2 培养基初始pH对转化的影响
由表 2可知,培养基初始pH为5.0~8.0时,底物转化率先上升再下降。当培养基的初始pH为6.5时,底物摩尔转化率达到最大值80.5%。因此,选择G. intermedia C2转化雄烯二酮初始培养基的最适pH为6.5。
| pH | 底物摩尔转化率 (%) | 15α-OH-AD摩尔得率 (%) | 11α, 15α-diOH-AD摩尔得率 (%) |
| 5.0 | 60.4±3.8 | 12.3±1.7 | 48.0±3.0 |
| 5.5 | 65.8±3.2 | 10.6±0.7 | 50.5±3.9 |
| 6.0 | 68.4±3.9 | 11.8±0.9 | 52.5±3.5 |
| 6.5 | 80.5±4.0 | 6.2±0.4 | 72.3±5.0 |
| 7.0 | 78.2±3.9 | 6.7±0.3 | 68.9±4.5 |
| 7.5 | 56.6±2.7 | 11.2±1.0 | 43.0±3.2 |
| 8.0 | 52.0±2.1 | 14.4±1.3 | 29.9±2.5 |
2.4.3 转化温度对转化的影响
由表 3可知,转化温度在28℃时转化率最高。这可能是由于G. intermedia C2的适宜生长温度为26~30℃,在28℃时酶的表达量最大,进而转化率最高。因此,选择G. intermedia C2转化雄烯二酮的最适转化温度为28℃。
| 温度 (℃) | 底物摩尔转化率 (%) | 15α-OH-AD摩尔得率 (%) | 11α, 15α-diOH-AD摩尔得率 (%) |
| 26 | 70.5±2.6 | 16.2±1.6 | 51.3±3.6 |
| 28 | 81.5±3.5 | 6.0±0.4 | 73.8±5.2 |
| 30 | 78.2±3.0 | 6.7±0.3 | 68.9±4.5 |
| 32 | 56.5±2.7 | 11.5±1.0 | 42.3±3.2 |
| 34 | 53.1±2.1 | 13.8±1.1 | 30.5±2.4 |
2.4.4 转化过程曲线
综合以上结果,G. intermedia C2转化雄烯二酮的最优工艺如下:G. intermedia C2培养基的初始pH为6.5,装液量为30ml/250ml,于28℃、220r/min摇床培养24h投加底物6g/L,转化周期为84h。G. intermedia C2对雄烯二酮的转化过程如图 3所示。结果表明,随着转化时间的延长,底物转化率上升;当转化84h时,残留底物浓度达到1.1g/L,转化率最高达到81.5%。继续延长转化时间,随着菌体的衰老,底物的转化率不再提高。本研究与文献报道[15]相比 (表 4),底物投料浓度及双羟产物摩尔得率均有所提高。底物AD的投料浓度提高至6g/L,11α, 15α-diOH-4-AD的最高摩尔得率达到73.8%。
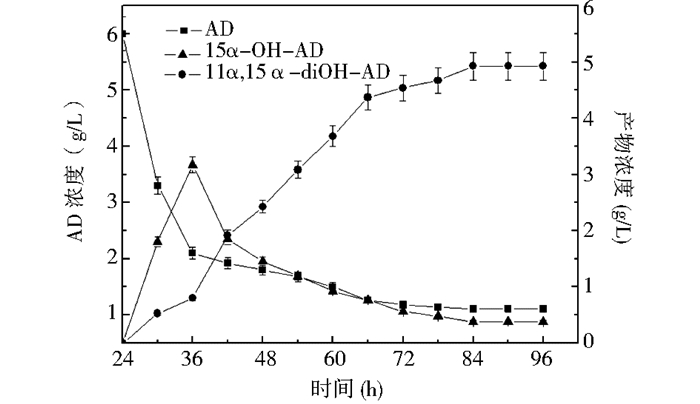
|
| 图 3 G. intermedia C2转化雄烯二酮的过程曲线 Figure 3 Curve of biotransformation from androst-4-en-3, 17-dione by G. intermedia C2 |
3 结论
为了进一步拓展雄烯二酮羟化衍生物的范围,合成一些具有潜在价值的新型甾体化合物,本研究以雄甾烷中一种有广泛用途的化合物雄烯二酮为底物,利用本实验室保藏的丝状真菌G. intermedia C2对雄烯二酮进行转化。结果表明,G. intermedia C2对AD具有转化能力, 转化产物通过质谱、1HNMR、13CNMR核磁光谱分析,确定分别为15α-OH-AD和11α, 15α-diOH-AD。转化过程分析发现,G. intermedia C2先将底物的15位羟基化合成15α-OH-AD,再将其11位羟基化形成双羟基产物。在以上工作基础上,通过工艺优化,确定了G. intermedia C2转化雄烯二酮的最适工艺如下:G. intermedia C2培养基的初始pH为6.5,装液量为30ml/250ml,于28℃、220r/min摇床培养24h投加底物6g/L,转化周期为84h。转化结束,底物的转化率可达到81.5%。本研究与文献报道相比,底物投料浓度及双羟产物摩尔得率均有所提高。本研究获得了具有潜在应用价值的甾体药物前体,为甾体药物的合成提供了更多的可能性途径。后续将对得到的羟化产物进行细胞及动物中的活性评价实验,从而为其在甾体药物方面的应用奠定基础。
| [1] | Mahato S B, Garai S. Advances in microbial steroid biotransformation. Steroids, 1997, 62(4) : 332–345. DOI:10.1016/S0039-128X(96)00251-6 |
| [2] | Baker M E. Origin and diversification of steroids:co-evolution of enzymes and nuclear receptors. Molecular and Cellular Endocrinology, 2011, 334(1-2) : 14–20. DOI:10.1016/j.mce.2010.07.013 |
| [3] | Weber A, Kennekke M, Klages U, et al. Process for the Production of 17-oxosteroids Via the Ermentative Oxidation of 17β-hydroxysteroids by Mycobacterium:US, US6203493A. 1993-05-17. |
| [4] | Roberts S M, Eddolls J P, Willetts A J, et al. Preparation of Adrenocorticoid Steroids:United Kingdom, GB2318790. 1997-10-31. |
| [5] | Tong W Y, Dong X. Microbial biotransformation:recent developments on steroid drugs. Recent Patents on Biotechnology, 2009, 3(2) : 141–153. DOI:10.2174/187220809788700157 |
| [6] | Peart P C, McCook K P, Russell F A, et al. Hydroxylation of steroids by Fusarium oxysporum, Xophiala jeanselmei and Ceratocystis paradoxa. Steroids, 2011, 76(12) : 1317–1330. DOI:10.1016/j.steroids.2011.06.010 |
| [7] | Li H, Liu H M, Ge W, et al. Synthesis of 7α-hydroxy-dehydroepiandrosterone and β-hydroxy-dehydroepiandrosterone. Steroids, 2005, 70(14) : 970–973. DOI:10.1016/j.steroids.2005.07.006 |
| [8] | Lamm A S, Chen A R M, Reynolds W F, et al. Steroid hydroxylation by Whetzelinia sclerotiorum, Hanerochaete chrysosporium and Mucor plumbeus. Steroids, 2007, 72(9-10) : 713–722. DOI:10.1016/j.steroids.2007.05.008 |
| [9] | Choudhary M I, Erum S, Atif M, et al. Biotransformation of 20S)-20-hydroxymethylpregna-1, 4-dien-3-one by four filamentous fung. Steroids, 2011, 76(12) : 1288–1296. |
| [10] | Donova M V, Egorova O V. Microbial steroid transformations:current state and prospects. Applied Microbiology and Biotechnology, 2012, 94(6) : 1423–1447. DOI:10.1007/s00253-012-4078-0 |
| [11] | Choudhary M I, Mohammoad M Y, Musharraf S G, et al. New oxandrolone derivatives by biotransformation using Rhizopus stolonife. Steroids, 2009, 74(13-14) : 1040–1044. DOI:10.1016/j.steroids.2009.08.003 |
| [12] | Koshimura M, Utsukihara T, Hara A, et al. Hydroxylation of steroid compounds by Gelasinospora retispora. Journal of Molecular Catalysis B:Enzymatic, 2010, 67(1-2) : 72–77. DOI:10.1016/j.molcatb.2010.07.008 |
| [13] | Kollerov V V, Shutov A A, Fokina V V, et al. Bioconversion of C19-and C21-steroids with parent and mutant strains of Curvularia lunata. Applied Biochemistry and Microbiology, 2010, 46(2) : 198–205. DOI:10.1134/S0003683810020122 |
| [14] | Huang L H, Li J, Xu G, et al. Biotransformation of dehydroepiandrosterone (DHEA) with Penicillium griseopurpureum Smith and Penicillium glabrum (Wehmer) Westling. Steroids, 2010, 75(13-14) : 1039–1046. DOI:10.1016/j.steroids.2010.06.008 |
| [15] | Wu Y, Li H, Zhang X M, et al. Efficient hydroxylation of functionalized steroids by Colletotrichum lini ST-1. Journal of Molecular Catalysis B:Enzymatic, 2015, 120 : 111–118. DOI:10.1016/j.molcatb.2015.07.003 |
 2017, Vol. 37
2017, Vol. 37




