文章信息
- 戴剑漉, 卢智黎, 林灵, 王以光, 赫卫清.
- DAI Jian-lu, LU Zhi-li, LIN Ling, WANG Yi-guang, HE Wei-qing.
- 利用异源正调控基因acyB2构建埃莎霉素Ⅰ高产菌株
- Construction of the Isomycin Ⅰ High-yield Strain by Introducing a Heterologous Positive Regulatory Gene acyB2
- 中国生物工程杂志, 2017, 37(3): 65-72
- China Biotechnology, 2017, 37(3): 65-72
- http://dx.doi.org/DOI:10.13523/j.cb.20170309
-
文章历史
- 收稿日期: 2016-12-19
- 修回日期: 2016-01-16
2. 东北农业大学生命科学学院 哈尔滨 150030
2. College of Life Science, Northeast Agricultural University, Harbin 150030, China
必特螺旋霉素 (Bitespiramycin, BT,原名生技霉素,药品注册名可利霉素) 是利用基因工程技术,将耐热链霉菌 (Streptomyces thermotolerans) 的4″-异戊酰基转移酶基因 (4″-isovaleryltransferase gene,ist) 导入到螺旋霉素产生菌 (S. spiramyceticus) 中进行表达,所产生的发酵产物[1]。BT是多组分药物,是以异戊酰螺旋霉素 (简称为埃莎霉素)Ⅰ、Ⅱ、Ⅲ三个组分为主成分,还含有其他酰化螺旋霉素的小组分。BT具有较高的亲脂性,口服吸收快,组织渗透性强,分布广,体内维持时间长,有较好的抗生素后效应[2-4]。已完成的三期临床试验研究结果证实,BT具有良好的疗效和安全性。埃莎霉素Ⅰ、Ⅱ和Ⅲ的区别是在其16元内酯环3位上具有不同的修饰基团,3位上是羟基的为埃莎霉素Ⅰ,对3-OH进行乙酰化和丙酰化修饰分别产生埃莎霉素Ⅱ和Ⅲ。3-OH的酰基化由3-O-酰基转移酶 (3-O-acyltransferase) 进行催化[5],此酶对底物的选择具有一定的宽容性,对乙酰基和丙酰基底物都能识别。
研究表明,埃莎霉素Ⅰ的抗菌活性与BT多组分的混合物没有显著差异,因此埃莎霉素Ⅰ可以单独成药,这样可以降低药物质控成本,而且可以做成注射剂型。我们在BT产生菌WSJ-1中阻断3-O-酰基转移酶基因 (sspA) 成功构建了只产生埃莎霉素Ⅰ组分的菌种WSJ-2[6-7],但其埃莎霉素Ⅰ的产量较低,只有280μg/ml左右,不利于规模化生产。
在链霉菌中经常通过改造调节基因来提高抗生素产量[8],特别是通过提高特异性正调控基因的表达来提高目标化合物的产量。例如,天蓝色链霉菌 (S. coelicolor) 中放线紫红素生物合成调控蛋白ActⅡ-4和十一烷基灵菌红素合成调控蛋白RedD [9],匹马菌素产生菌S. natalensis中的PimR [10]。还有些异源调控基因也能提高次级代谢产物的产量。例如,来源于S. platensis NRRL 18993的mgsA或者Streptomyces sp. YIM56141的chxA基因高表达可以提高S. amphibiosporus中lactimidomycin的产量[11]。
已知来源于耐热链霉菌的4″-异戊酰基转移酶基因 (ist) 与调节基因acyB2连锁,调节基因的存在可以激活ist基因的表达。研究证实,包含ist和其正调控基因acyB2的变铅青链霉菌可以将67%~79%外源添加的泰洛菌素转化为4″-异戊酰泰洛菌素,而仅含有单个ist或ist与不完整的acyB2基因的变铅青链霉菌,对泰洛菌素的转化率仅为0%~2.4% [12-13],说明acyB2对ist基因表达具有正调控作用。经同源比较,acyB2与生二素链霉菌 (S. ambofaciens ATCC 23877) 的srm40[14]序列的一致性为69%,与泰洛菌素产生菌 (S. fradiae) 中的调控蛋白TylR[15]的一致性为41%,它们均具有DDE转座酶保守结构域 (DDE transposase conserved domain);但经过分析这些同源蛋白没有明显的DNA结合结构域,因此这些调节蛋白调控靶基因的机制还未见报道。Srm40和TylR已证实为正调控蛋白,它们分别参与S. ambofaciens ATCC 23877和S. fradiae中螺旋霉素及泰洛菌素生物合成的调控[16-17]。
本研究拟利用调节基因acyB2激活ist基因表达的特点,改造菌种WSJ-2,将acyB2和ist基因连锁导入WSJ-2菌株中,通过提高ist基因的表达量来提高埃莎霉素Ⅰ的产量。
1 材料与方法 1.1 材料 1.1.1 菌种、基因和载体埃莎霉素Ⅰ产生菌WSJ-2(S. spiramyceticus WSJ-2):BT基因工程菌 (WSJ-1)3-O-酰基转移酶基因 (sspA) 阻断变株,本实验室构建[6];耐热链霉菌 (S. thermotolerans CGMCC4.1501),用于调节基因acyB2的PCR扩增,由中国微生物菌种保藏管理委员会普通微生物中心提供;E. coli DH5α:基因克隆和重组质粒构建受体菌;E. coli ET 12567:甲基化缺陷型大肠杆菌,用于重组质粒去甲基化;枯草芽孢杆菌 (Bacillus subtilis CPCC 100029):用于工程菌发酵产物的活性检测,本实验室保存。埃莎霉素Ⅰ产生菌 (WSJ-IA):含ist-acyB2连锁基因的WSJ-2,本研究构建。含ist基因和部分acyB2基因的片段来自于pSW4重组质粒[1];pBluescript Ⅱ SK (+):大肠杆菌克隆载体,含氨苄青霉素 (ampicillin,Amp) 抗性基因bla,购自Merck公司;pSET152:大肠杆菌-链霉菌穿梭型整合载体,含阿普拉霉素 (apramycin,Am) 抗性基因aac (3)Ⅳ,能通过噬菌体φ31的attP位点 (phage attachment site) 特异性整合到链霉菌染色体上[18],用于构建重组质粒,本实验室保存;pBSK-ia质粒:含ist-acyB2连锁基因的pBluescript Ⅱ SK (+) 重组质粒,本研究构建。pSET152-ia质粒:含ist-acyB2连锁基因的pSET152重组质粒,本研究构建。ET12567(pSET152-ia):含pSET152-ia质粒的E. coli ET12567,本研究构建。
1.1.2 试剂氨苄青霉素 (ampicillin,Amp),阿普拉霉素 (apramycin,Am) 购自武汉远城科技发展有限公司。螺旋霉素Ⅰ(spiramycin Ⅰ,SP Ⅰ) 和埃莎霉素Ⅰ(isomycinⅠ) 对照品,沈阳同联集团有限公司提供。链霉菌基因组快速提取试剂盒,购自广州东盛生物科技有限公司。限制性内切核酸酶,RNA提取试剂盒购自Qiagen公司 (德国),LA-Taq DNA聚合酶 (附带2×GC Buffer Ⅰ),SYBR Premix ExTaq TM (Perfect Real Time) 荧光染料,均购自宝生物工程 (大连) 有限公司。
1.1.3 培养基R2YE培养基按参考文献[19]配制,用于S. spiramyceticus WSJ-2原生质体的制备和再生,S. spiramyceticus WSJ-2及WSJ-IA斜面、种子、发酵和生物检定培养基均按参考文献[20]配制。
用于培养菌丝提取RNA的可溶性发酵培养基 (g/L):可溶性淀粉50.0,葡萄糖5.0,酵母提取物5.0,KH2PO4 10.0,K2HPO4·3H2O 7.0,NaCl 10.0,MgSO4·7H2O 1.0,NH4NO3 6.0,鱼粉20.0。将可溶性发酵培养基煮沸,在4℃静置过夜,4 000r/min离心15min取上清液,每500ml三角瓶中分装50 mL培养基。
1.2 方法 1.2.1 分子克隆链霉菌总DNA的提取参照文献[19]进行。大肠埃希菌DH5α与大肠杆菌ET12567感受态细胞的制备,PCR产物纯化,限制性酶切,DNA连接反应,大肠埃希菌DH5α与大肠杆菌ET12567转化,重组质粒筛选,参照文献[21]进行。PCR反应:采用TaKaRa LA-Taq DNA酶,GC-Ⅰ体系。DNA测序在中美泰和生物技术 (北京) 有限公司完成。
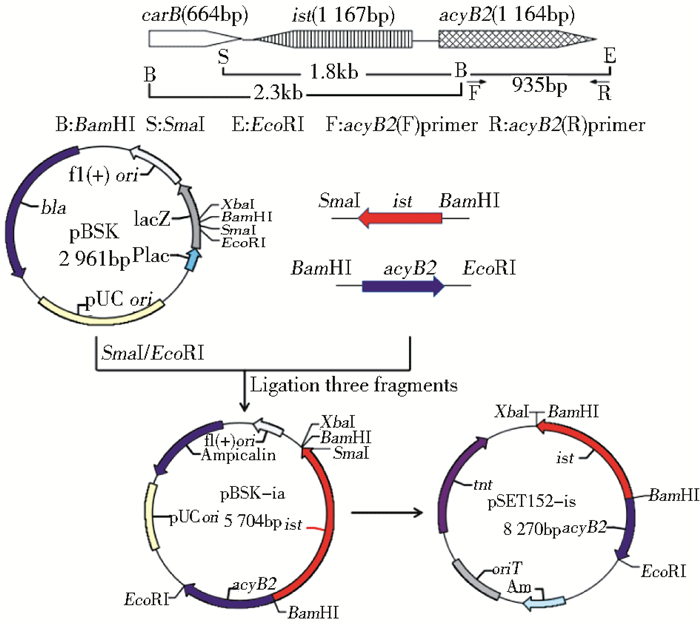
1.2.2 重组质粒pBSK-ia和pSET52-ia的构建ist基因源自本实验室最初构建在pKC1139载体的重组质粒pSW4[1],原来认为此质粒中包含ist和acyB2两个完整的基因,但通过Sma Ⅰ/BamH Ⅰ酶切和测序发现此片段包含ist完整基因和部分acyB2基因。为获得完整的acyB2基因,以耐热链霉菌 (S. thermotolerans CGMCC4.1501) 总DNA为模板,根据NCBI公布的acyB2基因的核苷酸序列 (GenBank Accession No. D31821) 设计引物 (表 1)。利用上游引物为acyB2-F, 在5′端加入BamH Ⅰ酶切位点, 下游引物为acyB2-R,在5′端分别加上EcoR Ⅰ酶切位点,通过PCR获得acyB2基因剩余的约900bp片段,BamH Ⅰ/EcoR Ⅰ双酶切后与包含ist基因的1.8kb Sma Ⅰ/BamH Ⅰ片段一起连入pBluesript Ⅱ SK (+) 载体,获得含完整ist基因和acyB2基因的重组质粒pBSK-ia,并进行DNA测序验证。
| Primer name | Oligonucleotide sequences (5′-3′) |
| acyB2-F | CGCGGATCCCGCTCAGGGACGCAAGACC |
| acyB2-R | CCGGAATTCGCCCCGTGACCTCACCGTC |
| IA-F | CTTCGAGGA ACTCCACGGG |
| IA-R | ACCGTC AGCGGGACAGGG |
| 16S RNA-F | GGTAGAGCTTGTTGACGCAGAG |
| 16S RNA-R | ATGAGGGCGAGGACAGCGATGC |
| ist-F | CGATGGAGAACCGCAGCCGAGC |
| ist-R | CGAGCAGCACGCCGAAGATGAAG |
用Xba Ⅰ/EcoR Ⅰ酶切pBSK-ia重组质粒,得到2.7kb的ist-acyB2连锁基因,通过Xba Ⅰ/EcoR Ⅰ酶切位点连入pSET152载体上,获得含ist-acyB2连锁基因的重组质粒pSET152-ia (图 1)。
|
| 图 1 重组质粒pSET152-ia的构建 Figure 1 The construction of recombinant plasmid pSET152-ia |
具体操作参照文献[19]进行。
1.2.4 菌株筛选、发酵及发酵液的提取摇瓶初筛:挑取转化子于含Am (50μg/ml) 的斜面培养基上,28℃培养10~12天,菌株长好后挖块接种到装量30ml发酵培养基的100ml三角瓶,28℃振荡培养96~120h后,发酵液经离心取上清液稀释,进行埃莎霉素Ⅰ生物活性检测。
摇瓶复筛:挑选一定量的初筛高产菌种,经传代后接种于种子培养基,28℃培养48~52h,以8%的接种量转入发酵培养基 (500ml三角瓶, 装50ml发酵培养基),28℃、96h进行二级摇瓶发酵复筛。
发酵液的提取:发酵液室温3 000r/min离心15min,上清液用1mol/L NaOH调至pH 8.5后,用1/2体积乙酸乙酯萃取,取出酯相于平皿中吹干,用适量甲醇溶解。
1.2.5 抗生素生物效价测定以枯草芽孢杆菌为检定菌,参考《中华人民共和国国药典》2005年版 (二部) 乙酰螺旋霉素微生物检定法[22]。采用杯碟法,用标准曲线法进行测定。参照文献[23]进行菌株摇瓶发酵产量分布的参数分析,计算变势B及菌株发酵产量的稳度和偏度。
1.2.6 Real-time PCR分析用可溶性发酵培养基培养WSJ-2和WSJ-IA菌株,取培养48h、72h、96h和120h的菌丝分别提取总RNA,进行RT-PCR和实时定量PCR分析。以16S RNA作为内参基因 (引物16S RNA-F/R,表 1),对每个样品中的ist基因表达进行定量分析,每个样品做3个重复。以培养48h的WSJ-2中ist的表达量设为1,使用2-ΔΔCt方法计算WSJ-2和WSJ-IA中ist基因在不同培养时间的表达量。SYBR Green Ⅰ染料法进行定量分析,实时定量PCR仪为罗氏公司的LightCycler 96。荧光定量PCR反应条件:96℃预变性3min,96℃变性30s,58℃退火30s,72℃延伸1min,共计35个循环,72℃延伸10min。
1.2.7 高效液相色谱分析发酵液经提取、挥干后溶于色谱纯甲醇,过滤后进样10μl。色谱仪:岛津LC-10ATvp液相色谱仪,二级管阵列检测器。色谱柱:Kromasil C18 (4.5mm×150mm,5μm)。流动相:CH3OH:1% NaH2PO4(55:45);检测波长:231nm;流速:1ml/min;柱温:25℃。以埃莎霉素Ⅰ标准品为对照品,检测并计算埃莎霉素Ⅰ(保留时间为34.534 min) 和螺旋霉素Ⅰ(保留时间为4.376min) 百分含量的比值,以此确定埃莎霉素Ⅰ的相对产量。
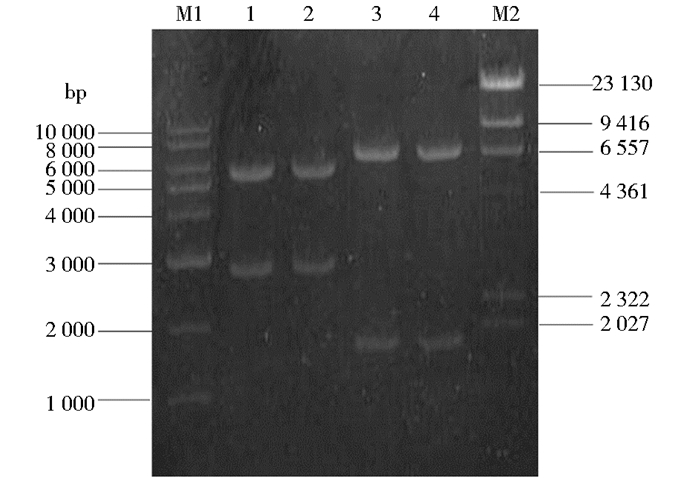
2 结果 2.1 重组质粒pSET152-ia的酶切鉴定和转化pSET152-ia用Xba Ⅰ-EcoR Ⅰ双酶切得到5.5kb和2.7kb两条带,用BamH Ⅰ酶切获得预期的6.4kb和1.8kb两条带,分别与pSET152载体和ist-acyB2连锁基因片段大小相符 (图 2),经过测序也证实2.7kb中包含完整的ist和acyB2基因。
|
| 图 2 重组质粒pSET152-ia的酶切鉴定 Figure 2 Identification of the recombinant plasmid pSET152-ia by restriction enzymes digestion 1, 2: pSET152-ia digested by Xba Ⅰ+EcoR Ⅰ, 3~4: pSET152-ia digested by BamH Ⅰ; M1:1kb ladder Marker; M2: λDNA Hind/Ⅲ Marker |
提取pSET152-ia重组质粒,转化至E. coli ET 12567中使重组质粒去甲基化。利用PEG介导的原生质体转化法将pSET152-ia导入到WSJ-2中,将转化子在含有Am (50μg/ml) 的平板进行传代培养,挑取阳性单克隆用IA-F/R引物 (表 1) 进行PCR,PCR产物测序验证正确。说明ist-acyB2基因通过链霉菌整合型载体pSET152整合进宿主菌WSJ-2染色体中,获得新的重组菌株命名为WSJ-IA。
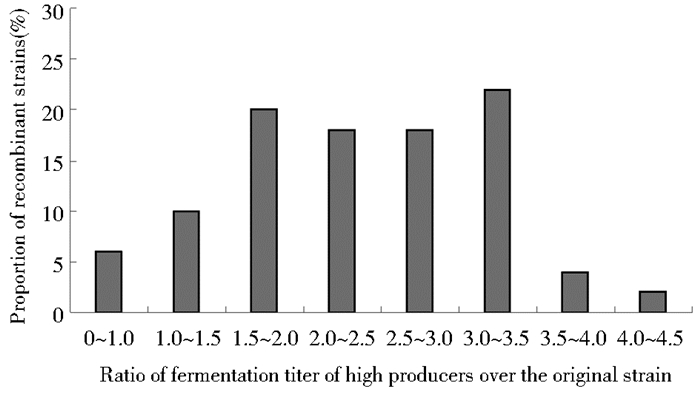
2.2 重组菌株WSJ-IA发酵产量分布的参数分析WSJ-IA发酵产物中的抑菌物质主要是螺旋霉素和酰化螺旋霉素,对408个WSJ-IA转化子先进行摇瓶发酵初筛,微生物法测定菌种发酵效价。根据效价选取50株进行复筛,其与原始菌株WSJ-2效价的比值如图 3所示。50株复筛菌株的效价高于WSJ-2的占94%。
|
| 图 3 重组菌株WSJ-IA产量分布图 Figure 3 Distribution of WSJ-IA recombinant strains with high fermentation titer compared to the original strain |
在发酵变势参数分析 (表 2) 中,可见复筛菌株的效价平均值X为665μg/ml,平均产量的标准差S为237.25,稳度Ct达2.80,偏度CS为-0.28,虽然出现了负偏,但仍使变势B达到741.19。表明调节基因acyB2的引入改变了原始菌株WSJ-2基因群的产量限定性。
| Ratio of fermentation titer of WSJ-IA/WSJ-2 | Number of strains | The proportion of recombinant strains (%) | The parametric analysis |
| 0~1.0 | 3 | 6 | |
| 1.0~1.5 | 5 | 10 | n=50 |
| 1.5~2.0 | 10 | 20 | X=665μg/ml |
| 2.0~2.5 | 9 | 18 | S=237.25 |
| 2.5~3.0 | 9 | 18 | Ct=2.80 |
| 3.0~3.5 | 11 | 22 | 1/ Ct=0.36 |
| 3.5~4.0 | 2 | 4 | Cs=-0.28 |
| 4.0~4.5 | 1 | 2 | B=741.19 |
| Note:n: Number of strains; X: Average titer; S: Standard deviation of average titer; Ct: Degree of stability of titer distribution (X/S); CS: Skewness of titer distribution Σ(Xi-X) 3/n/S3; Variable capacity B=X(6/Ct)1/6(1 + CS/8)1/2 | |||
2.3 重组菌株WSJ-IA的实时定量PCR检测
对WSJ-2和WSJ-IA菌株中ist基因表达进行定量分析,发现两种菌株的ist基因的转录产物在24h时几乎检测不到,因此取培养48h、72h、96h和120h的菌丝进行定量PCR分析 (图 4)。通过2-ΔΔCt方法计算,以WSJ-2培养48h的ist基因表达量的数值设为1。从图 4中可以看出,在不同培养时间,WSJ-IA菌株中ist的表达水平都比WSJ-2的高,WSJ-2在72h时ist的表达量最高,而WSJ-IA菌株是在培养96h达到最高,是WSJ-2的4.7倍左右。

|
| 图 4 Real-time PCR检测WSJ-2和WSJ-IA菌株中ist基因的相对表达量 Figure 4 The relative expression leavel of ist gene in WSJ-2 and WSJ-IA strains detected by Real-time PCR |
WSJ-IA菌株和原始菌株WSJ-2进行发酵培养,经反复筛选WSJ-IA中IA-41号菌株效价最高,达到 (1160±108)μg/ml (表 3),比原始菌株WSJ-2[(280±20)μg/ml]的提高了314%。
| Batch number | Isomycin Ⅰ (peak area%) | Spiramycin Ⅰ (peak area%) | Isomycin Ⅰ/spiramycin Ⅰ(%) | Titer (μg/ml) | |||||||
| IA-41 | WSJ-2 | IA-41 | WSJ-2 | IA-41 | WSJ-2 | IA-41 | WSJ-2 | ||||
| 1 | 29.16 | 15.18 | 13.87 | 17.37 | 210.24 | 87.39 | 1250 | 280 | |||
| 2 | 30.16 | 21.52 | 10.32 | 16.49 | 292.25 | 130.50 | 1190 | 300 | |||
| 3 | 29.93 | 15.64 | 14.56 | 20.56 | 205.56 | 76.07 | 1040 | 260 | |||
| X±S | 29.75±0.52 | 17.45±3.54 | 12.92±2.28 | 18.14±2.14 | 236.02±48.76 | 97.99±28.72 | 1160±108 | 280±20 | |||
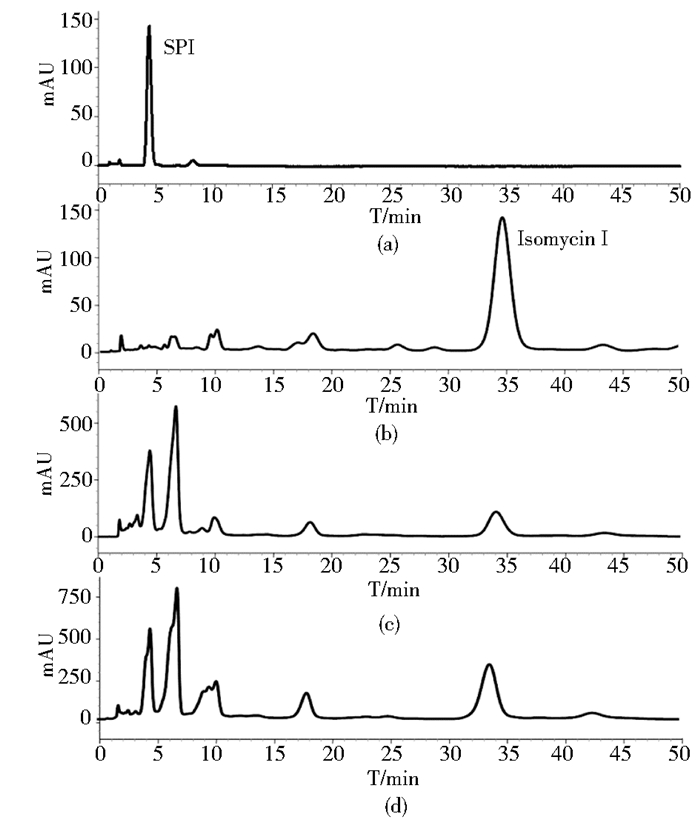
按方法1.2.7对发酵产物进行HPLC分析,计算埃莎霉素Ⅰ的相对产量。HPLC检测发现,螺旋霉素Ⅰ特征峰的保留时间在4.4min左右,埃莎霉素Ⅰ的保留时间为34.5min,保留时间6.6min左右为其它酰化螺旋霉素。从图 5中可以看出,在上样量相同的条件下,IA-41菌株中螺旋霉素和埃莎霉素Ⅰ特征峰的峰高和峰面积都大于WSJ-2的峰值。从表 3的统计中,在IA-41菌株中埃莎霉素Ⅰ占总发酵产物比例为 (29.75±0.52%) 左右,而WSJ-2中埃莎霉素Ⅰ所占比例为 (17.45±3.54)%。从埃莎霉素Ⅰ与螺旋霉素Ⅰ的峰面积比值来看,IA-41菌株中二者比例为 (236.02±48.76)%,在WSJ-2中的比例是 (97.99±28.72)%,IA-41中二者比值是WSJ-2的2.4倍左右,说明其埃莎霉素Ⅰ的相对含量明显高于原始菌株WSJ-2。
|
| 图 5 WSJ-2和IA-41发酵产物的HPLC检测 Figure 5 HPLC detection of the fermentation products from strain WSJ-2 and IA-41 (a) spiramycin Ⅰ(SP Ⅰ) (b) Isomycin Ⅰ (c) WSJ-2 (d) IA-41 |
将IA-41高产菌株在不加Am抗生素的情况下连续传3~4代后,再经加药 (Am, 50μg/ml) 检测,结果表明抗性表达稳定,而且发酵单位也达 (1 220±53)μg/ml,说明外源基因ist-acyB2在WSJ-IA基因组比较稳定,WSJ-IA是一种稳定型基因工程高产菌株。
3 讨论目前BT已完成临床试验研究,进入新药证书申报阶段。构建埃莎霉素Ⅰ单组分产生菌对简化生产工艺、质量控制及制剂改良均有重要价值。本研究利用调节基因acyB2激活ist基因表达的特点,将ist和其正调控基因acyB2同时导入埃莎霉素Ⅰ低产菌株WSJ-2中,通过acyB2的正调控来提高ist的表达量,从而提高由螺旋霉素Ⅰ转化生成埃莎霉素Ⅰ的产量。
S. spiramyceticus是中国医学科学院医药生物技术研究所 (原名为中国医学科学院抗菌素研究所) 从土壤中分离的螺旋霉素产生菌,经初步鉴定可能是一个产螺旋霉素链霉菌新种[24]。在早期构建的BT产生菌的产量较低,除了进行诱变育种外,为了提高ist的表达量,在链霉菌模式菌株S. lividans TK24中测试了多种提高ist基因表达的方法。首先在ist基因前面引入强启动子PermE*后转化到S. lividans TK24中,通过生物转化法可以将外加的螺旋霉素高效转化为必特螺旋霉素[25];另外利用S. mycarofaciens 1748中的正调控基因orf27和orf 28可以调控ist基因在S. lividans TK24中高表达,其转化效率与PermE*调控下的ist基因相当[26],但目前还没有将它们导入S. spiramyceticus中检测ist的表达情况。
S. spiramyceticus中含有螺旋霉素生物合成的正调控基因srm40的同源基因,与acyB2的一致性达到70%[27],在早期构建的BT产生菌中只引入了异源ist基因,因此推测ist基因的激活可能由该菌内的Srm40完成。AcyB2在S. thermotolerans和S. lividans中能激活ist基因表达[13],而在S. spiramyceticus中也可能具有正调控螺旋霉素生物合成的功能。所以在将ist-acyB2连锁基因整合在WSJ-2基因组上后,定量PCR研究显示ist基因表达量明显提高;而且在发酵效价、螺旋霉素和埃莎霉素Ⅰ的产量上WSJ-IA都比WSJ-2要高,说明acyB2既能正调控ist基因表达,也能促进螺旋霉素的生物合成。并通过发酵实验证实WSJ-IA菌株的埃莎霉素Ⅰ产量也比WSJ-2菌株高3倍以上。但通过同源分析发现,在acyB2中并没有DNA结合结构域,因此acyB2的作用机制还需要进一步研究。尽管acyB2提高埃莎霉素Ⅰ产量的作用机制还不清楚,但WSJ-IA高产菌株的构建成功,为埃莎霉素Ⅰ的后续研发奠定了重要基础。
| [1] | Shang G D, Dai J L, Wang Y G. Construction and physiological studies on a stable bioengineered strain of Shengjimycin. J Antibiot (Tokyo), 2001, 54(1) : 66–73. DOI:10.7164/antibiotics.54.66 |
| [2] | 孙丽文, 朱锦桃, 林赴田. 生技霉素药代动力学性能研究. 中国药理学通报, 2000, 16(6) : 694–698. Sun L W, Zhu J T, Lin F T. Pharmacokinetics of SJ-SPM. Chin Pharmacol Bull, 2000, 16(6) : 694–698. |
| [3] | Shi X G, Zhong D F, Sun L. Pharmacokinetics of a novel antibiotic bitespiramycin in rats. Asian J Drug Metabol Pharmacokin, 2003, 3(2) : 134–137. |
| [4] | Shi X G, Sun Y M, Zhang Y F, et al. Tissue distribution of bitespiramycin and spiramycin in rats. Acta Pharmacol Sin, 2004, 25(11) : 1396–1401. |
| [5] | 武临专, 马春燕, 王以光, 等. 螺旋霉素3-O-酰基转移酶基因的删除和主要产生螺旋霉素组分Ⅰ菌株的获得. 生物工程学报, 2007, 23(4) : 612–617. Wu L Z, Ma C Y, Wang Y G. Deletion of spiramycin 3-O-acyltransferase gene from Streptomyces spiramyceticus F21 resulting in the production of spiramycin Ⅰ as major component. Chin J Biotech, 2007, 23(4) : 612–617. DOI:10.1016/S1872-2075(07)60040-5 |
| [6] | Ma C Y, Zhou H X, Li J Y, et al. Construction of 4″-isovalerylspiramycin-I-producing strain by in-frame partial deletion of 3-O-acyltransferase gene in Streptomyces spiramyceticus WSJ-1, the bitespiramycin producer. Curr Microbiol, 2011, 62(1) : 16–20. DOI:10.1007/s00284-010-9664-8 |
| [7] | Li J Y, Ma C Y, Wang H Y, et al. On-line identification of 4″-isovalerylspiramycin Ⅰ in the genetic engineered strain of S. spiramyceticus F21 by liquid chromatography with electrospray ionization tandem mass spectrometry, ultraviolet absorbance detection and nuclear magnetic resonance spectrometry. J Chromatogr A, 2010, 1217(8) : 1417–1424. |
| [8] | Liu G, Chater K F, Chandra G, et al. Molecular regulation of antibiotic biosynthesis in Streptomyces. Microbiol Mol Biol Rev, 2013, 77(1) : 112–143. DOI:10.1128/MMBR.00054-12 |
| [9] | Sevcikova B, Kormanec J. Differential production of two antibiotics of Streptomyces coelicolor A3(2), actinorhodin and undecylprodigiosin, upon salt stress conditions. Arch Microbiol, 2004, 181(5) : 384–389. DOI:10.1007/s00203-004-0669-1 |
| [10] | Anton N, Mendes M V, Martin J F, et al. Identification of PimR as a positive regulator of pimaricin biosynthesis in Streptomyces natalensis. J Bacteriol, 2004, 186(9) : 2567–2575. DOI:10.1128/JB.186.9.2567-2575.2004 |
| [11] | Zhang B, Yang D, Yan Y, et al. Overproduction of lactimidomycin by cross-overexpression of genes encoding Streptomyces antibiotic regulatory proteins. Appl Microbiol Biotechnol, 2016, 100(5) : 2267–2277. DOI:10.1007/s00253-015-7119-7 |
| [12] | Epp J K, Huber M L, Turner J R, et al. Production of a hybrid macrolide antibiotic in Streptomyces ambofaciens and Streptomyces lividans by introduction of a cloned carbomycin biosynthetic gene from Streptomyces thermotolerans. Gene, 1989, 85(2) : 293–301. DOI:10.1016/0378-1119(89)90421-6 |
| [13] | Arisawa A, Kawamura N, Takeda K, et al. Cloning and nucleotide sequences of two genes involved in the 4″-O-acylation of macrolide antibiotics from Streptomyces thermotolerans. Biosci Biotech Bioch, 1993, 57(12) : 2020–2025. DOI:10.1271/bbb.57.2020 |
| [14] | Karray F, Darbon E, Oestreicher N, et al. Organization of the biosynthetic gene cluster for the macrolide antibiotic spiramycin in Streptomyces ambofaciens. Microbiol, 2007, 153(Pt12) : 4111–4122. |
| [15] | Bate N, Butler A R, Gandecha A R, et al. Multiple regulatory genes in the tylosin biosynthetic cluster of Streptomyces fradiae. Chem Biol, 1999, 6(9) : 617–624. DOI:10.1016/S1074-5521(99)80113-6 |
| [16] | Karray F, Darbon E, Nguyen H C, et al. Regulation of the biosynthesis of the macrolide antibiotic spiramycin in Streptomyces ambofaciens. J Bacteriol, 2010, 192(21) : 5813–5821. DOI:10.1128/JB.00712-10 |
| [17] | Stratigopoulos G, Bate N, Cundliffe E. Positive control of tylosin biosynthesis:pivotal role of TylR. Mol Microbiol, 2004, 54(5) : 1326–1334. DOI:10.1111/j.1365-2958.2004.04347.x |
| [18] | Kuhstoss S, Rao R N. Analysis of the integration function of the streptomycete bacteriophage φC31. J Mol Biol, 1991, 222(4) : 897–908. DOI:10.1016/0022-2836(91)90584-S |
| [19] | Kieser T, Bibb M J, Buttner M J. Practical Streptomyces Genetics. Norwich: The John Innes Foundation, 2000: 232-236. |
| [20] | 戴剑漉, 李瑞芬, 武临专, 等. 新一代必特螺旋霉素基因工程菌的微波诱变. 中国抗生素杂志, 2009, 34(7) : 406–410. Dai J L, Li R F, Wu L Z. Improvement of new generation of bitespiramycin producing strain by microwave radiation. Chin J Antibiot, 2009, 34(7) : 406–410. |
| [21] | Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning:A Laboratory Manual. 2nd ed New York: Cold Spring Harbor Laboratory Press, 1989: 20-25. |
| [22] | 国家药典委员会. 中华人民共和国药典.(2005年版二部). 北京: 化学工业出版社, 2005. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Volume 2. Beijing: Chemical Industry Press, 2005. |
| [23] | 刘垂玗. 微生物菌株的参数分析. 微生物学报, 1980, 20(2) : 166–172. Liu C Y. The parametric analysis on microbial strains. Acta Microbiol Sin, 1980, 20(2) : 166–172. |
| [24] | 于其伟. 一株产生螺旋霉素的链霉菌新种. 微生物学报, 1982, 22(1) : 13–16. Yu Q W. A new species of Streptomyces producing spiramycin. Acta Microbiol Sin, 1982, 22(1) : 13–16. |
| [25] | 杨永红, 赫卫清, 李瑞芬, 等. 利用强启动子PermE*提高4″-异戊酰基转移酶基因在变铅青链霉菌TK24中对螺旋霉素的4″-异戊酰化水平. 中国抗生素杂志, 2010, 35(11) : 826–830. Yang Y H, He W Q, Li R F, et al. Incorporation of PermE*, a strong promoter, at 5'-upstream of 4″-isovaleryltransferase gene improves the bioconversion of spiramycin to 4″-isovaleryspiramycin in Streptomyces lividans TK24. Chin J Antibiot, 2010, 35(11) : 826–830. |
| [26] | 张家瑚, 钟晶晶, 戴剑漉, 等. 耐热链霉菌4″-O-异戊酰基转移酶基因在变铅青链霉菌TK24中的表达. 生物工程学报, 2014, 30(9) : 1390–1400. Zhang J H, Zhong J J, Dai J L, et al. Expression of 4″-O-isovaleryltransferase gene from Streptomyces thermotolerans in Streptomyces lividans TK24. Chin J Biotech, 2014, 30(9) : 1390–1400. |
| [27] | 王以光, 姜洋, 赵小峰, 等. 可利霉素生物合成基因簇: 中国, CN201511028754. 2016-04-20. Wang Y G, Jiang Y, Zhao X F, et al. Biosynthetic Gene Cluster of Carrimycin:Chinese, CN201511028754.2016-04-20. |
 2017, Vol. 37
2017, Vol. 37




