文章信息
- 孙文佳, 姚宇峰, 杨旭, 黄惟巍, 刘存宝, 龙琼, 褚晓杰, 马雁冰.
- SUN Wen-jia, YAO Yu-feng, YANG Xu, HUANG Wei-wei, LIU Cun-bao, LONG Qiong, CHU Xiao-jie, MA Yan-bing.
- 乙肝核心抗原病毒样颗粒呈现HPV 16L1抗原表位及特异抗体诱导
- Presentation of HPV 16L1 Peptide-based HBcAg Virus-like Particle and Induction of Specific Antibody
- 中国生物工程杂志, 2017, 37(3): 58-64
- China Biotechnology, 2017, 37(3): 58-64
- http://dx.doi.org/DOI:10.13523/j.cb.20170308
-
文章历史
- 收稿日期: 2016-09-22
- 修回日期: 2016-11-12
人乳头瘤病毒 (human papillomavirus,HPV) 是一类无包膜的双链DNA病毒。高危型HPV感染是多种癌症发生发展的主要原因,约99.7%的宫颈癌及癌前病变中可检测到HPV感染[1]。宫颈癌在妇女癌症发病率中具第二位,发展中国家发生率明显高于发达国家,我国新增宫颈癌患者以每年15万人的速度增长,且年轻患者比率上升明显,死亡人数每年在5万左右[2]。因此,HPV疫苗的研究及应用具有重要意义。目前国际上已有Merk公司的四价、九价HPV疫苗和GSK公司的二价疫苗上市。该类疫苗制备成本高,疫苗推广接种受到一定限制,同时具有型别特异性,不能对非疫苗基因型病毒产生交叉保护作用。因此,研发具有广谱保护效果、价格低廉的新型疫苗需求迫切,尤其是对于经济落后的发展中国家而言尤为重要。
天然HPV呈正二十面体对称结构,衣壳蛋白由主要衣壳蛋白L1和次要衣壳蛋白L1组成。L1蛋白在病毒感染细胞初期具有重要作用,参与细胞表面受体的相互作用[3-4]。多种表达系统来源的L1蛋白在特定条件下可独自组装成与天然HPV病毒高度相似的类病毒样颗粒 (virus like particle, VLP)[5]。动物实验表明,其L1 VLPs具有较高免疫原性,能够诱导机体产生高滴度的HPV中和抗体[6]。因此,L1蛋白被认为是预防性疫苗的主要抗原,利用不同表达系统表达L1蛋白并组装成VLP是HPV预防性疫苗的主要研究方向[7]。
有研究显示,保护性的抗原肽免疫激发的抗体同样可以有效阻止HPV的感染并对多型别HPV都可以发挥保护作用。然而抗原肽免疫原性弱,需要采取有效策略,如佐剂及载体的应用来促进抗体诱导。乙肝病毒核心抗原 (hepatitis B virus core antigen,HBcAg) 具有在原核细胞中高效表达并自我组装成VLP的能力,可赋予抗原肽高免疫原性。本研究将HPV 16L1保守区域抗原表位QPLGVGISGHPLLNKLDDTE插入到HBcAg优势抗原表位区域,探讨嵌合VLPs的装配能力及免疫原性,为开发低成本的HPV疫苗及制备特异抗体提供了一个新的途径。
1 材料与方法 1.1 质粒与菌株质粒pThioHisA购自美国Invitrogen公司;大肠杆菌 (E.coli) DH5α、BL21购自北京全式金生物技术有限公司;表达HPV 16L1的酵母菌由本室构建并保存。质粒pHBcAg由本室构建并保存,其是将HBcAg基因克隆于pThioHisA表达载体的Nde Ⅰ和Pst Ⅰ之间,通过基因改造允许外源蛋白或肽段基因经BamH Ⅰ和EcoR Ⅰ插入HBcAg优势抗原表位 (78与79氨基酸之间)。
1.2 主要试剂及仪器DNA marker、r Taq多聚酶、T4 DNA连接酶、限制性内切核酸酶购自宝生物 (大连) 工程有限公司;质粒抽提试剂盒、DNA凝胶回收试剂盒及PCR产物纯化试剂盒购自北京天根生化科技有限公司;IPTG购自生工生物工程 (上海) 股份有限公司;HPV 16L1通用型单克隆抗体CAMVIR-1(sc-47699) 及HRP标记的羊抗鼠IgG-HRP二抗 (sc-2055) 购自美国Santa Cruz公司;Western blot显色底物Pierce ECL购自美国Thermo公司;Sephadex G-25填料购自美国GE公司;其他试剂均为国产分析纯。
1.3 HPV 16L1抗原表位寡聚核苷酸序列的合成HPV 16L1抗原表位选择文献报道的编码其寡聚核苷酸序列由生工生物工程 (上海) 股份有限公司合成。
1.4 实验动物SPF级别BALB/c小鼠,雌性,6~8周龄,体重16~18g,购自昆明医科大学动物实验中心。
1.5 重组质粒pHBcAg16L1的构建编码抗原肽的正负寡聚核苷酸片段以0.1mmol/L的浓度1:1混合,总体积10μl,在95℃条件下变性30s,缓慢冷却至室温退火复性,从而形成双链DNA片段。用BamH Ⅰ和EcoR Ⅰ酶切质粒pHBcAg,胶回收载体片段,在T4 DNA连接酶作用下,载体与片段室温连接2h,产物转化大肠杆菌DH5α感受态,并涂布于含100μg/ml氨苄青霉素的LB平板,37℃过夜培养后挑取单菌落,摇菌并提取质粒,以Pst Ⅰ/Nde Ⅰ,Pst Ⅰ/EcoR Ⅰ,Nde Ⅰ/EcoR Ⅰ三组酶进行双酶切鉴定,酶切片段大小正确的质粒送至生工生物工程 (上海) 股份有限公司进行测序。
1.6 目的基因的诱导表达重组质粒转化大肠杆菌BL21感受态,挑取单菌落并接种至含100μg/ml氨苄青霉素的LB液体培养基中,37℃、220r/min过夜培养,然后将菌液按5%转接至新LB液体培养基内,37℃、280r/min培养至菌液OD600值为0.5时,加入浓度为1mmol/L的IPTG诱导4h,表达产物经15%的SDS-PAGE进行分离鉴定。
1.7 表达产物Western blot鉴定将诱导后收获的菌液及超声收集样品经15% SDS-PAGE分离后转移至PVDF膜上,用含5%脱脂奶粉的1×TBST室温封闭1h;加入鼠抗HPV16L1单克隆抗体 (1:500稀释),室温孵育1h;1×TBST洗涤3次,每次5min;加入HRP标记的兔抗鼠IgG (1:10 000稀释),室温孵育1h;1×TBST洗涤3次,每次5min,1×TBS洗涤2次,每次5min。ECL显色,X线底片曝光分析结果。
1.8 重组蛋白硫酸铵沉淀纯化收集的菌体用20mmol/L的PBS缓冲液重悬,冰浴超声破碎,4℃,12 000g离心20min,上清液用40%饱和度硫酸铵室温沉淀30min,12 000g,收集沉淀,用20%饱和度硫酸铵洗涤3次,最后用20mmol/L的PBS缓冲液重悬,12 000g离心10min,收集上清液,反复加入PBS直至沉淀全部溶解。
1.9 重组蛋白蔗糖密度梯度超速离心纯化在超速离心管中预先铺好蔗糖浓度梯度,从上至下蔗糖密度分别为10%、20%、30%、40%、50%,每层1.8ml,将硫酸铵初步纯化的蛋白质样品2ml加至蔗糖密度最上层,40 000g、4℃离心4h,离心后的样品从上至下逐层取样,每层1ml,每层样品进行SDS-PAGE分析。随后用Sephadex G25凝胶层析进行脱盐备用。
1.10 病毒样颗粒的高效液相色谱分析将密度梯度离心后的样品取20μl进行高效液相色谱 (HPLC) 分析,填料为SRT SEC-1000,流速为0.2ml/min,流动相为PBS。根据出峰时间鉴定病毒样颗粒及其纯度。
1.11 电于显微镜观察将密度梯度离心后的样品经磷钨酸负染后,电子显微镜观察病毒样颗粒 (VLPs)。
1.12 动物分组及免疫选8只BALB/c小鼠随机分为2组:HPV 16L1组 (蛋白质含量为100μg)、HBcAg病毒样颗粒载体pHBcAg组 (对照组,蛋白质含量100μg), 每组4只。分别于0周、2周、4周经皮下免疫小鼠,0.2ml/只,分别于每次免疫后1周经腿静脉采血,分离血清。3次免疫结束后,麻醉小鼠,心脏采血,分离血清。
1.13 Western blot检测抗血清识别HPV 16L1用本室构建的表达HPV 16L1蛋白的酵母菌蛋白样品,经12% SDS-PAGE分离,转移至PVDF膜上,用含5%脱脂奶粉的1×TBST室温封闭1h;抗血清 (1:500稀释) 室温孵育1h;1×TBST洗涤3次,每次5min;加入HRP标记的兔抗鼠IgG (1:10 000稀释),室温孵育1h;1×TBST洗涤3次,每次5min,1×TBS洗涤2次,每次5min,ECL显色,X线底片曝光分析结果。
2 结果 2.1 重组质粒的酶切鉴定重组质粒分别用Pst Ⅰ/Nde Ⅰ,Pst Ⅰ/EcoR Ⅰ,Nde Ⅰ/EcoR Ⅰ进行双酶切,预计产物大小分别为500bp、270bp、230bp。2%琼脂糖凝胶电泳分析结果显示,所获得的目的片段条带大小与预期相符,见图 1。经测序后证明,L1抗原肽DNA片段的序列与插入构建正确。

|
| 图 1 重组质粒酶切鉴定的琼脂糖凝胶电泳图 Figure 1 Identification of recombinant plasmids by restriction enzyme digestion M:DNA Marker DL1 000;1:Recombinant plasmids digested by Pst Ⅰ/Nde Ⅰ; 2:Recombinant plasmids digested by Pst Ⅰ/EcoR Ⅰ; 3:Recombinant plasmids digested by Nde Ⅰ/EcoR Ⅰ |
HBcAg载体蛋白理论分子质量约为17.5kDa,重组的HBcAg/L1抗原肽嵌合蛋白的理论分子质量约为19kDa。经SDS-PAGE分析表明,对比诱导前菌体蛋白条带,IPTG诱导后菌体有特异蛋白表达条带出现,其相对分子质量大小与预期的目的蛋白相符,见图 2。

|
| 图 2 SDS-PAGE分析目的蛋白经IPTG诱导表达结果 Figure 2 Analysis of the expression of recombinant protein by SDS-PAGE M:Protein marker; 1:HBcAg/L1 induced by IPTG for 4h;2:HBcAg/L1 induced by IPTG for 0h;3:pHBcAg induced by IPTG for 4h;4:pHBcAg induce by IPTG for 0h |
Western blot分析显示,诱导表达的HBcAg/L1抗原肽嵌合蛋白能够被商业化的HPV 16 L1单克隆抗体 (克隆号:CAMV) 特异识别,在相对分子质量19kDa处可见特异性反应条带,而诱导表达HBcAg的菌体蛋白样品未见明显特异性条带,见图 3。
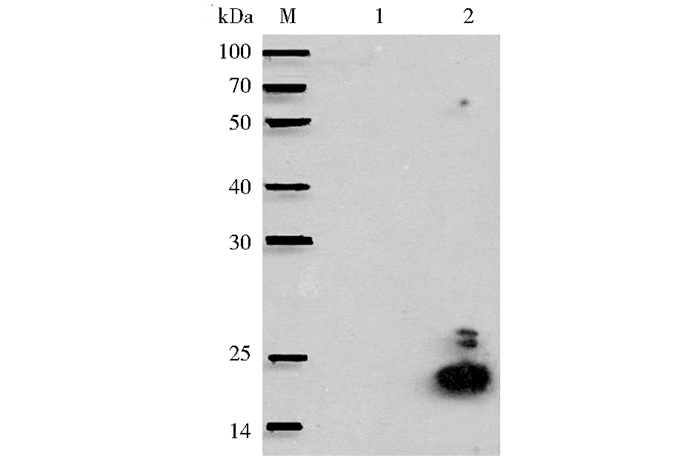
|
| 图 3 重组的HBcAg/L1抗原肽嵌合蛋白的抗原特异性鉴定 Figure 3 Analysis of recombinant protein by Western blot M:Protein marker; 1:pHBcAg induced by IPTG; 2:HBcAg/L1 induced by IPTG |
菌体超声破碎后,上清液经40%饱和度的硫酸铵盐析及20%饱和度的硫酸铵洗涤,进行蛋白质初步纯化。15%的SDS-PAGE分析显示,目的蛋白获得了有效的纯化,见图 4。
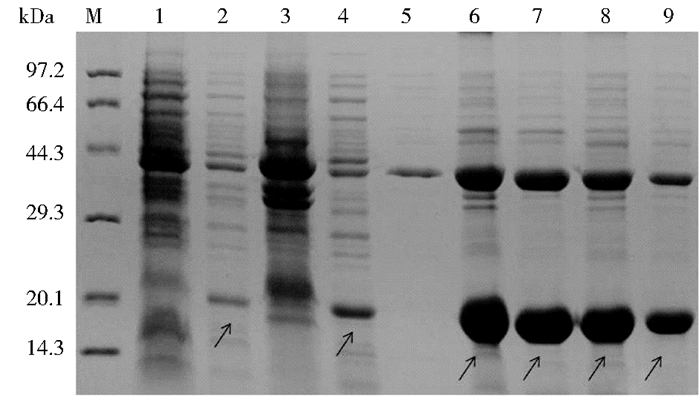
|
| 图 4 SDS-PAGE分析目的蛋白经IPTG诱导的表达及硫酸铵盐析法初步纯化结果 Figure 4 Ammonium sulfate deposition analysis of recombinant protein M:Protein Marker; 1:HBcAg/L1 induced by IPTG for 0h;2:HBcAg/L1 induced by IPTG for 4h;3:Ultrasonic precipitation; 4:Ultrasonic supernatant; 5~9:After ammonium sulfate precipitation HBcAg/L1 dissoluted by PBS |
硫酸铵初步纯化后的蛋白质样品经蔗糖密度梯度超速离心进一步纯化,用15%的SDS-PAGE分析显示,目的蛋白主要集中在4~7层,见图 5。此外,其行为与原始的HBcAg一致,提示重组HBcAg/L1抗原肽嵌合蛋白以病毒样颗粒存在。
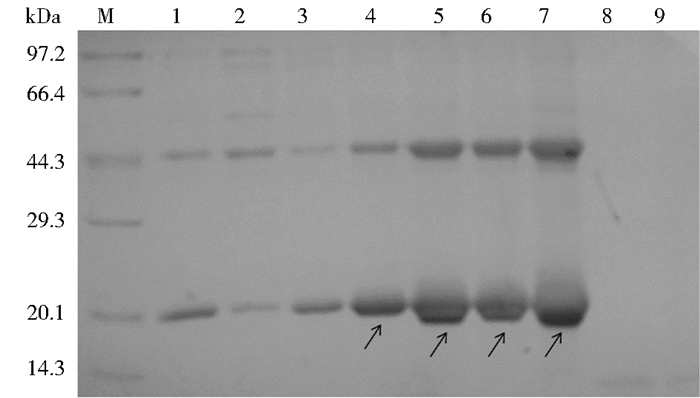
|
| 图 5 蔗糖密度梯度离心的SDS-PAGE分析 Figure 5 Sucrose density gradient centrifugation analysis of recombinant protein M:Protein marker; 1~9:Pipe solution of sucrose density gradient centrifugation from top to bottom |
将蔗糖密度梯度离心后收集的每层样品利用HPLC (SRT SEC-1000柱) 进行分析。结果显示,蔗糖密度梯度离心的4~7层蛋白质样品在0.2ml/min流速下,洗脱时间在25min左右,与原始HBcAg一致,见图 6,提示这些蛋白质样品以病毒样颗粒的形式存在。

|
| 图 6 病毒样颗粒的HPLC凝胶过滤分析 Figure 6 HPLC analysis of VLPs |
经透射电子显微镜观察,携带L1抗原表位的嵌合HBcAg形成直径约30nm的病毒样颗粒,形态与原始HBcAg形成的颗粒相似,见图 7。

|
| 图 7 病毒样颗粒的电子显微镜观察 Figure 7 Electronic microscopy of VLPs |
本科室先前制备的表达HPV 16 L1的毕赤酵母菌体蛋白样品经SDS-PAGE分离、转膜,并行样品泳道分离后以HBcAg/L1抗原肽VLPs免疫小鼠后血清进行检测,同时,以商业化HPV 16L1单克隆抗体 (CAMV) 作为阳性对照,而以HBcAg免疫小鼠的血清作为阴性对照。不同抗体反应膜重新拼接后统一以X线片曝光。结果显示,HBcAg/L1抗原肽VLPs免疫血清与商业化的抗体显示了相似的特异蛋白反应条带,而HBcAg免疫血清无特异反应条带,见图 8。
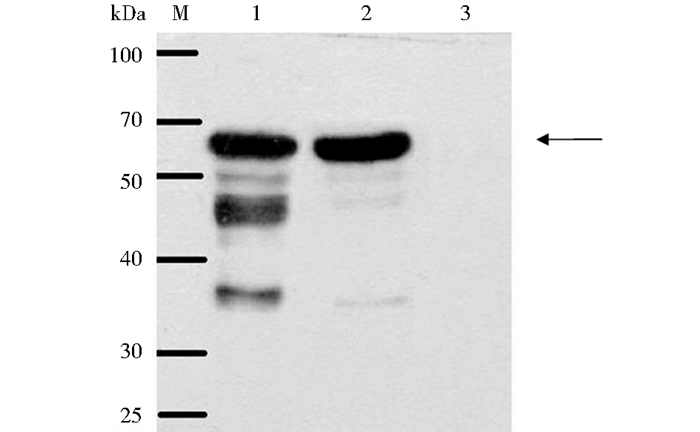
|
| 图 8 Western blot检测HBcAg/L1抗原肽VLPs的免疫血清对L1蛋白的特异识别 Figure 8 Analysis of anti-HBcAg/L1 VLPs antibody in mouse sera by Western blot M:Protein marker; 1:HPV16 L1 antibody (CAMVIR-1);2:HBcAg/L1 VLPs antibody; 3:HBcAg VLPs antibody |
据统计,HPV导致的癌症占全世界癌症的5.2%[8],严重危害妇女健康。由于尚未成功在体外培养繁殖HPV,因此至今没有适合HPV复制的细胞模型,无法从传统途径研发HPV预防性疫苗。由于重组HPV L1蛋白可以自组装成与天然HPV颗粒相似的病毒样颗粒 (VLPs),刺激机体产生特异性中和抗体IgG和IgA,因此目前HPV预防性疫苗研发热点主要集中在以基因工程技术制备的HPV病毒样颗粒 (VLPs) 疫苗。目前上市的两个商业化HPV疫苗均采用衣壳蛋白L1作为主要抗原成分,由于L1蛋白在昆虫细胞及酵母细胞表达系统中表达量低,制备及纯化工艺复杂,生产成本高[9]。因此研发具有广谱效果、价格低廉的新型HPV预防性疫苗势在必行。
有研究显示,HPV L1 VLPs表面具有线性和构象性表位,识别构象依赖性的中和抗体表位由单一的loop区组成,而L1五聚体晶体结构上BC、DE、EF、HI和FG loop区均暴露在五聚体的表面,这5个loop区是HPV中和表位的重要区域[10]。DE loop是一个线性表位,具有组装成可识别VLPs的能力[11],它在很多HPV型别中靠近重要的主要中和表位区域[12]。最近有结构功能研究显示,HPV 16型主要中和表位的Fab与病毒衣壳作用的优势结合涉及主要衣壳蛋白表面的多个loop区,DE loop是主要中和表位的核心组成部分[13],也是产生针对L1中和抗体活性的重要区域[14]。HPV11、HPV16、HPV18、HPV35四型别L1蛋白DE loop区序列高度同源[15]。已有研究表明,该表位针对HPV16、HPV18、HPV33、HPV35、HPV45、HPV55、HPV59型具有交叉中和反应活性[16-17]。后续研究显示,DE loop可能与L2蛋白存在相互作用,通过模拟HPV L2结构,利用结构预测软件分析L1/L2相互作用区域,结果显示L1的DE、FG loop的C端和L2发生相互作用[18-19]。目前提呈具有免疫原性L2表位疫苗的新策略是将L2肽段插入到HPV L1 VLPs中。已有研究将RG1——识别HVP线性中和表位的L2表位插入到HPV-16 L1或HPV 18L1病毒颗粒DE loop表面,形成嵌合型L1/L2 VLP疫苗,可产生针对L1和L2的型特异性抗体[20]。另有研究发现,将L2表位插入DE loop后形成的嵌合型L1/L2 VLP疫苗可以产生针对多个型别HPV (HPV-6、HPV-11、HPV-16、HPV-31、HPV-35、HPV-39、HPV-45、HPV-58、HPV-59) 的中和抗体[21]。
本研究根据已有研究结果,选取HPV 16L1 DE loop保守序列作为目的片段,具有良好的有效干预HPV感染应用前景。然而,肽表位普遍免疫原性较弱,本研究采用重组乙肝病毒核心抗原HBcAg作为疫苗载体,其优势为:①可在大肠杆菌中高效表达,并自我组装成VLPs;②易于纯化、制备;③纳米颗粒结构使抗原表位高度有序重复排列,赋予了肽表位强免疫原性;④纳米颗粒可向淋巴结迁移,有利于更多DCs的抗原摄取、加工、提呈;⑤VLPs可包裹核酸刺激物等,利于免疫系统的激活。通过改造乙肝表面核心抗原HBcAg序列,将来自DE loop区的保守抗原肽QPLGVGISGHPLLNKLDDTE插入到HBcAg,为保证疫苗蛋白的VLPs形式存在,本研究经高效液相色谱鉴定目的蛋白纯度及VLPs,同时通过电子显微镜观察,证明已获得大量结构完整的HPV 16L1 VLPs。用商业化抗体检测,已证明针对HPV 16L1,该VLPs具有良好的抗原特异性。小鼠免疫结果显示,该重组蛋白具有良好的免疫原性,为研发价格低廉、制备及纯化工艺简单的新型HPV预防性疫苗提供了新途径。
| [1] | Munoz N, Bosch F X, Castellsagué X, et al. Against which human papillomavirus types shall we vaceinate and serene the international perspective. Int J Cancer, 2004, 111(2) : 278–285. DOI:10.1002/ijc.20244 |
| [2] | Parkin D M, Bray F, Ferlay J, et al. Global cancer statistics, 2002. CA Cancer J Clin, 2005, 55(2) : 74–108. DOI:10.3322/canjclin.55.2.74 |
| [3] | Richards K F, Bienkowska-Haba M, Dasgupta J, et al. Multiple heparin sulfate binding site engagements are required for the infectious entry of human papillomavirus type 16. J Virol, 2013, 87(21) : 11426–11437. DOI:10.1128/JVI.01721-13 |
| [4] | Buck C B, Day P M, Trus B L. The papillomavirus major capsid protein L1. Virology, 2013, 445(1) : 169–174. |
| [5] | Lin L C, Lee T H, Chang C H, et al. Predictors of clinical deterioration during hospitalization following acute ischemic stroke. Eur Neurol, 2012, 67(3) : 186–192. DOI:10.1159/000334723 |
| [6] | Harro C D, Pan Y Y, Roden R B, et al. Safety and immunogenicity trial in adult volunteers of a human papillomavirus 16L1 virus-like particle vaccine. J Natl Cancer Inst, 2001, 93(4) : 284–292. DOI:10.1093/jnci/93.4.284 |
| [7] | Cardone G, Moyer A L, Cheng N, et al. Maturation of the human papillomavirus 16 capsid. Mbio, 2014, 5(4) : 1104–1114. |
| [8] | De M C, Ferlay J, Franceschi S, et al. Global burden of cancers attributable to infections in 2008:a review and synthetic analysis. Lancet Oncol, 2012, 13(6) : 607–615. DOI:10.1016/S1470-2045(12)70137-7 |
| [9] | Roden R, Wu T C. How will HPV vaccines affect cervical cancer. Nat Rev Cancer, 2006, 6(10) : 753–763. DOI:10.1038/nrc1973 |
| [10] | Fleury M J, Touzé A, Maurel M C, et al. Identification of neutralizing conformational epitopes on the human papillomavirus type 31 major capsid protein and functional implications. Protein Sci, 2009, 18(7) : 1425–1438. DOI:10.1002/pro.156 |
| [11] | Christensen N D, Dillner J, Eklund C, et al. Surface conformational and linearepitopes on HPV-16 and HPV-18 L1 virus-like particles as defined by monoclonal antibodies. Virology, 1996, 223(1) : 174–184. DOI:10.1006/viro.1996.0466 |
| [12] | Christensen N D, Cladel N M, Reed C A, et al. Hybrid papillomavirus L1 molecules assemble into virus-like particles that reconstitute conformational epitopes and induce neutralizing antibodies to distinct HPV types. Virology, 2001, 291(2) : 324–334. DOI:10.1006/viro.2001.1220 |
| [13] | Guan J, Bywaters S M, Brendle S A, et al. Structural comparison of four different antibodies interacting with human papillomavirus 16 and mechanisms of neutralization. Virologym, 2015, 483 : 253–263. DOI:10.1016/j.virol.2015.04.016 |
| [14] | Lin Xia, Yangfei Xian, Daning Wang, et al. A human monoclonal antibody against HPV16 recognizes an immunodominant and neutralizing epitope partially overlapping with that of H16.V5. Sci Rep, 2016, 11(6) : 19042. |
| [15] | Brooke B, Jhimli D, Michael K, et al. Crystal structures of four types of human papillomavirus L1 capsid proteins. The Journal of Biological Chemistry, 2007, 282(43) : 31803–31811. DOI:10.1074/jbc.M706380200 |
| [16] | Ludmerer S W, Benincasa D, Mark G E. Two amino acid residues confer type specificity to a neutralizing, conformationally dependent epitope on human papillomavirus type 11. J Virol, 1996, 70(7) : 4791–4794. |
| [17] | Combita A L, Touzé A, Bousarghin L, et al. Identification of two cross-neutralizing linear epitopes within the L1 major capsid protein of human papillomaviruses. J Virol, 2002, 76(13) : 6480–6486. DOI:10.1128/JVI.76.13.6480-6486.2002 |
| [18] | Chen X S, Garcea R L, Goldberg I, et al. Structure of small virus-like particles assembled from the L1 protein of human papillomavirus 16. Mol Cell, 2000, 5(3) : 557–567. DOI:10.1016/S1097-2765(00)80449-9 |
| [19] | Lowe J, Panda D, Rose S, et al. Evolutionary and structural analyses of alpha-papillomavirus capsid proteins yields novel insights into L2 structure and interaction with L1. Virol J, 2008, 5(1) : 1. DOI:10.1186/1743-422X-5-1 |
| [20] | Schellenbacher C, Kwak K, Fink D, et al. Efficacy of RG1-VLP vaccination against infections with genital and cutaneous human papillomaviruses. J Invest Dermatol, 2013, 133(12) : 2706–2713. DOI:10.1038/jid.2013.253 |
| [21] | Boxus M, Fochesato M, Miseur A, et al. Broad cross-protection is induced in preclinical models by a human papillomavirus vaccine composed of L1/L2 chimeric virus-like particles. J Virol, 2016, 90(14) : 6314–6325. DOI:10.1128/JVI.00449-16 |
 2017, Vol. 37
2017, Vol. 37




