文章信息
- 吴孟玲, 周嘉旺, 杜军.
- WU Meng-ling, ZHOU Jia-wang, DU Jun.
- Nodal检测双单抗夹心ELISA法建立及应用
- Development and Application of A Double Monoclonal Antibody Sandwich ELISA for the Assay of Nodal
- 中国生物工程杂志, 2017, 37(3): 51-57
- China Biotechnology, 2017, 37(3): 51-57
- http://dx.doi.org/DOI:10.13523/j.cb.20170307
-
文章历史
- 收稿日期: 2016-12-26
- 修回日期: 2017-01-16
肿瘤标志物 (tumor marker) 是肿瘤细胞本身存在或分泌的特异性物质,可以反映出肿瘤的发生发展过程,在肿瘤的筛查和治疗过程中起重要指导作用[1]。目前已发现100多种肿瘤标志物,常用的有20余种,肿瘤标志物在肿瘤的普查、预测、定位、确诊、分期、疗效监测及预后分析过程中都发挥着重要作用[2]。
Nodal是转化生长因子-β(transforming growth factor-β,TGF-β) 超家族成员之一,是一种进化保守的信号分子,在脊椎动物胚胎发育过程中的中胚层诱导、神经外胚层沿前后轴线的分化、左右不对称性的建立等方面起重要作用[3]。Nodal在胚胎期呈现高表达,之后逐渐减少,除子宫内膜等生殖系统组织外,成体组织几乎不再表达Nodal[4]。近年来,人们发现Nodal对细胞凋亡、肿瘤的发生、恶性肿瘤的迁徙有重要影响,并发现Nodal几乎在所有肿瘤细胞中表达[5]。在前期研究中,13种不同组织来源的30个肿瘤细胞株检测出的Nodal在mRNA及蛋白质水平均为高表达,免疫组织化学结果显示Nodal在乳腺癌、卵巢癌、结肠癌和直肠癌的标本中高表达,而正常组织均为阴性[6]。同时,Nodal作为一个分泌型蛋白,可通过人体体液 (如血清) 检出,因此Nodal具备作为新型肿瘤标志物的良好潜质,可以作为肿瘤临床诊断检测与跟踪治疗的重要指标[7]。
作为一个新型的肿瘤标志物,尚未有应用于Nodal的准确有效的高灵敏度检测手段,严重阻碍了Nodal临床应用价值的发挥,亟待建立相应的定性定量检测方法。酶联免疫吸附测定法 (enzyme linked immunosorbent assay, ELISA) 由瑞典Engvall等于1971年建立[8],通过固相载体吸附蛋白,结合酶标显色技术,从而检测样品中的抗原与抗体。该方法灵敏度高、特异性强、操作简便且易于定量检测,广泛应用于科学研究及医疗检测[9-10]。双抗夹心ELISA一般采用多抗作为捕获抗体,单克隆抗体作为检测抗体进行检测,本次实验中采用配对单克隆抗体建立双单抗夹心ELISA法,与一般多抗-单抗夹心ELISA法相比具有更高的特异性和批次稳定性,理论上具有更良好的临床应用效果。
1 材料与方法 1.1 主要试剂5周龄雌性BALB /c小鼠 (广东省医学动物实验中心);PEG1450溶液 (Sigma-Aldrich);小鼠骨髓瘤细胞SP2/0、A549及A549-Nodal细胞 (实验室构建保存);HAT 50×(Sigma-Aldrich);HT 50×(Sigma-Aldrich);HRP标记山羊抗小鼠IgG Fc端抗体 (北京义翘神州);弗氏完全佐剂 (Sigma-Aldrich);弗氏不完全佐剂 (Sigma-Aldrich);小鼠单克隆抗体亚类鉴定试剂盒 (郑州百基);标准Nodal (R & D);Nodal抗体WS65;牛血清白蛋白 (Sigma-Aldrich);FITC标记羊抗小鼠荧光二抗 (ABclonal);HRP-Biotin (Thermo Fisher);HRP-Streptavidin Conjugate (Thermo Fisher);EZ-Link NHS-PEG4-Biotinylation Kit (Thermo Fisher);rProtein G预装柱 (广州精达);TMB显色液 (碧云天);96孔酶标板 (Corning)。
1.2 主要仪器细胞培养箱 (Thermo);超净工作台;倒置显微镜 (Nikon);低温离心机 (Beckman Coulter);酶标仪 (Bio-Rad);流式细胞仪;微量可调移液器 (Eppendorf)
1.3 方法 1.3.1 Nodal重组蛋白表达及纯化(1) Nodal表达[11]:取甘油保存菌种以LB培养基扩大培养至菌液OD值为0.4~0.6,加入IPTG (1mmol/L) 诱导2~3h。收集菌体超声破碎至充分裂解,得到包涵体沉淀用1%SDS溶解即得到包涵体表达Nodal。
(2) Nodal纯化:包涵体蛋白进行SDS-PAGE凝胶电泳,浸入0.3mol/L KCl溶液冰浴孵育5min,目的蛋白被染为非透明白色条带,约15kDa,切下捣碎后置于3kDa透析袋中继续电泳,收集透析袋内溶液以PBS透析,4℃过夜。12 000r/min离心去除沉淀,上清液用3kDa超滤管浓缩,即得高纯度Nodal。
1.3.2 实验动物免疫及细胞融合(1) BALB/c小鼠5周左右,以纯化Nodal作为抗原,采用皮下多点注射免疫,初次免疫时抗原100μg/150μl/只,与等体积弗氏完全佐剂混合乳化注射,后续加强免疫采用半剂量抗原与等体积弗氏不完全佐剂混合乳化注射,重复3~5次即可,免疫完成后取血清用间接ELISA测定效价。
(2) 以小鼠腹腔巨噬细胞为饲养细胞预先铺入96孔培养板,脾细胞与SP2/0细胞按细胞数5:1比例经PEG诱导融合,用HAT完全培养基重悬融合后细胞,铺入5~10块96孔板,置于37℃,5%CO2培养箱中培养,适时补加HAT培养基。约1周后可见明显细胞克隆团,用HT培养基替换HAT培养基,继续培养至克隆团细胞数1 000个以上。
1.3.3 杂交瘤筛选96孔酶标板包被Nodal (5μg/ml), 利用间接ELISA法测定克隆团培养上清液,取阳性克隆进行有限稀释法挑取单克隆。至少重复此步骤3次,得到稳定分泌抗体的单克隆杂交瘤细胞。
1.3.4 单克隆抗体生物亚型及活性鉴定(1) 单克隆抗体亚型鉴定:96孔酶标板采用间接ELISA法测定杂交瘤培养上清液,分别加入抗小鼠IgG1、IgG2a、IgG2b、IgG3、IgM、IgA酶标二抗孵育,判断抗体亚类。
(2) Western blot鉴定:A549细胞与过表达Nodal的A549细胞 (A549-Nodal) 对照实验,分别提取A549与A549-Nodal细胞蛋白质,定量上样10%SDS-PAGE 10孔1.5mm凝胶,100μg/30μl/孔,电泳后电转至PVDF膜,5%牛奶室温封闭2h,分别以杂交瘤培养上清液作为一抗,商业化Nodal抗体WS65为阳性对照,4℃孵育过夜,HRP标记羊抗小鼠二抗室温孵育2h,曝光显影; 标准Nodal验证实验,标准Nodal 200ng/30μl/孔,上样15%SDS-PAGE 10孔1.5mm凝胶,其他操作同A549/A549-Nodal细胞对照实验。
(3) 流式细胞技术鉴定:A549细胞4%多聚甲醛固定,4℃过夜,Triton X-100打孔,室温20min,分装为实验组和对照组。实验组分别加入纯化单抗 (3μg/50μl体系) 作为一抗,阴性对照组加入稀释液,室温孵育30min,PBS洗涤3次。山羊抗小鼠FITC标记荧光二抗以PBS稀释200倍,室温孵育30min,洗涤后上机检测。
1.3.5 单克隆抗体生产及纯化(1) 单克隆抗体生产:8周龄BALB/c小鼠腹腔注射石蜡油0.5ml/只预刺激,1周后取对数期杂交瘤细胞注入预刺激过的小鼠腹腔,5×105/只,观察小鼠腹部膨大,颈椎脱臼处死小鼠取其腹水 (10~14天)。
(2) Protein G亲和柱纯化:腹水按亲和柱纯过流程过柱纯化,纯化抗体用BCA法定量,加入50%甘油及PBS调整浓度至1mg/ml,间接ELISA法测定单抗效价,-80℃保存。纯化抗体纯度用SDS-PAGE凝胶电泳检测,10μg/20μl/孔,上样10% SDS-PAGE凝胶,电泳至指示染料到达玻璃板底部,取凝胶进行考马斯亮蓝染色,室温30min,脱色至凝胶空白部分呈无色。
1.3.6 单克隆抗体配标记及双抗夹心ELISA法建立(1) 单克隆抗体生物素标记:按照生物素标记试剂盒流程,采用单克隆抗体与生物素分子数比例1:20进行标记并纯化。
(2) 单克隆抗体配对实验:采用双抗夹心ELISA法检测抗体对的配对性,7株抗体分别包被ELISA板 (2μg/ml),封闭后分别加入高浓度标准Nodal蛋白 (1μg/ml) 及阴性对照 (5%BSA) 作为一个实验组,分别加入除包被抗体以外的其它6株生物素化单克隆抗体作为捕获抗体,HRP标记的链亲和素检测,Nodal蛋白孔呈阳性且阴性对照孔呈阴性的实验组为阳性组,该实验组的包被抗体和捕获抗体即为可配对的抗体对。
(3) 双抗夹心ELISA法建立:选取配对抗体按交叉设计原理确定最佳抗体使用浓度,然后通过Nodal浓度梯度夹心ELISA,确定线性范围,作出标准曲线。
(4) 检测限与准确度 (回收实验) 测定:取空白样本 (5%BSA) 作为空白样本,重复测定20次,计算其OD450均值X及该组数据的标准差SD,以X+2SD值带入标准曲线方程计算得到对应浓度即为检测限。选5%BSA作为检测样本,分为体积相同的4份。在其中3份中加入不同量的标准Nodal,制成3个不同加入浓度的回收样本,计算加入的待测物的浓度。在另一份样本中加入同样量的无被测物的溶剂,制成基础样本。夹心ELISA法对回收样本和基础样本进行测定,取其均值进行如下计算:
 |
以正常人血清作为阴性对照,采用标准化的夹心ELISA法检测恶性肿瘤患者血清中的Nodal含量。
2 结果与分析 2.1 Nodal重组蛋白表达及纯化Nodal分子质量约为15kDa,经2mol/L尿素初步纯化的包涵体中目的蛋白含量超过80%,经SDS-PAGE凝胶电泳切胶纯化后纯度可达95%以上,考马斯亮蓝染色结果见图 1,大部分为单体,少量以二聚体的形式存在。
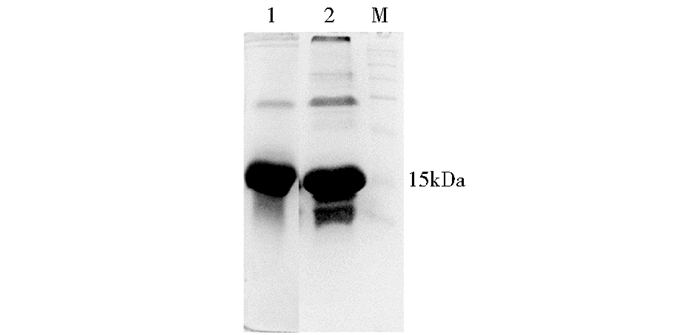
|
| 图 1 Nodal表达及纯化 Figure 1 Nodal preparation 1: The purified Nodal; 2: Inclusion-body Nodal |
融合小鼠取血清测定效价,以空白小鼠血清作为阴性对照,间接夹心ELISA检测结果如图 2(a)所示,以阴性对照OD450值的2倍作为阳性判定标准,小鼠血清效价已超过512 000,产生了高亲和力抗体,证明小鼠免疫成功,可进行后续细胞融合。
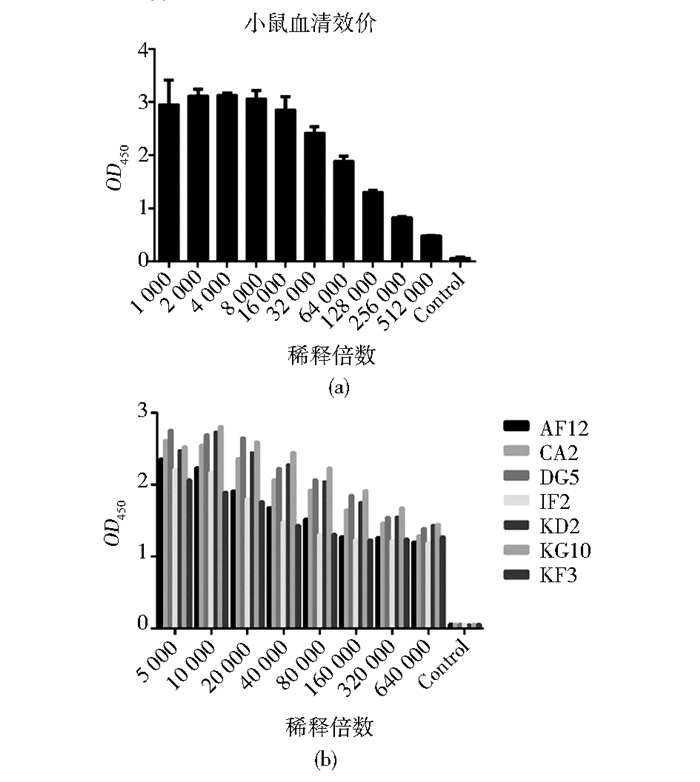
|
| 图 2 间接ELISA测定效价 Figure 2 Detection of dilution ratio (a) Sera dilution ratio of mice before cell fusion (b) Dilution ratio of purified monoclonal antibodies |
杂交瘤细胞注入预刺激的小鼠腹腔,产生含单克隆抗体的腹水,腹水经亲和柱纯化纯度鉴定结果如图 3(c)所示,7株单克隆抗体均具有较好的纯度,可进行后续生物素标记过程。稀释至1mg/ml的单克隆抗体经间接ELISA测定其效价,结果见图 2(b),7株单克隆抗体效价均大于64万,具有很强的亲和力。

|
| 图 3 抗体纯化及活性鉴定 Figure 3 The purity and biological activities of monoclonal antibodies (a) Measuring the bond between antibodies and the protein from A549(-)/A549-Nodal (+) cells by Western blot (b) Measuring the bond between antibodies and the hNodal by Western blot, from left to right is AF12, DG5, CA2, KD2, KG10 (c) Purity test of monoclonal antibodies, from left to right is KF3, KG10, IF2, KD2, CA2, DG5, AF12 |
亚克隆后的杂交瘤细胞上清稀释10倍后测定其抗体亚型,结果如表 1所示,此次融合获得4株分泌IgG1亚型单克隆抗体的杂交瘤细胞,2株分泌IgG2a亚型单克隆抗体的杂交瘤细胞,1株分泌IgG2b亚型单克隆抗体的杂交瘤细胞。
| 单克隆抗体 | AF12 | KG10 | IF2 | KF3 | KD2 | DG5 | CA2 |
| 亚型 | IgG1 | IgG1 | IgG1 | IgG1 | IgG2a | IgG2a | IgG2b |
A549-Nodal细胞株和A549细胞株的对照Western Blot实验结果显示为图 3(a),7株抗体均能特异性结合细胞中的Nodal,与阳性对照抗体WS65相比具有更优良的特异性。标准Nodal的Western-Blot结果[图 3(b)]进一步证明了单抗特异性结合于人源Nodal的成熟肽段。流式细胞检测结果如图 4所示,与阴性对照组相比,7株抗体所孵育的A549细胞内绿色荧光明显增强,表明单抗与细胞表达的Nodal产生了结合,经FITC标记的羊抗鼠二抗以绿色荧光的方式表现出来。
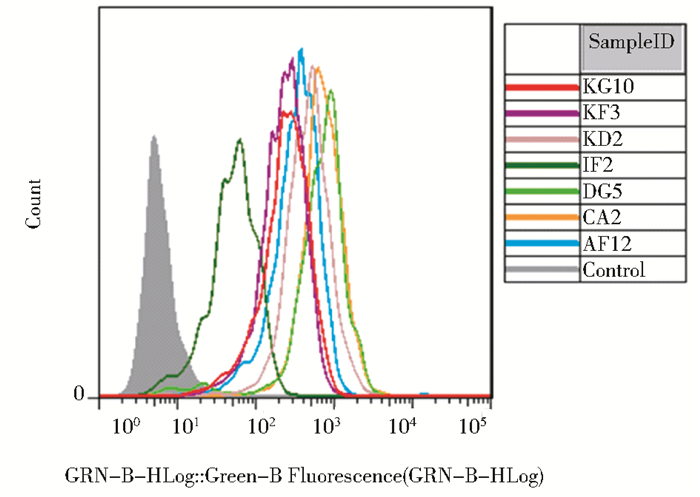
|
| 图 4 流式细胞技术测定抗体活性 Figure 4 Flow cytometry test monoclonal antibodies |
7株单克隆抗体理论上可产生21种配对方式,经夹心ELISA测定,最终有15对配对成功,见表 2。夹心ELISA检测配对抗体对Nodal的灵敏度,选择各方面表现优于其他抗体对的AF12-DG5抗体进行后续实验。
| AF12 | CA2 | DG5 | KF3 | KD2 | IF2 | |
| KG10 | + | + | + | - | + | - |
| AF12 | * | + | + | + | + | + |
| CA2 | * | * | - | + | - | + |
| DG5 | * | * | * | + | - | + |
| KF3 | * | * | * | * | + | - |
| KD2 | * | * | * | * | * | + |
| Note: +: Positive; -: Negtive; *: Repetitive | ||||||
2.6 双抗夹心ELISA法建立
根据初步棋盘滴定法确定双抗夹心ELISA法中抗体工作最佳浓度为:捕获抗体 (AF12)2μg/ml,检测抗体 (生物素化DG5)2μg/ml。Nodal浓度梯度夹心ELISA结果如图 5(a)所示,初步确定该夹心ELISA可能的线性范围为0~5 000pg/ml。以200pg/ml为间隔浓度,0~5 000pg/ml进行梯度测定,最终确定线性回归优良的浓度范围为0~3 000pg/ml,即为夹心ELISA法的线性范围,其标准曲线如图 5(b)所示。
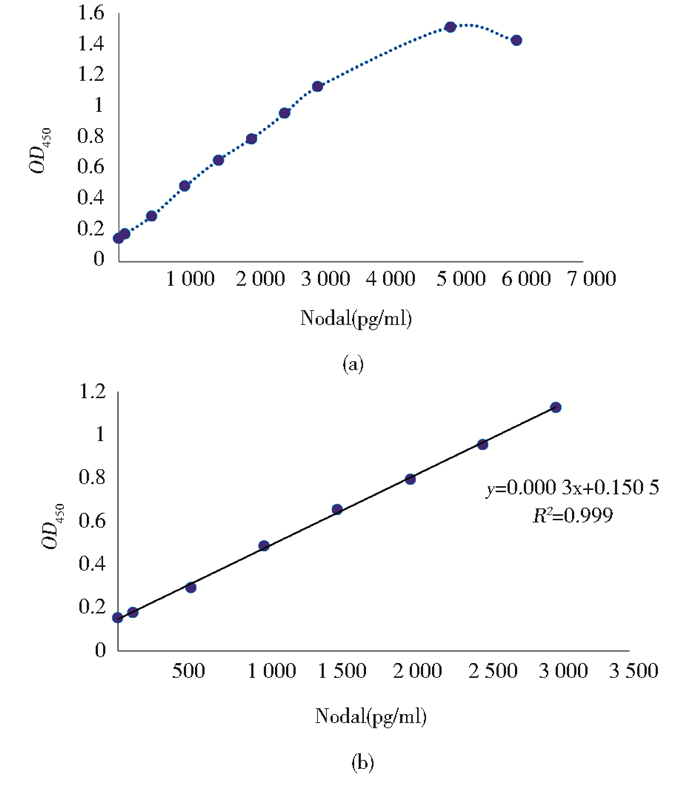
|
| 图 5 夹心ELISA法建立 Figure 5 Double antibody sandwich ELISA (a) Double antibody sandwich ELISA, capture antibody (AF12) 2μg/ml, detection antibody (DG5-biotin) 2μg/ml (b) Standard curve of double antibody sanwich ELISA Linear range is 0~3 000pg/ml, regression equation is y=0.000 3x+0.150 5, R2=0.999 |
经检测得到,此夹心ELISA法的检测限为68pg/ml,加入浓度分别为100pg/ml、600pg/ml和1 000pg/ml的标准蛋白质计算回收率分别为95.5%、99.9%、103.5%,平均回收率为99.6%,比例系统误差为0.4%,准确度良好。
2.7 临床血清检测肿瘤患者及正常人血清采用标准化的夹心ELISA法检测结果见图 6,其中正常人血清30例,鼻咽癌患者血清39例,结直肠癌患者血清100例,胆囊癌患者血清33例。检测结果显示,正常组血清中Nodal浓度测定值呈正态分布,其mean±SEM (standard error of mean,标准误) 值为 (499.2±80.27) pg/ml,95%置信区间为 (333.9±664.5) pg/ml。鼻咽癌组mean±SEM值为 (1 863±193.9) pg/ml,以正常人血清中Nodal浓度95%置信区间上限664.5pg/ml为监测点,92%的鼻咽癌患者血清中Nodal浓度高于该值;结直肠癌组mean±SEM值为 (2 467±134.2) pg/ml,97%的结直肠癌患者血清中Nodal浓度高于664.5pg/ml;胆囊癌组mean±SEM值为 (1 826±404.8) pg/ml,70%的胆囊癌患者血清中Nodal浓度高于664.5pg/ml。

|
| 图 6 肿瘤患者及正常人对照血清检测 Figure 6 Test of serum from malignant tumor patients and normal humen by double antibody sandwich ELISA |
综上所述,与正常人相比,胆囊癌、鼻咽癌和结直肠癌患者血清中的Nodal含量明显升高,其中70%胆囊癌、92%鼻咽癌和97%结直肠癌患者血清中Nodal浓度高于正常水平,具有统计学差异,进一步验证了Nodal作为肿瘤标志物的潜质及该夹心ELISA在临床应用方面的可能性。
3 讨论据资料显示,我国每年癌症新发病例估计为300万人,死亡人数高达200万人,给社会和家庭带来沉重的心理和经济负担[12]。在肿瘤的发展过程中,肿瘤标志物可以反映出肿瘤的发生和发展过程,在肿瘤的诊断、筛查、预测和监控方面发挥重要作用[13]。现阶段临床用于初步诊断的肿瘤标志物大多只能用于对某一特定组织来源的肿瘤进行诊断,使用范围窄、筛查难度高,存在着极大的局限性[14]。Nodal作为一个新型的肿瘤标志物,在前期研究中发现几乎在所有肿瘤中都高表达,表明其具有传统的肿瘤标志物所不能达到的广泛应用范围,具有极高的临床应用价值。为此我们结合生物素-链亲和素系统,开发Nodal检测用高灵敏度双抗夹心ELISA法并初步检测其临床应用价值[15-16]。
本研究通过小鼠免疫、细胞融合、间接ELISA筛选及单克隆抗体生物活性测定过程,成功筛选出7株分泌特异性抗Nodal的单克隆抗体,Western blot显示其特异性均优于市售抗体WS65,且为亲和力成熟的IgG亚型抗体。通过生物素标记及夹心ELISA测定,选择能同时结合与同一个Nodal分子的配对抗体AF12/DG5抗体对建立双单抗夹心ELISA法,该法不仅具有高灵敏度 (检测限为68pg/ml),且配对抗体进一步保证了Nodal检测的特异性及稳定性,可实现大批量稳定生产。
临床样本测定采用肿瘤患者血清与正常人血清对照进行检测,结果显示结直肠癌、胆囊癌和鼻咽癌患者血清中的Nodal含量与正常人存在有统计学意义的明显差异,为该夹心ELISA的临床应用提供了的证据。
| [1] | Conleyba T S. Prognostic and predictive markers in cancer. DIS Markers, 2004, 20(2) : 35–43. DOI:10.1155/2004/202031 |
| [2] | Sturgeon C. Practice guidelines for tumor marker use in the clinic. Clinical Chemistry, 2002, 48(8) : 1151–1159. |
| [3] | 杨立新, 郁卫东, 刘桂生, 等. Nodal信号的研究进展. 中国生物工程杂志, 2003, 23(3) : 15–19. Yang L X, Yu W D, Liu G S, et al. Recent advances in nodal signaling. China Biotechnology, 2003, 23(3) : 15–19. |
| [4] | Seo H J, Kim Y J, Cho K B, et al. Nodal metastasis after successful endoscopic submucosal dissection for colorectal mucosal cancer. Endoscopy, 2011, 43(Suppl 2 UCTN) : E374–E375. |
| [5] | Quail D F, Walsh L A, Zhang Gui-hua, et al. Embryonic protein nodal promotes breast cancer vascularization. Cancer Research, 2012, 72(15) : 3851–3863. DOI:10.1158/0008-5472.CAN-11-3951 |
| [6] | 方瑞, 杜军. Nodal信号调控与肿瘤的研究现状. 中华肿瘤防治杂志, 2012, 19(11) : 872–876. Fang R, Du J. Research advances of regulation of Nodal signal and tumor. Chinese Journal of Cancer Prevention and Treatment, 2012, 19(11) : 872–876. |
| [7] | Strizzi L, Hardy K M, Kirschmann D A, et al. Nodal expression and detection in cancer:experience and challenges. Cancer Research, 2012, 72(8) : 1915–1920. DOI:10.1158/0008-5472.CAN-11-3419 |
| [8] | Engvall E, Karin J, Perlmann P. Enzyme-linked immunosorbent assay. Ⅱ. Quantitative assay of protein antigen, immunoglobulin G, by means of enzyme-labelled antigen and antibody-coated tubes. Biochimica ET Biophysica ACTA (Bba)-Protein STRU, 1971, 251(3) : 427–434. DOI:10.1016/0005-2795(71)90132-2 |
| [9] | Zangar R C, Daly D S, White A M. ELISA microarray technology as a high-throughput system for cancer biomarker validation. Expert Review of Proteomics, 2006, 3(1) : 37–44. DOI:10.1586/14789450.3.1.37 |
| [10] | Gan S D, Patel K R. Enzyme immunoassay and enzyme-linked immunosorbent assay. Journal of Investigative Dermatology, 2013, 133(9) : 1–3. |
| [11] | 李玲玲, 江冠民, 张革, 等. 人源Nodal成熟肽的原核表达及多克隆抗体的制备. 细胞与分子免疫学杂志, 2011, 27(8) : 880–882, 88. Li L L, Jiang G M, Zhang G, et al. Prokaryotic expression and polyclonal antibody preparation of human Nodal mature peptide. Journal of Cellular and Molecular Immunology, 2011, 27(8) : 880–882, 88. |
| [12] | 陈万青, 张思维, 曾红梅, 等. 中国2010年恶性肿瘤发病与死亡. 中国肿瘤, 2014, 23(1) : 1–10. Chen M Q, Zhang S W, Zeng H M, et al. Report of cancer incidence and mortality in China, 2010. Bulletin of Chinese Cancer, 2014, 23(1) : 1–10. |
| [13] | Lech G, Ssotw n' ski R, Sodkowski M, et al. Colorectal cancer tumour markers and biomarkers:recent therapeutic advances. World Journal of Gastroenterology, 2016, 22(5) : 1745–1755. DOI:10.3748/wjg.v22.i5.1745 |
| [14] | Goulart B L, Clark J W, Pien H H, et al. Trends in the use and role of biomarkers in phase Ⅰ oncology trials. Clinical Cancer Research, 2007, 13(22) : 6719–6726. DOI:10.1158/1078-0432.CCR-06-2860 |
| [15] | Hsu S M, Raine L, Fanger H. Use of avidin-biotin-peroxidase complex (ABC) in immunoperoxidase techniques a comparison between ABC and unlabeled antibody (PAP) procedures. The Journal of Histochemistry and Cytochemistry, 1981, 29(4) : 577–580. DOI:10.1177/29.4.6166661 |
| [16] | Grumbach I M, Veh R W. The SA rABC technique a new ABC procedure for detection of antigens at increased sensitivity. The Journal of Histochemistry and Cytochemistry, 1995, 43(1) : 31–37. DOI:10.1177/43.1.7822761 |
 2017, Vol. 37
2017, Vol. 37




