文章信息
- 王明轩, 陈海琴, 顾震南, 陈卫, 陈永泉.
- WANG Ming-xuan, CHEN Hai-qin, GU Zhen-nan, CHEN Wei, CHEN Yong-quan.
- 高山被孢霉中Δ9脂肪酸脱饱和酶的表达、纯化和其细胞色素b5功能域的鉴定
- Expression, Purification of Mortierella alpina Δ9 Desaturase and Characterization of Its Cytochrome b5 Domain
- 中国生物工程杂志, 2017, 37(3): 43-50
- China Biotechnology, 2017, 37(3): 43-50
- http://dx.doi.org/DOI:10.13523/j.cb.20170306
-
文章历史
- 收稿日期: 2016-09-06
- 修回日期: 2016-11-12
多不饱和脂肪酸 (PUFAs) 在细胞膜的功能和信号转导中起着重要作用。研究显示,ω3脂肪酸对癌症和心血管疾病的预防有着积极作用[1-3]。多不饱和脂肪酸是由一系列脂肪酸脱饱和酶催化产生的,对脂肪酸脱饱和酶的研究具有重要意义。脂肪酸脱饱和酶可分为可溶性脂肪酸脱饱和酶和膜结合脂肪酸脱饱和酶,可溶性脂肪酸脱饱和酶主要存在于植物中并被广泛研究[4-6],膜结合脂肪酸脱饱和酶由于存在分离纯化等技术上的困难,对分离纯化后蛋白质性质的研究相对较少[7-8]。
根据膜结合脂肪酸脱饱和酶是否含有细胞色素b5功能域,可以分为亚铁血红素膜脂肪酸脱饱和酶 (heme integral desaturase) 和非亚铁血红素膜脂肪酸脱饱和酶 (non-heme integral desaturase)[9-10]。目前,哺乳动物人和大鼠中的Δ9脂肪酸脱饱和酶被成功分离纯化,但二者都不含有细胞色素b5功能域[11-12]。真核微生物中的Δ9脂肪酸脱饱和酶属于亚铁血红素膜脂肪酸脱饱和酶。Mitchell和Martin[13]对酿酒酵母中Δ9脂肪酸脱饱和酶细胞色素b5功能域的功能进行了体内实验研究,但并未对其进行分离纯化。因此,目前对于亚铁血红素脂肪酸脱饱和酶的分离纯化和体外性质研究国际上未有报道。
高山被孢霉 (Mortierella alpina) 是一种高产脂质的真菌,其既可以通过ω6脂肪酸脱饱和途径生产花生四烯酸 (arachidonic acid, AA),又可以通过ω3脂肪酸脱饱和途径生产二十碳五烯酸 (eicosapentaenoic acid, EPA),是脂质生物化学基础研究的重要模式菌[14-16]。该菌中Δ9脂肪酸脱饱和酶在C端含有细胞色素b5功能域,属于亚铁血红素脂肪酸脱饱和酶。本课题组前期研究已成功克隆和高效表达了高山被孢霉ATCC 32222 Δ9-I脂肪酸脱饱和酶[17],在前期研究的基础上,为保证细胞色素b5功能域的完整性,本研究进一步通过构建含有高效纯化标签ZZ-tag的表达单元,采用IgG亲和色谱纯化方法,使含有完整细胞色素b5功能域的脂肪酸脱饱和酶被成功分离、纯化和鉴定,这为融合细胞色素b5功能域在脂肪酸脱饱和反应中的机制研究奠定了基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒、培养基毕赤酵母菌株2(PichiaPinkTM Strain 2) 和表达质粒pPink-HC购自Invitrogen公司;高山被孢霉 (M. alpina ATCC 32222) 购于美国标准生物品收藏中心,由本实验室菌种库保藏,并已对其完成基因组测序[18]。BMGY/BMMY培养基 (百分比均为质量体积比):1%酵母抽提物,2%蛋白胨,100mmol/L磷酸盐缓冲液,1.34% YNB,0.000 4%生物素,1%甘油或0.5%甲醇。
1.1.2 主要仪器和试剂细胞破碎仪EmulsiFlex-C3购自Avestin公司;分光光度计为Beckman Coulter DU 800;IgG亲和填料、钴离子亲和填料、阳离子交换柱、Vivaspin浓缩管均购自GE Healthcare公司;SanPrep柱式质粒DNA小量抽提试剂盒购自生工生物工程 (上海) 股份有限公司。Anti-His HRP Conjugates抗体购自Qiagen公司。BCA蛋白质浓度测定试剂盒购自Thermo Scientific公司。去垢剂n-dodecyl-β-D-maltopyranoside (DDM)、n-octyl-β-D-glucoside (OG)、5-cyclohexyl-1-pentyl-β-D-Maltoside (CYMAL-5)、n-octyl-β-D-thioglucopyranoside (OTG)、N, N-dimethyldodecylamine N-oxide (LDAO)、Fos-choline-10(Fos10) 和Fos-choline-16(Fos16) 均购自Anatrace公司。二硫苏糖醇 (DTT)、Na2S2O4等其它常规试剂均购自Sigma。破碎缓冲液由20mmol/L Hepes pH7.5、150mmol/L NaCl、10%甘油、蛋白酶抑制剂苯甲基磺酰氟 (PMSF) 和Benzamidine各0.1mmol/L、1mmol/L MgCl2和40mg/L Dnase I组成;膜溶解缓冲液由50mmol/L Hepes pH7.5、150mmol/L NaCl、15%甘油、蛋白酶抑制剂苯甲基磺酰氟 (PMSF) 和Benzamidine各0.1mmol/L组成;洗涤缓冲液由20mmol/L Hepes pH7.5、150mmol/L NaCl、10%甘油、蛋白酶抑制剂苯甲基磺酰氟 (PMSF) 和Benzamidine各0.1mmol/L组成。
1.2 方法 1.2.1 表达载体的构建密码子优化后的高山被孢霉ATCC 32222 Δ9-I脂肪酸脱饱和酶基因由Genscript公司合成,所用表达载体为pPink-HC,目的基因3′端连有ZZ蛋白质作为纯化标签,RGS-10xHis作为Western blotting检测标签。
1.2.2 Δ9-I脂肪酸脱饱和酶的表达表达质粒的转化按照Invitrogen毕赤酵母表达手册PichiaPinkTM Expression System进行。转化子小量培养后,首先通过BCA方法对不同转化子细胞总蛋白质质量进行标定,随后利用Western blotting对转化子进行筛选。Western blotting实验中PVDF膜的裁剪和激活,滤纸、凝胶和PVDF膜的叠放次序,转膜槽的使用等按照《分子克隆实验指南》进行。将转移槽置于冰上,26W 2h转膜。使用5%脱脂奶粉封闭后,用Anti-RGS-His10 HRP Conjugates对目的蛋白质进行检测。筛选的转化子接种于50ml (250ml摇瓶) BMGY液体培养基中,28℃、250r/min振荡培养24h,使用此种子液按1%的接种量接种于1L (2.8L摇瓶) BMGY液体培养基中继续培养。当OD600到达100~120时,5 000g离心菌液,将菌体重悬于200ml BMMY培养基中培养24h进行诱导,收集的菌体于-80℃冻藏。
1.2.3 膜组分分离条件和去垢剂的筛选50g菌体被重悬于150ml破碎缓冲液,重悬后的细胞用EmulsiFlex-C3细胞破碎仪破碎三次,破碎压力为27 000psi,破碎液按梯度离心力分别为10 000g、20 000g、40 000g、100 000g离心1h,取上清液和沉淀进行SDS-PAGE分析。沉淀组分用不同去垢剂在4℃溶解1.5h后,4 000g离心30min,取上清液进行SDS-PAGE分析。
1.2.4 Δ9-I脂肪酸脱饱和酶的纯化200g菌体被重悬于600ml破碎缓冲液,重悬后的细胞用EmulsiFlex-C3细胞破碎仪破碎3次,破碎压力为27 000psi。破碎液1 000g离心30min后,取上清液20 000g离心1h,膜组分按7ml/g重悬于含有0.5% Fos16的膜溶解缓冲液中,在4℃溶解1.5h后4 000g离心30min,上清液与IgG亲和填料过夜孵育。结合了目的蛋白质的IgG填料用1L洗涤缓冲液洗涤3次后,加入2mg 3C蛋白酶和5mmol/L二硫苏糖醇 (DTT) 在4℃酶切12h。加入的3C蛋白酶用2ml预平衡的钴离子亲和填料去除。洗脱液透析至pH7.5后,进行阳离子交换色谱层析,流出组分经SDS-PAGE分析后用Vivaspin浓缩管进行浓缩,液氮冻存。
1.2.5 Δ9-I脂肪酸脱饱和酶浓度和纯度的测定总蛋白质浓度通过BCA试剂盒进行测定。通过与已知浓度的标准BSA样品进行对照,利用AlphaView SA软件 (Cell Biosciences, Inc.) 对SDS-PAGE胶图上目的蛋白质的量进行估算。纯度计算方法为胶图上目的蛋白质的量除以总上样量。
1.2.6 Δ9-I脂肪酸脱饱和酶的活性测定200μl酿酒酵母EGY49菌体重悬于破碎缓冲液中,加入200μl体积的玻璃珠在4℃振荡6min,破碎液上清液加入2μl纯化的Δ9-I脂肪酸脱饱和酶,28℃振荡3h,反应液通过GC/MS脂肪酸分析对空白组和实验组的C16:1Δ9和C18:1Δ9进行定量,实验组脂肪酸增加量的百分比定义为Δ9-I脱饱和酶活性[17]。
1.2.7 Δ9-I脂肪酸脱饱和酶细胞色素b5功能域的表征2μl 456.5μmol/L纯化的Δ9-I脂肪酸脱饱和酶稀释到198μl的Hepes缓冲液中,总体积200μl的样品用于波长扫描250~600nm。对于细胞色素b5功能域的还原实验,将12μl纯化的蛋白质稀释至200μl,加入0.5mg Na2S2O4进行还原反应。
2 结果 2.1 Δ9-I脂肪酸脱饱和酶在毕赤酵母中的表达表达载体的构建如图 1所示,在高山被孢霉ATCC 32222Δ9-I脂肪酸脱饱和酶基因序列3′端加入用于纯化的ZZ标签和用于Western blotting验证的RGS-10xHis标签,同时在ZZ标签和目的基因序列之间插入3C蛋白酶酶切位点,用于标签的移除。整个表达单元通过EcoRI和NaeI酶切位点连接至pPink-HC表达载体。表达载体转入毕赤酵母进行表达实验。
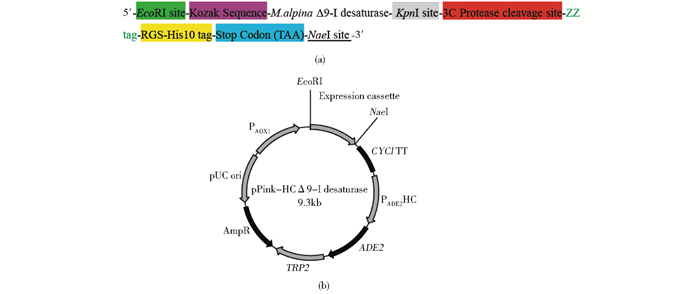
|
| 图 1 表达载体的构建 Figure 1 Construction of the expression plasmid (a) Expression cassette (b) Expression plasmid |
目的基因表达结果如图 2所示,Western blotting结果显示挑取的5个转化子均为阳性,其中2号转化子表达量最高。在SDS-PAGE分析中,2号转化子全细胞裂解液中目的蛋白质条带明显。选取2号转化子进行大量培养和蛋白质纯化实验。
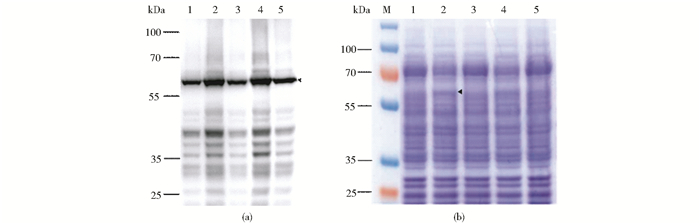
|
| 图 2 不同转化子全细胞裂解液的Western blotting和SDS-PAGE分析 Figure 2 Western blotting and SDS-PAGE analysis of whole cell lysate of transformants (a) Western blotting of different transformants 1~5: Transformants 1~5 (b) SDS-PAGE analysis of transformants 1~5: Transformants 1~5 |
收集的菌体经高压破碎后,采用离心法分离膜组分。分离结果如图 3所示,当离心力为10 000g时,含有目的蛋白质的膜组分被富集于沉淀中,当离心力为20 000g时,目的蛋白质含量达到最大值,而离心力超过40 000g时导致沉淀积压太紧,影响膜组分的溶解。因此,确定20 000g离心1h为富集含有Δ9-I脂肪酸脱饱和酶膜组分的最佳条件。
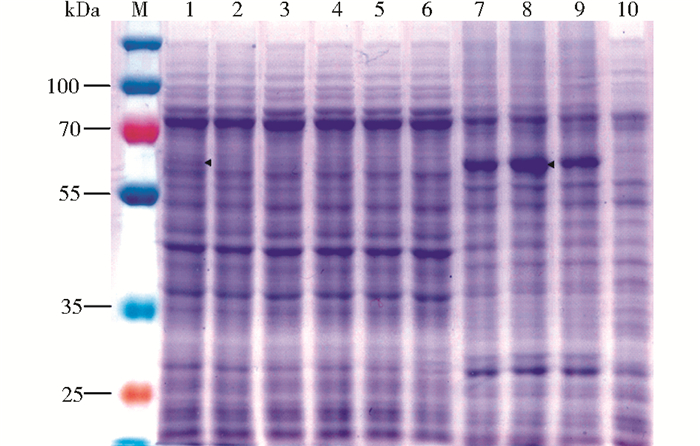
|
| 图 3 不同离心力对获取膜组分的影响效果 Figure 3 Separation of membrane factions using different centrifugation speeds 1: Whole cell lysate; 2: Supernatant of 1 000g centrifugation; 3~6: Supernatant of 10 000g, 20 000g, 40 000g, 100 000g centrifugation; 7~10: Pellets of 10 000g, 20 000g, 40 000g, 100 000g centrifugation |
膜蛋白质提取的条件对后续的蛋白质纯化至关重要,使用去垢剂是最常用的提取方法。一般用于膜蛋白提取的去垢剂有90多种,初次筛选的原则是选择不同的大类,通常选择具有不同极性头部、不同链长、不同最低成胶束浓度 (CMC) 的去垢剂[19-20]。在Δ9-I脂肪酸脱饱和酶提取中筛选的去垢剂种类如表 1所示。其中DDM是蛋白基因组学中首先选用的去垢剂, OG与Fos-choline-10曾被报道对毕赤酵母膜总蛋白质的提取具有最显著的效果[21]。
| Group | Detergent name | CMC (mmol/L) | Nagg | Chain length |
| Glucidic | n-Dodecyl-β-D-maltopyranoside (DDM) | 0.17 | 78~149 | C12 |
| Glucidic | n-Octyl-β-D-glucoside (OG) | 18 | 78 | C8 |
| Nonionic | 5-Cyclohexyl-1-pen-tyl-β-D-maltoside (CYMAL-5) | 2.4 | 47 | C23 |
| Nonionic | n-Octyl-β-D-thioglucopyranoside (OTG) | 9 | — | C8 |
| Zwitterionic | N, N-dimethyldodecylamine N-oxide (LDAO) | 1.0 | 76 | C12 |
| Zwitterionic | Fos-choline-16 | 0.013 | 178 | C16 |
| Zwitterionic | Fos-choline-10 | 11 | 24 | C10 |
| Ionic | SDS | 2.6 | 62 | C12 |
溶解效果如图 4所示,OG、OTG、LDAO基本没有提取效果,Fos-choline-10、CYMAL-5、DDM有一定提取效果,而比Fos-choline-10链长更长的双性去垢剂Fos-choline-16展现出最佳的提取效果,其提取效率接近阳性对照SDS。对去垢剂使用浓度考察的研究发现,Fos-choline-16使用浓度为0.5%~1.5%时提取效果最佳,最终选用0.5%的去垢剂使用浓度。
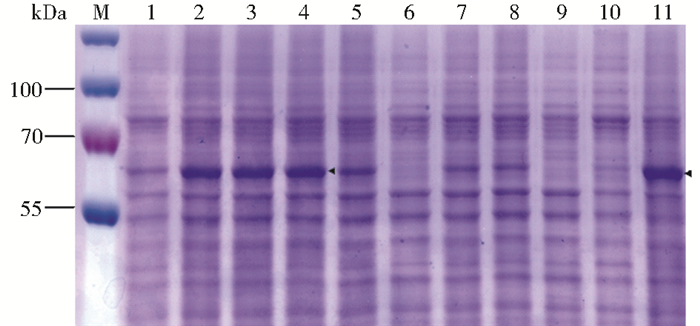
|
| 图 4 不同去垢剂使用效果的SDS-PAGE分析 Figure 4 SDS-PAGE analysis of detergents solubilization M:Marker; 1~4: Fos-choline-16 with different concentrations: 0.05%, 0.5%, 1%, 1.5%; 5~11: Fos-choline-10, OG, CYMAL-5, DDM, OTG, LDAO, SDS at 0.5% concentration |
IgG亲和纯化结果如图 5所示,膜去垢剂溶解液与IgG填料过夜孵育后,大量目的蛋白质与IgG结合。经3C蛋白酶酶切作用,Δ9-I脂肪酸脱饱和酶被成功切割,融合蛋白质大小从68kDa变为52kDa,与理论分子质量67.98kDa和51.75kDa一致,蛋白质结构完整。蛋白质定量估算结果见表 2,IgG亲和纯化的目的蛋白质纯度为96%,产量为5.1%(15.8mg/L)。
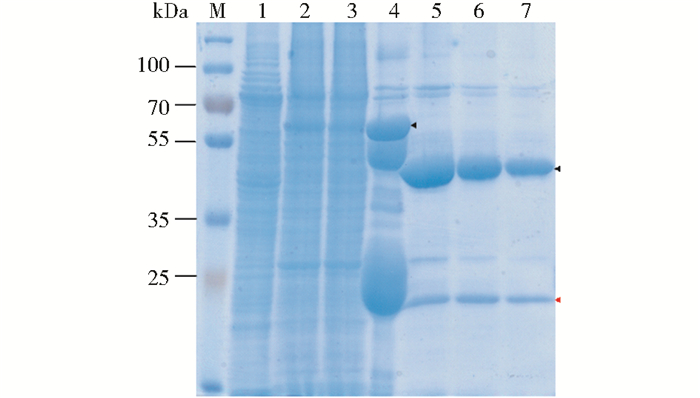
|
| 图 5 Δ9-I脂肪酸脱饱和酶的IgG亲和纯化产物的SDS-PAGE Figure 5 SDS-PAGE analysis of Δ9-I desaturase IgG affinity purification product 1: Supernatant of 20 000g centrifugation; 2: Pellets of 20 000g centrifugation; 3: Flow through of IgG purification; 4: Proteins on IgG beads; 5~7: Three elutions from IgG beads |
| Step | Concentration (mg/L) | Yield (%) | Purity (%) |
| Cell lysate | 310.0 | 100.0 | - |
| Centrifugation | 220.7 | 71.2 | - |
| Detergent extract | 185.1 | 59.7 | - |
| IgG affinity | 15.8 | 5.1 | 96 |
| Cation exchange | 5.3 | 1.7 | 99 |
IgG亲和纯化的蛋白质与钴离子填料孵育后,在pH7.5的缓冲液中过夜透析。根据酶切后融合蛋白质的理论pI值8.49,选择阳离子交换色谱法进一步纯化,纯化结果如图 6所示,流出组分A72~B4中目的蛋白质纯度很高,经蛋白质定量估算,阳离子交换后蛋白质纯度为99%,产量为1.7%(5.3mg/L),将目的蛋白质产物浓缩至23.6mg/ml,液氮冻存。
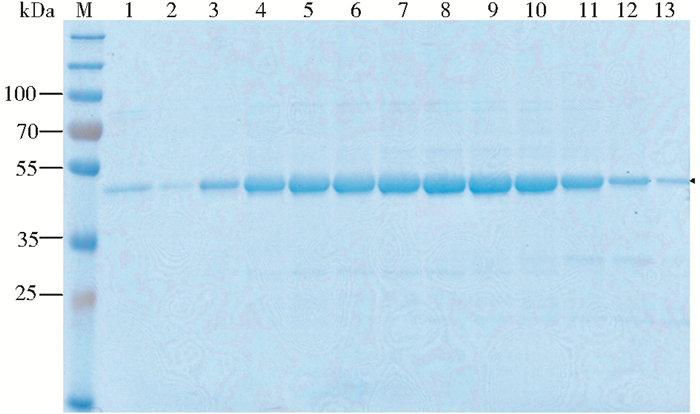
|
| 图 6 Δ9-I脂肪酸脱饱和酶的阳离子交换色谱纯化产物的SDS-PAGE Figure 6 SDS-PAGE analysis of Δ9-I desaturase cation exchange purification product M: Marker; 1~13: Fractions A72~B4 |
由于膜脂肪酸脱饱和反应需要细胞色素b5、细胞色素b5还原酶、膜组分等辅助因子,而酿酒酵母可以同时提供这些辅助因子和底物脂肪酸C14:0、C16:0、C18:0、C20:0,因此在Δ9-I脂肪酸脱饱和酶活性的初步测定中,采用酿酒酵母EGY49全细胞破碎物作为底物。反应结果如表 3所示,Δ9-I脂肪酸脱饱和酶在体外将C16:0和C18:0分别转化为C16:1Δ9和C18:1Δ9,转化率分别为 (16.88±9.32)%和 (20.61±7.55)%,比不含细胞色素b5功能域的Δ9-I脂肪酸脱饱和酶活性分别提高了2.8倍和2.9倍[17]。而其对C14:0和C20:0没有脱饱和效果,因此高山被孢霉Δ9-I脂肪酸脱饱和酶的偏好性底物为C18:0。
| Substrate | C14:0 | C16:0 | C18:0 | C20:0 |
| Product | — | C16:1Δ9 | C18:1Δ9 | — |
| Conversion rate | 0 | 16.88±9.32 | 20.61±7.55 | 0 |
| Note:①Percent increase over control | ||||
2.6 Δ9-I脂肪酸脱饱和酶细胞色素b5功能域的性质研究
纯化后的高山被孢霉Δ9-I脂肪酸脱饱和酶为红色。波长扫描结果如图 7所示,蛋白质在411nm处有强吸收,这与文献报道中游离细胞色素b5吸收特征一致,表明该细胞色素b5功能域中很可能存在辅助因子亚铁血红素[22]。
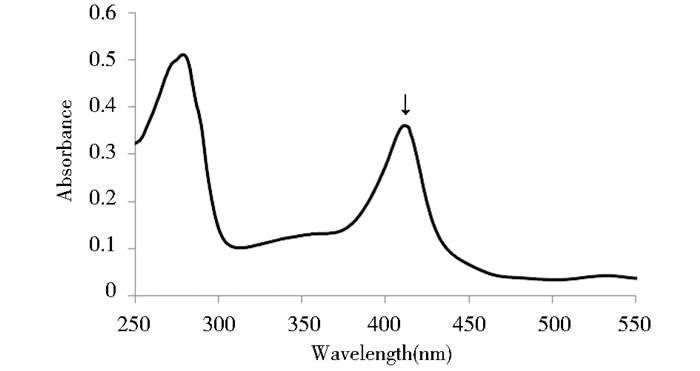
|
| 图 7 纯化的Δ9-I脂肪酸脱饱和酶波长扫描 Figure 7 Wavelength scan of purified Δ9-I desaturase |
根据文献报道,氧化态细胞色素b5铁血红素中的三价铁离子可以被Na2S2O4还原为二价铁离子[23]。因此,在这项研究中使用Na2S2O4对高山被孢霉Δ9-I脂肪酸脱饱和酶细胞色素b5功能域的氧化还原特性进行表征。如图 8所示,在还原剂的作用下,蛋白质最大吸收峰从411nm偏移至422nm,同时在521nm和554nm处吸收增加,而在对照实验中等体积Hepes缓冲液与Na2S2O4反应未见任何波长吸收特征,这与文献报道一致[23]。因此,特异性的波长吸收变化证实高山被孢霉Δ9-I脂肪酸脱饱和酶的细胞色素b5功能域含有辅助因子亚铁血红素,且能够被还原。

|
| 图 8 细胞色素b5功能域的还原实验 Figure 8 Reduction experiments of the cytochrome b5 domain |
由于膜蛋白质分离纯化技术上的困难,膜脂肪酸脱饱和酶体外性质的研究相对较少,并且含有融合细胞色素b5功能域的膜脂肪酸脱饱和酶的分离纯化国际上未有报道[7-8]。在本课题组前期研究中,通过设计在N端的His标签对膜结合Δ9-I脂肪酸脱饱和酶进行分离纯化,纯化后的蛋白质失去C端细胞色素b5功能域,脱饱和酶功能域仍具有活性[17]。在此基础上,本研究利用C端蛋白质A的片段ZZ蛋白质与IgG的亲和作用,成功纯化出完整的Δ9-I脂肪酸脱饱和酶,其对C16:0和C18:0底物的活性分别提高了2.8倍和2.9倍。另外,波长扫描和Na2S2O4还原实验证实其细胞色素b5功能域含有铁血红素且在体外能够被还原。
Enoch等[11]分离纯化了哺乳动物的膜结合Δ9脂肪酸脱饱和酶,在体外构建了脂肪酸脱饱和反应电子传递链,其中包括细胞色素b5还原酶、细胞色素b5和脂肪酸脱饱和酶。哺乳动物的膜结合Δ9脂肪酸脱饱和酶不含有融合细胞色素b5功能域,在体外脱饱和反应中需要游离的细胞色素b5传递电子和进行还原作用。而对于含有融合细胞色素b5功能域的脂肪酸脱饱和酶,在其失去融合细胞色素b5功能域时,可以使用外源酵母细胞色素b5作为电子传递体[17],当融合细胞色素b5功能域存在时,脱饱和酶活性增加。亚铁血红素Δ9脂肪酸脱饱和酶在进化过程中为何保留融合细胞色素b5功能域,其电子传递效率与游离细胞色素b5相比如何尚不清楚。因此,高山被孢霉ATCC 32222中的Δ9-I脂肪酸脱饱和酶的成功分离纯化和功能鉴定为亚铁血红素脂肪酸脱饱和酶脱饱和反应机制的研究奠定了基础。
| [1] | Gu Z, Shan K, Chen H, et al. N-3 Polyunsaturated fatty acids and their role in cancer chemoprevention. Current Pharmacology Reports, 2015, 1(5) : 283–294. DOI:10.1007/s40495-015-0043-9 |
| [2] | Weylandt K, Chen Y, Lim K, et al. Omega-3 PUFAs in the prevention and cure of inflammatory, degenerative, and neoplastic diseases 2014. Biomed Research International, 2015, 2015(2015) : 695875. |
| [3] | Bazinet R, Laye S. Polyunsaturated fatty acids and their metabolites in brain function and disease. Nature Review Neuroscience, 2014, 15(12) : 771–785. DOI:10.1038/nrn3820 |
| [4] | Whittle E, Cahoon E B, Subrahmanyam S, et al. A multifunctional acyl-acyl carrier protein desaturase from Hedera helix L. (English ivy) can synthesize 16-and 18-carbon monoene and diene products. The Journal of Biological Chemistry, 2005, 280(31) : 28169–28176. DOI:10.1074/jbc.M504205200 |
| [5] | Fox B G, Shanklin J, Somerville C, et al. Stearoyl-acyl carrier protein delta 9 desaturase from Ricinus communis is a diiron-oxo protein. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(6) : 2486–2490. DOI:10.1073/pnas.90.6.2486 |
| [6] | Schultz D J, Suh M C, Ohlrogge J B. Stearoyl-acyl carrier protein and unusual acyl-acyl carrier protein desaturase activities are differentially influenced by ferredoxin. Plant Physiology, 2000, 124(2) : 681–692. DOI:10.1104/pp.124.2.681 |
| [7] | Shanklin J, Guy J E, Mishra G, et al. Desaturases:emerging models for understanding functional diversification of diiron-containing enzymes. The Journal of Biological Chemistry, 2009, 284(28) : 18559–18563. DOI:10.1074/jbc.R900009200 |
| [8] | Wang M, Chen H, Gu Z, et al. Omega3 fatty acid desaturases from microorganisms:structure, function, evolution, and biotechnological use. Applied Microbiology and Biotechnology, 2013, 97(24) : 10255–10262. DOI:10.1007/s00253-013-5336-5 |
| [9] | Shanklin J, Whittle E. Evidence linking the Pseudomonas oleovorans alkane omega-hydroxylase, an integral membrane diiron enzyme, and the fatty acid desaturase family. FEBS Letters, 2003, 545(2-3) : 188–192. DOI:10.1016/S0014-5793(03)00529-5 |
| [10] | Meesapyodsuk D, Qiu X. The front-end desaturase:structure, function, evolution and biotechnological use. Lipids, 2012, 47(3) : 227–237. DOI:10.1007/s11745-011-3617-2 |
| [11] | Enoch H G, Catala A, Strittmatter P. Mechanism of rat liver microsomal stearyl-CoA desaturase. The Journal of Biological Chemistry, 1976, 251(16) : 5095–5103. |
| [12] | Goren M A, Fox B G. Wheat germ cell-free translation, purification, and assembly of a functional human stearoyl-CoA desaturase complex. Protein Expression and Purification, 2008, 62(2) : 171–178. DOI:10.1016/j.pep.2008.08.002 |
| [13] | Mitchell A G, Martin C E. A novel cytochrome b5-like domain is linked to the carboxyl terminus of the Saccharomyces cerevisiae delta-9 fatty acid desaturase. The Journal of Biological Chemistry, 1995, 270(50) : 29766–29772. DOI:10.1074/jbc.270.50.29766 |
| [14] | Shinmen Y, Shimizu S, Akimoto K, et al. Production of arachidonic acid by Mortierella fungi. Applied Microbiology and Biotechnology, 1989, 31(1) : 11–16. |
| [15] | Shimiziu S, Kawashima H, Shinmen Y, et al. Production of eicosapentaenoic acid by Mortierella fungi. Journal of the American Oil Chemists' Society, 1988, 65(9) : 1455–1459. DOI:10.1007/BF02898307 |
| [16] | Sakuradani E, Ando A, Shimizu S, et al. Metabolic engineering for the production of polyunsaturated fatty acids by oleaginous fungus Mortierella alpina 1S-4. Journal of Bioscience and Bioengineering, 2013, 116(4) : 417–422. DOI:10.1016/j.jbiosc.2013.04.008 |
| [17] | Chen H, Gu Z, Zhang H, et al. Expression and purification of integral membrane fatty acid desaturases. PLoS One, 2013, 8(3) : e58139. DOI:10.1371/journal.pone.0058139 |
| [18] | Wang L, Chen W, Feng Y, et al. Genome characterization of the oleaginous fungus Mortierella alpina. PLoS One, 2011, 6(12) : e28319. DOI:10.1371/journal.pone.0028319 |
| [19] | Gutmann D A, Mizohata E, Newstead S, et al. A high-throughput method for membrane protein solubility screening:the ultracentrifugation dispersity sedimentation assay. Protein Science, 2007, 16(7) : 1422–1428. DOI:10.1110/(ISSN)1469-896X |
| [20] | Wiener M C. A pedestrian guide to membrane protein crystallization. Methods, 2004, 34(3) : 364–372. DOI:10.1016/j.ymeth.2004.03.025 |
| [21] | Arachea B T, Sun Z, Potente N, et al. Detergent selection for enhanced extraction of membrane proteins. Protein Expression and Purification, 2012, 86(1) : 12–20. DOI:10.1016/j.pep.2012.08.016 |
| [22] | Mulrooney S B, Waskell L. High-level expression in Escherichia coli and purification of the membrane-bound form of cytochrome b5. Protein Expression and Purification, 2000, 19(1) : 173–178. DOI:10.1006/prep.2000.1228 |
| [23] | Holmans P L, Shet M S, Martin-Wixtrom C A, et al. The high-level expression in Escherichia coli of the membrane-bound form of human and rat cytochrome b5 and studies on their mechanism of function. Archives of Biochemistry and Biophysics, 1994, 312(2) : 554–565. DOI:10.1006/abbi.1994.1345 |
 2017, Vol. 37
2017, Vol. 37




