文章信息
- 倪璇, 高金欣, 余传金, 刘铜, 李雅乾, 陈捷.
- NI Xuan, GAO Jin-xin, YU Chuan-jin, LIU Tong, LI Ya-qian, CHEN Jie.
- 玉米弯孢叶斑病菌clt-1基因生物信息学分析和启动子的功能鉴定
- Bioinformatic Analysis and Promoter Identification of clt-1 Gene in Curvularia Lunata
- 中国生物工程杂志, 2017, 37(3): 37-42
- China Biotechnology, 2017, 37(3): 37-42
- http://dx.doi.org/DOI:10.13523/j.cb.20170305
-
文章历史
- 收稿日期: 2016-09-18
- 修回日期: 2016-11-12
2. 上海交通大学 国家微生物代谢重点实验室 上海 200240
2. State Key Laboratory of Microbial Metabolism, Shanghai Jiaotong University, Shanghai 200240, China
由新月弯孢[Curvularia lunata (Wakker) Boedijn]引起的玉米弯孢叶斑病 (Curvularia leaf spot) 是玉米叶部发生的一种真菌性病害,其分布广泛,属于世界范围的病害[1]。玉米弯孢叶斑病是继玉米大斑病、玉米小斑病和玉米圆斑病之后,在我国出现的又一个严重的灾害性病害[2]。该病害一旦发生会迅速蔓延,病斑较密集,对生产造成严重威胁。
目前,玉米弯孢叶斑病菌的致病机制研究主要集中在流行规律、种质资源抗病性及遗传分析、病原菌的生物学特性及致病性分化等方面[3-5],但对其致病分子机制方面的研究尚不深入。因此,开展玉米弯孢叶斑病菌致病相关基因的鉴定与功能分析,对揭示该病菌致病机制具有现实意义。前期通过ATMT方法构建玉米弯孢叶斑病菌突变株体系,筛选致病性差异变化较大的突变株,研究其生物学特性和致病相关因子活性变化,发现T806丧失了产生非寄主专化性毒素甲基-5-(羟甲基) 呋喃-2-羧酸的能力。通过巢式PCR扩增得到了标记基因clt-1,发现ATMT插入破坏了该基因的启动子[6]。本文对clt-1基因进行了生物信息学分析,并且对启动子活性进行了鉴定,为进一步研究玉米弯孢叶斑病菌毒素合成及致病机制奠定了基础。
1 材料与方法 1.1 材料、仪器设备 1.1.1 菌株与质粒Curvularia lunata CX-3 (野生型) 为强致病性菌株:大肠杆菌菌株DH5α作为感受态细菌;根癌农杆菌AgL1用于农杆菌介导的转化。pCPXHY1Egfp质粒用于扩增GFP序列;pSilent-1质粒用于扩增Ttrpc序列;pCAMBIA1300th质粒用于构建GFP标记载体。以上菌株和载体均保存于上海交通大学分子植物病理实验室。
1.1.2 主要试剂rTaq DNApolymerase mix,限制性内切核酸酶Hind Ⅲ和PstⅠ (TaKaRa);KOD-Plus-(Toyobo);潮霉素 (Merck);植物基因组DNA提取试剂盒,质粒提取及胶回收纯化试剂盒 (天根生化科技有限公司);潮霉素B、乙酰丁香酮 (AS)、MES、特美汀、利福平、卡那霉素、一步法快速克隆试剂盒 (前尘生物科技有限公司);其他试剂为国产分析纯 (国药化学试剂有限公司)。
1.1.3 主要仪器Mastercycler pro梯度PCR仪 (Eppendorf);显微镜DM2500 (Leica);UV-1600PCSpectrophotometer (Mapada);共聚焦激光扫描显微镜 (Zeiss LSM 700)。
1.2 方法 1.2.1 生物信息学分析氨基酸物理化学性质预测通过ExPASyProtparam (http://web.expasy.org/protparam/) 完成。疏水性/亲水性预测通过ExPaSyScale (http://web.expasy.org/protscale/) 完成。跨膜结构域和磷酸化位点通过CBS预测网站 (http://www.cbs.dtu.dk/services) 进行预测。亚细胞定位通过在线软件PSORT (http://psort.hgc.jp/) 和BaCelLo (http://gpcr.biocomp.unibo.it/bacello/pred.htm) 进行预测。利用在线软件InterProScan (http://www.ebi.ac.uk/interpro/) 预测蛋白质结构域。通过在线软件PSORT (http://psort.hgc.jp/) 和BaCelLo (http://gpcr.biocomp.unibo.it/bacello/pred.htm) 预测蛋白质的亚细胞定位。基因5′端非编码区启动子分析由在线软件Bimas (http://www-bimas.cit.nih.gov/molbio/) 预测完成。
1.2.2 核酸提取使用天根公司生产的植物基因组DNA提取试剂盒提取C. lunata CX-3基因组DNA。
1.2.3 启动子功能活性检测载体的构建以引物对Pclt1-F/R从CX-3基因组DNA扩增得到clt-1基因5′端非编码区序列;以引物对gfp-F/R从pCPXHY1Egfp载体中扩增得到GFP基因序列;以引物对Ttrpc-F/R从pSilent-1载体中扩增得到Trpc终止子序列。所用的引物如下:
Pclt1-F: CGACGGCCAGTGCCAAGCTTCTGACTGATGTTACGGA
Pclt1-R: TCGCCCTTGCTCACCATTCCTGCTGTCTATTGTA
gfp-F: TACAATAGACAGCAGGAATGGTGAGCAAGGGCGA
gfp-R: TTTCAGTAACGTTAAGTTTACTTGTACAGCTCGT
Ttrpc-F: ACGAGCTGTACAAGTAAACTTAACGTTACTGAAA
Ttrpc-R: TCCTCTAGAGTCGACCTGCAGTCACCAGCCCCTGGGTT
PCR反应程序为:94℃预变性3min;94℃变性30s,58℃退火30s,72℃延伸75s,共进行30个循环;72℃延伸10min;10℃保存。
使用一步法克隆试剂盒将以上3个含有重叠区域的DNA片段同时连入经Hind Ⅲ和Pst Ⅰ双酶切的pCAMBIA1300th载体中 (图 1)。检测表达载体正确后转化CX-3野生型菌株。

|
| 图 1 启动子功能活性检测表达质粒pC1300th-Pclt1-GFP的结构图 Figure 1 The expression vector pC1300th-Pclt1-GFP for promoter functional analysis |
质粒pC1300th-Pclt1-GFP采取冻融法转化到农杆菌AgL1中,农杆菌介导弯孢菌的遗传转化参照Gao等[6]的方法进行。将得到的拟转化子进行单胞分离,继代后,再用含潮霉素的培养基验证。对转化子进行PCR检测,并在共聚焦激光扫描显微镜下对阳性转化子进行分析,GFP信号的激发通道为488nm,接受通道为500~560nm (绿色)。
2 结果与分析 2.1 CLT-1蛋白的组成及理化性质利用ExPaSyProtparam (http://web.expasy.org/protparam/) 分析clt-1编码的氨基酸组成及理化性质。结果表明,clt-1基因编码745个氨基酸残基,分子质量为81.984 8kDa,等电点分别为8.62;不稳定性系数为55.08,280nm消光系数为53 455,是不稳定性蛋白质。
2.2 CLT-1蛋白的疏水性/亲水性分析和活性位点定位分析采用ExPaSyScale (http://web.expasy.org/protscale/) 对CLT-1的疏水性/亲水性进行预测。结果表明,CLT-1第57位的S有最大值为1.778,疏水性最强;第507位的R有最小值-3.244,亲水性最强。CLT-1中76.5%的氨基酸位于亲水区域,整个多肽链表现为亲水性 (图 2)。

|
| 图 2 CLT-1蛋白的疏水性/亲水性分析 Figure 2 Polar analysis of CLT-1 |
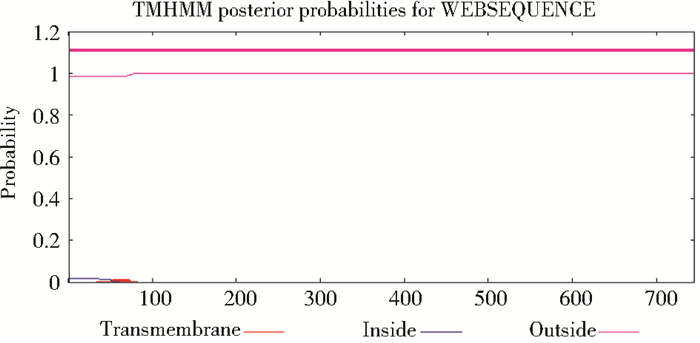
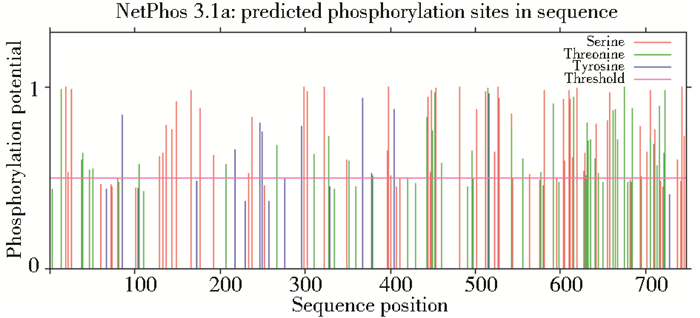
采用CBS预测网站 (http://www.cbs.dtu.dk/services) 对CLT-1蛋白序列跨膜结构域进行预测,发现其存在1个膜外区域,这与该肽链具有明显的亲水性相一致 (图 3)。通过在线软件PSORT (http://psort.hgc.jp/) 和BaCelLo (http://gpcr.biocomp.unibo.it/bacello/pred.htm) 预测CLT-1的亚细胞定位,结果表明,CLT-1定位于细胞核的K-NN百分率为60.0%,这与蛋白质疏水性/亲水性及跨膜结构域的预测结果一致。同时通过CBS预测网站对CLT-1蛋白中丝氨酸激酶、苏氨酸激酶与酪氨酸激酶的磷酸化位点进行在线分析,发现CLT-1含有54个丝氨酸激酶磷酸化位点、41个苏氨酸激酶磷酸化位点及10个酪氨酸激酶磷酸化位点 (图 4)。结果表明,CLT-1能够被激酶磷酸化,从而实现其功能的调控。
|
| 图 3 CLT-1蛋白的跨膜结构域预测 Figure 3 Transmembrane domain prediction of CLT-1 |
|
| 图 4 CLT-1蛋白的磷酸化位点预测 Figure 4 Phosphorylation sites prediction of CLT-1 |
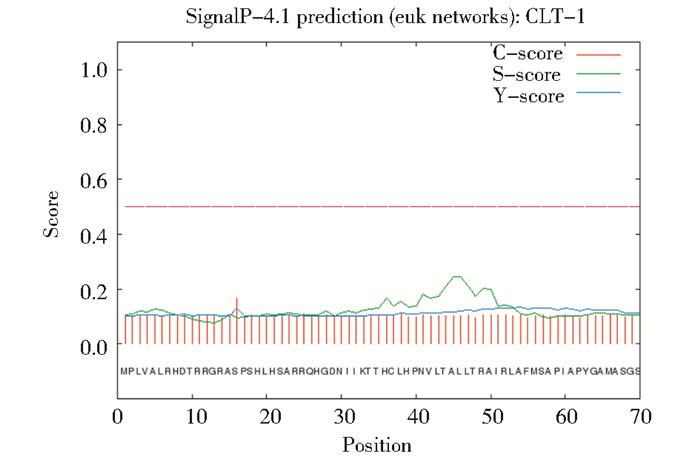
利用在线软件InterProScan (http://www.ebi.ac.uk/interpro/) 预测蛋白质结构域,结果显示CLT-1蛋白169~241位氨基酸残基存在一个典型的BTB结构域。利用在线软件SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/) 预测蛋白质的信号肽,在CLT-1中未发现信号肽序列,CLT-1蛋白为非分泌性蛋白 (图 5)。
|
| 图 5 CLT-1蛋白的信号肽预测 Figure 5 Signal peptide prediction of CLT-1 |
利用Bimas软件对已得到的clt-1基因5′端1 207bp非翻译区进行启动子区预测,发现在起始密码子前的这段序列中有明显的启动子特征区,在Bimas的分析中显示转录起始位点在903bp处,即位于起始密码子上游305bp处。在1 127bp,即位于起始密码子上游563bp处发现了TATA框。
2.6 启动子功能活性检测质粒的构建根据已知的clt-1基因5′端非编码区序列、GFP基因和TtrpC终止子设计特异性引物,PCR扩增分别获得长度为1 207bp、720bp和481bp的核苷酸序列 (图 6)。

|
| 图 6 启动子功能活性检测表达质粒的构建 Figure 6 Construction of the expression vector for promoter functional analysis (a) 1, 2: 5′ non-coding sequence of clt-1 (b) 1, 2: Gfp sequence (c) 1, 2: Ttrpc sequence M1: DL2000 DNA Maker; M2:DL5000 DNA Maker |
使用一步法克隆试剂盒将以上3个含有重叠区域的DNA片段同时连入经Hind Ⅲ和Pst Ⅰ双酶切的pCAMBIA1300th载体中,测序正确后用于农杆菌转化。
2.7 转化感受态农杆菌以1×106个/ml的分生孢子浓度进行遗传转化,潮霉素为抗性筛选标记,利用AgL1农杆菌菌株,转化5~7天后可以形成转化子,获得玉米弯孢叶斑病菌转化子。
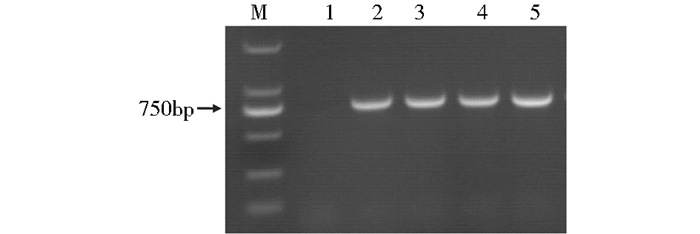
2.8 转化子的PCR鉴定从pC1300th-Pclt1-GFP质粒转化的再生平板上获得的转化子提取DNA并利用GFP基因引物进行PCR鉴定。从图 7中可知,野生型CX-3中没有检测出GFP基因,而挑取的转化子基因组中成功导入了GFP基因。
|
| 图 7 转化子基因组DNA的PCR扩增电泳图 Figure 7 PCR amplification of genomic DNA from transformants M: DL2000 DNA Maker; 1:CX-3; 2~5:Transformants |
将PCR扩增为阳性的转化子菌丝和分生孢子固定在盖玻片上,在共聚焦激光扫描显微镜下检测绿色荧光蛋白的表达,4个pC1300th-Pclt1-GFP转化子的菌丝均可以发出强烈的绿色荧光,说明clt-1基因的启动子可以驱动外源GFP基因在弯孢菌中表达的活性 (图 8)。

|
| 图 8 荧光显微镜下观察到的荧光菌丝和孢子 Figure 8 The hyphae and spores under fluorescent electronic microscope |
前期研究通过ATMT方法共获得3 000个转化子,经过生物学性状及致病性分析发现T806在菌落形态、生长速率、产孢量、产色素及毒素等方面都发生了显著的变化[7]。经NCBI nucleotide blast比对发现,在T-DNA右翼有一段长2 384bp的DNA序列。通过巢式PCR扩增得到了标记基因clt-1,推测突变体表现的性状可能是T-DNA破坏了该基因的转录与表达所致。
将clt-1基因敲除后,弯孢菌的大多数形态特征与野生株相比没有发生明显的变化,却在黑色素和毒素产生能力上发生了变化,说明该基因表达产物可能以不同的形式参与致病相关次生代谢物的形成[6, 8]。敲除子色素的变化也受到pH的影响,在低pH (3~4) 条件下黑色素的合成完全受到阻碍,因此推测CLT-1蛋白可以与受pH调控的蛋白质互作而影响色素合成相关的基因表达。同时,敲除子产孢能力明显下降,可以推测该基因也可能是病菌产生分生孢子与次生代谢物的调控网络的交叉节点之一。
为了进一步丰富对新基因clt-1的认识,我们对该基因编码蛋白质进行了生物信息学分析。研究发现CLT-1蛋白具有BTB蛋白质-蛋白质互作结构域,它是基因调控网络的重要表现形式。此类似现象在其它病原真菌中也有发现。例如,在稻瘟病菌 (Magnaporthe grisea) 中的MgRac-1蛋白与Chem1蛋白作用调控孢子的产生,与Nox蛋白互作决定其致病性,两条信号通路通过MgRac-1蛋白相互交叉在一起[9-10]。对于病原真菌而言,产孢能力、黑色素和毒素产生水平是公认的致病因子[11]。从这个意义上推测,要全息化认识clt-1基因在弯孢叶斑病菌产生致病因子调控网络中的作用本质需要从基因组学和代谢组学角度深入研究。
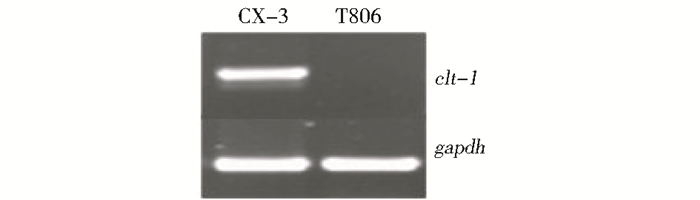
启动子是指位于结构基因5′端上游,能够被RNA聚合酶和其他转录因子识别并与之结合,从而起始基因转录的一段DNA序列,是基因表达调控的重要顺式作用元件,直接关系到目的基因表达。RT-PCR证实T-DNA插入破坏了clt-1基因的转录与表达 (图 9)。绿色荧光蛋白基因 (GFP基因) 是一种来源于水母 (Aequorea victoria) 的新颖报告基因,与其它报告基因相比该基因具有对真菌无毒害且便于检测等优点。为了进一步证实T-DNA破坏的序列是否具有启动子活性,本试验利用GFP基因为报告基因,检测clt-1基因启动子的活性。结果表明,clt-1基因的启动子可以驱动外源GFP基因在弯孢菌中表达的活性。本文对clt-1基因进行了生物信息学分析,并且对启动子活性进行了鉴定,为进一步研究玉米弯孢叶斑病菌毒素合成及致病机制奠定了基础。
|
| 图 9 RT-PCR分析clt-1的表达 Figure 9 RT-PCR analysis of the expression of clt-1 |
| [1] | 吕国忠, 陈捷, 白金铠, 等. 我国玉米病害发生现状及防治措施. 植物保护, 1997, 23(4) : 20–21. Lv G Z, Chen J, Bai J K, et al. The occurrence status and control measures of maize disease in China. Plant Protection, 1997, 23(4) : 20–21. |
| [2] | 李富华, 王玉涛, 潘开文. 玉米弯孢叶斑病研究现状、问题与展望. 植物保护, 2004, 30(6) : 5–10. Li F H, Wang Y T, Pan K W. Progresses, problems and prospects of maize Curvularia leaf spot disease. Plant Protection, 2004, 30(6) : 5–10. |
| [3] | 赵君, 王国英, 胡剑, 等. 玉米弯孢菌叶斑病抗性的ADAA遗传模型的分析. 作物学报, 2002, 27(1) : 127–130. Zhao J, Wang G Y, Hu J, et al. Genetic analysis of maize resistance to Curvularia leaf spot by ADAA model. Acta Agronomica Sinica, 2002, 27(1) : 127–130. |
| [4] | 傅俊范, 李海春, 白元俊, 等. 玉米弯孢菌叶斑病传播梯度模型. 植物病理学报, 2003, 33(5) : 456–461. Fu J F, Li H C, Bai Y J, et al. Spread gradient model of leaf spot disease (Curvularia lunata) in maize. Acta Phytopathologica Sinica, 2003, 33(5) : 456–461. |
| [5] | 薛春生, 肖淑芹, 翟羽红, 等. 玉米弯孢叶斑病菌致病类型分化研究. 植物病理学报, 2008, 38(1) : 6–12. Xue C S, Xiao S Q, Zhai Y H, et al. Pathogenicity differentiation of Curvularia lunata. Acta Phytopathologica Sinica, 2008, 38(1) : 6–12. |
| [6] | Gao J X, Liu T, Chen J. Insertional mutagenesis and cloning of the gene required for the biosynthesis of the non-host specific toxin in Cochliobolus lunatus that causes maize leaf spot. Phytopathology, 2014, 104(4) : 332–339. DOI:10.1094/PHYTO-07-13-0190-R |
| [7] | Liu T, Liu L X, Jiang X, et al. Agrobacterium-mediated transformation as a useful tool for the molecular genetic study of the phytopathogen Curvularia lunata. Europe Journal of Plant Pathology, 2010, 126(3) : 363–371. DOI:10.1007/s10658-009-9541-0 |
| [8] | Gao J X, Jing J, Liu T, et al. Identification of Clt-1-regulated proteins associated with the production of non-host-specific toxin and pathogenicity in Cochliobolus lunatus. Journal of Phytopathology, 2015, 163(1) : 33–41. DOI:10.1111/jph.2014.163.issue-1 |
| [9] | Chen J S, Zheng W, Zheng S Q, et al. Rac1 is Required for pathogenicity and Chem1-dependent conidiogenesis in rice fungal pathogen Magnaporthe grisea. PLoS One, 2008, 4(11) : 1–16. |
| [10] | Yi M, Park J H, Ahn J H, et al. MoSNF1 regulates sporulation and pathogenicity in the rice blast fungus Magnaporthe oryzae. Fungal Genetics and Biology, 2008, 45(8) : 1172–1181. DOI:10.1016/j.fgb.2008.05.003 |
| [11] | Steiner U, Oerke E C. Localized melanization of appressoria is required for pathogenicity of Venturia inaequalis. Phytopathology, 2008, 97(10) : 1222–1230. |
 2017, Vol. 37
2017, Vol. 37




