文章信息
- 盛彬, 杨帆, 孙心旖, 陈瑶, 李莉, 杨建一, 杜圣家, 刘铭.
- SHENG Bin, YANG Fan, SUN Xin-yi, CHEN Yao, LI Li, YANG Jian-yi, DU Sheng-jia, LIU Ming.
- GPRC6A过表达前列腺癌细胞株构建及EMT相关研究
- Construction of the Stable Prostate Cancer Cell Lines Overexpress GPRC6A and EMT Study
- 中国生物工程杂志, 2017, 37(3): 18-26
- China Biotechnology, 2017, 37(3): 18-26
- http://dx.doi.org/DOI:10.13523/j.cb.20170303
-
文章历史
- 收稿日期: 2016-09-29
- 修回日期: 2016-11-12
2. 北京协和医学院研究生院 北京 100005
2. Peking Union Medical College and Chinese Academy of Medical Sciences, Graduate School, Beijing 100005, China
近年来, 随着我国老龄化人口的增长, 前列腺癌正成为严重影响我国男性健康的泌尿系恶性肿瘤[1-2]。前列腺癌好发骨转移,加重病情的发展[3]。有必要寻找前列腺癌骨转移的标志物,为前列腺癌骨转移有效防治提供新思路和药物作用的新靶点。
GPRC6A是2004年发现的G蛋白耦联受体C家族成员,位于染色体6q22.31,与已证实的G蛋白耦连受体C家族成员有很大的同源性,同样拥有7TM和异常长ATD,GPRC6A在脑、骨骼肌、睾丸和白细胞中大量表达,并广泛表达于其他组织[4-5]。
上皮间质转化 (epithelial-mesenchymal transition, EMT) 是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,最早发现在心脏细胞形态变化过程中起作用[6]。多项研究发现,EMT参与肿瘤的转移和侵袭,与肿瘤进程相关, 同时受多种转录因子调控,如Snail、Slug、Twist和Zeb1/2等[7-9]。
病例-对照研究表明,GPRC6A与前列腺癌的风险相关[10-12]。Pi等[13]在细胞和动物实验中发现GPRC6A能够促进前列腺癌细胞增殖,GPRC6A缺陷小鼠前列腺癌进程缓慢,小鼠生存率明显提高。我们课题组在前期研究中发现,改变GPRC6A基因表达会影响前列腺癌细胞的迁移和侵袭能力[14]。我们假设GPRC6A可能在前列腺癌转移中发挥作用。在本次研究中,我们尝试构建稳定过表达GPRC6A基因的前列腺癌细胞株,并探讨其对细胞迁移和侵袭能力的影响,检测肿瘤转移相关的EMT因子表达,为以后GPRC6A在前列腺癌发生发展中机制的研究奠定基础。
1 材料 1.1 细胞和载体HEK-293T细胞购置于中国科学医学院基础医学研究所细胞资源中心。Lncap C4-2细胞购自北京博奥派克生物科技有限公司。pCDH-CMV-MCS-EF1-GFP+Puro (CD513B) 慢病毒载体购置于汉恒生物科技有限公司。
1.2 主要试剂和耗材RPMI1640培养基、FBS及Trizol购置于Life Technologies公司。DNA marker、质粒小提试剂盒、质粒大提试剂盒、DNA纯化试剂盒、凝胶回收试剂盒购置于Qiagen公司。NovoRec® PCR一步定向克隆试剂盒购置于上海近岸科技有限公司。限制性内切核酸酶、dNTP、TaqDNA聚合酶、T4 DNA连接酶、反转录酶、PCR及qRT-PCR检测试剂盒及DNA marker购置于宝生物工程 (大连) 有限公司。VigoFect转染试剂购置于北京威格拉斯生物技术有限公司。Puromincin购置于Sigma公司。蛋白质提取试剂盒、BCA蛋白定量试剂盒及SDS-PAGE凝胶试剂盒购置于普利莱生物有限公司。兔抗GPRC6A购置于Abcam公司,鼠单抗β-actin购置于Sigma公司,辣根过氧化物酶标记羊抗兔、辣根过氧化物酶标记羊抗鼠二抗购置于中杉金桥生物有限公司。蛋白质预染marker购置于Fermentas公司。PVDF膜购置于Millipore公司。Matrigel及其余化学分析纯购置于Sigma公司。细胞培养皿、多孔培养板及Transwell小室购置于康宁公司。PCR引物由Oligo6.0设计并由上海生工生物公司合成。
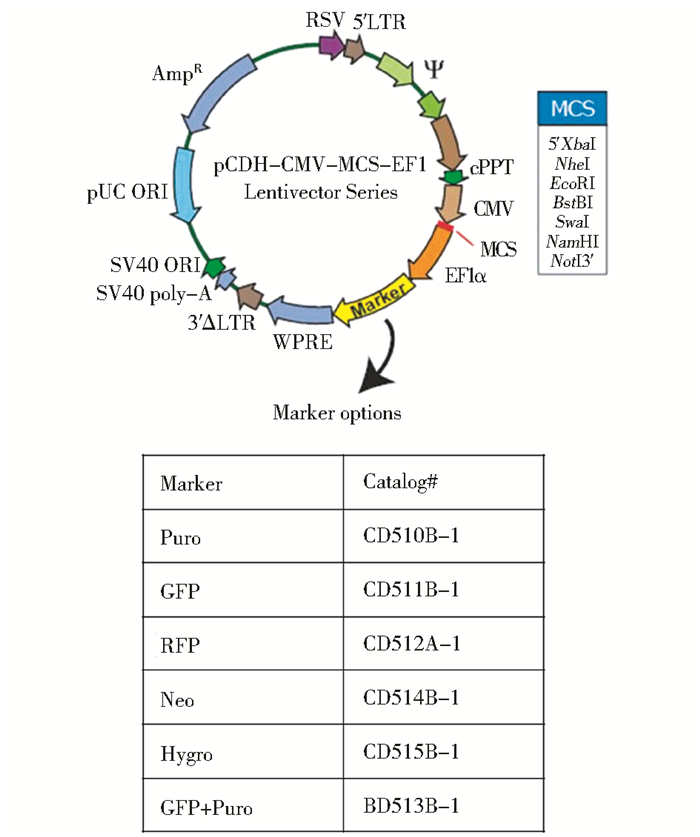
2 方法 2.1 重组质粒的构建和鉴定对GPRC6A用6对引物分段扩增单个外显子小片段 (引物序列见表 1)。PCR反应条件:95℃预变性5min,95℃变性30s,58℃退火30s,72℃延伸10min,16℃结束反应。取少量扩增产物进行琼脂糖凝胶电泳检测。随后将6个外显子小片段两两进行拼接,使用Novorec将三个片段接入pCDH-CMV-MCS-EF1-GFP+Puro慢病毒载体 (载体信息见图 1),使用pCDH测序引物进行菌落PCR鉴定,同时随机取6个菌落,送1ml菌液测序,使用Seq Builder预测ORF。
| GPRC6A外显子上的扩增小片段 | 引物 | 产物长度 (bp) |
| 片段1 | pCDH-FLAG+GPRC6A F①: tttgacctccatagaagattctagaatggactacaaggacgac | 274 |
| R②: GAAAAACTGATATTTCAAAGCCAACACACTCCTGGAT | ||
| 片段2 | F: atccaggagtgtgttggctttgaaatatcagtttttc | 338 |
| R: TTGATTCATAACCCACCTGTGGCATGAGCTGTAAATTC | ||
| 片段3 | F: gaatttacagctcatgccacaggtgggttatgaatcaac | 881 |
| R: CATTTTTTAGCACACCAAGTAACTCCCATGGTTGAAAGGCGT | ||
| 片段4 | F: acgcctttcaaccatgggagttacttggtgtgctaaaaaatg | 253 |
| R: GAGCATTTAGATTGAATTTGCTTAAGATTCCTGAAC | ||
| 片段5 | F: gttcaggaatcttaagcaaattcaatctaaatgctc | 162 |
| R: CATAAAAGGCAGTGAGGCATATCTGTCTGATTAGTGTAATG | ||
| 片段6 | F: cattacactaatcagacagatatgcctcactgccttttatg | 1153 |
| pCDH-GPRC6A R:ATCGCAGATCCTTCGCGGCCGCTCATATACTTGACATTCTTTTTC | ||
| Note: ①F: Forward; ②R: Reverse | ||
|
| 图 1 pCDH-CMV-MCS-EF1-GFP+Puro慢病毒载体 (CD513B-1) 信息 Figure 1 Information of the pCDH-CMV-MCS-EF1-GFP+Puro lentivirus vector (CD513B-1) |
实验前一天将293T细胞铺60mm培养皿,第二天达70%~80%可转染。包装慢病毒载体pCDH-GPRC6A (对照pCDH空载体)5μg,加生理盐水至250μl。同时取转染试剂VigoFect 4μl,加生理盐水至250μl,静置5min后,轻轻将两者混匀静置20min,均匀加入293T细胞培养皿中,放入孵箱6h后更换新鲜完全培养液,24h后观察荧光。培养48h后,取一半转染慢病毒载体的293T细胞Trizol提取RNA反转录并通过RT-PCR在mRNA水平检测293T细胞中GPRC6A的表达。反转录反应条件:37℃ 15min → 85℃ 5s→4℃ 2min。RT-PCR反应条件:95℃ 30s→95℃ 5s→60℃ 30~34s (循环40次)→72℃ 31s。所用引物见表 2。取另一半转染慢病毒载体的293T细胞,提取蛋白,BCA法定量后,进行SDS-PAGE电泳分离并转印至PVDF膜,经5%脱脂奶粉TBST室温封闭60min后,分别孵育抗GPRC6A单抗 (1:1 000) 和β-actin,4℃摇床4℃过夜,TBST洗膜5min×5次,室温下孵育二抗 (1:5 000)60min,TBST洗膜5min×5次后,ECL发光液孵育后化学发光仪进行检测。
| 引物 | 序列 | 产物长度 (bp) |
| GPRC6Art F①1 | CCGGGACATATCATAATTGGAGG | 234 |
| GPRC6Art R②1 | CATTGCCACTGTGACTTCTGT | |
| GPRC6Art F2 | TAAGGCTGTCATAGGTTCTGGG | 78 |
| GPRC6Art R2 | TGTGGCATGAGCTGTAAATTCA | |
| GPRC6Art F3 | TCCTGAGTGACAAAATTCGCTT | 197 |
| GPRC6Art R3 | GGCTATGCACACGTTATTTGCT | |
| GPRC6Art F4 | GTTGAATTTACAGCTCATGCCACAGGT | 174 |
| GPRC6Art R4 | GTGGTTATGATGCCAATCCAGTTC | |
| Note: ①F: Forward; ②R: Reverse | ||
2.3 慢病毒感染Lncap C4-2细胞及稳定株筛选、鉴定
实验前一天将293T细胞铺100mm培养皿,使第二天转染质粒时细胞密度达70%~80%。包装慢病毒载体pCDH-GPRC6A (对照pCDH空载体) 和辅助质粒vsv-g、rsrv和pmd2.0g各10μg,加生理盐水至250μl。同时取转染试剂VigoFect 4μl,加生理盐水至250μl,静置5min后,轻轻将两者混匀静置20min,均匀加入293T细胞培养皿中,放入孵箱6h后更换新鲜完全培养液,24h后观察荧光。培养48h后,收集富含慢病毒颗粒的细胞上清液,于4℃、4 000g离心10min除去细胞碎片,并以0.45μm滤器过滤上清液,于离心管中,使用上清液感染LncapC4-2细胞,培养24h后去掉病毒上清液再以同样方法二次感染LncapC4-2细胞,培养24h后,荧光显微镜下观察荧光。LncapC4-2慢病毒感染48h后用0.7μg/ml puromycin药物筛选 (前期实验确定最优筛选浓度),每隔一天换用新鲜含puromycin的完全培养基,10天后抗性群落能被识别并扩大培养。在荧光显微镜下将带有绿色荧光的克隆挑入96孔板,长满后移入24孔板继续扩大培养建立稳定过表达GPRC6A的细胞株 (C4-2 GPRC6A),冻存细胞用于后续实验。同时以相同方法建立稳定的没有连接目的基因的对照pCDH慢病毒感染的Lncap C4-2细胞株 (C4-2 pCDH)。RT-PCR和Western blot方法分别在mRNA和蛋白质水平验证GPRC6A表达。
2.4 细胞划痕和transwell侵袭实验LncapC4-2细胞实验前一天铺于6孔板使第二天细胞有80%~90%汇合,包含1% FBS的1640培养液处理细胞24h。用10μl无菌枪头和直尺在培养皿中心划一条直线,用DPBS洗细胞3次以去除划下的细胞,加入完全培养基,荧光倒置显微镜下随机5个视野拍照,37℃、5%CO2培养箱培养24h后荧光显微镜下拍照观察划痕愈合情况。
用1mg/ml matrigel 60μl包被小室聚碳酸酯膜上层,将LncapC4-2细胞用1% FBS的1 640制成浓度为5×105/ml的细胞悬液,取200μl细胞悬液铺种到小室上方,小室下方的24孔板中加入700μl 10% FBS的1640培养基。CO2培养箱中培养24h后取出,PBS洗小室两次,4%多聚甲醛固定20min,PBS洗一次,0.1%结晶紫染色20min,PBS洗3次,倒置显微镜下观察拍照。
2.5 GPRC6A过表达和EMT相关因子表达Lncap C4-2细胞Trizol法提取RNA并反转录 (方法同2.2),qPCR检测EMT相关指标E-cad和SNAIL的表达,按照试剂盒方法进行。所用引物见表 3。
| 基因 | 引物 |
| E-cad | F①: AGACCAAGTGACCACCTTAG |
| R②: GCAGCAGAATCAGAATTAGCAAAG | |
| SNAIL | F: GTGGTTCTTCTGCGCTACTG |
| R: GGCTGCTGGAAGGTAAACTCTG | |
| GAPDH | F: CAACAGCCTCAAGATCATCAGCA |
| R: TGGCATGGTCTGTGGTCATGAGT | |
| Note:①F: Forward; ②R: Reverse | |
2.6 统计学分析
所有数据采用SPSS17.0统计软件进行统计学分析,两组间比较采用Student’s-t检验,P<0.05为差异有统计学意义。
3 结果 3.1 重组质粒的构建和鉴定6个外显子小片段及拼接的3个片段的扩增结果琼脂糖凝胶电泳显示条带大小正确。将3个条带拼接在一起,琼脂糖凝胶电泳结果为2 866bp,与理论值相近,提示GPRC6A扩增成功。将扩增产物连接于pCHD载体上,检测条带大小正确,菌落PCR鉴定,可以扩增出来阳性菌落,随机取6个菌落,送1ml菌液测序,测序结果正确,使用Seq Builder预测ORF (再次确定可以表达),存在所要的ORF,构建质粒瞬转HEK-293T细胞证明GPRC6A过表达质粒pCDH-GPRC6A构建成功 (图 2)。

|
| 图 2 重组质粒构建片段扩增及鉴定 Figure 2 Amplification and identification of recombinant plasmid (a) Six small fragments amplification, from left to right, the fragment lengthare 274bp, 338bp, 881bp, 253bp, 162bp and 1 153bp respectively, red arrows are tagged as amplified fragments (b) Three segments connected by six small fragments from left to right are 612bp、1 134bp and 1 315bp, respectively, red arrows are tagged as amplified fragments (c) PCR identification of the positive colon products (426bp), the used marker is TAKARA LD1000 (d) The results of the sequencing of the clones consistent with cDNA GPRC6A sequence alignment, 4 fragments were randomly selected |
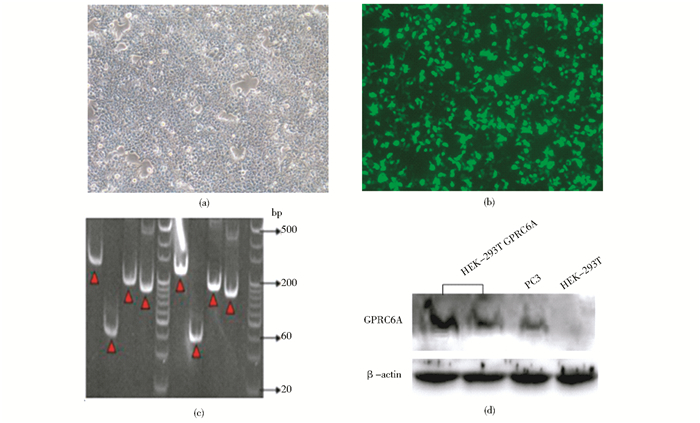
目的质粒转染HEK-293T细胞48h后荧光倒置显微镜观察荧光,可见多数细胞发出绿色荧光。转染48h后,RT-PCR检测结果显示转染GPRC6A慢病毒载体的HEK-293T的GPRC6A mRNA上扩增片段与以cDNA为模板扩增的片段大小一致。Western blot检测GPRC6A蛋白表达结果显示,GPRC6A过表达载体在弱表达GPRC6A的HEK-293T细胞中表达。进一步证明了GPRC6A过表达质粒pCDH-GPRC6A构建成功 (图 3)。
|
| 图 3 慢病毒载体转染293T细胞及GPRC6A表达鉴定 Figure 3 Detection expression and identification of GPRC6A in 293T cells transfected with lentivirus vector GPRC6A (a) The white light observation of HEK-293T cells transfected pCDH-GPRC6A lentiviral vector after 48h (b) The fluorescence observation of GFP expression in HEK-293T cells transfected pCDH-GPRC6A lentiviral vector after 48h (c) Detection the expression of GPRC6A in mRNA level, the cDNA template From the transfected HEK-293T cells (left), the cDNA template; From the splicing cDNA (right); The band size was in agreement with the expected positive results; Red arrows are tagged as amplified fragments, the used DNA marker is TAKARA 20bp ladder (d) Detection of protein level expression of GPRC6A by Western blot |
慢病毒两次感染Lncap C4-2的细胞48h后经puromycin药物筛选扩大培养后荧光倒置显微镜下可见细胞均有GFP表达。分别用RT-PCR和Western blot验证GPRC6A在过表达的LncapC4-2细胞中mRNA和蛋白质水平的表达。以LncapC4-2 pCDH作为对照,LncapC4-2 GPRC6A细胞中的GPRC6A的mRNA和蛋白质水平都明显上调。以上结果说明,过表达GPRC6A的LncapC4-2前列腺癌细胞株构建成功 (图 4)。

|
| 图 4 稳定过表达GPRC6A和对照Lncap C4-2细胞株的建立及鉴定 Figure 4 Construction and identification of stable overexpression of GPRC6A LncapC4-2 pCDH cells and control LncapC4-2 pCDH cells (a) The white light observation of control LncapC4-2 pCDH cells (b) The fluorescence observation of GFP expression in control LncapC4-2 pCDH cells (c) The white light observation of GPRC6A overexpression LncapC4-2 cells (d) The fluorescence observation of GFP expression in GPRC6A overexpression LncapC4-2 cells (e) Detection of GPRC6A expression in mRNA level (f) Detection of GPRC6A expression in protein level, red arrows are tagged as GPRC6A |
LncapC4-2 GPRC6A细胞的24h迁移能力和侵袭能力都比对照LncapC4-2 pCDH细胞增强。EMT相关基因的qRT-PCR结果显示表达GPRC6A的LncapC4-2细胞中SNAIL的mRNA水平比空载LncapC4-2细胞都增加,而E-cad的表达则降低,差异具有显著性 (P < 0.05)(图 5)。

|
| 图 5 GPRC6A过表达LncapC4-2细胞划痕和transwell实验及EMT相关基因表达 Figure 5 Identification of EMT phenotype of the LncapC4-2 cell stably transfected overexpression of GPRC6A (a) Wound healing results showed the migration capacities of Lncap C4-2 pCDH cells and Lncap C4-2 GPRC6A cells (b) Transwell results showed the invasive capacities of Lncap C4-2 pCDH cells and Lncap C4-2 GPRC6A cells (c) The mRNA levels of E-cad tested by QPCR (d) The mRNA levels of Snail tested by QPCR |
前列腺癌的发生与遗传因素、环境、饮食及其他因素相关。骨骼是最常见的前列腺癌转移器官,超过80%~90%的前列腺癌患者最终会发生骨转移[15]。GPRC6A是新发现的G蛋白耦连受体C家族成员,能够被氨基酸和阳离子、骨钙素激活,同时受睾酮作用[16-18]。而骨钙素由成骨细胞分泌,因此我们推测GPRC6A可能参与前列腺癌的骨转移。
为了更好地研究GPRC6A基因在前列腺癌细胞转移中的作用以及后续动物实验建模,我们使用慢病毒感染目的细胞,将构建的载体基因整合基因组,从而能够长时间、稳定表达目的基因GPRC6A。构建稳定细胞株的关键是选择一种易于检测和筛选的载体质粒,本实验使用的是具有Puromycin和GFP双筛选标记的慢病毒过表达载体pCDH-CMV-MCS-EF1 Lentivector Series,能够更好地筛选出GPRC6A表达的单克隆细胞,保证动物实验的造模稳定性。由于目的基因GPRC6A的cDNA较大,约为2 866bp,原计划使用GPRC6AF+GPRC6AR,以PC3 cDNA为模板PCR得到全长,再将上游引物换成通用引物加入pCDH接头。扩增失败后改用以PC3基因组DNA为模板,扩增单个外显子小片段拼接方法获得GPRC6A基因的cDNA序列。另外,基因过长还会导致包装出来的病毒滴度较低,故实验选择二次感染目的细胞的方法建立稳定过表达目的基因的前列腺癌LncapC4-2 GPRC6A细胞株。实验选用的LncapC4-2细胞,是从LNcap细胞动物造模后筛选出的有骨转移能力的细胞株,对以后动物原位前列腺癌转移模型制备有重要意义。
通过EMT可以使肿瘤细胞丢失上皮特性,从而获得侵袭能力[19]。EMT受多种因子的调控,不同程度相关因子的表达改变会引起细胞间粘连和细胞形态的改变,参与细胞的转移和侵袭[20]。
E-cad是EMT密切相关蛋白,广泛分布于成熟组织的上皮细胞,能够促进细胞的黏附聚集,维持细胞极性和形态结构。并伴随着EMT进程,E-cad的表达显著降低[21-23]。在本次研究中我们发现,我们构建的过表达GPRC6A的前列腺癌LncapC4-2细胞中,E-cad表达降低。Snail在中胚层和神经嵴的前体中能够引起EMT作用,也能够通过与E-cad启动子区域相互作用,抑制上皮表型的表达,参与肿瘤的EMT过程[24-25]。在本次研究中,构建的过表达GPRC6A的LncapC4-2细胞的SNAIL表达量增加。表明GPRC6A与前列腺癌的EMT进程密切相关。同时迁移和侵袭实验也提示GPRC6A可以促进前列腺癌细胞的转移。
综上所述,我们课题组成功构建了过表达GPRC6A的前列腺癌细胞以及进行了转移相关表型和EMT相关研究,过表达GPRC6A的前列腺癌细胞株形态稳定,荧光强烈、细胞迁移和侵袭表型明显,GPRC6A过表达细胞有EMT相关基因的差异表达,是研究GPRC6A在前列腺癌发生发展过程中EMT作用机制及动物研究的理想工具细胞。
| [1] | 齐金蕾, 王黎君, 周脉耕, 等. 1990-2013年中国男性前列腺癌疾病负担分析. 中华流行病学杂志, 2016, 37(6) : 778–782. Qi J L, Wang L J, Zhou M G, et al. Disease burden of prostate cancer among men in China, from 1990 to 2013. Chinese Journal of Epidemiology, 2016, 37(6) : 778–782. |
| [2] | Wong M C, Goggins W B, Wang H H, et al. Global incidence and mortality for prostate cancer:analysis of temporal patterns and trends in 36 countries. Eur Urol, 2016, 70(5) : 862–874. DOI:10.1016/j.eururo.2016.05.043 |
| [3] | Bergstrom S H, Rudolfsson S H, Bergh A. Rat prostate tumor cells progress in the bone microenvironment to a highly aggressive phenotype. Neoplasia, 2016, 18(3) : 152–161. DOI:10.1016/j.neo.2016.01.007 |
| [4] | Wellendorph P, Brauner-Osborne H. Molecular cloning, expression, and sequence analysis of GPRC6A, a novel family C G-protein-coupled receptor. Gene, 2004, 335(1) : 37–46. |
| [5] | Clemmensen C, Smajilovic S, Wellendorph P, et al. The GPCR, class C, group 6, subtype A (GPRC6A) receptor:from cloning to physiological function. Br J Pharmacol, 2014, 171(5) : 1129–1141. DOI:10.1111/bph.12365 |
| [6] | Bolender D L, Markwald R R. Epithelial-mesenchymal transformation in chick atrioventricular cushion morphogenesis. Scan Electron Microsc, 1979, 3(3) : 313–321. |
| [7] | Boyer B, Valles A M, Edme N. Induction and regulation of epithelial-mesenchymal transitions. Biochem Pharmacol, 2000, 60(8) : 1091–1099. DOI:10.1016/S0006-2952(00)00427-5 |
| [8] | Hanahan D, Weinberg R A. Hallmarks of cancer:the next generation. Cell, 2011, 144(5) : 646–674. DOI:10.1016/j.cell.2011.02.013 |
| [9] | Gonzalez R S, Huh W J, Cates J M, et al. Micropapillary colorectal carcinoma clinical, pathologic, and molecular properties, including evidence of epithelial-mesenchymal transition. Histopathology, 2016, 70(2) : 223–231. |
| [10] | Takata R, Akamatsu S, Kubo M, et al. Genome-wide association study identifies five new susceptibility loci for prostate cancer in the Japanese population. Nat Genet, 2010, 42(9) : 751–754. DOI:10.1038/ng.635 |
| [11] | Lindström S, Schumacher F R, Campa D, et al. Replication of five prostate cancer loci identified in an Asian population——results from the NCI breast and prostate cancer cohort consortium (BPC3). Cancer Epidemiol Biomarkers Prev, 2012, 21(1) : 212–216. DOI:10.1158/1055-9965.EPI-11-0870-T |
| [12] | Wang M, Liu F, Hsing A W, et al. Replication and cumulative effects of GWAS-identified genetic variations for prostate cancer in Asians:a case-control study in the ChinaPCa consortium. Carcinogenesis, 2012, 33(2) : 356–360. DOI:10.1093/carcin/bgr279 |
| [13] | Pi M, Quarles L D. GPRC6A regulates prostate cancer progression. Prostate, 2012, 72(4) : 399–409. DOI:10.1002/pros.21442 |
| [14] | 刘铭. 中国北方人群前列腺癌风险位点识别和GPRC6A基因功能的研究. 北京: 北京协和医学院, 2012. Liu M.Identification of prostate cancer risk SNPs in northern Chinese men and the functional study of GPRC6A gene. Beijing:Peking Union Medical College and Chinese Academy of Medical Sciences, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10023-1012447535.htm |
| [15] | Park J C, Eisenberger M A. Advances in the treatment of metastatic prostate cancer. Mayo Clin Proc, 2015, 90(12) : 1719–1733. DOI:10.1016/j.mayocp.2015.10.010 |
| [16] | Christiansen B, Hansen K B, Wellendorph P, et al. Pharmacological characterization of mouse GPRC6A, an L-alpha-amino-acid receptor modulated by divalent cations. Br J Pharmacol, 2007, 150(6) : 798–807. DOI:10.1038/sj.bjp.0707121 |
| [17] | Pi M, Faber P, Ekema G, et al. Identification of a novel extracellular cation-sensing G-protein-coupled receptor. J Biol Chem, 2005, 280(48) : 40201–40209. DOI:10.1074/jbc.M505186200 |
| [18] | Wang C, Liu Y, Cao J M. G protein-coupled receptors:extranuclear mediators for the non-genomic actions of steroids. Int J Mol Sci, 2014, 15(9) : 15412–15425. DOI:10.3390/ijms150915412 |
| [19] | Gandalovicova A, Vomastek T, Rosel D, et al. Cell polarity signaling in the plasticity of cancer cell invasiveness. Oncotarget, 2016, 7(18) : 25022–25049. |
| [20] | Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition. Nat Rev Mol Cell Biol, 2014, 15(3) : 178–196. DOI:10.1038/nrm3758 |
| [21] | Lee J Y, Kong G. Roles and epigenetic regulation of epithelial-mesenchymal transition and its transcription factors in cancer initiation and progression. Cell Mol Life Sci, 2016, 73(24) : 4643–4660. DOI:10.1007/s00018-016-2313-z |
| [22] | Giannelli G, Koudelkova P, Dituri F, et al. Role of epithelial to mesenchymal transition in hepatocellular carcinoma. J Hepatol, 2016, 65(4) : 798–808. DOI:10.1016/j.jhep.2016.05.007 |
| [23] | Claperon A, Mergey M, Nguyen H T, et al. EGF/EGFR axis contributes to the progression of cholangiocarcinoma through the induction of an epithelial-mesenchymal transition. J Hepatol, 2014, 61(2) : 325–332. DOI:10.1016/j.jhep.2014.03.033 |
| [24] | Peinado H, Olmeda D, Cano A. Snail, Zeb and bHLH factors in tumour progression:an alliance against the epithelial phenotype. Nat Rev Cancer, 2007, 7(6) : 415–428. DOI:10.1038/nrc2131 |
| [25] | Zhou B, Zhan H, Tin L, et al. TUFT1 regulates metastasis of pancreatic cancer through HIF1-Snail pathway induced epithelial-mesenchymal transition. Cancer Lett, 2016, 382(1) : 11–20. DOI:10.1016/j.canlet.2016.08.017 |
 2017, Vol. 37
2017, Vol. 37




