文章信息
- 吉彩霞, 刘晓骅, 徐丽, 董超群, 罗进勇.
- JI Cai-xia, LIU Xiao-hua, XU Li, DONG Chao-qun, LUO Jin-yong.
- Runx1促进BMP9诱导的间充质干细胞MEFs的成骨分化
- Runx1 Enhances BMP9-induced Osteogenic Differentiation in Mesenchymal Stem Cell Line MEFs
- 中国生物工程杂志, 2017, 37(3): 10-17
- China Biotechnology, 2017, 37(3): 10-17
- http://dx.doi.org/DOI:10.13523/j.cb.20170302
-
文章历史
- 收稿日期: 2016-08-15
- 修回日期: 2016-10-12
间充质干细胞 (mesenchymal stem cells,MSCs) 具有自我更新和多项分化潜能,在不同诱导条件下可以分化形成骨、软骨等组织。在骨损伤和骨修复过程中,间充质干细胞常作为种子细胞被广泛应用[1-3]。因此,研究其成骨相关的诱导因素成为骨组织工程研究的重点和热点。小鼠胚胎成纤维细胞 (mouse embryonic fibroblast, MEFs) 是间充质干细胞中的一种[4]。骨形态发生蛋白 (bone morphogenetic proteins,BMPs) 属于转化生长因子β(transforming growth factor β, TGF-β) 超家族成员,得名于其促成骨能力。目前分离得到的20余种BMPs中,BMP2、BMP4、BMP6、BMP7和BMP9具有促成骨作用,而本课题前期研究证实BMP9的作用最强[5-6],临床疾病骨缺损和骨不连有望通过BMP9治愈[7],鉴于其临床应用的巨大前景,研究BMP9促成骨的影响因素,为其早日应用于临床提供科学依据, 变得尤为重要。目前研究证实, 大量转录因子参与调节BMP9诱导MSCs向成骨分化,如DLX5、OSX等[8-9],但其他转录因子的作用还有待阐明。Runx1作为Runx家族中的一员,是调节造血干细胞分化的重要转录因子,其基因和蛋白质结构与该家族另一成员Runx2具有高度相似性[10],而Runx2是BMP9诱导MSCs向成骨分化过程中重要的转录因子[11]。随着Runx1在软骨中的作用被发现,我们开始关注它在成骨细胞中的功能,目前已证实Runx1条件敲除的小鼠骨发育不良[12-13]。但它是否参与BMP9促成骨的过程,目前未有研究,因此本课题探讨研究Runx1在BMP9诱导MSCs向成骨分化中的作用。
1 材料与方法 1.1 材料小鼠胚胎成纤维细胞MEFs (购自美国典型菌种保藏中心),HEK293细胞和HCT116细胞 (本实验室保存),BMP9腺病毒 (芝加哥大学医学中心何通川教授惠赠),RFP和GFP腺病毒 (本实验室保存),Runx1基因模板、大肠埃希菌DH10B、含有缺失E1和E3区的野生型腺病毒骨架质粒pAdEasy-1的BJ5183感受态大肠埃希菌、腺病毒穿梭质粒pAdTrace-TO4(本实验室保存),PCR引物、PrimerSTAR高保真酶、普通PCR试剂盒、Trizol及逆转录试剂盒 (TaKaRa公司),KpnⅠ、XhoⅠ、PmeⅠ、PacⅠ(New England Biolab公司),质粒提取试剂盒 (Omega公司),T4 DNA连接酶和Lipofectamine 2000(Invitrogen公司),DMEM高糖培养基 (Hyclone公司),胎牛血清 (Gibico公司),碱性磷酸酶定量检测试剂盒 (BD公司),Naphthol AS-MX碱性磷酸酶溶液、Fast Blue RR Salt、茜素红S、β-磷酸甘油和维生素C (Sigma公司),鼠Runx1一抗和β-actin一抗 (CST公司),辣根过氧化物酶标记的二抗 (中杉金桥),其他试剂均为进口或国产分析纯。
1.2 方法 1.2.1 构建pAdTrace-TO4-Runx1穿梭质粒根据Gen Bank小鼠Runx1基因mRNA序列 (Gen Bank:NM _001754.4) 和在线设计软件设计的相应引物,高保真PCR扩增Runx1的编码序列 (电泳后可观察到1443bp的条带),胶回收扩增产物后用KpnⅠ、XhoⅠ双酶切,乙醇沉淀纯化酶切产物后备用。同时用KpnⅠ、XhoⅠ双酶切穿梭质粒pAdTrace-TO4后, 碱性磷酸酶 (CIP) 处理,将双酶切纯化后的Runx1片段和载体质粒用T4 DNA连接酶连接,纯化连接产物后, 电转入DH10B感受态并取适量细菌铺入含卡那霉素 (100mg/L) 的普通琼脂平板,37℃培养过夜后,挑选不同的单克隆菌落进行PCR筛选, 将筛选产物经琼脂凝胶电泳成像分析 (阳性单克隆菌落电泳后可观察到450bp的条带),挑选3~5个阳性克隆接种于15ml含卡那霉素的LB液体培养基, 37℃、180r/min过夜后,提取质粒,PCR和KpnⅠ、XhoⅠ双酶切鉴定质粒,将阳性克隆质粒送金斯瑞公司进行测序鉴定,验证序列正确性。
1.2.2 重组腺病毒质粒pAd-Runx1的构建及腺病毒的包装扩增将测序正确的穿梭质粒pAdTrace-TO4-Runx1经PmeⅠ酶切线性化后电转入BJ5183感受态与pAdEasy-1骨架质粒进行同源重组,并于含卡那霉素的普通琼脂平板上进行筛选,37℃过夜后,挑取细小的单克隆接种于10ml含卡那霉素的LB液体培养基扩增,37℃、180r/min过夜后提取质粒, 进行质粒筛选和PacⅠ酶切鉴定,将同源重组成功的质粒命名为pAd-Runx1。用PacⅠ酶切重组腺病毒质粒pAd-Runx1,用脂质体Lipofectamine 2000介导转染入HEK293细胞中,于37℃、5% CO2的饱和湿度培养箱中培养,36h后观察报告基因RFP荧光表达量,至80%以上细胞变圆、10%细胞脱落漂浮后收获病毒,并进行逐轮扩增,直至病毒滴度增高。
1.2.3 细胞培养用含10%的胎牛血清、100mmol/L青霉素及100g/L链霉素的DMEM高糖培养基于37℃、5% CO2的饱和湿度培养箱中培养MEFs细胞、HEK293细胞和HCT116细胞,细胞密度达80%~90%后进行传带。
1.2.4 条件培养基的制备将HCT116细胞接种于100mm的细胞培养皿中,当细胞密度达到70%~80%时,加入适量过表达BMP9的腺病毒,保证感染效率为80%~90%,4h后换为不含胎牛血清、青霉素及链霉素的DMEM高糖培养基继续培养,分别收集24h和48h的上清液离心备用。
1.2.5 碱性磷酸酶活性测定及染色将MEFs细胞接种于24孔板中,用含10%胎牛血清、100mmo/L青霉和100g/L链霉素的DMEM高糖培养基培养,待细胞密度达30%~40%后加入适量的Ad-Runx1或Ad-RFP,保证感染效率在30%左右。感染36h后加入BMP9条件培养基,继续培养至第7天,弃去培养基并裂解细胞后,离心取上清液,按试剂盒说明进行ALP活性检测。同时弃去培养基后,加入0.1g /L Naphthol AS-MX碱性磷酸酶溶液和0.6g/L Fast Blue RR Salt混合液250μl进行ALP染色,避光10min后,观察染色结果。
1.2.6 钙盐沉积实验将MEFs细胞接种于24孔板中,用含5%胎牛血清、100mmo/L青霉、100g/L链霉素,以及终浓度为50mg/L维生素C和10mmol/L β-磷酸甘油的DMEM高糖培养基培养,待细胞密度达30%~40%后加入适量的Ad-Runx1或Ad-RFP,保证感染效率在30%左右。继续培养至第14天,弃去培养基,PBS洗两遍后,0.05%戊二醛固定10min,用去离子水洗净固定液并加入0.04%的茜素红染液 (200μl/孔),在显微镜下观察有红色物质堆积时弃去染液并用去离子水终止反应。
1.2.7 RT-PCRMEFs细胞接种于60mm的细胞培养皿中,待细胞密度达40%~50%加入处理因素至所需天数后,提取细胞RNA,按试剂盒说明逆转录为cDNA,RT-PCR检测相关基因表达,PCR扩增产物经2%琼脂糖凝胶电泳,紫外成像后保存结果,所有样本的结果以小鼠基因GAPDH作为内参照。所用引物序列见表 1。
| Gene | Forward primer (5′to 3′) | Reverse primer (5′to 3′) |
| GAPDH | GGCTGCCCAGAACATCAT | CGGACACATTGGGGGTAG |
| Runx1(clone) | AATCGGAAAGCGGAATTTACCATGGCTTCAGACAGCATATTTGA | AAGCGCTCACGGGATACTCGATTTTCAGTAGGGCCTCCACACG |
| Runx1(screening) | ATTGCCAGCCATCACAGTGA | TCGGAAAAGGACAAGCTCCC |
| Runx1 | GCCATGGCTACGGTTCAG | CAGAACCAGCGGTTAGGC |
| Runx2 | GGTGAAACTCTTGTTGTCC | AGTCCCAACTTCCTGTGCT |
1.2.8 Western blot
MEFs细胞接种于100mm的细胞培养皿中,待细胞密度达40%~50%加入处理因素至所需天数后,用不含胎牛血清、青霉素及链霉素的DMEM高糖培养基处理细胞过夜后提取细胞总蛋白质,按操作步骤进行Western blot检测。
1.2.9 统计学分析数据用均数±标准差 (x±s) 表示,组间比较采用单因素方差分析,两组间的比较采用单因素方差分析,统计学数据均用SSPS17.0软件包处理。
2 结果 2.1 BMP9促进间充质干细胞MEFs细胞中Runx1的表达首先,Ad-BMP9和Ad-GFP腺病毒分别感染间充质干细胞MEFs 48h后,提取RNA并逆转录为cDNA,RT-PCR检测发现,较对照组,BMP9可以促进Runx1 mRNA水平的表达[图 1(a)、(b)],用Ad-BMP9和Ad-GFP分别感染MEFs细胞72h后,Western blot检测Runx1蛋白水平的变化,结果发现,较对照组,BMP9可以促进Runx1蛋白水平的表达[图 1(c)、(d)]。

|
| 图 1 MEFs细胞中BMP9对Runx1表达的影响 Figure 1 Effect of BMP9 on Runx1 in MEFs (a), (b) The expression of Runx1 was detected by RT-PCR after exogenous Ad-BMP9 infection for 48h (c), (d) The expression of Runx1 was detected by Western blot after exogenous Ad-BMP9 infection for 72h; GAPDH and β-actin were used as loading control, separately. Data present mean±SD (n=3). * P < 0.05 |
RCR扩增Runx1的编码序列 (1 443bp),凝胶电泳分析显示,1 400bp左右出现明显条带[图 2(a)]。菌落PCR筛选 (阳性筛选产物450bp)、凝胶电泳分析显示,450bp左右出现明显条带[图 2(b)]。质粒PCR筛选、凝胶电泳分析显示,450bp左右出现明显条带[图 2(c)]。质粒KpnⅠ、XhoⅠ双酶切产物凝胶电泳分析显示,1 400bp左右出现明显条带[图 2(d)]。将验证无误的质粒送金斯瑞公司测序,测序结果完全正确。
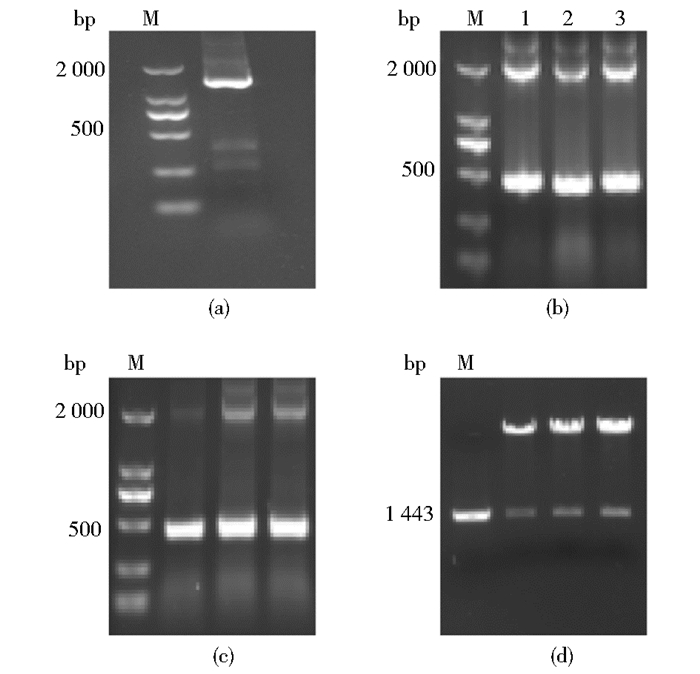
|
| 图 2 Runx1重组腺病毒穿梭质粒的构建 Figure 2 Construction of recombinant plasmid of adenovirus-mediated Runx1 (a) PCR product Runx1 (b) Bacterial colony PCR 1~3: Positive clone (c) Plasmid PCR (d) Double enzyme digest plasmid M: DNA marker |
将线性化的pAdTrace-TO4-Runx1与BJ5183中的pAdEasy-1骨架质粒同源重组,重组后的质粒较pAdEasy-1骨架质粒大 (约30 000bp),重组质粒凝胶电泳分析显示,重组后的质粒 (1~3) 出现在pAdEasy-1骨架质粒 (0) 的后方[图 3(a)]。PacⅠ酶切重组质粒产物凝胶电泳分析显示,重组质粒被切割成1个约30kb的大片段和1个4.5kb的小片[图 3(b)]。PacⅠ酶切重组质粒后转入HEK293,分别在36h[图 3(c)]和第3天[图 3(d)]观察报告基因RFP荧光表达量, 显示荧光强度逐渐增强。

|
| 图 3 Ad-Runx1穿梭质粒与AdEasy-1骨架质粒的重组和腺病毒的包装 Figure 3 Identification of recombinant plasmid and packaging of Ad-Runx1 (a) Screen out recombinant plasmid M: DNA Marker (λ-EcoT14); 0: Adeasy; 1~3: Recombinant positive plasmid (b) Enzyme digest positive Recombinant plasmid M: DNA Marker (λ-EcoT14); 1~2:Digested positive recombinant plasmid (c), (d) Fluorescence imaging of HEK293 infected by digested positive recombinant plasmid after 36h and 3d, respectively |
用Ad-Runx1和Ad-RFP分别感染MEFs细胞,48h后提取RNA逆转录成cDNA,RT-PCR结果显示,Ad-Runx1处理组, Runx1在mRNA水平表达明显上调[图 4(a)、(b)];72h后提取总蛋白质,Western blot结果显示,Ad-Runx1处理组, Runx1在蛋白质水平表达明显上调[图 4(c)、(d)]。
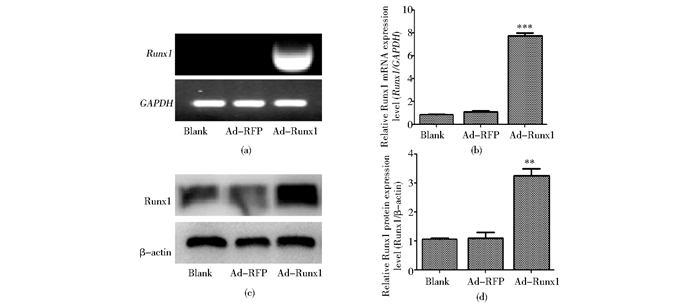
|
| 图 4 重组腺病毒Ad-Runx1的验证 Figure 4 Effective over-expression of Runx1 by Ad-Runx1 (a), (b) The endogenous expression of Runx1 was detected by PCR after exogenous Ad-Runx1 infection for 48h in MEFs cells (c), (d) The expression of Runx1 was detected by Western blot after exogenous Ad-Runx1 infection for 72h GAPDH and β-actin were used as loading control, separately. Data present mean±SD (n=3). ** P < 0.01; *** P < 0.001 |
MEFs细胞接种于24孔板,Ad-Runx1和BMP9条件培养基共同处理,分化培养7天后,ALP染色和活性测定显示,较单独BMP9组相比,Ad-Runx1和BMP9共同处理后,ALP的染色和活性明显增加,表明Ad-Runx1增强了BMP9对MEFs细胞的成骨早期诱导作用[图 5(a)、(b)]。
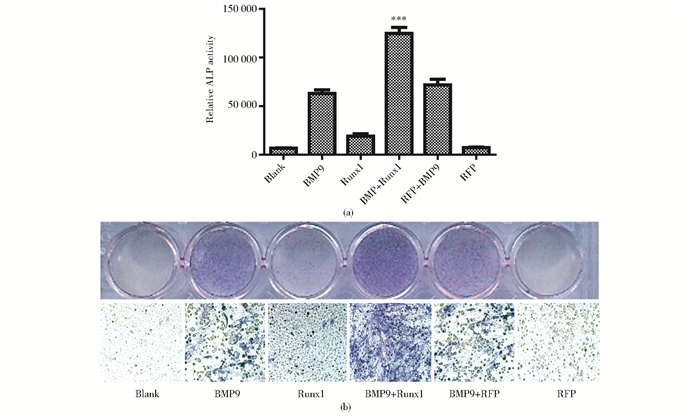
|
| 图 5 Runx1增强BMP9诱导MEFs细胞成骨早期分化指标ALP Figure 5 Runx1 promote BMP9-induced ALP activity in MEFs (a) Runx1 promoted BMP9-induced ALP activity in MEFs which were determined by ALP quantification assay *** P < 0.001 (b) Runx1 promoted BMP9-induced ALP activity in MEFs which were determined by staining (×100) |
用Ad-Runx1处理BMP9诱导的MEFs细胞,分化培养14天后用茜素红S进行染色。结果显示,较单独BMP9组相比,Ad-Runx1和BMP9共同处理后,钙盐沉积明显增加,表明Ad-Runx1增强了BMP9对MEFs细胞的成骨晚期诱导作用 (图 6)。

|
| 图 6 Runx1增强BMP9诱导MEFs细胞成骨晚期分化指标钙盐沉积 Figure 6 Runx1 promote BMP9-induced calcium deposition in MEFs Runx1 promoted BMP9-induced calcium deposition in MEFs which were determined by Alizarin Red S staining (×100) |
用Ad-Runx1处理BMP9诱导的MEFs细胞,48h后提取RNA逆转录成cDNA,72h后提取总蛋白质,RT-PCR结果和Western blot结果显示,较单独BMP9组相比,Ad-Runx1和BMP9共同处理后,Runx2在mRNA和蛋白质水平表达均明显上调 (图 7)。
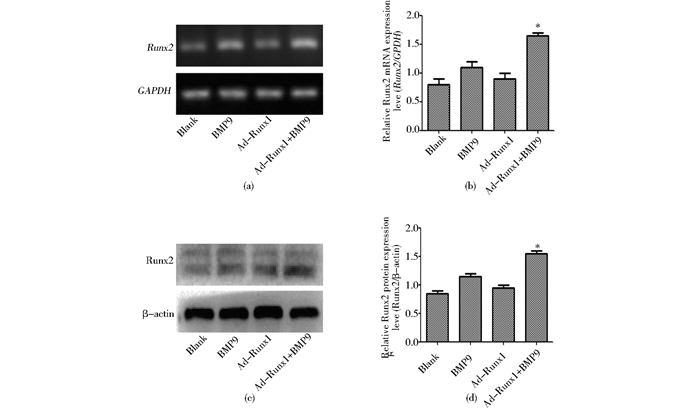
|
| 图 7 Runx1增强BMP9诱导的成骨关键转录因子RUNX2的表达 Figure 7 Runx1 enhances BMP9-induced expressions of RUNX2 (a), (b) The expression of Runx2 was detected by RT-PCR after exogenous Ad-Runx1 and BMP9 infection for 48h (c), (d) The expression of Runx2 was detected by Western blot after exogenous Ad-Runx1 and BMP9 infection for 72h GAPDH and β-actin were used as loading control, separately. Data present mean±SD (n=3). * P < 0.05 |
伴有骨缺损的骨不连会导致患者致畸、致残。为解决这一临床问题而发展的骨组织工程主要包括三个要素:骨支架、种子细胞、细胞因子[14]。MSCs由于它的多项分化和自我更新能力常作为种子细胞被应用。这提示我们寻找MSCs的调节因子并阐明这些调节因子作用的具体机制是发展骨组织工程的突破口。在调节干细胞成骨分化的过程中,涉及大量蛋白质以及转录因子参与,如Oct3/4、Sox2、Nanog、c-Myc、Klf4、BMPs和Wnt蛋白等[15]。BMP9促MSCs成骨分化的作用已被证实,作为具有强烈促成骨作用的细胞因子,在临床前实验中,它的有效使用剂量远远低于其他BMP家族成员且仅形成特异性矿化结节[16]。这提示我们BMP9重组蛋白拥有应用于临床治疗的巨大潜能,阐明其下游分子机制,可以增强BMP9的作用效果和减少它的不良反应。已证实参与BMP9调节间充质干细胞MEFs成骨分化的下游分子包括PTEN、COX-2、Runx2、Runx3、SHP等[17]。Runx1作为Runx家族中的成员,不仅在前体软骨细胞及前体成骨细胞中表达且和Runx2在早期分化的间充质干细胞中表达,Runx1在这些细胞中的表达会促进软骨细胞分化,而干扰Runx1的表达会抑制软骨细胞和成骨细胞分化以及Runx2的表达[18-20]。这提示我们,Runx1具有调节间充质干细胞成骨分化的能力。结合以上三点,本课题重点阐述BMP9在诱导MSCs骨发育过程中的作用是否与Runx1相关,即Runx1在BMP9诱导间充质干细胞MEFs细胞成骨分化中的作用。
本课题首先利用过表达BMP9的重组腺病毒处理MEFs细胞探讨了BMP9对MEFs细胞中Runx1内源性表达的影响。结果表明,BMP9能使Runx1的mRNA和蛋白质水平均上调。说明Runx1为BMP9调节成骨分化过程中下游分子,直接参与BMP9诱导成骨分化的过程。接着,我们构建了表达RFP荧光标记的过表达Runx1腺病毒,并检测成骨早晚期指标ALP和钙盐沉积以及成骨关键转录因子Runx2的变化。结果显示,Runx1可以增强BMP9诱导的成骨分化并使Runx2上调。以上研究内容不仅丰富了转录因子Runx1的生物学作用,更重要的是完善了BMP9成骨分化的分子机制,为BMP9早日应用于临床提供了科学的理论基础,并丰富了骨组织工程学的内容,促进了它的进一步发展。
综上,本研究利用Ad-easy系统构建过表达Runx1重组腺病毒的实验表明,该方法简便、成功率高、实验周期短、对实验条件要求较低,这是本实验能顺利完成的根本保证[21]。该研究首次初步证实了Runx1可以促进BMP9诱导的MEFs细胞向成骨分化。但BMP9调节间充质干细胞成骨分化是一个极其复杂的过程,除涉及主要的BMP9-Smad和非经典的MAPKs信号通路及相关转录因子外,还涉及众多其他信号通路、蛋白质、细胞因子[22-23]。在后期的工作中我们会进一步寻找Runx1发挥作用涉及的信号通路以及下游相关靶因子。
| [1] | Arthur A, Zannettino A, Gronthos S. The therapeutic applications of multipotential mesenchymal/stromal stem cells in skeletal tissue repair. J Cell Physiol, 2009, 218(2) : 237–245. DOI:10.1002/jcp.v218:2 |
| [2] | Molofsky A V, Pardal R, Morrison S J. Diverse mechanisms regulate stem cell self-renewal. Curr Opin Cell Biol, 2004, 16(6) : 700–707. DOI:10.1016/j.ceb.2004.09.004 |
| [3] | Myers T J, Granero-Molto F, Longobardi L, et al. Mesenchymal stem cells at the intersection of cell and gene therapy. Expert Opin Biol Ther, 2010, 10(12) : 1663–1679. DOI:10.1517/14712598.2010.531257 |
| [4] | Huang E, Bi Y, Jiang W, et al. Conditionally immortalized mouse embryonic fibroblasts retain proliferative activity without compromising multipotent differentiation potential. PLoS One, 2012, 7(2) : e32428. DOI:10.1371/journal.pone.0032428 |
| [5] | Luu H H, Song W X, Luo X, et al. Distinct roles of bone morphogenetic proteins in osteogenic differentiation of mesenchymal stem cells. J Orthop Res, 2007, 25(5) : 665–677. DOI:10.1002/(ISSN)1554-527X |
| [6] | Kang Q, Sun M H, Cheng H, et al. Characterization of the distinct orthotopic bone-forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery. Gene Ther, 2004, 11(17) : 1312–1320. DOI:10.1038/sj.gt.3302298 |
| [7] | Lamplot J D, Qin J, Nan G, et al. BMP9 signaling in stem cell differentiation and osteogenesis. Am J Stem Cells, 2013, 2(1) : 1–21. |
| [8] | Liu C, Weng Y, Yuan T, et al. CXCL12/CXCR4 signal axis plays an important role in mediating bone morphogenetic protein 9-induced osteogenic differentiation of mesenchymal stem cells. Int J Med Sci, 2013, 10(9) : 1181–1192. DOI:10.7150/ijms.6657 |
| [9] | Hojo H, Ohba S, He X, et al. Sp7/osterix is restricted to bone-forming vertebrates where It acts as a Dlx Co-factor in osteoblast specification. Dev Cell, 2016, 37(3) : 238–253. DOI:10.1016/j.devcel.2016.04.002 |
| [10] | Yoshida C A, Komori T. Role of Runx proteins in chondrogenesis. Crit Rev Eukaryot Gene Expr, 2005, 15(3) : 243–254. DOI:10.1615/CritRevEukarGeneExpr.v15.i3 |
| [11] | Chen C, Tang Z, Song Q, et al. Downregulated microRNA-23b promotes BMP9-mediated osteogenesis in C2C12 myoblast cells by targeting Runx2. Mol Med Rep, 2016, 13(3) : 2492–2498. |
| [12] | Wang J, Wang X, Holz J D, et al. Runx1 is critical for PTH-induced onset of mesenchymal progenitor cell chondrogenic differentiation. PLoS One, 2013, 8(9) : e74255. DOI:10.1371/journal.pone.0074255 |
| [13] | Wu M, Li C, Zhu G, et al. Deletion of core-binding factor beta (Cbfbeta) in mesenchymal progenitor cells provides new insights into Cbfbeta/Runxs complex function in cartilage and bone development. Bone, 2014, 65 : 49–59. DOI:10.1016/j.bone.2014.04.031 |
| [14] | Loi F, Cordova L A, Pajarinen J, et al. Inflammation, fracture and bone repair. Bone, 2016, 86 : 119–130. DOI:10.1016/j.bone.2016.02.020 |
| [15] | Saito T, Ohba S, Yano F, et al. Runx1 and Runx3 are downstream effectors of nanog in promoting osteogenic differentiation of the mouse mesenchymal cell line C3H10T1/2. Cell Reprogram, 2015, 17(3) : 227–234. DOI:10.1089/cell.2014.0059 |
| [16] | Long L, Ormiston M L, Yang X, et al. Selective enhancement of endothelial BMPR-Ⅱ with BMP9 reverses pulmonary arterial hypertension. Nat Med, 2015, 21(7) : 777–785. DOI:10.1038/nm.3877 |
| [17] | Huang J, Yuan S X, Wang D X, et al. The role of COX-2 in mediating the effect of PTEN on BMP9 induced osteogenic differentiation in mouse embryonic fibroblasts. Biomaterials, 2014, 35(36) : 9649–9659. DOI:10.1016/j.biomaterials.2014.08.016 |
| [18] | Smith N, Dong Y, Lian J B, et al. Overlapping expression of Runx1(Cbfa2) and Runx2(Cbfa1) transcription factors supports cooperative induction of skeletal development. J Cell Physiol, 2005, 203(1) : 133–143. DOI:10.1002/(ISSN)1097-4652 |
| [19] | Wang Y, Belflower R M, Dong Y F, et al. Runx1/AML1/Cbfa2 mediates onset of mesenchymal cell differentiation toward chondrogenesis. J Bone Miner Res, 2005, 20(9) : 1624–1636. DOI:10.1359/JBMR.050516 |
| [20] | Yamashiro T, Wang X P, Li Z, et al. Possible roles of Runx1 and Sox9 in incipient intramembranous ossification. J Bone Miner Res, 2004, 19(10) : 1671–1677. DOI:10.1359/JBMR.040801 |
| [21] | Lu F, Gao J H. High efficient generation of recombinant adenovirus containing human Fas gene using a method of homologous recombination in bacteria. Chin Med J, 2004, 84(7) : 559–563. |
| [22] | van Caam A, Madej W, Thijssen E, et al. Expression of TGFbeta-family signalling components in ageing cartilage:age-related loss of TGFbeta and BMP receptors. Osteoarthritis Cartilage, 2016, 24(7) : 1235–1245. DOI:10.1016/j.joca.2016.02.008 |
| [23] | Xu D J, Zhao Y Z, Wang J, et al. Smads, p38 and ERK1/2 are involved in BMP9-induced osteogenic differentiation of C3H10T1/2 mesenchymal stem cells. BMB Rep, 2012, 45(4) : 247–252. DOI:10.5483/BMBRep.2012.45.4.247 |
 2017, Vol. 37
2017, Vol. 37




