文章信息
- 陈坤, 曹雪玮, 张琴, 赵健, 王富军.
- CHEN Kun, CAO Xue-wei, ZHANG Qin, ZHAO Jian, WANG Fu-jun.
- EGF类生长因子来源的新型靶向肽在抗肿瘤药物蛋白中的应用
- Application of EGF-like Growth Factor-derived Tumor-homing Peptide for Antineoplastic Protein
- 中国生物工程杂志, 2017, 37(3): 1-9
- China Biotechnology, 2017, 37(3): 1-9
- http://dx.doi.org/DOI:10.13523/j.cb.20170301
-
文章历史
- 收稿日期: 2016-11-20
- 修回日期: 2016-12-13
2. 浙江日升昌药业有限公司 东阳 322100;
3. 上海中医药大学中药研究所 上海 201203
2. Zhejiang Reachall Pharmaceutical Co. Ltd, Dongyang 322100, China;
3. Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
MAP30是一种来源于苦瓜的Ⅰ型核糖体失活蛋白,文献报道其具有抗肿瘤药理活性,但MAP30本身的低细胞穿膜特性限制了其在肿瘤治疗中的应用开发研究[1]。细胞穿膜肽 (cell-penetrating peptides, CPP) 是一类能携带药物分子 (大分子,DNA和RNA) 进入细胞的短肽[2-3],其中TAT是一种来源于HIV-1转录因子的经典穿膜肽,可携带多种蛋白质分子 (包括抗肿瘤蛋白药物) 跨越细胞膜屏障进入细胞[4]。不过,现有的CPP普遍都缺少对肿瘤细胞的选择性,这是目前CPP在抗肿瘤药物治疗应用中的一大障碍,也是相关重组药物蛋白在应用中可能产生严重不良反应的重要原因之一[5]。
肿瘤靶向型细胞穿膜肽是一类可以选择性靶向结合到肿瘤细胞表面的多肽,它通过特异性引导携带的药物分子富集到肿瘤细胞而大大降低药物分子对正常细胞可能存在的毒副作用,因而成为目前靶向药物运输载体的研究热点[6]。在这方面研究中,人们除了对肿瘤细胞表面特异性表达的蛋白多糖 (如HSPG) 有较多关注以外,更多都关注到在多种肿瘤细胞表面都存在表皮生长因子受体家族 (EGFR family) 过表达的现象,而且这种过表达与肿瘤的发生、发展、转移有密切联系。因此,它们成为了肿瘤疾病靶向治疗的热门靶标[7-8]。现在已经上市的许多肿瘤靶向治疗药物许多是通过抑制表皮生长因子受体 (EGFR) 相关活性的发挥来达到肿瘤治疗的目的,如表皮生长因子受体抗体类药物、相关酪氨酸激酶抑制剂类药物等。现已发现的表皮生长因子受体的配体有多种,由整个表皮生长因子 (epidermal growth factor,EGF) 类配体组成了一个EGF超家族。在这个超家族中,所有的配体都具有典型的三环状结构,其中第三环在与各种表皮生长因子受体的相互识别与结合中发挥重要作用[9]。牛痘病毒生长因子 (VGF) 是该超家族成员之一,研究表明,其第三环具有与EGFR特异性结合的能力,但其促细胞生长作用表现不明显[10-11]。本课题组前期观察到VGF来源的第三环S3和HBD穿膜肽重组后表现出较好的肿瘤细胞靶向穿膜特性[8],本研究期望通过将S3与其它穿膜序列的融合,进一步优化提高其肿瘤细胞靶向穿膜特性。
人类肝素样表皮生长因子 (HB-EGF) 在肿瘤细胞中也存在过表达现象,其分子内比一般的EGF类生长因子多了一个肝素结合域 (HE),可与细胞表面的EGFR和HSPG相互结合,具有双靶点结合的特点[12]。本研究将VGF中的EGFR结合域 (S3) 与人的肝素样表皮生长因子 (HB-EGF) 来源的肝素结合域 (HE) 进行融合表达,期望该融合多肽S3-HE对肿瘤细胞具有更为优异显著的靶向性能。同时,将此S3-HE靶向序列再与穿膜肽TATm组合,以期获得一种新的靶向运输载体。本研究将这种新型靶向运输载体与苦瓜来源的MAP30核糖体失活蛋白融合表达,研究此新融合蛋白的抗肿瘤活性,并观察分析其对肿瘤细胞和正常细胞的选择性差异。本研究有望推动MAP30的临床应用进程,促进肿瘤治疗药物靶向运输研究的发展。
1 材料与方法 1.1 材料与试剂表达质粒MAP30-pET28b,MAP30-TAT-pET28b,EGFP-S3-HBD-pET28b均为本实验室保存;大肠杆菌DH5α和BL21(DE3),人宫颈癌细胞 (HeLa),人高转移肺癌细胞 (95D),小鼠黑色素瘤细胞 (B16),人乳腺癌细胞 (MB-MDA-231),人非小细胞肺癌细胞 (A549),人胚胎成纤维细胞 (MRC-5) 均为本实验室保存;表达载体构建的相关引物由生工生物工程 (上海) 股份有限公司完成;异丙基硫代半乳糖苷 (IPTG),噻唑蓝 (MTT) 等均购自生工生物工程 (上海) 股份有限公司;基因序列测序由上海睿迪生物科技有限公司完成。
1.2 实验方法 1.2.1 重组质粒EGFP-S3-HE-TATm和MAP30-S3-HE-TATm的构建双靶向肽S3-HE基因片段 (GACCTGCAGGAAGCTGACCTGGACCTGCTGCGTGTTACCCTGT CTT CTAAACCGCAGGCTCTGGCTACCCCGAACAAAGAAGAACACGGTAAACGTAAAAAAAAAGGTAAAG GTCTGGGT) 由生工生物工程 (上海) 股份有限公司合成,然后与载体EGFP-pET28b重组得到质粒EGFP-S3-HE-pET28b。根据EGFP-S3-HE-pET28b质粒设计引物扩增TATm片段 (GGTTACGGTCGTAAAA AACGT CGTCAGCGTCGT),引物设计如下:含有BamHⅠ酶切位点的正向引物:5′-CGCGGATCCGGTGGT GGT GGTTCTGGTGGTGGTGGTT-3′与含有XhoⅠ酶切位点的反向引物:5′-CCGCTCGAGTTAACGAC GC TG ACGACGTTTTTTACGACCGTAACCACCCAGACCTTT-3′。以EGFP-S3-HE-pET28b为模板,用上述引物PCR扩增S3-HE-TATm片段,扩增产物回收后,用BamHⅠ和XhoⅠ双酶切,与BamHⅠ和XhoⅠ双酶切后的载体质粒EGFP-TAT-pET28b及MAP30-TAT-pET28b分别连接,将S3-HE-TATm片段与载体中的TAT序列置换,得到重组质粒EGFP-S3-HE-TATm和MAP30-S3-HE-TATm。E.coil DH5α转化重组质粒,以菌液为模板,用上述引物PCR扩增,确定质粒重组完成后,通过序列比对确认重组序列的正确性。
1.2.2 重组蛋白的表达与纯化重组质粒经转化得到E.coli BL21(DE3) 菌株,接种到含50μg/ml卡那霉素的LB培养基中,37℃培养10~12h后以2%接种量接种于LB培养基中于37℃培养,待菌液浓度OD600达到0.6左右时,加入1mmol/L IPTG于16℃诱导表达15h。收集菌体后超声破碎,12 000r/min离心后取上清液在Ni2+柱中亲和纯化。经过梯度洗涤后,用含有200mmol/L咪唑的缓冲液收集目标蛋白。经过透析液 (20mmol/L Tris-HCl,0.5mol/L NaCl,5%甘油,pH 7.2) 过夜透析,对目标蛋白用12.5% SDS-PAGE鉴定。蛋白质除菌后在-80℃中保存。重组蛋白浓度用BCA试剂盒进行测定。
1.2.3 体外细胞的培养本研究中所用到的肿瘤细胞株和正常细胞株均采用RPMI-1640培养基 (含有10%胎牛血清和1%青霉素-链霉素) 在含5% CO2浓度的培养箱中37℃培养。取生长状态良好的对数生长期细胞约4×104个在25cm2的细胞培养瓶中培养24h后,用胰蛋白酶消化收集细胞用于后续细胞实验。
1.2.4 带有绿色荧光蛋白标签的穿膜肽的细胞穿膜试验通过激光扫描共聚焦显微镜 (CLSM) 与荧光显微镜分析融合有靶向穿膜序列的绿色荧光蛋白 (EGFP) 在动物细胞中的穿膜能力。肿瘤或正常细胞株在6孔细胞培养板中培养12~16h后,加入不同浓度梯度的带有靶向穿膜序列的EGFP重组蛋白,与细胞在37℃共孵育12h,收集细胞并用预冷PBS清洗三次后用4%多聚甲醛固定。然后细胞用PBS清洗两次后用DAPI染色30min。通过CLSM与荧光显微镜分析重组融合蛋白在细胞内的定位来确定其穿膜作用效果。
1.2.5 药物蛋白的体外细胞生长抑制试验将通过重组表达纯化得到的MAP30-TAT,MAP30-S3-HBD-TATm和MAP30-S3-C4-TATm重组蛋白分别与细胞孵育后,通过考察细胞量来确定药物蛋白对细胞生长的影响。细胞在96孔细胞板中培养过夜,然后用不同浓度梯度的蛋白质孵育24h之后用5mg/ml的MTT溶液在37℃孵育4h。除去MTT溶液后每孔加入150μl二甲基亚砜 (DMSO)。通过酶标仪 (492nm吸收波长处) 测定每孔的吸光度以确定细胞存活率。
1.2.6 流式细胞仪分析细胞在6孔细胞板中培养过夜,加入不同浓度梯度的带有绿色荧光蛋白标签的靶向穿膜融合蛋白共孵育12h。用预冷PBS清洗三次后用0.25%无EDTA胰蛋白酶消化收集细胞。通过流式细胞仪 (激发波长Ex 488nm,发射波长Em 530nm) 分析细胞内绿色荧光强度。
2 实验结果 2.1 重组质粒EGFP-S3-HE-TATm和MAP30-S3-HE-TATm的构建为了提高S3-HE的细胞穿膜能力,并保留其对肿瘤细胞的靶向效果,在S3-HE的C端重组连接上一段TAT弱化肽TATm。如1.2.1节所述进行重组质粒构建,以EGFP-S3-HE-pET28b为模板,通过上述引物PCR扩增得到S3-HE-TATm序列[图 1(a)],使用BamHⅠ和XhoⅠ对S3-HE-TATm序列与EGFP-TAT-pET28b和MAP30-TAT-pET28b载体双酶切[图 1(b)],将S3-HE-TATm序列与载体中的TAT部分进行置换,得到新的EGFP-S3-HE-TATm和MAP30-S3-HE-TATm重组质粒。将重组质粒转化E.coil DH5α,采用菌落PCR方法扩增目标基因,其扩增片段大小 (320bp) 与预期相符[图 1(c)]。同时将此重组质粒目标基因序列进行测序分析,没有发现突变存在,由此确认重组质粒构建成功。
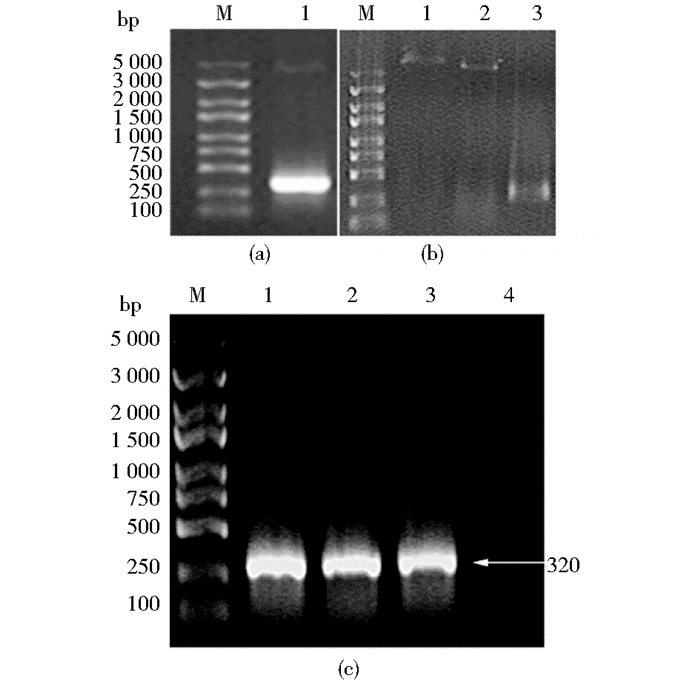
|
| 图 1 MAP30-S3-HE-TATm-pET28b、EGFP-S3-HE-TATm-pET28b的构建 Figure 1 Constructions of MAP30-S3-HE-TATm-pET28b and EGFP-S3-HE-TATm-pET28b M:DNA Marker; (a) 1:PCR product of S3-HE-TATm (b) 1:MAP30-TAT-pET28b after digested by BamH Ⅰand XhoⅠ; 2:EGFP-TAT-pET28b after digested by BamHⅠ and XhoⅠ; 3:S3-HE-TATm after digested by BamH Ⅰand XhoⅠ (c) 1:PCR product of EGFP-S3--HE-TATm-pET28b; 2:PCR product of MAP30-S3-HE-TATm-pET28b; 3:Positive control; 4:Negative control |
将含有重组质粒的E.coil BL21(DE3) 重组菌按照1.2.2节进行表达及纯化。SDS-PAGE电泳结果如图 2所示。结果表明,E.coil BL21(DE3) 重组菌经异丙基-β-D-硫代半乳糖苷 (IPTG) 诱导后以上清液形式表达融合蛋白。EGFP-S3-HE-TATm蛋白 (39.98kDa) 浓度约为2.21mg/ml,EGFP-S3(37.54kDa) 浓度约为0.79mg/ml,MAP30-S3-HE-TATm (41.64kDa) 浓度约为2.32mg/ml,EGFP-S3-HBD (36.69kDa) 浓度约为0.74mg/ml,MAP30(29.68kDa) 浓度约为0.59mg/ml;MAP30-TAT (30.98kDa) 浓度约为1.24mg/ml。上述蛋白质通过凝胶扫描软件分析纯度达到90%以上,蛋白质经过无菌过滤后用于细胞实验。
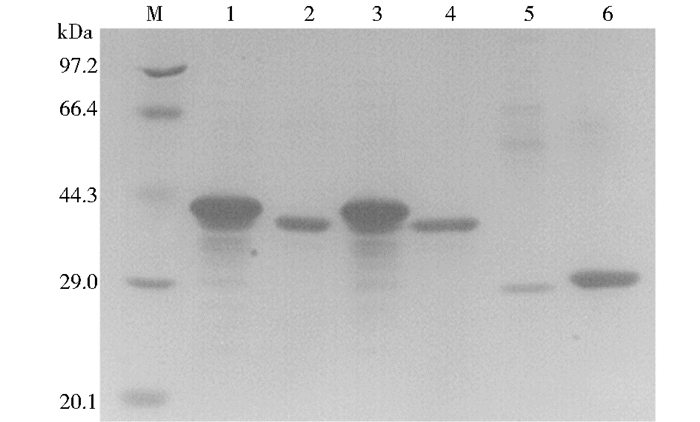
|
| 图 2 纯化的重组融合蛋白的SDS-PAGE分析 Figure 2 SDS-PAGE detection of fusion protein M:Low molecule weight protein marker; 1:Purified EGFP-S3-HE-TATm; 2:Purified EGFP-S3;3:Purified MAP30-S3-HE-TATm; 4:Purified EGFP-S3-HBD; 5:Purified MAP30;6:Purified MAP30-TAT |
EGFR在多数肿瘤细胞表面存在过表达,同时肿瘤细胞表面的HSPG也存在异常表达的现象。我们所用的S3结构域是源自EGF超家族的VGF的EGFR结合域;而HE则是源自同样是EGF超家族成员的HB-EGF与HSPG的结合区域。我们首先通过观察带有EGFP的S3-HE重组蛋白在肿瘤细胞和正常细胞中穿膜后的分布,来分析对肿瘤细胞的靶向性。实验结果显示,在2μmol/L浓度下,EGFP-S3-HE与细胞共孵育12h后,激光共聚焦显微镜观察到在肿瘤细胞株HeLa细胞质中分布了大量的绿色荧光蛋白,而在正常细胞株MRC-5细胞质中几乎没有看到绿色荧光的存在[图 3(a)]。将EGFP-S3-HE进一步与95D、MB-MBA-231和A549三种肿瘤细胞株共孵育,结果在这三种肿瘤细胞中都观察到了显著的绿色荧光[图 3(b)]。以上结果表明,S3-HE对肿瘤细胞具有显著的选择性吸附和穿膜活性,但对正常细胞则没有明显的类似效应。分析其可能是融合蛋白中的S3-HE靶向穿膜序列能够特异性地与肿瘤细胞表面高表达的EGFR与HSPG结合,从而表现出对肿瘤细胞的靶向性,而对正常细胞而言,由于其细胞表面的EGFR表达量远低于肿瘤细胞,细胞表面的HSPG的量和种类也有差异,所以重组蛋白对其的吸附力和穿膜能力都很差,从而显示了低靶向性。
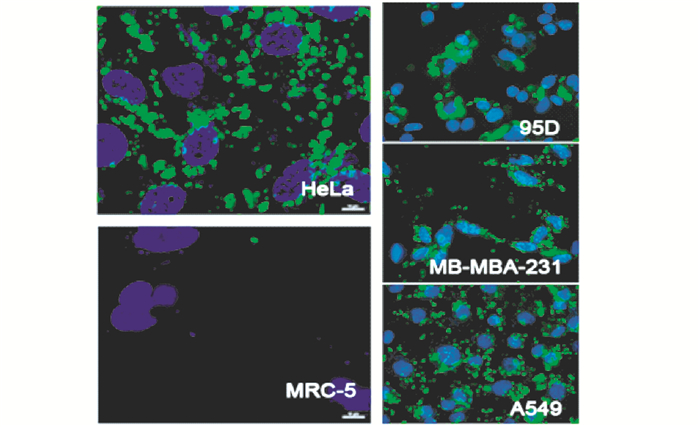
|
| 图 3 EGFP-S3-HE的激光共聚焦检测与荧光显微镜检测 Figure 3 Laser confocal microscopy detection and fluorescence microscopy detection of EGFP-S3-HE (a) Laser confocal microscopy detection (b) Fluorescence microscopy detection |
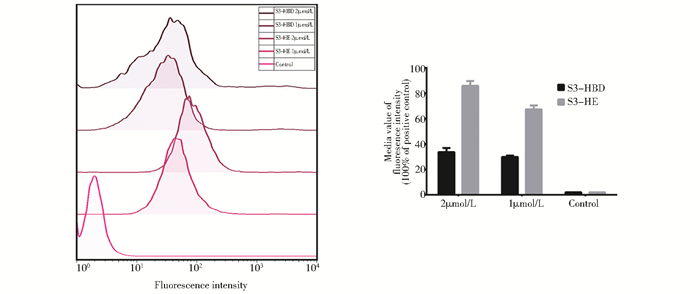
为了进一步提高S3-HE作为药物运输载体将抗肿瘤药物MAP30高效运输到肿瘤细胞内,我们在S3-HE的C端融合连接了经弱化处理的细胞穿膜肽TATm[7]。将此EGFP-S3-HE-TATm重组蛋白与HeLa细胞共孵育12h (1μmol/L),观察其靶向穿膜特性,结果如图 4所示。激光共聚焦观察显示以EGFP-S3-HE-TATm处理的HeLa细胞质中,绿色荧光的强度远高于EGFP-S3-HE处理的HeLa细胞。流式细胞分析结果进一步表明,以EGFP-S3-HE-TATm (1μG,与HeLa共孵育12h) 处理细胞后荧光强度是以同样浓度EGFP-S3-HE处理细胞后的荧光强度的2.7倍,表明TATm确实增强了S3-HE的细胞穿膜活性。
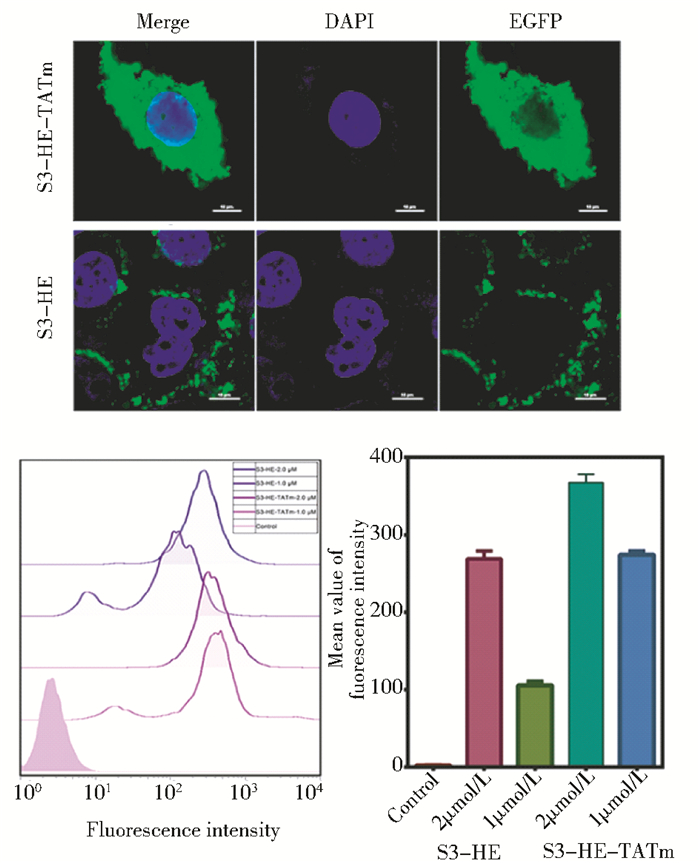
|
| 图 4 EGFP-S3-HE与EGFP-S3-HE-TATm的激光共聚焦检测及流式细胞术检测 Figure 4 Laser confocal microscopy detection and flow cytometry detection of EGFP-S3-HE and EGFP-S3-HE-TATm |
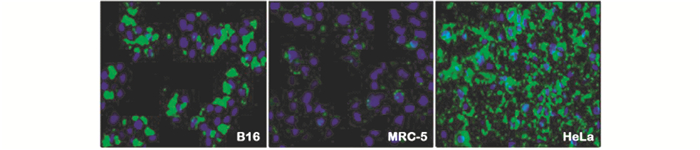
为了检测穿膜肽TATm对S3-HE肿瘤靶向性的影响,将1μmol/L EGFP-S3-HE-TATm重组蛋白与B16、MRC-5和HeLa三种细胞分别共孵育12h,荧光显微镜检测结果如图 5所示。可以看到,在HeLa和B16两种肿瘤细胞的细胞质中有显著的绿色荧光分布,而在正常细胞株的MRC-5细胞质中绿色荧光并不明显,这表明TATm的引入没有改变原S3-HE对肿瘤细胞的靶向特性,重组蛋白S3-HE-TATm对HeLa和B16细胞仍保持显著的靶向穿膜特性,同时对MRC-5细胞则仍保持低穿膜活性。上述结果表明,S3-HE连接了穿膜肽TATm,增强了对肿瘤细胞的穿膜能力,而对正常细胞穿膜效果没有明显增加。
|
| 图 5 EGFP-S3-HE-TATm的荧光显微镜检测 Figure 5 Fluorescence microscopy detection of EGFP-S3-HE-TATm |
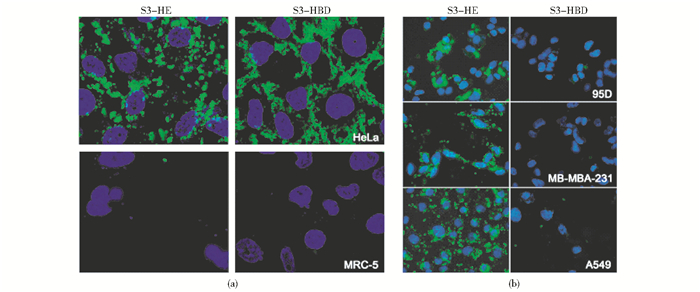
S3-HBD是本课题组前期发现的肿瘤靶向序列,而S3-HE是本研究新构建的双靶向序列。为了比较这二者对肿瘤细胞的靶向作用效果,我们将2μmol/L EGFP-S3-HBD与EGFP-S3-HE分别与HeLa、95D、MB-MBA-231、A549、MRC-5五种细胞进行共孵育12h,结果如图 6(a)和图 7所示。通过共聚焦检测显示,2μmol/L EGFP-S3-HE与HeLa细胞共孵育后,细胞内呈现显著的绿色荧光,流式分析显示2μmol/L EGFP-S3-HE在HeLa中的荧光量是EGFP-S3-HBD的2.8倍。荧光显微镜分析显示[图 6(b)],与EGFP-S3-HE共孵育后,95D、MB-MBA-231、A549细胞内都呈现明显的绿色荧光,而这些细胞与EGFP-S3-HBD共孵育后,上述三种细胞内都没有呈现出明显的绿色荧光。同时,无论是EGFP-S3-HBD还是EGFP-S3-HE,与正常细胞 (MRC-5) 共孵育后,细胞内都没有呈现显著的绿色荧光。上述结果说明,S3-HE对HeLa的靶向穿膜效率高于S3-HBD,且对肿瘤细胞靶向的广谱性高于S3-HBD。同时,S3-HE和S3-HBD一样,都对正常细胞MRC-5没有靶向性。说明S3-HE作为一种双靶向载体,其对肿瘤靶向性明显优于单靶向载体S3-HBD。
|
| 图 6 EGFP-S3-HE与EGFP-S3-HBD的激光共聚焦检测与荧光显微镜分析 Figure 6 Laser confocal microscopy detection and fluorescence microscopy detection of EGFP-S3-HE and EGFP-S3-HBD (a) Laser confocal microscopy detection (b) Fluorescence microscopy detection |
|
| 图 7 EGFP-S3-HE与EGFP-S3-HBD流式细胞术检测结果 Figure 7 Flow cytometry detection of EGFP-S3-HE and EGFP-S3-HBD |
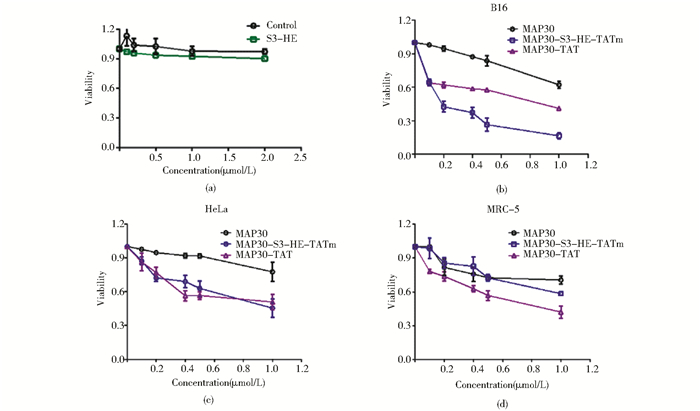
S3和HE这两段序列都是源自EGF类生长因子超家族的生长因子,在实验中也观察了其是否会对细胞有促生长效应。将EGFP-S3-HE蛋白与HeLa细胞共孵育24h后,细胞存活率如图 8(a)所示,采用的对照样品是与蛋白质经过同样透析过程的缓冲液 (20mmol/L Tris-HCl,0.5mol/L NaCl,5%甘油)。在细胞中加入S3-HE重组蛋白的浓度为0~2μmol/L,发现HeLa细胞的存活率并没有提高,表明S3-HE重组蛋白在此浓度范围没有可观察到的促细胞生长效应。
|
| 图 8 重组蛋白对细胞存活率的影响 Figure 8 Effects of recombination proteins on cell viability |
前面的实验结果已经证明S3-HE-TATm靶向穿膜序列可以将绿色荧光蛋白靶向运输到肿瘤细胞的细胞质中。为了验证其对其它药物蛋白的靶向运输能力,我们将此序列与苦瓜来源的核糖体失活蛋白MAP30的基因融合,检测重组表达的融合蛋白MAP30-S3-HE-TATm对细胞生长的抑制作用效果。分别将重组表达的MAP30、MAP30-TAT与MAP30-S3-HE-TATm三种重组蛋白与B16、HeLa、MRC-5三种细胞共孵育24h后检测细胞存活率。结果发现,对于B16细胞,如图 8(b)所示,在同样的蛋白质浓度 (1μmol/L) 下,与MAP30重组蛋白共孵育后其存活率约为65%;与带有TAT细胞穿膜肽的MAP30重组蛋白 (MAP30-TAT) 共孵育后存活率约为40%;而与带靶向穿膜载体S3-HE-TATm的MAP30重组蛋白 (MAP30-S3-HE-TATm) 孵育后存活率仅为20%。通过计算得知 (表 1),重组蛋白MAP30对B16细胞的IC50值为1.837;带TAT的重组蛋白MAP30-TAT的IC50值为0.691;而带S3-HE-TATm的重组蛋白MAP30-S3-HE-TATm的IC50值为0.195,这说明S3-HE-TATm在B16细胞中的穿膜效率高于TAT。但对HeLa细胞来说,如图 8(c)所示,MAP30-TAT重组蛋白和MAP30-S3-HE-TATm重组蛋白对HeLa细胞的生长抑制效果类似,没有显著区别。而对于MRC-5细胞,如图 8(d)所示,与1μmol/L MAP30重组蛋白共孵育后的细胞存活率约为75%,与MAP30-TAT重组蛋白共孵育后细胞存活率为45%,与MAP30-S3-HE-TATm共孵育后细胞存活率约为65%。同时,从表 1也可知,MAP30重组蛋白对MRC-5的IC50值为1.776,MAP30-TAT重组蛋白的IC50值为0.852,而MAP30-S3-HE-TATm的IC50值为1.129。这说明在融合S3-HE-TATm后,MAP30重组蛋白对MRC-5细胞的毒性低于融合有TAT穿膜肽的重组蛋白,这种方式更适合于对肿瘤的治疗应用。
| B16 | HeLa | MRC-5 | |
| MAP30 | 1.837 | 6.003 | 1.776 |
| MAP30-S3-HE-TATm | 0.195 | 1.093 | 1.129 |
| MAP30-TAT | 0.691 | 0.908 | 0.852 |
| Note:Obtained by GraphPad Prime 6 | |||
3 讨论
目前,靶向药物的运输载体是抗肿瘤治疗中的研究热点。在本研究中,通过融合VGF中的EGFR结合域S3以及HB-EGF中的EGFR与HSPG结合域HE, 得到一种具有肿瘤靶向性的多肽载体。实验结果显示,S3-HE对肿瘤细胞 (HeLa、95D、MB-MBA-231和A549) 具有明显的靶向性,而对正常细胞MRC-5没有靶向性 (图 3), 推测S3-HE的优良靶向性是由于S3和HE都来源于EGF超家族,S3可以与肿瘤细胞表面过表达的EGFR结合,而HE可以与肿瘤细胞表面过表达的EGFR和异常表达的HSPG结合,所以S3-HE具有双靶向效应,对肿瘤细胞表现出显著的靶向性。MTT实验结果表明,S3和HE融合多肽对细胞没有明显的促生长效应[图 8(a)]。
文献报道很多抗肿瘤药物需要在细胞质中发挥药效[12],S3-HE虽然对肿瘤靶向性显著,但要作为抗肿瘤药物载体其穿膜活性还需要进一步提高,因此本文考虑通过在S3-HE的C端连接另一细胞穿膜肽,得到一种同时具有肿瘤靶向性与穿膜性的多肽载体。TAT是一种经典的高效穿膜肽,但因缺少肿瘤细胞靶向性而限制了其在抗肿瘤药物中的应用[4]。弱化的TAT序列 (TATm) 其穿膜性有所降低,可以减小对正常细胞的毒副作用[7]。本研究选用TATm作为穿膜肽,将其与S3-HE重组后得到靶向穿膜载体多肽S3-HE-TATm。实验观察到S3-HE-TATm保留了S3-HE的肿瘤靶向性,同时提高了整个结构域对肿瘤细胞的穿膜效率 (图 4)。
MAP30是一种来源于苦瓜的Ⅰ型核糖体失活蛋白质,已被证实在细胞质中具有显著的抗肿瘤活性[13-14]。本研究将S3-HE-TATm与MAP30融合以提高MAP30对肿瘤细胞的特异性杀伤效应, 结果显示,S3-HE-TATm可以有效提高MAP30对肿瘤细胞 (B16和HeLa) 的生长抑制,与经典穿膜肽TAT相比,S3-HE-TATm在肿瘤细胞B16中的穿膜性能更强,而对正常细胞MRC-5中的穿膜性能却反而降低[图 8(b)~(d)],表 1), 说明S3-HE-TATm对肿瘤细胞更具有明显的靶向性。上述结果表明S3-HE-TATm是一种优良的肿瘤靶向穿膜肽,可以提高抗肿瘤蛋白的药效,并降低对正常细胞的毒副作用。此外,实验还观察到S3-HE-TATm在B16和HeLa细胞中穿膜性能有差异 (图 5),这可能是由于B16和HeLa肿瘤细胞表面EGFR及HSPG表达程度不同,从而导致了S3-HE这种靶向差异性的结果。我们还将新构建的这种双靶向载体S3-HE-TATm与课题组前期设计的单靶向载体S3-HBD[8]进行了比较,实验观察到双靶向载体S3-HE-TATm对肿瘤细胞的靶向效率与广谱性都比单靶向载体S3-HBD有明显提高 (图 6、图 7),原因可是S3和HE都是来源于EGF家族,HE进一步强化了载体对EGFR的靶向作用。本课题设计的双靶向载体S3-HE-TATm拓展了肿瘤药物运输载体的设计思路,可以显著提高抗肿瘤药物的治疗效果且降低毒副作用,在抗肿瘤药物治疗中有重要价值。
致谢 感谢华东理工大学生物反应器工程重点实验室提供的实验仪器。| [1] | Xue Y J, Han X H, Chen D Y, et al. Effects of recombinant MAP30 on cell proliferation and apoptosis of human esophageal carcinoma EC-1.71 cells. African Journal of Pharmacy & Pharmacology, 2011, 5(24) : 2680–2688. |
| [2] | Koren E, Torchilin V P. Cell-penetrating peptides:breaking through to the other side. Trends in Molecular Medicine, 2012, 18(7) : 385–393. DOI:10.1016/j.molmed.2012.04.012 |
| [3] | Fang S, Fan T, Fu H W, et al. A novel cell-penetrating peptide derived from human eosinophil cationic protein. PLoS One, 2013, 8(3) : e57318–e57318. DOI:10.1371/journal.pone.0057318 |
| [4] | Yoon J S, Jung Y T, Hong S K, et al. Characteristics of HIV-TAT protein transduction domain. Journal of Microbiology, 2004, 42(4) : 328–335. |
| [5] | Svensen N, Walton J G A, Bradley M. Peptides for cell-selective drug delivery. Trends in Pharmacological Sciences, 2012, 33(4) : 186–192. DOI:10.1016/j.tips.2012.02.002 |
| [6] | Tebbutt N, Pedersen M W, Johns T G. Targeting the ERBB family in cancer:couples therapy. Nature Reviews Cancer, 2013, 13(9) : 663–673. DOI:10.1038/nrc3559 |
| [7] | Tan M, Lan K H, Yao J, et al. Selective inhibition of ErbB2-overexpressing breast cancer in vivo by a novel TAT-based ErbB2-targeting signal transducers and activators of transcription 3-blocking peptide. Cancer Research, 2006, 66(7) : 3764–3772. DOI:10.1158/0008-5472.CAN-05-2747 |
| [8] | Long T N, Yang X Z, Du X, et al. Enhancing tumor-specific intracellular delivering efficiency of cell-penetrating peptide by fusion with a peptide targeting to EGFR. Amino Acids, 2015, 47(5) : 1–10. |
| [9] | Hynes N E, Lane H A. ERBB receptors and cancer:the complexity of targeted inhibitors. Nature Reviews Cancer, 2005, 5(5) : 341–354. DOI:10.1038/nrc1609 |
| [10] | Ciardiello F, Tortora G. EGFR antagonists in cancer treatment. New England Journal of Medicine, 2008, 358(11) : 1160–1174. DOI:10.1056/NEJMra0707704 |
| [11] | Lu J X, Peng Y, Meng Z F, et al. Rational design of an EGF-IL18 fusion protein:Implication for developing tumor therapeutics. Biochemical & Biophysical Research Communications, 2005, 334(1) : 157–161. |
| [12] | Brooke J S, Cha J H, Eidels L. Latent transforming growth factor β-binding protein-3 and fibulin-1C interact with the extracellular domain of the heparin-binding EGF-like growth factor precursor. Bmc Cell Biology, 2002, 3(5) : 856–860. |
| [13] | Lv Q, Yang X Z, Fu L Y, et al. Recombinant expression and purification of a MAP30-cell penetrating peptide fusion protein with higher anti-tumor bioactivity. Protein Expression & Purification, 2015, 111 : 9–17. |
| [14] | Fang E F, Zhang C Z Y, Wong J H, et al. The MAP30 protein from bitter gourd (Momordicacharantia) seeds promotes apoptosis in liver cancer cells in vitro, and in vivo. Cancer Letters, 2012, 324(324) : 66–74. |
 2017, Vol. 37
2017, Vol. 37




