文章信息
- 夏启玉, 李美英, 杨小亮, 肖苏生, 贺萍萍, 郭安平.
- XIA Qi-yu, LI Mei-ying, YANG Xiao-liang, XIAO Su-sheng, HE Ping-ping, GUO An-ping.
- 免疫层析试纸条技术及其在转基因检测中的应用
- Immunochromatography Test Strip and Its Applications in Detection of Genetically Modified Organisms
- 中国生物工程杂志, 2017, 37(2): 101-110
- China Biotechnology, 2017, 37(2): 101-110
- http://dx.doi.org/DOI:10.13523/j.cb.20170215
-
文章历史
- 收稿日期: 2016-08-04
- 修回日期: 2016-09-27
2. 农业部转基因植物及植物用微生物环境安全监督检验测试中心 海口 571101
2. Environmental Safety Supervision and Inspection Center for Genetically Modified Plants and Microorganism Used in Plants, Ministry of Agriculture, Haikou 571101, China
据统计,2015年全球转基因作物的种植面积为1.797亿公顷,即从1996年转基因番茄开始大规模商业化种植到2015年的20年间,全球转基因作物的种植面积增加了100倍[1]。但是,转基因作物及其产品的食用安全和环境安全等问题仍是人们关注的焦点。迄今为止,我国只批准了转基因棉花、木瓜和杨树的商业化种植,还未批准任何转基因主粮的商品化生产。但是,我国出口的米制品中还是屡次检出转基因成分,非法种植和销售转基因作物还是时有发生。因此,我国仍需加强对非法种植转基因和销售转基因产品的安全监管。农业部2015年农业转基因生物安全监管工作方案指出,要严查未经安全评价和品种审定转基因产品的非法扩散,保障我国农业转基因生物产业健康发展。并提出,充分利用试纸条等快速检测方法,降低成本,扩大市场监测范围。
免疫层析试纸条 (Immunochromatography test strip,ICTS) 是目前常用的快速检测方法之一。免疫层析是80年代初发展起来的一种快速免疫分析技术,有效结合了层析法和免疫检测法的优点。最常见的款型是侧向流设计的试纸条。ICTS具有操作简单、检测快速、结果易观察、样品需要量少、成本低、携带和保存方便等优点,此外,试纸条检测无需仪器或仅需简单仪器,且操作人员不需技术培训,非常适合现场检测及大规模筛查检测之用,目前已广泛应用于医学检测[2-6]、食品安全检测[7-10]、农牧业[11-15]等多个领域中,具有良好的应用前景。本文主要介绍了ICTS的组成、原理和标记物,及其在转基因检测中的应用研究。
1 免疫层析试纸条 1.1 组成结构试纸条由样品垫、结合垫、反应膜、检测线 (T线)、质控线 (C线)、吸收垫及背衬组成 (图 1)。
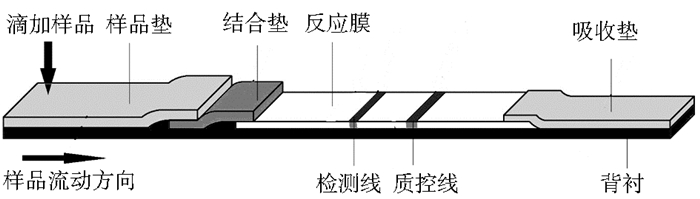
|
| 图 1 试纸条结构 Figure 1 Schematic illustration of the test strip |
样品垫主要的功能是接收样品,并均匀一致地将它转运至结合物释放区域或分析膜。样品垫还具有一些特殊的功能,如阻止分析物与其它成份的非特异性结合等。一般采用可润湿的惰性反应材料,如纤维素、玻璃微纤维和纺织聚合物等。
结合垫是试纸条重要的组件之一,是标记物附着的载体,需要有亲水性和良好的流动属性以保证样品能均一地转移到反应膜上。此外,还应具有以下特性:较低的非特异性吸附能力、均一的层析性能、均匀的基质容量、较低的阻逆性、易操作性和均一的可压缩性。常用材料有玻璃纤维、聚酯纤维和人造纤维丝。
反应膜是试纸条中另一个重要的组件,它是检测反应和质量控制反应的载体。功能是固定特定目的分子,同时将样品和检测结合物引导流向反应区域。膜需要有高的蛋白吸附能力,同时还需具备一定的孔隙度和润湿性以保证水性样品的毛细流动。常用材料是硝酸纤维素 (NC) 膜。
吸收垫位于试纸条的末端,主要功能是吸收反应膜上多余的样品及防止液体发生反向流动效应导致假阳性,因此需要采用具有较强吸水力和较大吸水体积的亲水材料,一般选用纤维素材料作为吸收垫。
背衬,即试纸条的支撑底板,通常为PVC材料,应有一定的机械强度。
1.2 原理ICTS可分为两类:夹心法和竞争法。夹心法常用于检测带有多个抗原表位的大分子抗原,如大分子蛋白质、细菌、病毒等[16-21];竞争法常用于检测具有单一抗原表位的小分子抗原[22-26]。下面以胶体金标记物为例,分别阐述夹心法和竞争法的原理。
夹心法:将金标抗体 (Au) Ab1吸附在结合垫上,捕获抗体Ab2喷涂于T线,抗Ab1二抗喷涂于C线。待测样品通过毛细管作用向前层析,层析至结合垫上时溶解其上的金标抗体,如果样品中含有待检抗原 (Ag) 则会与 (Au) Ab1结合,形成 (Au) Ab1-Ag继续向前层析,前行到T线时被抗体Ab2捕获形成 (Au) Ab1-Ag-Ab2的复合物,T线显现红色条带,过量的 (Au) Ab1继续前行,在C线处被抗Ab1二抗捕获形成复合物,C线也显示红色条带,为阳性结果;若T线无条带,C线为红色条带,为阴性结果。
竞争法:将金标抗体 (Au) Ab1吸附于结合垫上,抗原偶联物喷涂于T线,抗Ab1二抗喷涂于C线。待测样品通过毛细管作用向前层析,层析至结合垫时将其上的 (Au) Ab1溶解,如果样品中含有待检抗原 (Ag) 则会与 (Au) Ab1结合,形成 (Au) Ab1-Ag复合物继续向前层析,前行到T线时,T线上的抗原偶联物竞争结合有限的 (Au) Ab1,此时T线显示浅红色或不显色,T线颜色与样品中的抗原浓度呈反比,之后,(Au) Ab1-Ag复合物继续前行,在C线处被二抗捕获形成复合物,C线显示红色,为阳性结果;样品中不含待检抗原时,则T线上捕获到的金标抗体较多,T线和C线显示为红色条带,为阴性结果。
1.3 免疫标记物试纸条的标记物有酶、胶体金、胶乳颗粒、脂质体等,可根据不同的需要选择使用,目前应用最广泛的为胶体金。
免疫层析技术早期使用最多的标记物是酶,酶-底物的反应具有信号放大作用,能增加检测灵敏度。Ono等[27]报道称,以碱性磷酸酶标记的试纸条用于检测人血清总IgE,灵敏度比胶体金法高20倍。但是,由于酶对温度的要求高,稳定性差等缺陷,使其在试纸条中的应用并不普遍。
胶体金 (colloidal gold) 是由氯金酸 (HAuCl4) 在还原剂作用下,聚合成为许多单个直径在1~150 nm之间的金颗粒,并由于静电作用成为一种稳定的胶体状态,颜色呈桔红色到紫红色。因其具有颜色鲜亮、易于制备、强蛋白质吸附性、成本低、标记容易、稳定性好等优点,而被广泛用于免疫检测[28-32]中,目前商品化的试纸条主要是采用胶体金标记。但胶体金也有灵敏度不足、不易定量、颜色单一等缺点。
胶乳作为免疫层析标记物,一般是用聚乙烯聚合的胶乳颗粒。胶乳标记后的生物大分子的物质活性不变,具有良好的稳定性。将胶乳染成不同的颜色或在胶乳表面连接或内部包埋染料或荧光物质,制成彩色或荧光胶乳作为标记物,灵敏度高,且能定量,有着良好的应用前景[33, 7, 13]。但是胶乳颗粒的价格较贵,限制了它的普及应用。
脂质体 (Liposome) 是由磷脂分子在水相中自发形成的内为中空外有双层磷脂分子的微球,如其表面或内部含有染料的话,可作为免疫标记物。由于脂质体膜上能嵌合多个抗原或抗体分子,膜内水相能包含大量的显色剂,因而具有较高的灵敏度。Shukla等[34]采用脂质体免疫试纸条检测沙门氏菌,检测限远高于商业化的免疫试纸条。但是,脂质体的合成与标记比较费时,脱水后脂质体难以直接包被在结合垫上,限制了其在试纸条上的应用。
此外,近年有一些新型的标记物,如上转磷光颗粒、量子点、时间分辨荧光等,因其自身的优点在ICTS的标记方面的应用越来越多。
上转磷光 (upconverting phosphor,UCP) 颗粒是由包埋于氧化硫等惰性材料中的稀土镧系元素组成的一类能上转发光产生磷光的纳米级晶体粒子,它通过共价键与多种生物活性分子稳定结合,该粒子可在低能级的红外线激发下发射高能级的可见光。UCP不存在光学衰减且化学惰性强,且背景极低而灵敏度高。UCP良好的光学性状使其非常适合用作免疫标记物[35-39]。但是UCP颗粒不易制备,价格昂贵,标记繁琐,限制了其应用。
量子点 (quantum dots,QDs) 是一类由Ⅱ-Ⅳ、Ⅲ-Ⅴ或Ⅳ-Ⅵ族元素组成、直径为2~20 nm的半导体纳米微晶体,是一种理想的荧光标记物。QDs具有以下特点:(1) 激发光谱宽且连续分布,发射光谱窄而对称;(2) 发射的荧光强度大,寿命长,稳定性好,信号易检测;(3) 发射光谱可以通过改变其粒径大小、构成来控制。其优良的特性使其在免疫标记试纸条方面被广泛应用[40-43]。但QDs需要专门的检测仪器,且非特异性结合限制了QDs的检测灵敏度甚至导致错误的信号。
时间分辨荧光免疫分析 (time resolved fluoroimmunoassay,TRFIA) 技术是一种新型微量分析技术,它是以镧系稀土元素 (如Eu3+、Tb3+、Sm3+、Dy3+) 作为标记物,其荧光强度高,荧光衰变时间长,利用延缓测量时间,可消除自然荧光的干扰。TRFIA具有灵敏度高、特异性强、背景低、重复性好、标记位点多、标记物制备简便且储存久等优点,已成为食品、环境和医学检验中常用的分析方法[44-50]。TRFIA的缺点是需要时间分辨荧光速测仪。
2 ICTS在转基因检测中的应用转基因检测常用的方法一般分为两类,一类是基于核酸序列的方法,如定性PCR、荧光定量PCR、等温扩增等;另一类则是基于蛋白的方法,如ELISA、Western、试纸条等。PCR法仍然是目前转基因检测的主要方法,但PCR法需要昂贵的仪器设备及专业的技术人员,且耗时久,不适宜大规模筛查及现场即时检测;而试纸条法因其检测时间短,操作简便,结果易观察,成本低,更适合大规模筛查和即时检测。目前用于转基因检测的试纸条也可分为蛋白试纸条和核酸试纸条,下面分别讲述它们的研究应用及优缺点。
2.1 蛋白试纸条目前应用最为广泛的转基因检测试纸条是蛋白试纸条,它是基于转基因产品中外源蛋白 (杀虫蛋白Bt、抗除草剂蛋白等) 的检测,如Cry1Ac、Cry2A、BAR、PAT、CP4-EPSPS等。蛋白试纸条检测时只需将植物的叶片或种子经过简单的破碎处理,就可进行检测,5~15分钟即可得到结果。目前国内外已有很多商业化的转基因检测蛋白试纸条。我国油料所也研制出了具有成本低、灵敏度高、特异性强、通用性广等优势的蛋白试纸条,该试纸条还可用于抛光精米、玉米淀粉、玉米糊精等深加工产品的检测,效果良好。
国外针对转基因检测的蛋白试纸条的应用研究有很多。Ma等[51]用市售的蛋白试纸条检测了转基因作物中的Bt (Cry1Ab) 和LL (PAT),虽然检测方法简单快速,但检测限分别为1 %和2 %,灵敏度低于ELISA法和PCR法。Van den Bulcke等[52]对利用蛋白试纸条法检测转基因作物中5种主要的的外源蛋白 (CP4-EPSPS,CryIAb,Cry9C,PAT/pat和PAT/bar) 的方法进行了评价,并且还对食品和饲料中的转基因成分采用了蛋白试纸条 (CP4-EPSPS、CryIAb和PAT/pat) 和PCR法分别检测并进行了比较。结果表明,蛋白试纸条法适合用于作物的种子和叶片等原材料中转基因外源蛋白的检测;在食品和饲料等加工产品的检测中,蛋白试纸条的使用受转基因成分含量和外源蛋白自身的物理化学特性 (耐热性) 的限制,CP4-EPSPS蛋白相对适用于食品和饲料的转基因检测,而CryIAb和PAT/pat则不适用于食品和饲料中的转基因检测。Kumar[53]研发了一种可以同时检测转基因植物中常见的杀虫蛋白Vip3A和Cry1Ab/Cry1Ac的胶体金免疫试纸条,Cry1Ac和Cry1Ab蛋白检测限是50 ng/ml,Vip3A蛋白的检测限是100 ng/ml。Nascimento等[54]评价了蛋白试纸条法对不同浓度梯度的转基因玉米Bt11和MON810的种子、胚乳和胚轴中的转基因成分的检测灵敏度,并与传统PCR法比较了检测限。结果发现,Bt11和MON810中,种子的检测限为0.8%和1.6%,均高于试纸条所推荐的检测限 (Bt11:0.4%,MON810:0.8%),而PCR法中Bt11和MON810的检测限均达0.5%,表明蛋白试纸条法针对Bt11和MON810的检测灵敏度低于PCR法,仍有待提高。Cantelmo等[55]用美国EnviroLogix公司的蛋白试纸条对含有不同含量转基因玉米MON89034、NK603和TC1507的玉米种子、胚乳和胚的转基因成分分别进行了检测,对TC1507还用传统PCR法进行了检测,结果表明,在分别含有MON89034、NK603和TC1507的种子样品中均能检测出含量低至0.2%的转基因成分,低于试纸条推荐的检测限,而该研究中传统PCR法对TC1507转化事件的检测限为1%。Mutoni等[56]分别用蛋白试纸条法 (Cry1Ab和CP4) 和PCR法 (cry1Ab和cry1Ba) 对肯尼亚市场上的115份玉米样品进行了转基因检测,结果表明试纸条的检测结果与PCR法检测结果完全一致。Mohammed等[57]利用Cry1Ab/Ac Bt试纸条快速筛选转基因 (Cry1Ab) 豇豆和非转基因豇豆杂交的F1代和F2代中具有抗虫基因Cry1Ab的转基因豇豆品系,结果表明准确度为100%,为杂交培育后代的抗性性状筛选节省了时间,有效增加杂交培育的效率。
随着国家进一步加强对转基因生物安全的监管,且国内人们对转基因产品的关注度越来越高,转基因检测技术也显得至关重要。近些年来国内学者利用蛋白试纸条快速检测转基因成分的研究报道也逐渐增多。如2005年阚贵珍等[58]用试纸条法和PCR法对喷施草甘膦后部分存活的大豆材料后代进行了转基因成分检测,两种方法均从存活的大豆材料后代中检出了转基因成分CP4-EPSPS,两种检测方法的结果完全一致。2010年丁耀魁等[59]采用美国Strategic Diagnostics Inc (SDI) 公司的蛋白试纸条检测不同转基因含量大豆中的转基因成分CP4-EPSPS,检测限可达0.1 %,检测结果与PCR法的检测结果完全一致。聂新辉等[60]用金标试纸条检测转Bt基因棉花,结果表明,由于转Bt基因抗虫棉的抗虫性存在时空表达差异的现象,因此棉花不同时期、不同器官的样品应采用相应的稀释倍数检测,才能获得可靠的结果。除了用来检测转基因作物外,有研究者研发了两种竞争法胶体金试纸条用来检测转基因牛奶中的人乳铁 (hLF) 蛋白,一种是用胶体金标记hLF蛋白,检测线处喷涂抗hLF蛋白的单克隆抗体;另一种是胶体金标记抗hLF蛋白的多克隆抗体,检测线处喷涂hLF蛋白;阳性结果是只有质控线出现红色条带,阴性结果是检测线和质控线同时出现红色条带;用转基因牛奶作为样品,发现两种试纸条的检测结果一致,检测限为10 μg/ml[61]。此外,还有研究人员开发了一种利用不同抗体对的蛋白试纸条可以区分毕赤酵母中表达的重组植酸酶和转基因玉米中表达的重组植酸酶[62]。
蛋白试纸条相对于传统PCR检测来说,不需要进行繁琐的样品DNA提取步骤,样品仅需简单破碎,无需仪器和专业技术人员,就可直接进行检测,仅需5~15分钟,且成本低廉,非常适合现场即时检测或者条件较差的基层实验室检测。但是蛋白试纸条不适用于深加工转基因产品的检测,且仍存在假阴性和假阳性问题,如2001年Fagan等[63]评价了美国SDI公司的Roundup Ready大豆试纸条在田间条件下的检测情况。该研究发现,在转基因大豆最高含量为1%的试验中,试纸条的假阳性率为6.70%;当转基因大豆含量为0.01%时,只有6.70%的样品检出转基因,即假阴性率达93.30%;当转基因大豆含量为0.1%时,假阴性率达70.50%;当转基因大豆含量为0.50%时,假阴性率为33.30%;当转基因大豆含量为1%时,假阴性率为31.82%;当转基因大豆含量为10%时,全部检出。研究结果表明,该试纸条不适用于检测转基因含量在1%及以下的样品。统计分析表明,人员的操作表现而非测试试纸条材料的缺陷,是造成该试纸条假阳性和假阴性结果的主要原因,而样本大小可能会起到次要作用。试纸条假阳性和假阴性的产生有许多不同的原因,可能由样品或试纸条本身的设计缺陷或操作不当引起。随着试纸条技术的发展,其产品设计和质量越来越优化,操作步骤也日趋简化,由产品质量和人为操作引起的假阳性或假阴性结果的可能性也越来越小。排除产品质量和人为操作的原因,假阴性通常是试纸条灵敏度导致的问题,而假阳性则通常是样品非特异性吸附导致的问题。本研究室尝试过国内外多家公司的蛋白试纸条产品,结果均不是很理想,主要问题还是灵敏度偏低。如果能解决这些问题,蛋白试纸条将在转基因的快速检测上有着更好的应用前景。
2.2 核酸试纸条除了用来检测蛋白之外,ICTS还能用来检测核酸,近些年来有关核酸试纸条的研究报道越来越多。核酸试纸条可以结合PCR、多重PCR、环介导等温扩增 (loop-mediated isothermal amplification,LAMP)、赖解旋酶等温扩增 (helicase-dependent isothermal DNA amplification,HDA)、交叉引物恒温扩增 (cross priming amplification,CPA) 等多种核酸扩增方法,将引物或探针标记异硫氰酸荧光素 (FITC)、地高辛 (DIG) 或生物素 (biotin) 等,扩增产物可用含相应抗体标记的试纸条来检测。目前核酸试纸条已在细菌[64-67]、病毒[68-74]、真菌[75]、线虫[76]、疟原虫[77]和锥虫[78-79]的检测方面有较多的应用。目前已有商品化核酸试纸条出售。
近几年来,利用核酸试纸条检测常见的转基因成分CaMV35S启动子的研究较多,如Woo等[80]用双重PCR结合一次性核酸试纸条装置Type Ⅱ BEStTM Cassette检测了含转基因玉米59122的玉米粉中的外源CaMV35S启动子和内源基因SSIIb,检测限为1%。该双重PCR中,CaMV35S的上游引物标记有FITC,SSIIb的上游引物标记有DIG,CaMV35S和SSIIb的下游引物均标记有biotin。试纸条中的结合垫上含有结合了亲和素的有色粒子,层析膜上的T线和C线可同时检测两个扩增产物,其中T线能捕获FITC标记的CaMV35S的扩增产物,C线能捕获DIG标记的SSIIb的扩增产物。Huang等[81]建立了CPA结合一次性核酸试纸条检测CaMV35S启动子的方法,并对该方法进行了条件优化、特异性和灵敏度的实验。该CPA反应的一条检测引物标记了FITC,另一条引物标记了biotin,含有FITC-biotin双标记的CPA扩增产物与试纸条上结合垫处亲和素包被的红色胶乳颗粒结合,继续前行在固定了FITC抗体的T线处被捕获。结果表明,该方法特异性良好,检测限是30拷贝的含CaMV35S启动子序列的质粒pBI121DNA,最低能检测到含量0.05%的MON810标准样品,且重复性良好。利用该试纸条对来自市场的样品如饼干、豆粉、豆粕、饲料等9个样品进行了CaMV35S检测,结果与实时PCR检测结果一致。Kolm等[82]研究了用HDA技术结合核酸试纸条检测转基因作物中的外源CaMV35S启动子。实验中,HDA引物用DIG和biotin标记,试纸条的结合垫上含有亲和素包被的胶体金,检测线处喷涂了抗DIG的抗体,HDA反应时间为60分钟,试纸条检测只需5~10分钟。用转基因玉米MON810、Bt11和NK603对此方法进行了特异性和灵敏度实验,结果表明该方法检测这三种转基因玉米的特异性良好,灵敏度均能达到0.5%。
此外,还有一些检测除草剂基因及大豆转化事件的核酸试纸条的研究报道。汪琳等[83]建立了核酸试纸条结合LAMP技术检测转基因产品中的cp4-EPSPS基因的方法,并进行了特异性、稳定性和灵敏度实验。该方法在一对环引物上分别标记了biotin和FITC,核酸试纸条采用德国的Milenia GenLine HybriDetect试剂盒。结果表明该方法具有高度特异性和稳定性,检测限为10个拷贝的含EPSPS DNA的质粒。Wang等[84]建立了LAMP结合试纸条技术的快速检测RRS转基因大豆的方法,该实验中,内源基因Lec1和转化体特异性序列G35S的内引物FIP的5′端均标记有biotin,探针均标记了FITC,试纸条上的结合垫上含有胶体金标记的抗FITC抗体,T线上喷涂有亲和素,C线上喷涂有抗FITC抗体的二抗,扩增产物能特异性结合在T线上。检测结果说明,该方法的特异性良好,检测限为2.4拷贝的线性质粒pTLH10,灵敏度为传统PCR方法的20倍,且LAMP产物的试纸条检测与琼脂糖凝胶电泳检测结果一致。还有研究报道[85]利用PCR结合核酸试纸条法快速灵敏地检测转基因黑曲霉,灵敏度为凝胶电泳检测PCR产物法的10倍以上;其PCR上游引物5′端标记biotin,探针标记FITC,PCR反应结束后,加入探针杂交,再将杂交产物加入到试纸条的样品垫进行检测,探针法核酸试纸条能降低引物二聚体引起的假阳性。
核酸试纸条是基于核酸的检测方法,核酸比蛋白稳定,因此可以检测蛋白试纸条难以检测的深加工产品,还可以检测启动子和终止子等调控元件。此外,与传统的琼脂糖凝胶电泳法检测核酸扩增结果相比,核酸试纸条避免了接触致癌的溴化乙锭,扩增结果判断简单快速。但是,核酸试纸条法也存在假阳性和假阴性问题,假阳性问题主要是引物二聚体和非特异性扩增引起的,利用探针法可以提高检测特异性,降低假阳性,但是探针法成本较高。假阴性则主要是核酸扩增的效率导致的,如果结合高效率的核酸扩增的话,灵敏度可能会高于蛋白试纸条。但由于需要DNA提取及核酸扩增步骤,耗时较久,需要仪器,这些缺点限制了其实际应用;如果能简化核酸提取及扩增的繁琐步骤,进一步提高特异性和灵敏度,降低成本,核酸试纸条将会在转基因检测上有很好的发展前景。
3 展望试纸条法操作简单,检测快速,成本低廉,结果易判断,适合于快速筛查检测。但是,试纸条也存在灵敏度低、不易定量等问题,这也是限制试纸条推广应用的一个瓶颈。随着科学技术的不断发展,试纸条的主要研究方向将致力于提高灵敏度、定量和多元检测等方面。
采用新型更灵敏的标记物或信号放大系统如生物素-亲和素系统,再结合一些简单便携的检测仪器可达到提高灵敏度的效果。曾令文 (Zeng L W) 研究组[86]研发了一种超灵敏检测铅离子的非酶信号扩增试纸条,可检测出10 pmol/L的铅离子。有研究者[87]开发了一种纳米酶免疫试纸条,用于快速检测埃博拉病毒,检测限低至1 ng/ml,灵敏度是传统试纸条的100倍。传统的试纸条属于终点定性检测,不适合于需要定量的检测。T/C比值法可在一定程度上消除时空差异、样本基质对试纸条显色差异的影响,目前广泛应用于试纸条定量检测[88-90],李超辉等[91]建立了基于T/C比值法的胶体金免疫试纸条定量检测尿样中克伦特罗的方法。在同一个试纸条上同时检测多个目标蛋白或基因的多元检测试纸条目前已实现了商品化,如EnviroLogix公司的QuickStix Combo Kit可以同时检测四种蛋白产物;Advant Biotechnologies公司的Pro StripsTM可同时检测五种生物毒素;德国的Milenia GenLine HybriDetect的核酸试纸条试剂盒也可以同时检测两种基因。
由于传统的PCR检测方法较复杂,耗费时间久,需要大量的人力物力,而抽样量小、抽查面积小也容易导致漏检,而适合基层检测和现场即时检测的试纸条法简单、快速、经济,可以大面积大范围地快速筛查转基因作物。随着试纸条技术的不断创新发展,其有望在我国转基因成分检测中发挥更大的作用。
| [1] | JamesC. 2015年全球生物技术/转基因作物商业化发展态势. 中国生物工程杂志, 2016, 36(4) : 1–11. James C. Global status of commercialized biotech/GM crops:2015. China Biotech, 2016, 36(4) : 1–11. |
| [2] | Pugia M J, Sommer R G, Kuo H H, et al. Near-patient testing for infection using urinalysis and immuno-chromatography strips. Clin Chem Lab Med, 2004, 42(3) : 340–346. |
| [3] | Higashi Y, Miyoshi H, Takeda K, et al. Evaluation of a newly-developed immunochromatography strip test for diagnosing dermatophytosis. Int J Dermatol, 2012, 51(4) : 406–409. DOI:10.1111/ijd.2012.51.issue-4 |
| [4] | 黄欢, 李朔, 孙丽洲, 等. 长引物快速PCR结合核酸试纸条法可视化检测四种病原体. 标记免疫分析与临床, 2013, 20(6) : 436–439. Huang H, Li S, Sun L Z, et al. Development of a long-primer fast PCR coupled with visual nucleic acid dipstick assay for detection of four pathogens. Labeled Immunoassays & Clin Med, 2013, 20(6) : 436–439. |
| [5] | 徐宽, 沈鹤柏, 朱龙章. 纳米金免疫层析法定量检测尿RBP. 上海师范大学学报 (自然科学版), 2013, 42(2) : 154–160. Xu K, Shen H B, Zhu L Z. Gold nanoparticle immunochromatographic assay for quantitative detection of urinary RBP. J Shanghai Normal Univ (Nat Sci), 2013, 42(2) : 154–160. |
| [6] | Leem H, Shukla S, Song X, et al. An efficient liposome-based immunochromatographic strip assay for the sensitive detection of Salmonella typhimurium in pure culture. J Food Safety, 2014, 34(3) : 239–248. DOI:10.1111/jfs.2014.34.issue-3 |
| [7] | 崔浩, 陈耀强, 唐勇, 等. 莱克多巴胺荧光胶乳颗粒免疫层析检测法的建立. 分析测试学报, 2011, 30(7) : 764–768. Cui H, Chen Y Q, Tang Y, et al. Development of an immunochromatography assay with fluorescent latex particles for the rapid detection of ractopamine. J Instr Anal, 2011, 30(7) : 764–768. |
| [8] | Bai Z H, Luo Y B, Xu W T, et al. Development of a new fluorescence immunochromatography strip for detection of chloramphenicol residues in chicken muscles. J Sci Food Agr, 2013, 93(15) : 3743–3747. DOI:10.1002/jsfa.2013.93.issue-15 |
| [9] | Zhang L, Huang Y J, Wang J Y, et al. Hierarchical flowerlike gold nanoparticles labeled immunochromatography test strip for highly sensitive detection of Escherichia coli O157:H7. Langmuir, 2015, 31(19) : 5537–5544. DOI:10.1021/acs.langmuir.5b00592 |
| [10] | Che H X, Tian B, Bai L N, et al. Development of a test strip for rapid detection of lactoperoxidase in raw milk. J Zhejiang Univ-Sci B (Biomed & Biotechnol), 2015, 16(8) : 672–679. |
| [11] | Bautista D A, Elankumaran S, Arking J A, et al. Evaluation of an immunochromatography strip assay for the detection of Salmonella sp. from poultry. J Vet Diagn Invest, 2002, 14(5) : 427–430. DOI:10.1177/104063870201400514 |
| [12] | Nimitphak T, Meemetta W, Arunrut N, et al. Rapid and sensitive detection of Penaeus monodon nucleopolyhedrovirus (PemoNPV) by loop-mediated isothermal amplification combined with a lateral-flow dipstick. Mol Cell Probe, 2010, 24(1) : 1–5. DOI:10.1016/j.mcp.2009.09.004 |
| [13] | 蒋韬, 任维维, 梁仲, 等. 口蹄疫O、Asia1分型彩色胶乳试纸条诊断方法的建立. 畜牧兽医学报, 2011, 42(6) : 815–822. Jiang T, Ren W W, Liang Z, et al. Development of a rapid colour latex particles immunochromatographic striptest for the diagnosis of foot-and-mouth disease virus O and Asia 1 type. Acta Veterinaria et Zootechnica Sinica, 2011, 42(6) : 815–822. |
| [14] | 李怀明, 赖卫华, 许恒毅, 等. 基于荧光硅球的克伦特罗快速定量免疫层析试纸条的研制. 分析化学, 2011, 39(11) : 1647–1652. Li H M, Lai W H, Xu H Y, et al. A fluorescent silica nanobead-based lateral flow immunochromatographic strip for rapid and quantitative detection of clenbuterol. Chinese J Anal Chem, 2011, 39(11) : 1647–1652. |
| [15] | Siah A, McKenna P. Rapid detection assay for the invasive vase tunicate, Ciona intestinalis, using loop-mediated isothermal amplification combined with lateral flow dipstick. Manage Biol Invasions, 2013, 4(1) : 81–86. DOI:10.3391/mbi |
| [16] | Khamrin P, Dey S K, Chan I W, et al. Evaluation of a rapid immunochromatography strip test for detection of astrovirus in stool specimens. J Trop Pediatr, 2010, 56(2) : 129–131. DOI:10.1093/tropej/fmp055 |
| [17] | 解泉源, 赖卫华, 刘春梅, 等. 大肠杆菌O157:H7荧光微球免疫层析试纸条的研制. 食品科学, 2013, 34(16) : 353–357. Xie Q Y, Lai W H, Liu C M, et al. Development of fluorescent microsphere immunochromatographic strip for detection of Escherichia coli O157:H7. Food Sci, 2013, 34(16) : 353–357. |
| [18] | 吴海云, 陈晨, 左月明, 等. 基于电阻抗分析的免疫层析试纸条定量检测大肠杆菌O157:H7. 中国食品学报, 2013, 13(17) : 175–180. Wu H Y, Chen C, Zuo Y M, et al. Quantitative detection of Escherichia coli O157:H7 based on the electrical impedance analysis of immunochromatographic test strip. J Chinese Inst Food Sci Tech, 2013, 13(17) : 175–180. |
| [19] | Shukla S, Leem H, Lee J S, et al. Immunochromatographic strip assay for the rapid and sensitive detection of Salmonella typhimurium in artificially contaminated tomato samples. Can J Microbiol, 2014, 60(6) : 399–406. DOI:10.1139/cjm-2014-0223 |
| [20] | Amada T, Yoshimatsu K, Koma T, et al. Development of an immunochromatography strip test based on truncated nucleocapsid antigens of three representative hantaviruses. Virol J, 2014, 11(1) : 87. DOI:10.1186/1743-422X-11-87 |
| [21] | 李军涛, 候水平, 姬泽薇, 等. 免疫荧光层析试纸条法检测食用油中的黄曲霉毒素B1. 中国卫生检验杂志, 2015, 25(7) : 963–965. Li J T, Hou S P, Ji Z W, et al. An immunofluorescence chromatographic test method for detection of aflatoxin B1 in edible oil. Chin J Health Lab Tec, 2015, 25(7) : 963–965. |
| [22] | Zhu Y, Li L, Wang Z H, et al. Development of an immunochromatography strip for the rapid detection of 12 fluoroquinolones in chicken muscle and liver. J Agr Food Chem, 2008, 56(14) : 5469–5474. DOI:10.1021/jf800274f |
| [23] | 胡华军, 付涛, 张明洲, 等. CdTe/ZnSe核壳量子点免疫层析试纸条检测克伦特罗的研究. 分析化学, 2010, 38(12) : 1727–1731. Hu H J, Fu T, Zhang M Z, et al. Development of CdTe/ZnSe core/shell quantum dots-based lateral-flow immunoassay for rapid detection of clenbuterol. Chinese J Anal Chem, 2010, 38(12) : 1727–1731. |
| [24] | 龚云飞, 陈宗伦, 奚茜, 等. 三聚氰胺胶体金免疫层析试纸条的研制. 生物工程学报, 2012, 28(7) : 887–898. Gong Y F, Chen Z L, Xi X, et al. Colloidal gold immunochromatographic strip for rapid detection of melamine. Chin J Biotech, 2012, 28(7) : 887–898. |
| [25] | 胡佳丽, 刘小雷, 于东升, 等. 头孢氨苄残留荧光免疫层析试纸条的研制. 中国药学杂志, 2014, 49(12) : 1067–1072. Hu J L, Liu X L, Yu D S, et al. Development of fluorescent immunochromatographic strip for detection of cefalexin residue. Chin Pharm J, 2014, 49(12) : 1067–1072. |
| [26] | Zhu A R, Huo R L, Zhou W, et al. Establishment of colloidal gold immunochromatography strip for detection of florfenicol residues. Curr Pharm Anal, 2014, 10(4) : 263–270. DOI:10.2174/1573412910666140702162232 |
| [27] | Ono T, Kawamura M, Arao S, et al. A highly sensitive quantitative immunochromatography assay for antigen-specific IgE. J Immunol Methods, 2003, 272(1-2) : 211–218. DOI:10.1016/S0022-1759(02)00504-5 |
| [28] | Tripathi V, Nara S, Singh K, et al. A competitive immunochromatographic strip assay for 17-α-hydroxy progesterone using colloidal gold nanoparticles. Clin Chim Acta, 2012, 413(1-2) : 262–268. DOI:10.1016/j.cca.2011.10.016 |
| [29] | Masinde L A, Sheng W, Xu X, et al. Colloidal gold based immunochromatographic strip for the simple and sensitive determination of aflatoxin B1 and B2 in corn and rice. Microchim Acta, 2013, 180(9) : 921–928. |
| [30] | Wang Y, Wang L F, Zhang J W, et al. Preparation of colloidal gold immunochromatographic strip for detection of Paragonimiasis skrjabini. PLoS One, 2014, 9(3) : e92034. DOI:10.1371/journal.pone.0092034 |
| [31] | Zhang Y B, Wang Y J, Meng J, et al. Development of an immunochromatographic strip test for rapid detection of lily symptomless virus. J Virol Methods, 2015, 220 : 13–17. DOI:10.1016/j.jviromet.2015.03.021 |
| [32] | Yang X D, Zhang G P, Wang F Y, et al. Development of a colloidal gold-based strip test for the detection of chlorothalonil residues in cucumber. Food Agr Immunol, 2015, 26(5) : 729–737. DOI:10.1080/09540105.2015.1018875 |
| [33] | Reid S M, Ferris N P, Bruning A, et al. Development of a rapid chromatographic strip test for the pen-side detection of foot-and-mouth disease virus antigen. J Virol Methods, 2001, 96(2) : 189–202. DOI:10.1016/S0166-0934(01)00334-2 |
| [34] | Shukla S, Leem H, Kim M. Development of a liposome-based immunochromatographic strip assay for the detection of Salmonella. Anal Bioanal Chem, 2011, 401(8) : 2581–2590. DOI:10.1007/s00216-011-5327-2 |
| [35] | Qu Q, Zhu Z W, Wang Y F, et al. Rapid and quantitative detection of Brucella by up-converting phosphor technology-based lateral-flow assay. J Microbiol Meth, 2009, 79(1) : 121–123. DOI:10.1016/j.mimet.2009.07.015 |
| [36] | Li L P, Zhou L, Yu Y, et al. Development of up-converting phosphor technology-based lateral-flow assay for rapidly quantitative detection of hepatitis B surface antibody. Diagn Micr Infec Dis, 2009, 63(2) : 165–172. DOI:10.1016/j.diagmicrobio.2008.10.020 |
| [37] | Hong W Y, Huang L H, Wang H R, et al. Development of an up-converting phosphor technology-based 10-channel lateral flow assay for profiling antibodies against Yersinia pestis. J Microbiol Meth, 2010, 83(2) : 133–140. DOI:10.1016/j.mimet.2010.08.005 |
| [38] | Zhang P P, Liu X, Wang C B, et al. Evaluation of up-converting phosphor technology-based lateral flow strips for rapid detection of Bacillus anthracis spore, Brucella spp., and Yersinia pestis. PLoS One, 2014, 9(8) : e105305. DOI:10.1371/journal.pone.0105305 |
| [39] | Corstjens P L, de Dood C J, Priest J W, et al. Feasibility of a lateral flow test for neurocysticercosis using novel up-converting nanomaterials and a lightweight strip analyzer. PLoS Negl Trop Dis, 2014, 8(7) : e2944. DOI:10.1371/journal.pntd.0002944 |
| [40] | Bruno J G. Application of DNA aptamers and quantum dots to lateral flow test strips for detection of foodborne pathogens with improved sensitivity versus colloidal gold. Pathog, 2014, 3(2) : 341–355. DOI:10.3390/pathogens3020341 |
| [41] | Cheng X L, Pu X, Jun P, et al. Rapid and quantitative detection of C-reactive protein using quantum dots and immunochromatographic test strips. Int J Nanomed, 2014, 9(1) : 5619–5626. |
| [42] | Wang C Y, Hou F, Ma Y C. Simultaneous quantitative detection of multiple tumor markers with a rapid and sensitive multicolor quantum dots based immunochromatographic test strip. Biosens Bioelectron, 2015, 68 : 156–162. DOI:10.1016/j.bios.2014.12.051 |
| [43] | Zheng Y, Wang K, Zhang J J, et al. Simultaneous quantitative detection of Helicobacter pylori based on a rapid and sensitive testing platform using quantum dots-labeled immunochromatiographic test strips. Nanoscale Res Lett, 2016, 11(1) : 62. DOI:10.1186/s11671-016-1254-7 |
| [44] | Liu T C, Chen M J, Ren Z Q, et al. Development of an improved time-resolved fluoroimmunoassay for simultaneous quantification of C-peptide and insulin in human serum. Clin Biochem, 2014, 47 : 439–444. DOI:10.1016/j.clinbiochem.2014.01.016 |
| [45] | Le T, Yi S H, Wei S, et al. A competitive dual-label time-resolved fluoroimmunoassay for the simultaneous detection of chlortetracycline and doxycycline in animal edible tissues. Food Agr Immunol, 2015, 26(6) : 804–812. DOI:10.1080/09540105.2015.1036355 |
| [46] | Lin G F, Liu T C, Hou J Y, et al. A magnetic nanoparticle-based time-resolved fluoroimmunoassay for determination of the cytokeratin 19 fragment in human serum. J Fluoresc, 2015, 25(2) : 361–367. DOI:10.1007/s10895-015-1518-0 |
| [47] | Lu J Y, Zou L L, Liu B, et al. Development of a time-resolved fluoroimmunoassay of CFP-10 for rapid diagnosis of tuberculous pleural effusion. Tuberculosis, 2015, 95(4) : 426–431. DOI:10.1016/j.tube.2015.04.005 |
| [48] | Shi H Y, Sheng E Z, Feng L, et al. Simultaneous detection of imidacloprid and parathion by the dual-labeled time-resolved fluoroimmunoassay. Environ Sci Pollut Res, 2015, 22(19) : 14882–14890. DOI:10.1007/s11356-015-4697-y |
| [49] | Xie M J, Huang H, Hang J F, et al. Evaluation of the analytical and clinical performances of time-resolved fluoroimmunoassay for detecting carcinoma antigen 50. J Immunoass Immunoch, 2015, 36(3) : 265–283. DOI:10.1080/15321819.2014.937542 |
| [50] | Zhou B, Zhang J, Fan J, et al. A new sensitive method for the detection of chloramphenicol in food using time? resolved fluoroimmunoassay. Eur Food Res Technol, 2015, 240(3) : 619–625. DOI:10.1007/s00217-014-2363-0 |
| [51] | Ma B L, Subedi K, Evenson L, et al. Evaluation of detection methods for genetically modified traits in genotypes resistant to European corn borer and herbicides. J Environ Sci Heal B, 2005, 40(4) : 633–644. DOI:10.1081/PFC-200061573 |
| [52] | Van den Bulcke M, De Schrijver A, De Bernardi D, et al. Detection of genetically modified plant products by protein strip testing:an evaluation of real-life samples. Eur Food Res Technol, 2007, 225(1) : 49–57. DOI:10.1007/s00217-006-0381-2 |
| [53] | Kumar R. Development of dipsticks for simultaneous detection of Vip3A and Cry1Ab/Cry1Ac transgenic proteins. J AOAC Int, 2012, 95(4) : 1131–1137. DOI:10.5740/jaoacint.11-271 |
| [54] | Nascimento V E, Von Pinho É V, Von Pinho R G, et al. Detection limits of the strip test and PCR for genetically modified corn in Brazil. Genet Mol Res, 2012, 11(3) : 2497–2505. DOI:10.4238/2012.June.27.2 |
| [55] | Cantelmo N F, Von Pinho É V, Von Pinho R G, et al. Detection of transgenic events in maize using immunochromatographic strip test and conventional PCR. Cienc Agrotec, 2013, 37(5) : 404–409. DOI:10.1590/S1413-70542013000500003 |
| [56] | Mutoni C K, Magiri E, Boga I H, et al. Inadvertent presence of genetically modified elements in maize food products in Kenyan markets. Afr J Biotechnol, 2013, 12(31) : 4881–4890. DOI:10.5897/AJB |
| [57] | Mohammed B S, Ishiyaku M F, Sami R A. Application of Cry1Ab/Ac Bt strip for screening of resistance for Maruca vitrata in cowpea. Afr J Biotechnol, 2013, 12(40) : 5869–5874. DOI:10.5897/AJB |
| [58] | 阚贵珍, 喻德跃. 试纸条法和PCR法检测抗草甘膦转基因大豆的外源基因. 中国油料作物学报, 2005, 27(4) : 18–21. Kan G Z, Yu D Y. Detection of transgenes resistant to glyphosate in soybean by combining test strip and PCR methods. Chin J Oil Crop Sci, 2005, 27(4) : 18–21. |
| [59] | 丁耀魁, 沈娟, 马黎黎. 快速检测试纸条法在大豆转基因检测中的应用. 粮油食品科技, 2010, 18(2) : 45–46. Ding Y K, Shen J, Ma L L. Application of test paper in detecting transgenic soybean. Sci Tech Cereals Oils & Foods, 2010, 18(2) : 45–46. |
| [60] | 聂新辉, 尤春源, 陈惠瑜, 等. 金标Bt-CryIAb/Ac试纸条定性检测转Bt基因棉花的方法研究. 中国棉花, 2013, 40(1) : 15–17. Nie X H, You C Y, Chen H Y, et al. Study on detecting methods using lateral flow strip of Bt-CryIAb/Ac. China Cotton, 2013, 40(1) : 15–17. |
| [61] | Liu C X, Zhai S L, Zhang Q D, et al. Immunochromatrography detection of human lactoferrin protein in milk from transgenic cattle. J AOAC Int, 2013, 96(1) : 116–120. DOI:10.5740/jaoacint.11-376 |
| [62] | Zhou X J, Hui E, Yu X L, et al. Development of a rapid immunochromatographic lateral flow device capable of differentiating phytase expressed from recombinant Aspergillus niger phyA2 and genetically modified corn. J Agric Food Chem, 2015, 63(17) : 4320–4326. DOI:10.1021/acs.jafc.5b00188 |
| [63] | Fagan J, Schoel B, Haegert A, et al. Performance assessment under field conditions of a rapid immunological test for transgenic soybeans. Int J Food Sci Tech, 2001, 36 : 357–367. DOI:10.1046/j.1365-2621.2001.00482.x |
| [64] | Prompamorn P, Sithigorngul P, Rukpratanporn S, et al. The development of loop-mediated isothermal amplification combined with lateral flow dipstick for detection of Vibrio parahaemolyticus. Lett Appl Microbiol, 2011, 52(4) : 344–351. DOI:10.1111/lam.2011.52.issue-4 |
| [65] | Chen X X, Gan M, Xu H, et al. Development of a rapid and sensitive quantum dot-based immunochromatographic strip by double labeling PCR products for detection of Staphylococcus aureus in food. Food Control, 2014, 46 : 225–232. DOI:10.1016/j.foodcont.2014.04.044 |
| [66] | 庞璐, 宋喆, 吴冬雪, 等. PCR-免疫胶体金试纸条方法检测食品中肠出血性大肠杆菌O157:H7. 食品安全质量检测学报, 2015, 69(2) : 447–451. Pang L, Song Z, Wu D X, et al. Detection of Escherichia coli O157:H7 in food by PCR-immunogold method. J Food Safe Qual, 2015, 69(2) : 447–451. |
| [67] | 李尚阳, 周前进, 张严峻, 等. 环介导等温扩增联合横向流动试纸条可视化检测志贺氏菌. 微生物学通报, 2016, 43(7) : 1616–1626. Li S Y, Zhou Q J, Zhang Y J, et al. Visual detection of Shigella based on loop-mediated isothermal amplification combined with a lateral flow dipstick. Microbiol China, 2016, 43(7) : 1616–1626. |
| [68] | Puthawibool T, Senapin S, Flegel T W, et al. Rapid and sensitive detection of Macrobrachium rosenbergii nodavirus in giant freshwater prawns by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. Mol Cell Probe, 2010, 24(5) : 244–249. DOI:10.1016/j.mcp.2010.07.003 |
| [69] | Arunrut N, Seetang-Nun Y, Phromjai J, et al. Rapid and sensitive detection of Laem-Singh virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. J Virol Methods, 2011, 177(1) : 71–74. DOI:10.1016/j.jviromet.2011.06.020 |
| [70] | Tsai S M, Liu H J, Shien J H, et al. Rapid and sensitive detection of infectious bursal disease virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. J Virol Methods, 2012, 181(1) : 117–124. DOI:10.1016/j.jviromet.2011.09.002 |
| [71] | Khunthong S, Jaroenram W, Arunrut N, et al. Rapid and sensitive detection of shrimp yellow head virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. J Virol Methods, 2013, 188(1-2) : 51–56. DOI:10.1016/j.jviromet.2012.11.041 |
| [72] | Gou H C, Deng J R, Pei J J, et al. Rapid and sensitive detection of type Ⅱ porcine reproductive and respiratory syndrome virus by reverse transcription loop-mediatedisothermal amplification combined with a vertical flowvisualization strip. J Virol Methods, 2014, 209 : 86–94. DOI:10.1016/j.jviromet.2014.09.011 |
| [73] | Kusumawati A, Tampubolon I D, Hendarta N Y, et al. Use of reverse transcription loop-mediated isothermal amplification combined with lateral flow dipstick for an easy and rapid detection of Jembrana disease virus. Virus Dis, 2015, 26(3) : 189–195. DOI:10.1007/s13337-015-0277-5 |
| [74] | Su Z D, Shi C Y, Huang J, et al. Establishment and application of cross-priming isothermal amplification coupled with lateral flow dipstick (CPA-LFD) for rapid and specific detection of red-spotted grouper nervous necrosis virus. Virol J, 2015, 12 : 149. DOI:10.1186/s12985-015-0374-5 |
| [75] | Vaagt F, Haase I, Fischer M. Loop-mediated isothermal amplification (LAMP)-based method for rapid mushroom species identification. J Agric Food Chem, 2013, 61(8) : 1833–1840. DOI:10.1021/jf304824b |
| [76] | 张裕君, 王金成, 魏亚东. 可视化核酸试纸条法快速检测松材线虫. 植物保护, 2013, 39(4) : 94–98. Zhang Y J, Wang J C, Wei Y D. Visual nucleic acid test strips for rapid detection of Bursaphelenchus xylophilu. Plant Protect, 2013, 39(4) : 94–98. |
| [77] | Yongkiettrakul S, Jaroenram W, Arunrat N, et al. Application of loop-mediated isothermal amplification assay combined with lateral flow dipstick for detection of Plasmodium falciparum and Plasmodium vivax. Parasitol Int, 2014, 63(6) : 777–784. DOI:10.1016/j.parint.2014.06.004 |
| [78] | Njiru Z K, Ouma J O, Enyaru J C, et al. Loop-mediated isothermal amplification (LAMP) test for detection of Trypanosoma evansi strain B. Exp Parasitol, 2010, 125(3) : 196–201. DOI:10.1016/j.exppara.2010.01.017 |
| [79] | Njiru Z K. Rapid and sensitive detection of human African trypanosomiasis by loop-mediated isothermal amplification combined with a lateral-flow dipstick. Diagn Micr Infec Dis, 2011, 69(2) : 205–209. DOI:10.1016/j.diagmicrobio.2010.08.026 |
| [80] | Woo H J, Chung C M, Shin K S, et al. Application of polymerase chain reaction with disposable amplicon detection device for identification of regulatory gene introduced into genetically modified maize. J Korean Soc Appl Biol Chem, 2011, 54(6) : 860–864. DOI:10.1007/BF03253173 |
| [81] | Huang X, Zhai C C, You Q M, et al. Potential of cross-priming amplification and DNA-based lateral-flow strip biosensor for rapid on-site GMO screening. Anal Bioanal Chem, 2014, 406(17) : 4243–4249. DOI:10.1007/s00216-014-7791-y |
| [82] | Kolm C, Mach R L, Krska R, et al. A rapid DNA lateral flow test for the detection of transgenic maize by isothermal amplification of the 35S promoter. Anal Methods, 2015, 7(1) : 129–134. DOI:10.1039/C4AY01997K |
| [83] | 汪琳, 罗英, 周琦, 等. 核酸试纸条在检测转EPSPS基因作物中的应用. 生物技术通讯, 2011, 22(2) : 238–242. Wang L, Luo Y, Zhou Q, et al. Application of nucleic acid strips in the detection of transgenic EPSPS crops. Lett Biotechnol, 2011, 22(2) : 238–242. |
| [84] | Wang X M, Teng D, Guan Q F, et al. Detection of roundup ready soybean by loop-mediated isothermal amplification combined with a lateral-flow dipstick. Food Control, 2013, 29(1) : 213–220. DOI:10.1016/j.foodcont.2012.06.007 |
| [85] | 张裕君, 贺艳, 赵卫东, 等. PCR核酸试纸条法检测转基因黑曲霉. 食品研究与开发, 2013, 34(20) : 62–64. Zhang Y J, He Y, Zhao W D, et al. The method of PCR and nucleic acid strips to detect transgenic Aspergillus niger. Food Res Dev, 2013, 34(20) : 62–64. |
| [86] | Zeng L W, Chen J H, Zhou X M. Enzyme-free strip biosensor for amplified detection of Pb2+ based on a catalytic DNA circuit. Chem Commun, 2013, 49(10) : 984–986. DOI:10.1039/C2CC37598B |
| [87] | Duan D M, Fan K L, Zhang D X, et al. Nanozyme-strip for rapid local diagnosis of Ebola. Biosens Bioelectron, 2015, 74 : 134–141. DOI:10.1016/j.bios.2015.05.025 |
| [88] | Xu W, Chen X L, Huang X L, et al. Ru (phen)32+ doped silica nanoparticle based immunochromatographic strip for rapid quantitative detection of β-agonist residues in swine urine. Talanta, 2013, 114 : 160–166. DOI:10.1016/j.talanta.2013.04.013 |
| [89] | Li X, Li W B, Yang Q H, et al. Rapid and quantitative detection of prostate specific antigen with a quantum dot nanobeads-based immunochromatography test strip. ACS Appl Mater Interfaces, 2014, 6(9) : 64066–64414. |
| [90] | 段宏, 陈雪岚, 江湖, 等. 量子点荧光微球免疫层析试纸条定量检测恶性疟原虫. 分析化学, 2015, 43(3) : 338–343. Duan H, Chen X L, Jiang H, et al. Quantum-dot submicrobead-based immunochromatographic strip for rapid and quantitative detection of Plasmodium falciparum. Chinese J Anal Chem, 2015, 43(3) : 338–343. |
| [91] | 李超辉, 罗薇, 徐波, 等. 胶体金免疫层析试纸条定量检测猪尿中克伦特罗. 食品科学, 2013, 34(12) : 114–118. Li C H, Luo W, Xu B, et al. Development of colloidal-gold immunochromatographic strip for rapid and quantitative detection of clenbuterol in swine urine. Food Sci, 2013, 34(12) : 114–118. |
 2017, Vol. 37
2017, Vol. 37




