文章信息
- 徐振宇, 任红艳, 毕延震, 郑新民, 李莉, 张佳兰.
- XU Zhen-yu, REN Hong-yan, BI Yan-zhen, ZHENG Xin-min, LI Li, ZHANG Jia-lan.
- 单细胞PCR体系的建立及其在CRISPR/Cas9靶点活性检测中的应用
- Establishment of the Single-cell PCR System and Its Application in the Target-activity Detection of CRISPR/Cas9 System
- 中国生物工程杂志, 2017, 37(2): 74-80
- China Biotechnology, 2017, 37(2): 74-80
- http://dx.doi.org/DOI:10.13523/j.cb.20170211
-
文章历史
- 收稿日期: 2016-08-03
- 修回日期: 2016-09-24
2. 湖北省农业科学院畜牧兽医研究所 动物胚胎工程与分子育种湖北省重点实验室 武汉 430064
2. Key Laboratory of Animal Embryo Engineering and Molecular Breeding of Hubei Province, Institute of Animal and Veterinary Sciences, Hubei Academy of Agricultural Sciences, Wuhan 430064, China
自上世纪80年代后期Jeffreys等[1]用PCR技术扩增出单个人类淋巴细胞的小卫星DNA以及Kumar等[2]用PCR技术检测单细胞的癌基因以来,单细胞PCR开始应用于某些特定的医学以及神经生物学研究。近年来,随着单细胞PCR技术的发展以及人们对单细胞水平分析的需求,单细胞PCR开始向更多的生物学领域渗透[3~6]。由于单细胞PCR是以单个细胞所含的DNA或RNA为模板进行扩增,因此其模板的制备是影响整个反应成功与否的关键因素。在单细胞PCR模板制备过程中,选择合适的细胞裂解方法是影响实验成功与否以及效率高低的关键因素。目前常用的细胞裂解方法有冻融变性法、碱裂解法、蛋白酶K裂解法等。大量文献[7-10]报道了各种裂解方法对单细胞PCR扩增效率以及ADO率的影响,但结果都不尽相同,且对于使用何种裂解方法、如何使用等尚未达成共识。
转基因动物是研究基因的发育和疾病等功能的重要工具,通常通过引入突变或基因靶向修饰的方法获得[11-12]。目前,直接将位点特异性核酸酶的DNA或mRNA注射入不同动物的单细胞胚胎中,使DNA在特定位置发生双链断裂的方法已经被开发使用[13-16],使用这类方法可使获得转基因动物的成本与周期大幅缩减。规律成簇的间隔短回文重复序列 (clustered regularly interspaced short palindromic repeats,CRISPR) 结构与一些功能相关的蛋白 (CRISPR-as-sociated,Cas) 合称为CRISPR/Cas9系统[17],是一种广泛存在于细菌和古细菌等原核生物中由RNA介导的可遗传的获得性免疫系统[18-19],现已开发为一种适用范围广泛的基因定向修饰技术。在该系统中,Cas9蛋白在sgRNA的引导下,识别含有PAM序列 (NGG基序) 的基因靶点并进行切割,从而实现靶点DNA双链的断裂。因其具有使用方便、靶向精准、效率高、成本低、周期短等特点,是目前最受欢迎的基因编辑工具。然而如何快速准确筛选出具有高生物学活性的靶点是利用CRISPR/Cas9技术进行高效精准基因编辑的关键。
本研究利用三种不同蛋白酶K细胞裂解液对体外培养成熟的猪卵母细胞进行裂解,并直接作为模板进行PCR扩增,最终筛选出一种高效稳定的细胞裂解体系,并成功建立单细胞双重巢式PCR检测体系。利用该体系对CRISPR/Cas9基因靶点活性进行单细胞胚胎水平检测,结果证明其准确高效可行。
1 材料与方法 1.1 猪卵母细胞本研究使用的猪卵母细胞为体外培养成熟的卵母细胞。在生猪屠宰场采集新鲜卵巢,两小时内运回实验室,抽吸直径3~5mm的卵泡,在电镜下用口吸管捡取胞质均匀致密且包裹2层以上卵丘细胞的卵丘卵母细胞复合体 (COCs),转移至DPBS中洗涤3次,再转入mTCM199中清洗三次,最后转入经过平衡的成熟培养液中 (mTCM199+10IU/ml PMSG+10IU/ml hCG+10% pFF),在39℃、5%CO2、饱和湿度培养箱中培养46~48h。用0.1%透明质酸酶去除颗粒细胞,转入DPBS内洗涤3次后收集作为样品。
1.2 试剂孕马血清促性腺激素 (PMSG) 和人绒毛膜促性腺激素 (hCG) 购于宁波市三生药业有限公司;透明质酸酶购于上海生物制品厂;快速琼脂糖凝胶DNA回收试剂盒购于北京康为世纪生物科技有限公司;本试验中所使用的引物由上海英潍捷基 (Invitrogen) 公司合成;细胞裂解液为自配;100bp DNA Maker、Taq酶、dNTP、Buffer等购自宝生物 (大连) 工程有限公司;SDS、Tween-20、NP-40购自上海生工公司;其他试剂除特殊说明外均购自Sigma公司。
1.3 引物设计与合成参照GenBank收录的猪肌肉生长抑制激素 (Myostatin,MSTN) 基因、小鼠RBM10(RNA binding motif protein 10) 基因相关信息,针对每个基因设计合成多对巢式引物,分别建立PCR方法,优化反应条件,选择特异性较强的引物用于单细胞双重巢式PCR反应,最终确定4对引物 (表 1)。
| 基因 | 引物 | 序列 (5′→3′) | 片段大小 (bp) |
| MSTN | TALEN-F1 | GTCAAATGAATCAGCTCACCC | 788 |
| TALEN-R1 | CTTACGTACAAGCCAACAGC | ||
| Del-F1 | GGCGTTACTCAAAAGCAAAAGTAAAAGG | 187 | |
| Del-R1 | CACAGCCCCTCTTTTTCC | ||
| RBM10 | RBM10-KO-P-PL1 | CCTCCAACCTCTACCTTT | 259+/2332- |
| RBM10-KO-P-PR1 | ACTGTTAGTTCAAATGGGAG | ||
| RBM10-KO-P-PL2 | AGGCACATAAGCCACGAA | 148+/2221- | |
| RBM10-KO-P-PR2 | TCCAAGACTGGGAGCAAA | ||
| 表 1中RBM10基因为基因删除的目的基因,“+”表示为完全删除,“-”表示为野生型 | |||
1.4 细胞裂解液的配制
SDS细胞裂解液:使用灭菌三蒸水配制0.5ng/ml蛋白酶K、0.5% SDS细胞裂解液,-20℃保存备用;
NP-40细胞裂解液:使用灭菌三蒸水配制0.5ng/ml蛋白酶K、0.5% NP-40细胞裂解液,-20℃保存备用;
Tween-20细胞裂解液:用灭菌三蒸水配制0.5ng/ml蛋白酶K、1% Tween-20细胞裂解液,-20℃保存备用;
1.5 电镜下观察三种裂解液裂解过程在平皿内分别滴加三种细胞裂解液200μl,用口吸管捡取去颗粒细胞的成熟卵母细胞,逐个放入三种细胞裂解液液滴中,在电镜下观察其裂解过程。
1.6 样品准备在电镜下,用口吸管将去除颗粒细胞并在DPBS内清洗3次后的卵母细胞收集装入灭菌PCR管内,加入5μl细胞裂解液。吸取5μl最后一次清洗卵母细胞的DPBS装入灭菌PCR管内作为阴性对照组模板。将盛有样品的灭菌PCR管高速瞬时离心后,在PCR仪内55℃孵化1h,95℃灭活10min,吸取上清转移至新的灭菌PCR管内。
1.7 PCR反应在本试验中,卵母细胞组为实验组,最后一次清洗卵母细胞的DPBS组为阴性对照组,提取的猪基因组DNA为阳性对照,水作为空白对照。实验组和阴性对照组:向装有模板的PCR管内加入2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (TALEN-F1、TALEN-R1) 各1μl、灭菌三蒸水补至20μl;阳性对照组:向灭菌PCR管内加入0.5μl野生型猪基因组DNA (100ng/μl)、2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (TALEN-F1、TALEN-R1) 各1μl、灭菌三蒸水补至20μl;空白组:向灭菌PCR管内加入2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (TALEN-F1、TALEN-R1) 各1μl、灭菌三蒸水补至20μl。混匀离心后进行第一轮PCR扩增,扩增条件为:94℃ 5min;94℃ 30s、56℃ 30s、72℃ 30s,35个循环;72℃延伸5min。实验组和阴性对照组取1μl第一轮PCR产物为模板,阳性对照组将第一轮PCR产物稀释100倍后取1μl作为模板,加入2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (Del-F1、Del-R1) 各1μl、灭菌三蒸水补至20μl,混匀离心后进行第二轮PCR扩增,扩增条件为:94℃ 5min;94℃ 30s、55℃ 30s、72℃ 30s,35个循环;72℃延伸5min。完成反应后取8μl产物用2%琼脂糖凝胶进行电泳。
1.8 靶点活性检测将体外转录获得的Cas9 mRNA与sgRNA显微共注射到小鼠受精卵胞质内,注射后的受精卵置于37℃、5% CO2、饱和湿度培养箱中用M16培养液进行套皿法培养,培养46~48h后收集样品,分别装入盛有5μl细胞裂解液的灭菌PCR管内,按照上述裂解程序进行裂解制备PCR模板。实验组:向装有模板的PCR管内加入2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (RBM10-KO-P-PL1、RBM10-KO-P-PR1) 各1μl、灭菌三蒸水补至20μl;阴性对照组:向灭菌PCR管内加入0.5μl提取的野生型小鼠基因组DNA (100ng/μl)、2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (RBM10-KO-P-PL1、RBM10-KO-P-PR1) 各1μl、灭菌三蒸水补至20μl;空白组:向灭菌PCR管内加入2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (RBM10-KO-P-PL1、RBM10-KO-P-PR1) 各1μl、灭菌三蒸水补至20μl。混匀离心后进行第一轮PCR扩增,扩增条件为:94℃ 5min;94℃ 30s、52℃ 30s、72℃ 1min,35个循环;72℃延伸5min。实验组取1μl第一轮PCR产物为模板,阳性对照组将第一轮PCR产物稀释100倍后取1μl作为模板,加入2μl 10×PCR Buffer、1.6μl 2.5mmol/L dNTP、0.2μl Taq酶、上下游引物 (RBM10-KO-P-PL2、RBM10-KO-P-PR2) 各1μl、灭菌三蒸水补至20μl,混匀离心后进行第二轮PCR扩增,扩增条件为:94℃ 5min;94℃ 30s、58℃ 30s、72℃ 30s,35个循环;72℃延伸5min。完成反应后取8μl产物用2%琼脂糖凝胶进行电泳。切胶回收阳性组PCR产物,经T-A克隆后进行测序验证。
2 结果与分析 2.1 电镜下观察结果SDS细胞裂解液的裂解效果最好,在1min内细胞完全裂解,透明带完全消失,胞内物质呈星云状释放出来;其次为NP-40细胞裂解液,1min左右透明带完全消失,再过约30s后细胞开始破裂,胞内物质呈星云状释放;Tween-20细胞裂解液的效果最差,1min左右透明带开始消失,经过3min的消化后透明带有少量残留,细胞膜完整性较好,胞内物质少量释放。(图 1)

|
| 图 1 电镜下细胞裂解结果 Figure 1 Cell lysis results in electron microscope A:Oocytes of porcine before lysis; B1、B2、B3:Cell state in different time treated by SDS cell lysate buffer; C1、C2、C3:Cell state in different time treated by NP-40 cell lysate buffer; D1、D2、D3:Cell state in different time treated by Tween-20 cell lysate buffer |
使用三种不同细胞裂解液裂解猪体外成熟的卵母细胞,进行单细胞PCR的模板制备。每种细胞裂解液分别裂解20枚卵母细胞,裂解后的细胞进行双重巢式PCR反应,2%琼脂糖凝胶电泳检测结果见图 2。图 2A为SDS细胞裂解液组电泳结果,其结果表明20组样品均未出现阳性条带。图 2B为NP-40细胞裂解液组电泳结果,在20组样品中,19组呈明显阳性,其阳性率高达95%。图 2C为Tween-20细胞裂解液组电泳结果,在20组样品中,13组呈现明显阳性,其阳性率为65%,显著低于NP-40细胞裂解液组 (P < 0.05)。该结果与在电镜下观察到的结果不一致,推测可能与SDS、NP-40、Tween-20的蛋白变性能力有关。

|
| 图 2 单细胞双重巢式PCR扩增结果 Figure 2 Results of the single cell double-nested PCR A:The electrophoresis of the single cell PCR, using the template prepared by SDS lysis buffer; B:The electrophoresis of the single cell PCR, using the template prepared by NP-40 lysis buffer; C:The electrophoresis of the single cell PCR, using the template prepared by Tween-20 lysis buffer; D:The schematic diagram of 100bp DNA Marker; M:100bp DNA Marker; 1~20:Experimental group; -:Negative control group; +:Positive control group; K:Blank control group |
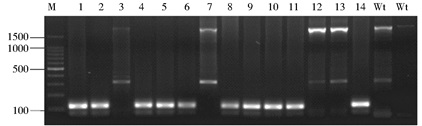
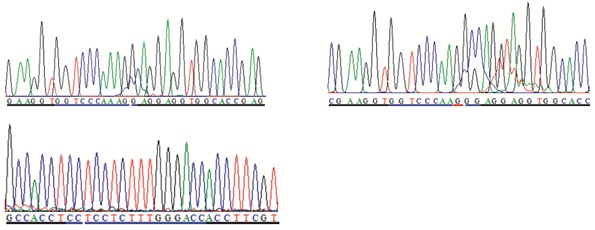
在胞质显微注射的小鼠受精卵内随机挑选45枚,使用NP-40细胞裂解液进行裂解,在裂解过程中,由于高温,有3个装有受精卵的灭菌PCR管出现破裂损失,剩余的受精卵进行单细胞双重巢式PCR检测,其结果见图 3。剩余的受精卵均扩增良好,其中36枚 (1、2、4~6、8~11、14~24、26~29、31~42) 呈现阳性,另外6枚 (3、7、12、13、25、30) 与野生型对照组结果一致。在本试验中,Wt组条带较弱,且呈现差异,可能与模板 (第一次反应产物) 稀释过量有关。实验组中条带亮度呈现差异可能与模板制备的质量相关。将阳性组PCR产物进行测序,测序结果 (图 4) 表明目的基因在靶点发生大片段删除,进一步证明本次单细胞双重巢式PCR检测结果的真实性、准确性。
|
| 图 3 靶点活性单细胞PCR检测结果 Figure 3 Results of the target-activity assay using single cell PCR M:100bp DNA Marker; 1~14:Amplicons of single cell double-nested PCR using the mice zygote, which has been co-injected the Cas9 mRNA and sgRNA, as the template; WT:Amplicons of double-nested PCR using the mice genomic DNA as the template |
|
| 图 4 靶点活性检测单细胞PCR阳性结果测序 Figure 4 The sequencing figure for the positive results of the single cell PCR The black underline represent sequence of two ends of the target; The blue underline represent sequence of the target after the knockout; The red underline represent the randomly inserted sequence after the knockout |
随着单细胞PCR技术的发展以及人们对单细胞水平分析的需求,单细胞PCR在临床PGD、基因表达、DNA测序等领域的运用愈加广泛。细胞裂解后得到的模板质量高低是影响单细胞PCR扩增效率至关重要的因素。目前常用细胞裂解的方法有冻融变性法、碱裂解法、蛋白酶K裂解法等。Sermon等[20]和Gitlin等[21]比较了KOH/DTT、液氮和纯水三种不同的裂解方法对PCR扩增率的影响,发现碱裂解液扩增率高,并且在扩增杂合子细胞时ADO率更低。1999年Dietmair等[22]将活检的单个细胞置于10μl 1×PCR缓冲液中,其中包含0.5% Tween-20和4mg/ml蛋白酶K,加上石蜡油,在PCR仪中48℃温浴14h,然后在94℃下蛋白酶变性10min,他们发现使用此方法裂解的细胞均能成功地扩增β珠蛋白片段。易萍等[23]比较了冻融变性法、碱裂解法、蛋白酶K裂解法对单细胞PCR结果的影响,其结果表明蛋白酶K裂解液效果明显优于其他方法。在本研究中,对蛋白酶K裂解液进行改进,并进行对比试验,实验结果中Tween-20裂解液组虽成功扩增出目的条带,但与Dietmair等[22]的结果并不完全一致,这可能与操作规范、试验环境等因素有关。
SDS、NP-40和Tween-20在工业中均作为去垢剂使用,其中SDS是一种阴离子表面活性剂,具有较强的蛋白变性能力,常用于核酸抽提操作中破坏细胞壁及裂解核酸。NP-40和Tween-20都属于非离子型去垢剂,与SDS相比较为温和,具有较强的蛋白结合能力,常用作蛋白提取操作中的细胞裂解。本研究对蛋白酶K裂解法进行改进,将Tween-20更换为活性更强的NP-40和SDS,分别对体外成熟的猪卵母细胞进行裂解,在电镜下观察其裂解过程,结果表明,SDS裂解液对细胞的裂解效果最好,但其PCR结果中却未见明显条带,导致该结果的原因可能为是SDS将PCR反应体系中的Taq酶失活,进而抑制了PCR反应。Tween-20与NP-40裂解产物PCR结果均出现阳性目的条带,这可能与这两种去污剂在乳化蛋白时,并不破坏蛋白的结构相关,这样降低了对PCR反应体系中Taq酶的抑制作用。结合电镜下观察的裂解效果来看,NP-40裂解液与另外两种裂解液相比,裂解效果稳定,对PCR反应体系的影响小,因此更适用于单细胞PCR反应模板的制备。
目前sgRNA靶点活性检测主要采取的方法有限制性内切酶法、非配对内切酶法、SSA活性检测法[24]。本研究室李晓敏等[25]通过SSA活性检测法对猪SST基因靶点进行检测,检测结果与后续细胞实验结果差异显著。由此可见,以上体外检测结果并不能完全真实表示其在细胞内或者胚胎内的活性。本研究结合显微注射技术与单细胞PCR技术,成功建立了一种将CRISPR/Cas9 mRNA与靶点sgRNA胞质显微共注射入体外培养的受精卵内,并将培养48h后的单个卵裂球收集,进行单细胞双重巢式PCR检测靶点活性的方法。经该方法检测出的活性为受精卵内靶点的真实活性,在后续试验中可真实重复。
| [1] | Jeffreys A J, Wilson V, Neumann R, et al. Amplification of human minisatellites by the polymerase chain reaction:towards DNA fingerprinting of single cells. Nucleic Acids Research, 1988, 16(23) : 10953–10971. DOI:10.1093/nar/16.23.10953 |
| [2] | Kumar R, Barbacid M. Oncogene detection at the single cell level. Oncogene, 1988, 3(3) : 647–651. |
| [3] | 刘建强, 吴大洲, 张印则, 等. 单细胞巢式PCR检测RHD的初步研究. 中国输血杂志, 2015, 28(7) : 760–762. Liu J Q, Wu D Z, Zhang Y Z, et al. Primary study on single-cell nested PCR for detection of RHD. Chinese Journal of Blood Transfusion, 2015, 28(7) : 760–762. |
| [4] | 钟昌高, 李麓芸, 陆长富, 等. 单细胞单轮二重PCR诊断X-连锁鱼鳞病. 生命科学研究, 2009, 13(4) : 332–336. Zhong C G, Li L Y, Lu C F, et al. Diagnosing X-linked ichthyosis by monoplast single-round duplex PCR. Life Science Research, 2009, 13(4) : 332–336. |
| [5] | Chrenek P, Boulanger L, Heyman Y, et al. Sexing and multiple genotype analysis from a single cell of bovine embryo. Theriogenology, 2001, 55(5) : 1071–1081. DOI:10.1016/S0093-691X(01)00467-8 |
| [6] | 陈从英, 黄路生, 陈静波, 等. 牛早期胚胎性别鉴定PCR反应体系的优化研究. 畜牧兽医学报, 2003, 34(3) : 209–212. Chen C Y, Huang L S, Chen J B, et al. The study on optimizing the system of PCR for sex determination of bovine preimplantation embryos. Acta Veterinaria et Zootechnica Sinica, 2003, 34(3) : 209–212. |
| [7] | Piyamongkol W, Harper J C, Sherlock J K, et al. A successful strategy for preimplantation genetic diagnosis of myotonic dystrophy using multiplex fluorescent PCR. Prenat Diagn, 2001, 21 : 223–232. DOI:10.1002/(ISSN)1097-0223 |
| [8] | Abou-Sleiman P M, Apessos A, Harper J C, et al. First application of preimplantation genetic diagnosis to neurofibromatosis type 2 (NF2). Prenat Diagn, 2002, 22 : 519–524. DOI:10.1002/(ISSN)1097-0223 |
| [9] | Sandalinas M, Sadowy S, Alikani M, et al. Developmental ability of chromosomally abnormal human embryos to develop to the blastocyst stage. Human Reprod, 2001, 16 : 1954–1958. DOI:10.1093/humrep/16.9.1954 |
| [10] | Bahçe M, Escudero T, Sandalinas M, et al. Improvements of preimplantation diagnosis of aneuploidy by using microwave-hybridization, cell recycling and monocolor labeling of probes. Molec Human Reprod, 2000, 9 : 849–854. |
| [11] | Copeland N G, Jenkins N A. Harnessing transposons for cancer gene discovery. Nature Reviews Cancer, 2010, 10 : 696–706. DOI:10.1038/nrc2916 |
| [12] | Kool J, Berns A. High-throughput insertional mutagenesis screens in mice to identify oncogenic networks. Nature Reviews Cancer, 2009, 1038(10) : 389–399. |
| [13] | Wang H Y, Yang H, Shivalila C, et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-Mediated genome engineering. Cell, 2013, 153(4) : 910–918. DOI:10.1016/j.cell.2013.04.025 |
| [14] | Bogdanove A J, Voytas D F. TAL effectors:customizable proteins for DNA targeting. Science, 2011, 333(6051) : 1843–1846. DOI:10.1126/science.1204094 |
| [15] | Carroll D, Beumer K J, Morton J J, et al. Gene targeting in Drosophila and Caenorhabditis elegans with zinc-finger nucleases. Humana Press, 2008, 435 : 63–77. |
| [16] | Urnov F D, Rebar E J, Holmes M C, et al. Genome editing with engineered zinc finger nucleases. Nature Reviews Genet, 2010, 11(9) : 636–646. DOI:10.1038/nrg2842 |
| [17] | Sorek R, Kunin V, Hugenholtz P. CRISPR-A widespread system that provides acquired resistance against phages in bacteria and archaea. Nature Reviews Microbiology, 2008, 6(3) : 181–186. DOI:10.1038/nrmicro1793 |
| [18] | Wiedenheft B, Stenberg S H, Doudna J A. RNA-guided genetic silencing systems in bacteria and archaea. Nature, 2012, 482(7385) : 331–338. DOI:10.1038/nature10886 |
| [19] | 左其生, 李东, 张亚妮, 等. CRISPR-CAS介导的基因编辑工具. 生物技术通报, 2014, 7 : 37–43. Zuo Q S, Li D, Zhang Y N, et al. Gene editing tools mediated by CRISPR-Cas. Biotechnology Bulletin, 2014, 7 : 37–43. |
| [20] | Sermon K, Lissens W, Nagy ZP, et al. Simultaneous amplification of the two most frequent mutations of infantile Tay-Sachs disease in single blastomeres. Human Reproduction, 1995, 10(8) : 2214–2217. DOI:10.1093/oxfordjournals.humrep.a136270 |
| [21] | Gitlin SA, Lanzendorf SE, Gibbons WE. Polymerase chain reaction amplification specificity:incidence of allele dropout using different DNA preparation methods for heterozygous single cells. Assist Reprod Genet, 1996, 13(2) : 107–111. DOI:10.1007/BF02072530 |
| [22] | Dietmair W, Hartmann A, Wallinger S, et al. Mutliple mutation anlyses in single tumor cells with improved whole genome amplification. American Journal of Pathology, 1999, 154(1) : 83–95. DOI:10.1016/S0002-9440(10)65254-6 |
| [23] | 易萍, 李力, 王华, 等. 细胞裂解法对单细胞PCR扩增效率的影响. 中国优生与遗传杂志, 2005, 13(2) : 27–32. Yi P, Li L, Wang H, et al. The assessment of the amplified efficacy of single cell PCR by different lysis buffers. Chinese Journal of Birth Health & Heredity, 2005, 13(2) : 27–32. |
| [24] | Sorek R, Kunin V, Hugenholtz P. CRISPR-A widespread system that provides acquired resistance against phages in bacteria and archaea. Microbiology, 2008, 3(6) : 181–186. |
| [25] | 李晓敏, 任红艳, 毕延震, 等. CRISPR/Cas9体外酶切检测猪生长抑素基因定点修饰靶点活性的研究. 中国畜牧兽医, 2016, 43(1) : 31–38. Li X M, Ren H Y, Bi Y Z, et al. Study on detection of pig SST gene site-directed modification activity by CRISPR/Cas9 system in vitro. China Animal Husbandry and Veterinary Medicine, 2016, 43(1) : 31–38. |
 2017, Vol. 37
2017, Vol. 37




