文章信息
- 韦璇, 郝雅荞, SusannaLeongSuJan, 吴言, 柳叶飞, 赵洪新.
- WEI Xuan, HAO Ya-qiao, Susanna Leong Su Jan, WU Yan, LIU Ye-fei, ZHAO Hong-xin.
- Saccharomyces cerevisiae和Yarrowia lipolytica对自由饱和脂肪酸的选择性吸收及胞内积累特性研究
- Selective Uptake and Increased Accumulation of Free Saturated Fatty Acids by the Yeast Saccharomyces cerevisiae and Yarrowia lipolytica
- 中国生物工程杂志, 2017, 37(2): 63-73
- China Biotechnology, 2017, 37(2): 63-73
- http://dx.doi.org/DOI:10.13523/j.cb.20170210
-
文章历史
- 收稿日期: 2016-07-21
- 修回日期: 2016-09-06
2. 浙江理工大学 生命科学学院 浙江省植物与次生代谢重点实验室 杭州 310018;
3. School of Chemical and Biomedical Engineering, Nanyang Technological University, Singapore 637459, Singapore
2. Zhejiang Province Key Laboratory of Plant Secondary Metabolism and Regulation, College of Life Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, China;
3. School of Chemical and Biomedical Engineering, Nanyang Technological University 369798, Singapore
微生物油脂 (microbial oils, MOs) 又称单细胞油脂 (single cell oils, SCOs), 是由酵母、霉菌、细菌和藻类等微生物,在一定条件下,利用碳水化合物、碳氢化合物和普通油脂为碳源、氮源,辅以无机盐产生并储存于细胞内的油脂或脂质[1]。利用微生物油脂 (MOs) 可以转化生产生物柴油-脂肪酸甲酯 (Biodiesel)[2-4],也可开发高营养油脂,特别是某些特定脂肪酸组成的油脂, 如EPA、DHA、类可可脂等,因此,产油微生物 (oleaginous microorganisms, OMs) 是一类极具应用开发价值的资源微生物[5-8]。由于受遗传因素和脂肪酸理化性质的影响,菌株对脂肪酸的吸收利用,有一定的选择性,而且胞内积累油脂的组成成分,与底物组成具有相关性[9-10]。研究者[8-12]利用动物脂肪和蔬菜油为底物,研究了C. lipolytica对两类油脂的吸收利用及积累情况进行了测定,结果表明C. lipolytica对不同链长的饱和、不饱和脂肪酸的吸收利用存在差异,不饱和脂肪酸的吸收速度明显快于饱和脂肪酸,而且不同来源油脂的组成成分,也影响细胞内甘油三酯 (triglycerides, TGAs) 和甾醇酯 (steryl esters, SE) 的积累和成分组成。另一方面,微生物吸收的脂肪酸,部分经β-氧化途径 (β-oxidation pathway) 降解,部分形成TGAs、SE或参与细胞膜系统的组成[13-14]。Janice等[15]敲除了Ralstonia eutropha H16催化β-氧化途径的第一个酶基因fadD3,提高了细胞脂肪酸的积累,达到62 mg/L;Weerawat等[16]在Saccharomyces cerevisiae中表达脂肪酸合成酶FAS1、FAS2和ACC2,胞内的脂肪酸积累量提高了4倍。这些研究成果提示,通过调整底物的组成成分,或基因工程调控胞内脂肪酸的合成代谢或分解代谢,可以提高脂肪酸或某些特定油脂在细胞中的积累量。
酵母 (Yeast) 的部分种属是极具应用前景的单细胞产油微生物[1]。尽管酿酒酵母S. cerevisiae不是典型的产油微生物,但作为单细胞真核微生物的典型代表,有三个关键酶POX1, POX2和POX3参与脂肪酸的β氧化过程[14],所以敲除S. cerevisiae的pox1, pox2或pox3,可为进一步探究产油微生物 (OMs) 对底物选择性的利用,特别是对单一自由饱和脂肪酸的选择性利用、胞内积累及对细胞生长影响,开发特色高附加值的油脂,具有重要的指导意义。
本研究以不产油脂的酿酒酵母 (Saccharomyces cerevisiae) 和可以产油的解脂耶罗维亚酵母 (Yarrowia lipolytica) 为出发菌株,以短链和中链 (C5~C18) 不同碳链长度的自由饱和脂肪酸为唯一碳源,研究了供试菌对脂肪酸的吸收利用情况,分析了脂肪酸在胞内的积累特征,为扩大底物选择利用范围,生产油脂或开发特定高附加值的油脂,提供参考。
1 材料与方法 1.1 出发菌株本研究用到的菌株及表型特征如表 1所示。
| Strains’ name | Genetic characteristics | Biological characteristics | Source |
| Y. lipolytica CLIB122 | 野生型 | 积累油脂 | EUROSCAF1) |
| Y. lipolytica po1d | MatA, leu2-270, ura3-302, xpr2-322 Leu-, Ura-, DAEP, Suc+ | 积累油脂 | EUROSCAF |
| Y. lipolytica po1e | MatA, leu2-270, ura3-302, xpr2-322 Leu-, Ura-, DAEP, Suc+ | 积累油脂 | EUROSCAF |
| Y. lipolytica po1f | MatA, leu2-270, ura3-302, xpr2-322 Leu-, Ura-, DAEP, Suc+ | 积累油脂 | EUROSCAF |
| S. cerevisiae S288C | 野生型 | 不积累油脂 | EUROSCAF |
| S. cerevisiae S228C BY4741 | Mat A, his3-, leu2-, met15-, ura3-, Wild-type lab strain | 不积累油脂 | EUROSCAF |
| S. cerevisiae S228C BY4741-pox 1 | Mat A, his3-, leu2-, met15-, ura3-, YGL205w∷kan MX4, ΔPOX 1 | 不积累油脂 | EUROSCAF |
| S. cerevisiae S228C BY4741-pox 1, 3 | Mat A, his3-, leu2-, met15-, ura3-, YGL205w∷kan MX4, ΔPOX 1 ΔPOX 2 | 不积累油脂 | 本研究 |
| 1)EUROSCAF网址:http://web.uni-frankfurt.de/fb15/mikro/euroscarf/ | |||
1.2 培养基与菌体培养 1.2.1 培养基
YPD:10g/L酵母提取物、20g/L胰蛋白胨、20g/L葡萄糖、固体加15g/L琼脂粉。
YNB:6.7g/L酵母基本氮源、营养缺陷型菌株添加相应的营养物质如URA/HIS/LEU等、固体培养基添加30g/L琼脂,pH自然。
YNBD:YNB、20g/L葡萄糖,pH自然。或:葡萄糖10g/L、(NH4)2SO4 1g/L、K2HPO4 0.125g/L、KHPO4 0.875g/L、KI 0.0001g/L、MgSO4· 7H2O 0.5g/L、CaCl2·2H2O 0.lg/L、NaCl 0.1g/L、营养缺陷型菌株添加相应的营养物质如URA/HIS/LEU等、微量元素母液l ml和维生素母液l ml (两种母液均按常规配制,pH5.8~6.0),pH自然。
YNBF0.1:YNB培养基,添加1g/L的单一自由饱和脂肪酸,pH自然。
1.2.2 菌体培养按V:V=100:1(培养基:种子液) 的接种比例,将过夜培养活化的种子液,转接到250ml盛有150ml培养基的三角瓶中,30℃,180r/min条件下摇床培养。
1.3 仪器与试剂主要大型仪器:气相色谱-质谱联机 (Gas Chromatography -Mass Spectrometer,GC/Mass)(Agilent Technologies Inc. USA);超微量分光光度计Nanodrop 2000(Thermo Fisher Scientific Inc. USA);FastPrep-24(MP Biomedicals Inc. USA);低温摇床 (Thermo Fisher Scientific Inc. USA);奥林巴斯荧光显微镜 (Olympus BX 51 Fluorescence Microscope, Japan);离心机 (Thermo Fisher Scientific Inc. USA);伯乐电击转化仪 (Bio-Rad Laboratories Inc. USA) 等。
化学试剂:C5戊酸 (pentanoic acid)、C6己酸 (hexanoic acid)、C7庚酸 (heptanoic acid)、C8辛酸 (octanoic acid)、C9壬酸 (nonanoic acid)、C10癸酸 (decanoic acid)、C11十一烷酸 (undecanoic acid)、C12十二烷酸 (lauric acid)、C13十三烷酸 (tridecanoic acid)、十八烷酸 (octadecanoic acid) 和油酸 (oleic acid),酸洗玻璃珠 (Glass beads, acid-washed)、尼罗红 (Nile red) 等药品,以上试剂均购於Sigma试剂公司 (Sigma-aldrich.USA);基因组DNA提取试剂盒、质粒提取试剂盒、凝胶回收试剂盒及分子操作所需试剂主要购於Promega公司。
1.4 S. cerevisiae S228C BY4741-pox1, 3工程菌的构建基因克隆、载体构建与检测等常规分子生物学操作方法,依据参考文献[17-19]。
根据NCBI数据库中的pox3基因序列,设计带有同源臂的敲除引物Sc-kout pox3-F/R和筛选检测引物Pox3 checking-F/R (表 2)。以pUG72质粒DNA为模板,用Sc-kout pox3-F/R为引物,PCR扩增marker基因ura。PCR扩增条件:95℃预变性5min;94℃ 30s,56℃ 30s,72℃ 1.2 min,35个循环;72℃ 10 min;PCR产物4℃保存备用。用Promega Wizard SV Gel and PCR Clean-up System凝胶回收试剂盒,回收PCR产物;将回收的PCR产物电转化到S. cerevisiae S228C BY4741-pox1的感受态细胞中,将菌液涂布到不含有尿嘧啶 (URA) 的YNBD平板上,30℃培养,直到有菌落出现[19];挑取单菌落,用Pox3 checking-F/R引物进行菌落PCR筛选;提取含有阳性信号菌落的基因组DNA,用Pox3 checking-F/R引物重新进行PCR验证,回收PCR产物,送生物公司测序,进一步验证;制备S. cerevisiae S228C BY4741-pox1, 3突变株的感受态细胞,将质粒pSH62转化到双敲除突变株中,在不含有组氨酸 (HIS) 的YNBD平板上筛选,获得含有pSH62质粒的菌株。将含有pSH62质粒的菌株进行诱导重组酶表达后,菌液涂布到YPD固体平板上,直至菌落出现。挑取单菌落,转接到YNBD不加有尿嘧啶 (URA) 的平板上检测去除marker URA,菌株不生长说明URA marker去除;将成功去除URA marker的S. cerevisiae S228C BY4741-pox1, 3菌株,在含有5-FOA (5-fluoro orotic acid) 的液体PDA培养基培养,然后挑选在不含有组氨酸 (HIS) 的YNBD平板培养基不能生长,而在PDA平板上可以生长的菌落[19-20],得到不含有URA marker、pSH62质粒的S. cerevisiae S228C BY4741-pox1, 3双突变株,供后续实验。
| Primer | 序列 (5′-3′) Sequence (5′-3′) | Source |
| Sc-kout pox3-F1) | GTGGCTCTGAGTACAGAGTGAATATAACACTACATAAAAGCAATGCAGCTGAAGCTTCGTACGC | 本研究 |
| Sc-kout pox3-R2) | ATAATAAAAAGGGAGAATATTAACTATTATCAAGTATTAAAACTA GCATAGGCCACTAGTGGATCTG | 本研究 |
| Pox3 checking-F | CGCTATCAAAGGGAAACGGG | 本研究 |
| Pox3 checking-R | CAGAAATGCTGGATGGGAAGC | 本研究 |
| Plasmid | 筛选标记Marker | Reference |
| pUG72 | URA3(含有loxP-ura3+-loxP) | [15] |
| pSH62 | HIS3 | [15] |
| 1),2)引物Sc-kout pox3-F/R中下划线部分为敲除pox3设计同源臂 | ||
1.5 测定方法
菌株生长曲线和以单一自由饱和脂肪酸为唯一碳源的利用能力测定:将超低温冰箱保藏的Y. lipolytica和S. cerevisiae系列菌株,在YPD固体平板上划线,30℃活化培养,挑取单菌落,转接到YPD液体培养基中,30℃、180r/min条件下过夜培养,作为种子液。按1/100接种量,接种到250ml盛有150ml YPD液体培养基的三角瓶中 (设三个生物学重复),调试初始OD600为≤0.003±1,每隔2h取200μl样品,用Nanodrop 2000测定OD600,以OD值为纵坐标,培养时间为横坐标,绘制生长曲线;以YNBF0.1作为培养基,相同方法进行接种、培养及测定OD600,绘制生长曲线,根据曲线状态推定不同菌株是否能利用单一自由饱和脂肪酸作为唯一碳源生长。
CFU (活菌数/L) 的测定:将样品按10-2、10-3、10-4……稀释后,在YPD琼脂平板上点样,培养18h,数菌落数量,设3个生物学重复,取平均值,进行CFU活菌数/L计算,推测菌体在单一自由饱和脂肪酸作为唯一碳源培养基里的生长状态。
1.6 细胞破碎和胞内脂肪酸的提取收集细胞加入适量细胞裂解液和酸洗玻璃珠 (Glass beads, acid-washed),利用FastPrep-24破碎细胞[20];脂肪酸提取方法见参考文献[21-22]。
1.7 取样点和胞内脂类测定计算选择对数期和稳定期两个取样时间点,进行脂肪酸积累情况测定。离心收集10ml的培养物,将菌体分成等重量的二份小样,其中一份小样提取脂类[20-22],另一份无菌水洗涤3次后,12 000转离心10min,去上清,沉淀在60℃烘箱中,恒重24h。
脂类所占细胞的重量计算方法如下 (设三个生物学重复):脂类Fat (weight)=Ft-F0/CDW (Ft:为提取的脂类和容器总重量;F0:容器的重量;CDW为细胞干重。
1.8 脂肪酸的积累特征比较尼罗红 (Nile red) 全细胞脂类染色,荧光显微镜 (Olympus BX 51 Fluorescence Microscope 100×) 观察细胞中脂类存在位置和状态[23]。
1.9 GC/Mass测定胞内脂肪酸组成提取酵母细胞中总的脂类,进行酯化,制备GC/Mass分析样品[21-22],GC/Mass分析脂类的组成[22-24]。
2 结果与分析 2.1 S.cerevisiae S228C BY4741-pox1, 3工程菌获得以pUG72质粒DNA为模板,用引物Sc-kout pox3-F/R进行PCR扩增,结果如图 1a所示,获得带有同源臂的URA线性载体;回收PCR产物,电转化S. cerevisiae S228C BY4741-pox1感受态细胞,在不含有尿嘧啶 (URA) 的YNBD抗性平板培养,结果获得疑是突变株单菌落200多个;随机挑取20个单菌落,用Pox3 checking-F/R引物进行菌落PCR筛选,结果如图 1b所示,在20个菌落中获得1个有阳性信号的菌落;提取菌落PCR阳性信号菌株的基因组DNA,用Pox3 checking-F/R引物进一步做PCR验证,结果如图 1c所示;回收图 1c中PCR条带,送到生物公司测序,测序结果NCBI网上比对表明,得到的克隆为S. cerevisiae S228C BY4741-pox1, 3双敲出突变菌株。根据1.4方法中的步骤,去除URA Marker、pSH62质粒,得到不含有URA Marker、pSH62质粒的S. cerevisiae S228C BY4741-pox1, 3双突变株,作为进一步深入探究自由脂肪酸吸收和积累的供试菌株。

|
| 图 1 loxP-URA3-loxP线性DNA和S. cerevisiae S228C BY4741-pox1, 3构建及突变株凝胶检测电泳 Figure 1 Gel images of PCR fragment of loxP-URA3-loxP linear DNA and checking S. cerevisiae S228C BY4741-pox1, 3 (a) PCR loxP-URA3-loxP线性DNA (b) 菌落PCR结果 (c) 提取DNA检测和阴性对照Marker:FastRun50-15kTM 1kp ladder DNA; 箭头所示为目标带 |
Y. lipolytica 4株菌和S. cerevisiae S228C 3株菌的生长曲线测定结果表明:7株供试菌株的生长曲线,是标准的S型生长曲线。而且培养48h时,Y. lipolytica po1e终OD值相对较大,细胞密度较高,所以选Y. lipolytica po1e作为进一步实验出发菌株;菌株S. cerevisiae S228C BY4741 -pox1和S. cerevisiae S228C BY4741-pox1, 3,是在S. cerevisiae S228C BY4741的基础上,单敲除了pox1或双敲除pox1和pox3[18],将对脂肪代谢产生影响。因此,后续实验选择S. cerevisiae S228C BY4741-pox1、S. cerevisiae S228C BY 4741-pox1, 3和S. cerevisiae S228C BY4741(对照) 进行单一自由饱和脂肪酸选择性吸收的相关测定。
将供试酵母在单一自由饱和脂肪酸为唯一碳源的YNBF0.1培养基中培养,6h作为一个取样点进行菌体生物量 (OD600) 测定,结果表明 (图 2、图 3):对Y. lipolytica po1e菌株,当碳链C链长≤10时,测定的OD600值没有变化,表明菌体细胞没有繁殖。CFU测定时,经过72h培养也没有菌落出现 (图 2a),说明当碳链C≤10的单一自由饱和脂肪酸,对Y. lipolytica po1e的生长有较强抑制作用,甚至杀死细胞;同样方法测定S. cerevisiae S228C系列菌株生物量 (OD600) 时,也有相似的结果。
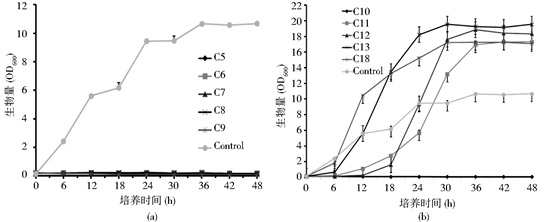
|
| 图 2 Y. lipolytica po1e对饱和脂肪酸的利用动力学曲线 Figure 2 The growth dynamic curve of Y. lipolytica po1e under different carbon chain saturated fatty acids media (a) Carbon chain from 5 to 9 (b) Carbon chain from 10 to 18 |
|
| 图 3 S. cerevisiae S228C BY4741 (a) 和S. cerevisiae S228C BY4741-pox1(b) 饱和脂肪酸的利用动力学曲线 Figure 3 The growth dynamic curve of S. cerevisiae S228C BY4741 (a) and S. cerevisiae S228C BY4741-pox1 (b) under different carbon chain saturated fatty acids media Carbon chain from 10 to 18 |
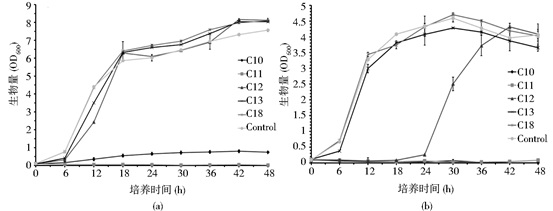
因此,在测定S. cerevisiae系列菌株的脂肪酸利用动力学情况时,仅选择碳链C≥10单一自由饱和脂肪酸为唯一碳源的培养基,进行测定,结果如图 3所示。但当碳链长C=11时Y. lipolytica po1e和S. cerevisiae S228C系列菌株的细胞生长情况有明显差异,Y. lipolytica po1e可以利用碳链C=11的单一自由饱和脂肪酸,但细胞培养18h之前生长速度较慢,OD600仅达到2左右,24h时开始加速生长,培养48h的OD600与其他单一自由饱和脂肪酸培养基的生物量水平一致。
而S. cerevisiae三株菌,用含有C=11的单一自由饱和脂肪酸培养基,培养48h的OD600值没有变化,表明细胞没有繁殖,CFU检测72h的结果,没有菌落出现,说明C=11自由饱和脂肪酸,对两类酵母的作用不同。S. cerevisiae S228C BY4741对C12自由饱和脂肪酸利用十分缓慢,细胞的生物量48h在1左右。而S. cerevisiae S228C BY4741-pox1和S. cerevisiae S228C BY4741-pox1, 3对C12自由饱和脂肪酸利用结果一致,也表现出明显的生长延迟,菌体24h之后开始快速生长,说明在菌体生长初期C12对其有一定抑制作用,而敲除pox基因时,使S. cerevisiae S228C BY4741利用C12单一自由饱和脂肪酸的能力增强 (S. cerevisiae S228C BY 4741-pox1, 3的数据没有列出)(图 3a, b)。
2.3 脂肪酸的积累Y. lipolytica和S. cerevisiae S228C培养24h,菌体处于对数期,48h进入稳定期,因此,选择对数期 (24h) 和稳定期 (48h) 两个取样时间点,进行脂肪酸积累情况测定。样品收集和处理方法如1.7操作步骤。根据1.7公式计算出脂类所占细胞的重量,结果见表 3。
| Strains and media | C11 | C12 | C13 | C18 | Control | |||||||||
| 24h | 48h | 24h | 48h | 24h | 48h | 24h | 48h | 24h | 48h | |||||
| Y. lipolytica po1e | ||||||||||||||
| YNBF0.1 | 10 | 20 | 13.46 | 36.75 | 20.71 | 41.42 | 46.8 | 57.65 | 17.3 | 30.02 | ||||
| S. cerevisiae S228C BY4741 | ||||||||||||||
| YNBF0.1 | 0 | 0 | 2.31 | 3.04 | 5.5 | 5.14 | 6.98 | 6.4 | 2.0 | 2.02 | ||||
| S. cerevisiae S228C BY4741-pox1 | ||||||||||||||
| YNBF0.1 | 0 | 6.36 | 2.08 | 4.14 | 7.5 | 8.18 | 7.98 | 7.40 | 2.0 | 1.6 | ||||
| S. cerevisiae S228C BY4741-pox1, 3 | ||||||||||||||
| YNBF0.1 | 0 | 7.46 | 2.38 | 4.44 | 7.58 | 8.42 | 7.77 | 7.69 | 2.21 | 1.69 | ||||
从表 3数据可以看出Y. lipolytica po1e 24h的脂类积累小于48h的积累量,而且C=18脂肪酸培养基的脂类积累量,达到其他脂肪酸培养基,细胞积累脂肪酸的2倍多 (表 3)。而且Y. lipolytica po1e的脂类积累随着培养时间增加到48h,脂类的积累也有所增加,特别是当C=12,和C=18时脂类的积累略高于其他脂肪酸为底物时的积累量,说明偶数碳的脂肪酸被吸收的速度快于奇数碳链的脂肪酸 (图 4a);
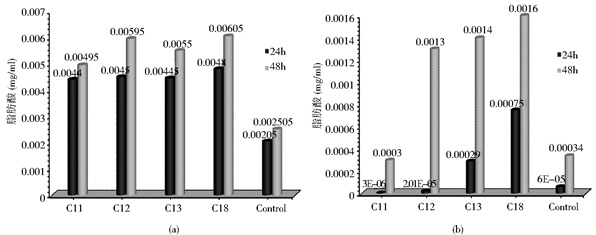
|
| 图 4 饱和脂肪酸在Y. lipolytica po1e (a) 和S. cerevisiae S228C BY4741-pox1细胞中的积累 (b) Figure 4 Accumulation of saturated fatty acids in Y. lipolytica po1e (a) and S. cerevisiae S228C BY4741-pox1 (b) (Carbon chain from 11 to 18; n=3) |
而S. cerevisiae S228C三株菌的脂类积累很少,S. cerevisiae S228C BY4741-pox1和S. cerevisiae S228C BY4741-pox1, 3的脂类积累量,约为S. cerevisiae S228C BY4741的1.0~1.7倍 (表 3)。S. cerevisiae S228C BY4741-pox1 24h的脂类积累较少,只有当以C13和C18为底物时,有脂类的积累,而培养48h时,酵母积累脂类有所增加,而对照相几乎没有脂类积累 (图 4b)。
2.4 Y.lipolytica和S.cerevisiae脂肪酸的积累特征比较尼罗红 (Nile red) 是一种亲脂性的恶嗪类荧光染料,与脂类物质如腊酯、三酰甘油及各种脂肪酸结合后,在紫外光下显示红色,可用来检测细胞中脂类的位置和状态[23]。
培养基中没有添加自由饱和脂肪酸时,S. cerevisiae S228C BY4741-pox1和S. cerevisiae S228C BY4741-pox1, 3细胞中脂肪主要在细胞膜上,颗粒状脂肪粒在细胞质中没有或者很少 (图 5 A),但在添加自由饱和脂肪酸为唯一碳源的培养基YNBF0.1培养后,除了酵母细胞膜上,细胞质中也有颗粒状脂肪粒 (图 5 B)。S. cerevisiaeS228C BY4741-pox1, 3双敲除菌株有类似的结果 (图 6中未列出);而Y. lipolytica po1e在YNBD培养基中,细胞的脂肪主要以脂质体 (lipid body, LB) 颗粒状存在细胞中,但颗粒的数量明显少且小,大约在1~3粒 (图 5 C),培养基添加自由饱和脂肪酸为唯一碳源时,胞内脂肪粒明显增加,并且颗粒较大,说明在含有脂肪酸的培养基中,外源脂肪被吸收和利用,并储存到细胞膜和细胞内 (图 5 D)。
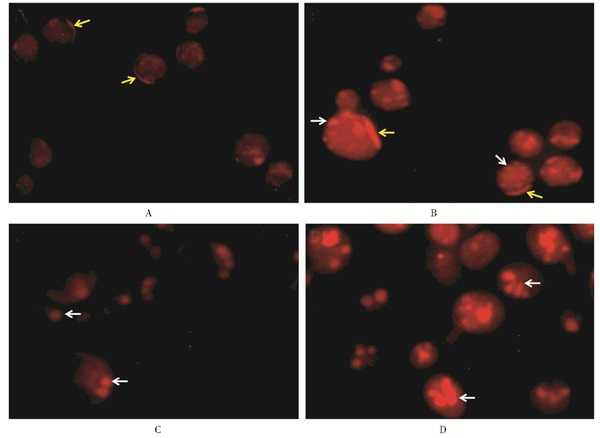
|
| 图 5 饱和脂肪酸在S. cerevisiae S228C BY4741-pox1和Y. lipolytica po1e细胞中的积累特征 Figure 5 Light microscopy images of lipid body phenotypes of Y. lipolytica po1e and S. cerevisiae S228C BY4741-pox1 A/B: S. cerevisiae S228C BY4741-pox1, A/C:YNBD培养基, B/D: YNBF0.1培养基黄色箭头指示细胞膜, 白色箭头指示油脂颗粒; C/D: Y. lipolytica po1e, 100× |
|
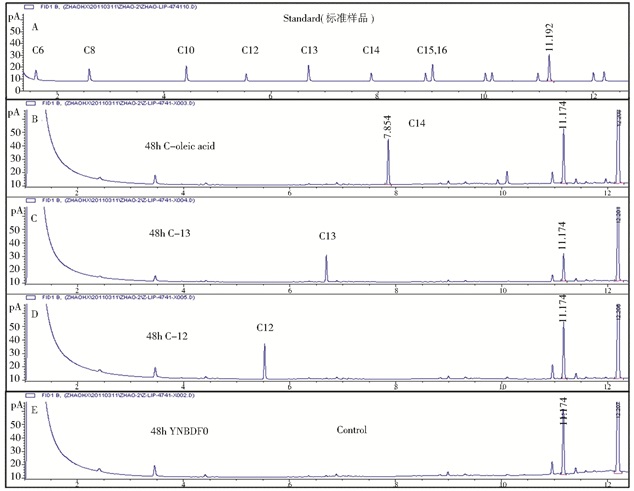
| 图 6 S. cerevisiae S228C BY4741-pox1在YNBF0.1培养48h胞内脂肪酸组成GC/Mass检测结果 Figure 6 GC/Mass analysis of fatty acid profile of S. cerevisiae S228C BY4741-pox1cultivated at 48h in YNBF0.1 A:各种脂肪酸混合标准样品; B:市售橄榄油; C: C13; D: C12; E:培养基中无脂肪酸 |
将2.3中提取培养48h样品的总脂类,加入硼酸、NaCl和甲醇,甲脂化,做成分析上样样品,GC/Mass分析脂类的组成[21-22],结果如图 6所示 (仅列S. cerevisiae S228C BY4741-pox1 GC/Mass的部分结果)。
GC/Mass分析结果表明:在S.cerevisiae S228C BY4741产生的脂类中没有检测出培养基中存在的相应脂肪酸,但有长链脂肪酸存在;而在S.cerevisiae S228C BY4741-pox1和S.cerevisiae S228C BY4741 -pox1, 3菌体中,可以检测到加入培养基中不同链长的单一饱和脂肪酸的积累 (图 6),说明:pox1和pox3基因敲除后,可以积累培养基加入的相应碳链长脂肪酸。S.cerevisiae S228C BY4741-pox1, 3积累的脂肪酸较S.cerevisiae S228C BY4741-pox1略高,也说明了双敲除菌株降解脂肪酸的途径阻断得更完全 (表 3);而Y.lipolytica po1e则完全不同,在没加脂肪酸的培养条件下,也可以积累脂肪酸颗粒,而且GC/Mass可以检测到碳链长度≥16的脂肪酸,但培养基中加入不同碳链长度的饱和脂肪酸时,GC/ Mass结果也没有检测到相应长度的脂肪酸,而且同样可以检测到长链脂肪酸的存在,但含量明显增加,说明加入不同链长的饱和脂肪酸,有利于脂类量的增加 (表 4)。
| Strains | Media | C11 | C12 | C13 | C16 | C18 |
| Y. lipolytica po1e | YNBD | N1) | N | N | 9.11 | 0.20 |
| YNBF0.1 | N | N | N | 15.16 | 0.54 | |
| S. cerevisiae S228C BY4741-pox1 | YNBD | N | N | N | 0.245 | 0.41 |
| YNBF0.1 | 1.17 | 2.21 | 3.78 | 0.873 | 1.901 | |
| S. cerevisiae S228C BY4741-pox1, 3 | YNBD | N | N | N | 0.257 | 0.492 |
| YNBF0.1 | 1.32 | 2.47 | 3.88 | 1.27 | 2.08 | |
| 1) N没有检测出相应的脂肪酸 | ||||||
3 讨论
储存油脂是一些产油微生物 (OMs) 的生理特性,通过生物工程手段,调控菌体的代谢过程,不但可以生产生物柴油,提高生物柴油的产量[4, 6-7],也可以积累特色高附加值的油脂[4-5]。Y. lipolytica是典型可以利用和积累油脂的微生物,其对脂类代谢具有特殊性[10, 23]。脂肪酸被细胞吸收和运输在Y. lipolytica细胞中的有2个系统,一是C12和C14系统,另一个C16和C18系统,但两个系统似乎互相并不影响[8, 25],从本研究也得到证实。本研究中尽管是单一自由饱和脂肪酸为底物,C12和C18作为不同培养体系的底物,吸收互不影响,测定的吸收利用指标相似,和Kohlwein等[25-26]的研究结果相一致。当以超市所售橄榄油或油酸 (包含不同链长的脂肪酸) 为底物时,细胞的生长情况和以单一脂肪酸为底物的结果一致,进一步说明了这一点 (相关结果整理中)。S. cerevisiae并不具有产油或储存油脂的特性,其吸收的脂肪酸会通过β-氧化途径,被作为碳源消耗或合成更长链的脂肪酸参与膜的组成[26-27]。其代谢过程仅有少量的不饱和脂肪酸作为胞内膜系统的组成成分。pox1和pox3是酵母S. cerevisiae S228C细胞参与脂肪酸β-氧化途径的两个基因。pox1和pox3编码的脂乙酰辅酶A氧化酶 (fatty acyl-CoA oxidase) 是在脂肪酸诱导下,催化脂肪酸降解的关键酶之一[27]。因此,本研究以S. cerevisiae S228C BY4741-pox1作为出发菌株的结果表明,pox1敲除之后,细胞可以吸收积累培养基中添加的相应自由脂肪酸;基于Δpox1敲除突变株,敲除pox3的双敲除突变株S. cerevisiae S228C BY4741-pox1, 3,结果细胞同样可以吸收积累培养基中添加的相应自由脂肪酸,与Guo等[28]的研究结果一致[28]。这些结果表明,可以通过基因改造,优化微生物的代谢过程,吸收并积累特色高附加值的脂肪酸,使利用酵母尤其是产油酵母生产特色高附加值脂肪酸成为可能。
本研究也表明,部分短链 (C5) 和中链 (C6-C10) 脂肪酸,对产油酵母 (Y. lipolytica) 和不产油酵母 (S. cerevisiae) 具有极强的抑制作用,甚至杀死细胞;而当C链长≥11时,细胞可以良好生长。但对于C11的利用,Y. lipolytica与S. cerevisiae有很大的不同,前者可以很好地利用,对后者则有明显的抑制作用。而对C12自由饱和脂肪酸的利用,S. cerevisiae S228C BY4741和S. cerevisiae S228C BY4741-pox1也有一定差异。S. cerevisiae S228C BY4741-pox1对C12为底物时有延迟效应,当培养24h以后,才开始生长,并很快进入对数生长期,S. cerevisiae S228C BY4741-pox1, 3有相似的结果。GC/Mass结果也显示,Y. lipolytica没有检测到培养基中加入的各种自由饱和脂肪酸,仅检测到长链的脂肪酸。可能是加入的脂肪酸通过β-氧化途径被细胞利用,或经合成途径,生成更长的脂肪酸;而S. cerevisiaeS228C BY4741-pox1和S. cerevisiae S228C BY4741-pox1, 3可以积累培养基加入的不同链长脂肪酸,因pox1和pox3是β-氧化途径中的二个酶[28],敲除后阻断了脂肪酸的降解,因而积累在细胞中。以上结果为了解酵母对单一自由饱和脂肪酸的选择性利用,生产特色油脂,及通过生物技术手段提高特色高附加值油脂的产量,具有一定指导意义。
致谢 感谢浙江理工大学人才基金项目 (11612932611513) 对本研究的支持。| [1] | Bonturi N, Matsakas L, Nilsson R, et al. Single cell oil producing yeasts Lipomyces starkeyi and Rhodosporidium toruloides:selection of extraction strategies and biodiesel property prediction. Energies, 2015, 8(6) : 5040–5052. DOI:10.3390/en8065040 |
| [2] | Papanikolaou S, Aggelis G. Lipids of oleaginous yeasts. Part Ⅰ:Biochemistry of single cell oil production. European Journal of Lipid Science and Technology, 2011, 113 : 1031–1051. DOI:10.1002/ejlt.v113.8 |
| [3] | Espinosa G I, Parashar A, Bressler D C. Hydrothermal treatment of oleaginous yeast for the recovery of free fatty acids for use in advanced biofuel production. Journal of Biotechnology, 2014, 187 : 10–15. DOI:10.1016/j.jbiotec.2014.07.004 |
| [4] | Xin M, Yang J M, Xu X, et al. Biodiesel production from oleaginous microorganisms. Renewable Energy, 2009, 34(1) : 1–5. DOI:10.1016/j.renene.2008.04.014 |
| [5] | 朱法科, 林炜铁, 鲍时翔, 等. 花生四烯酸高产菌株的选育. 工业微生物, 1999, 29 : 1–3. Zhu F K, Lin W T, Bao S X, et al. Selection and breeding of high yield peanut four acid producing strain. Industrial Microbiology, 1999, 29 : 1–3. |
| [6] | 刘波, 孙艳, 刘永红, 等. 产油微生物油脂生物合成与代谢调控研究进展. 微生物学报, 2005, 45(1) : 153–156. Lu B, Sun Y, Liu Y H, et al. Research progress in biosynthesis and metabolism regulation by oleaginous microorganisms. Acta Microbiologica Sinica, 2005, 45(1) : 153–156. |
| [7] | 贾彬, 王亚南, 何蔚红, 等. 生物柴油新原料-微生物油脂. 生物技术通报, 2014, 1 : 19–26. Jia B, Wang Y N, He W H, et al. New biodiesel raw material microbial lipid. Biotechnology Bulletin, 2014, 1 : 19–26. |
| [8] | Runguphan W, Jay D K. Metabolic engineering of Saccharomyces cerevisiae for production of fatty acid derived biofuels and chemicals. Metabolic Engineering, 2014, 21 : 103–113. DOI:10.1016/j.ymben.2013.07.003 |
| [9] | Shen Q, Lin H, Wang Q, et al. Sweetpotato vines hydrolysate promotes single cell oils production of Trichosporon fermentans in high-density molasses fermentation. Bioresource Technology, 2015, 176 : 249–256. DOI:10.1016/j.biortech.2014.11.045 |
| [10] | Papanikolaou S, Aggelis G. Selective uptake of fatty acids by the yeast Yarrowia lipolytica. European Journal of Lipid Science and Technology, 2003, 105 : 651–655. DOI:10.1002/(ISSN)1438-9312 |
| [11] | Papanikolaou S, Chevalot I, Komaitis M, et al. Single cell oil production by Yarrowia lipolytica growing on an industrial derivative of animal fat in batch cultures. Applied Microbiology and Biotechnology, 2002, 58 : 308–312. DOI:10.1007/s00253-001-0897-0 |
| [12] | 李小英, 聂小安, 陈洁, 等. 微生物油脂制备生物柴油技术研究现状及发展趋势. 生物质化学工程, 2015, 45(6) : 37–43. Li X Y, Nie X A, Chen J, et al. Research status and development trendency of biodiesel preparation from microbial lipid. Biomass Chemical Engineering, 2015, 45(6) : 37–43. |
| [13] | Sander M H, Sara V, Fatima V V, et al. The Biochemistry and physiology of mitochondrial fatty acid β-oxidation and its genetic disorders. Annual Review of Physiology, 2016, 78 : 23–24. DOI:10.1146/annurev-physiol-021115-105045 |
| [14] | Kalervo H J, Anu M M, Hanspeter R K, et al. The biochemistry of peroxisomal β-oxidation in the yeast Saccharomyces cerevisiae. FEMS Microbiology Reviews, 2003, 27(1) : 35–64. DOI:10.1016/S0168-6445(03)00017-2 |
| [15] | Janice S C, Brendan C, Brendon D, et al. Production of fatty acids in Ralstonia eutropha H16 by engineering β-oxidation and carbon storage. PeerJ 3:e1468 https://doi.org/10.7717/peerj.1468 |
| [16] | Weerawat R, Jay D K. Metabolic engineering of Saccharomyces cerevisiae for production of fatty acid-derived biofuels and chemicals. Metabolic Engineering, http://dx.doi.org/10.1016/j.ymben.2013.07.003. |
| [17] | Sambrook J, Fritsch E F, Maniatis T. Molecular Cloning:A Laboratory Manual, 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989. |
| [18] | Boeke J D, Lacroute F, Fink G R. A positive selection for mutants lacking orotidine-5'-phosphate decarboxylase activity in yeast:5-fluoro-orotic acid resistance. Molecular and General Genetics, 1984, 197(2) : 345–346. DOI:10.1007/BF00330984 |
| [19] | Gueldener U, Heinisch J, Koehler G J, et al. A second set of loxP marker cassettes for Cre-mediated multiple gene knockouts in budding yeast. Nucleic Acids Research, 2002, 15 : 30. |
| [20] | Horvath A, Riezman H. Rapid protein extraction from Saccharomyces cerevisiae. Yeast, 1994, 10(10) : 1305–1310. DOI:10.1002/(ISSN)1097-0061 |
| [21] | Martin A, Francesco G. A single-step method for rapid extraction of total lipids from green microalgae. PLoS One, 2014, 9(2) : e89643. DOI:10.1371/journal.pone.0089643 |
| [22] | Andréina L, Alexandre D K, Stéphane D. Development of solid-phase extraction and methylation procedures to analyse free fatty acids in lipid-rich seeds. Plant Physiology and Biochemistry, 2007, 45 : 250–257. DOI:10.1016/j.plaphy.2007.01.012 |
| [23] | Athanasios B, Mrozova Z, France T, et al. Control of lipid accumulation in the yeast Yarrowia lipolytica. Applied and Environmental Microbiology, 2008, 74(24) : 7779–7789. DOI:10.1128/AEM.01412-08 |
| [24] | Stephanie J N, Barbara H S, Boyd B D, et al. Solid-phase extraction in combination with GC/MS for the quantification of free fatty acids in adipocere. European Journal of Lipid Science and Technology, 2008, 110 : 73–80. DOI:10.1002/(ISSN)1438-9312 |
| [25] | Schneiter R, Kohlwein S D. Organelle structure, function, and inheritance in yeast:a role for fatty acid synthesis. Cell, 1997, 88 : 431–434. DOI:10.1016/S0092-8674(00)81882-6 |
| [26] | Oksana T, Kim S, Kohlwein S D. Fatty acid synthesis and elongation in yeast. Biochimica et Biophysica Acta, 2007, 1771 : 255–270. DOI:10.1016/j.bbalip.2006.07.004 |
| [27] | Wang T W, Luo Y, Small G M. The POXl gene encoding peroxisomal acyl-CoA oxidase in Saccharomyces cereuisiae is under the control of multiple regulatory elements. The Journal of Biological Chemistry, 1994, 269(39) : 24480–24485. |
| [28] | Guo Y Q, Song H L, Wang Z Y, et al. Expression of POX2 gene and disruption of POX3 genes in the industrial Yarrowia lipolytica on the γ-decalactone production. Microbiological Research, 2012, 167(4) : 246–252. DOI:10.1016/j.micres.2011.10.003 |
 2017, Vol. 37
2017, Vol. 37




