文章信息
- 陈国强, 吴文涛, 王纪明, 廖韦红, 张海波, 咸漠, 雷廷宙, 魏玉西.
- CHEN Guo-qiang, WU Wen-tao, WANG Ji-ming, LIAO Wei-hong, ZHANG Hai-bo, XIAN Mo, LEI Ting-zhou, WEI Yu-xi.
- 出芽短梗霉A5产胞外多糖发酵条件的优化及产物结构鉴定
- Production and Characteristics of Pullulan Produced by Aureobasidium pullulans A5
- 中国生物工程杂志, 2017, 37(2): 54-62
- China Biotechnology, 2017, 37(2): 54-62
- http://dx.doi.org/DOI:10.13523/j.cb.20170209
-
文章历史
- 收稿日期: 2016-09-09
- 修回日期: 2016-10-25
2. 中国科学院青岛生物能源与过程研究所 生物基材料重点实验室 青岛 266101;
3. 山东鲁抗生物制造有限公司 邹城 273500;
4. 河南省科学院能源研究所有限公司 郑州 450000
2. CAS Key Laboratory of Biobased Materials, Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China;
3. Lukang Biological Manufacture Company Limited of Shandong, Zoucheng 273500, China;
4. Henan Academy of Sciences Institute of Energy Co., LTD, Zhengzhou 450000, China
普鲁兰多糖 (pullulan),也叫茁霉多糖、普聚多糖或茁霉糖,是无味无嗅的白色粉末。它是以出芽短梗霉作为生产菌株,在发酵过程中利用生物糖发酵所产生的类似葡聚糖、黄原胶的胞外水溶性粘质多糖,其分子结构是以麦芽三糖为单体的直链多糖,这些单体之间以α-1, 6-糖苷键连接而成,并且麦芽三糖是由葡萄糖以α-1, 4-糖苷键连接而成的[1],由于上述的结构特点,该多糖被赋予了聚合物的一些独特的特性,即具有非常好的溶液特性及稳定性、分解性和难消化吸收性、成膜性、成纤维性、阻氧性、可塑性、粘结性以及固结性、被覆性,胶囊特性及易自然降解等独特的理化和生物学特性, 无毒无害, 对人体无任何副作用,并且在2006年5月19日.国家卫生部发布了第8号公告,确定普鲁兰多糖为新增四种食品添加剂产品之一,它可在糖果、巧克力包衣、膜片、复合调味料和果蔬汁饮料中用作被膜剂和增稠剂。因此在食物和食品方面、化学工业、医疗和药品、烟草、化妆品、环境保护、农产品保鲜等方面有着非常广的应用[2-3]。
尽管普鲁兰多糖有上述如此多的特性,以及这些特性所赋予它的广泛应用,但是其目前较低的产量和分子量限制了它的应用,所以目前此项研究主要集中在菌株发酵的优化和菌株的筛选,以此来提高普鲁兰多糖的产量和分子量。发酵的优化主要是集中在发酵条件和培养基的优化[4],主要包括培养基的pH[5-7]、接种量、碳源 (土豆淀粉废水,玉米淀粉,甘薯,粗黄糖等)[8-10]以及无机离子[11-14]等[15];普鲁兰酵母菌株[1]又名出芽短梗霉,它又称"黑酵母",这是由于它在产普鲁兰多糖的同时会伴随黑色素的产生,严重影响普鲁兰多糖的产量,并给下一步纯化带来一定的难度;再者发酵后的多糖可塑性较差,这也限制了普鲁兰多糖在某些方面的应用,其根本原因与多糖的分子量有关,不同分子量的普鲁兰多糖具有不同的粘稠度,因此获得无色素、较高分子量的普鲁兰多糖生产菌株,对于提高普鲁兰多糖的产量,降低普鲁兰多糖的生产成本以及实现普鲁兰多糖的广泛应用具有重要的意义。
本实验是将土样样品,通过产糖培养基筛选出一株产糖菌株,经过形态学鉴定以及ITS间隔序列分析,得知为出芽短梗霉属 (Aureobasidium pullulans),因此命名为Aureobasidium pullulans A5;并对其发酵条件和培养基进行了优化,最后,通过薄层层析,红外光谱以及凝胶色谱对产物进行了初步的结构分析和分子量的测定,这也进一步证明了菌株A5的产物即普鲁兰多糖,并丰富了普鲁兰酵母发酵产糖的候选菌株。
1 材料与方法 1.1 材料 1.1.1 土样来源土样样品 (1、2、3、4) 取自重庆医科大学周围树下腐质土壤,置于自封袋中4 ℃保存备用。
1.1.2 土样处理方法称取1 g土样溶于10 ml无菌水中,并置于30 ℃,180 r/min摇床中过夜培养。
1.2 菌株和培养基 1.2.1 菌株菌株A5为本实验室从重庆医科大学附近腐质土壤中经过多次富集,分离得到的菌株。
1.2.2 培养基筛选培养基:1% (w/v) 酵母浸粉,2% (w/v) 蛋白胨,2% (w/v) 琼脂,自然pH,1%氯霉素 (1 mg/L),0.05%曲利苯蓝 (与多糖类分子结合生成蓝色复合物,且颜色深浅与多糖量呈正向关系),并添加100 g/L葡萄糖。
YPD培养基:2% (w/v) 葡萄糖,1% (w/v) 酵母浸粉,2% (w/v) 蛋白胨,2% (W/V) 琼脂,自然pH。
种子培养基:2% (w/v) 葡萄糖,1% (w/v) 酵母浸粉,2% (w/v) 蛋白胨,自然pH。
基础发酵产糖培养基[15]:4% (w/v) 葡萄糖,1% (w/v) 酵母粉, 2% (w/v) 蛋白胨, 0.5% (w/v) K2HPO4, 0.06% (w/v) (NH4)2SO4,自然pH。
以上培养基的灭菌条件为:1×105 Pa灭菌30 min。
1.3 方法 1.3.1 菌株筛选方法将过夜培养的土样原液放在30 ℃恒温箱中静置一段时间,取上清梯度稀释10-3, 10-4倍,分别吸取100 μl涂布到筛选培养基上,30 ℃恒温培养2~3天,以菌落颜色深浅、表面质地为筛选指标,挑选出颜色深,菌落表面湿润,产胶多的菌株,在YPD培养基进行划线培养,并对其进行编号。最后接入种子培养基中培养并放在-80 ℃保存。
1.3.2 菌株鉴定方法(1) 形态学鉴定:将纯化的菌株在固体培养基上划线培养,连续几天观察菌株生长状况、菌落形态及培养特征。依据《真菌鉴定手册》对筛选到的真菌进行鉴定[16]。(2) ITS间隔序列分析:用种子培养基对筛选到的菌株进行发酵培养,30 ℃,180 r/min恒温震荡培养24~36 h后用酵母DNA组提取试剂盒 (TIANGEN公司) 提取酵母基因组DNA。采用通用引物ITS-1和ITS-4进行PCR扩增[17],PCR扩增程序为:预变性温度94 ℃,5 min;变性温度94 ℃,50 s;退火温度53 ℃,50 s;延伸温度72 ℃,1 min;72 ℃保持10 min,产物保存在4 ℃备用。PCR产物送华大基因科技服务有限公司进行测序,测序结果在NCBI基因库中进行序列比对,并构建系统发育树。
1.3.3 种子液的制备从固体平板上挑取新活化的一环菌株接种到种子培养基中,在30℃、180 r/min条件下培养36~48 h,即得到发酵种子液。
1.3.4 发酵条件的优化(1) 初始pH对胞外多糖产量的影响:将培养基的初始pH分别调至3、4、5、6、7、自然pH=7.45和8,按照6%的接种量,将种子液接种到发酵培养基中,在30 ℃,180 r/min的条件下培养,并在发酵24 h、48 h时测定胞外多糖的产量,用来探究不同初始pH对菌株胞外多糖产量的影响。(2) 不同接种量对胞外多糖产量的影响:在上述发酵实验的基础上,接种量分别调至1%、3%、5%、7%、9%、11%,在30 ℃,转速180 r/min的条件下发酵培养2天,分别在发酵24 h、48 h时测定胞外多糖的产量,以此来探究不同的接种量对菌株产糖的影响。
1.3.5 发酵培养基的优化(1) 不同碳源对胞外多糖产量的影响:在基础产糖培养基上,分别用麦芽糖,蔗糖,麦麸糖化液代替葡萄糖,pH 6,接种量为7%,发酵液的体积为50 ml/250 ml,在30 ℃,180 r/min条件下发酵2天,分别在发酵24 h、48 h测量胞外多糖的产量,用来考察不同碳源对胞外多糖产量的影响。(2) 麦芽糖浓度对胞外多糖产量的影响:在上述发酵的条件下,以麦芽糖作为最佳碳源,分别调整麦芽糖的浓度为2%、4%、6%、8%、10%、12%[18],在30℃,180 r/min条件下发酵2天,分别在发酵24 h、48 h测量胞外多糖的产量,用来考察不同浓度的麦芽糖对胞外多糖产量的影响。(3) 其他离子对胞外多糖产量的影响:在以麦芽糖为最佳碳源的条件下,并向基础产糖培养基中添加硫酸镁、氯化钠、氯化钙、硫酸铜,使终浓度为0.3 g/L,在发酵24 h、48 h时测量胞外多糖的产量,以探究不同种类无机离子对胞外多糖产量的影响。
1.3.6 多糖的粗提取取5 ml发酵液煮沸10 min,8 000 r/min离心10 min;弃去沉淀,收集上清液,加入2倍体积的无水乙醇 (预冷),4℃沉淀8 h;8 000 r/min离心10 min,弃上清收集沉淀,60℃烘干至恒重;称量并记录[4, 19]。
1.3.7 多糖的分离纯化(1) 将2 g粗多糖加40 ml蒸馏水稀释成5%的多糖水溶液,加入氯仿/戊醇=4:1混合液,充分震荡,以2 000 r/min离心15 min, 除去沉淀,将上清液用此方法重复操作8次,最后得到去除蛋白的上清液,得到粗多糖。(2) 将粗多糖加入98%乙醇至终浓度20%(体积浓度), 4 ℃醇析8h,以10 000 r/min离心10 min,沉淀为多糖[20]。
1.3.8 结构分析薄层层析 (TLC) [20]:(1) 将普鲁兰多糖标准液和纯化后的多糖样品溶液 (1 g/10 ml) 各分成两份,每份10 ml,其中一份添加普鲁兰酶100 μl,室温酶解6~8 h。(2) 将普鲁兰多糖标准溶液、普鲁兰多糖水解液、多糖样品溶液、多糖样品酶解液分别稀释100倍,按照普鲁兰多糖标准溶液、普鲁兰多糖水解液、麦芽三糖、多糖样品酶解液、多糖样品溶液的顺序在硅胶层析板上点样,在展层液中层析,待液体层析到硅胶板顶部后取出吹干,重复层析2~3次。(3) 将显色剂喷到层析后的硅胶板上,吹干后在酒精灯上加热显色,观察显色反应。
红外光谱 (FT-IR):将纯化得到的多糖组分,采用KBr与多糖混匀 (1:100),压片,并在4 000~400 cm-1进行红外光谱扫描IR吸收[21]。
1.3.9 胞外多糖分子量的测定-凝胶渗透色谱 (GPC)精密称取0.05 g纯化后的多糖样品加流动相溶解制成5 mg/ml溶液,离心取上清溶液,进样20 μl,GPC软件根据出峰时间,计算出样品的分子量[22]。
1.3.10 发酵液中黑色素分析根据Gadd [23]和West等[24]对发酵液中黑色素的测定方法,在540 nm处测定其吸光度值。
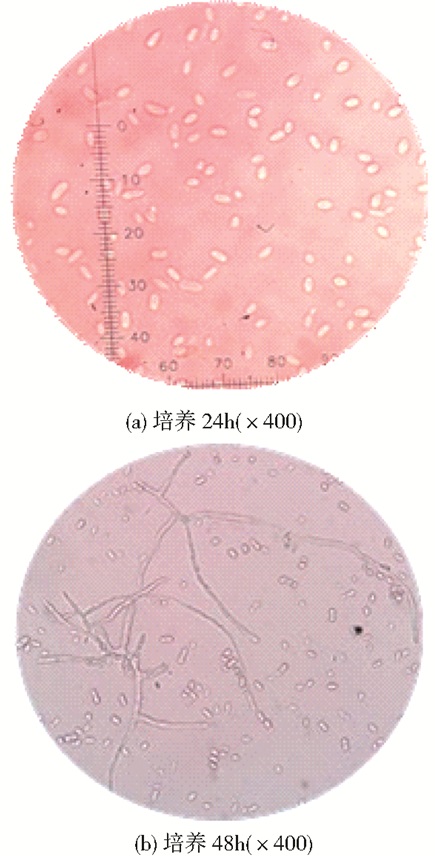
2 结果与分析 2.1 菌株A5的筛选与鉴定 2.1.1 形态学鉴定这是一种最基本菌种鉴定的方法,因此可以简单,快速地初步判断该菌株的种属,本实验在筛选培养基上得到一株真菌菌株A5,此菌株在YPD培养基上呈圆形,比细菌大而厚,表面光滑,湿润,粘稠,容易挑起,菌落质地均匀,正反面、边缘以及中央部分的颜色很均一,菌落颜色为乳白色 (图 1);在显微镜下观察,在平板上培养24 h时,可以看到卵圆形的单细胞 (图 2a);培养48 h时,有些酵母细胞会聚集在一起,酵母细胞呈现假菌丝体 (图 2b),这是出芽短梗霉菌体的二型性 (一种真菌既能生长成酵母状细胞又能生长成菌丝体状细胞)。

|
| 图 1 出芽短梗霉在YPD培养基上的形态特征 Figure 1 The morphological characteristic of Aureobasidium pullulans A5 grew on the YPD medium |
|
| 图 2 出芽短梗霉A5显微形态特征 Figure 2 The microscopic character of Aureobasidium pullulans A5 |
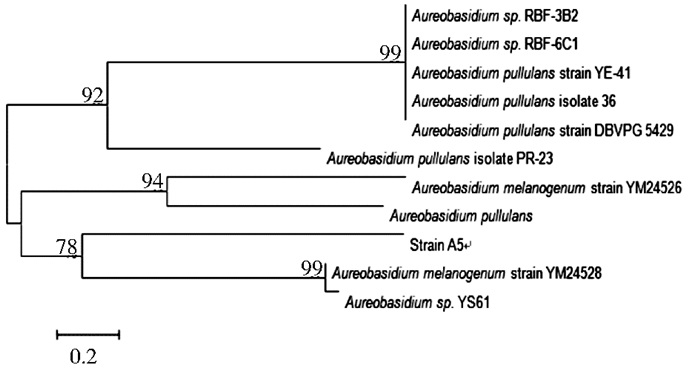
ITS间隔序列是目前进行菌种鉴定较多采用的方法。ITS是内源转录间隔区 (Internally Transcribed Spacer) 的英文缩写, 位于rRNA编码基因18 S、5.8 S和28 S之间的小基因片段,其优点有:具有高拷贝数, 整个序列的长度在600~800 bp。选择的两对引物以ITS区的序列为靶目标,其中引物ITS1和ITS4扩增的是ITSⅠ区、5.8 S rDNA和ITSⅡ区的基因序列。所得到的基因序列在NCBI的GenBank中通过BLAST程序进行相似性序列检测分析,并且选取与已知序列相似性高的菌株构建出系统进化树如图 3所示。相似度结果分析表明:菌株A5与菌株YM24528和PR-23的相似度达到99%,具有非常相近的亲缘关系,再结合其生理生化特性,可以确定A5菌株为出芽短梗霉属,命名为出芽短梗霉A5。
|
| 图 3 菌株A5和序列相似高菌株的系统进化树 Figure 3 Phylogenetic tree of strain A5 and some high related species |
将基础产糖培养基的初始pH分别调至3、4、5、6、7,自然pH=7.45和8,摇床培养2 d后,菌株胞外多糖产量如图 4所示。

|
| 图 4 初始pH对胞外多糖产量的影响 Figure 4 Effects of initial pH on exopolysaccharides (EPS) production |
在发酵过程中,培养基的初始pH不仅会影响菌株的生长,而且会影响有关合成胞外多糖的酶活性[25],本实验在发酵过程中发现,随着发酵的不断进行,培养基的pH会降低,最终的pH会维持在一个相对低于或等于其初始值的水平[6]。从图 4可以看出,初始pH为6时,胞外多糖的产量是最高的,无论是低于还是高于菌株发酵的最适pH,产量都会降低。当初始pH为3时,产量最低。
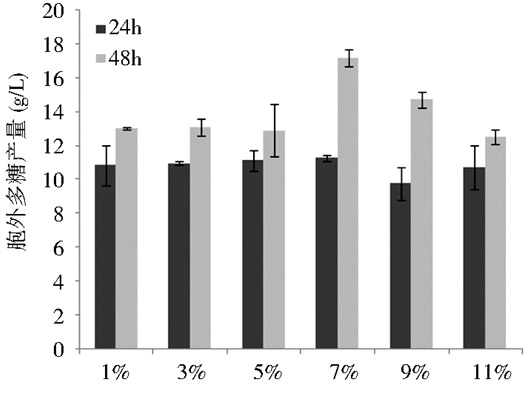
2.2.2 接种量对胞外多糖产量的影响将培养36~48 h的种子液 (即OD600为48) 分别以1%、3%、5%、7%、9%、11%的接种量接到初始pH为6的发酵培养基中,摇床发酵2 d后,菌株胞外多糖的产量如图 5所示。
|
| 图 5 接种量对胞外多糖产量的影响 Figure 5 Effects of inoculation amount on EPS production |
接种量的多少直接影响到菌株对葡萄糖的利用率,接种量过高时,菌株会利用培养基中的葡萄糖生长,不利于胞外多糖的积累;接种量过低时,菌株不能够充分利用葡萄糖,从而影响产物的积累[15],所以由图 5可知,接种量是7%时,既保证了菌株的生长,又保证了菌株能够充分利用葡萄糖,最终达到最高的胞外多糖产量。
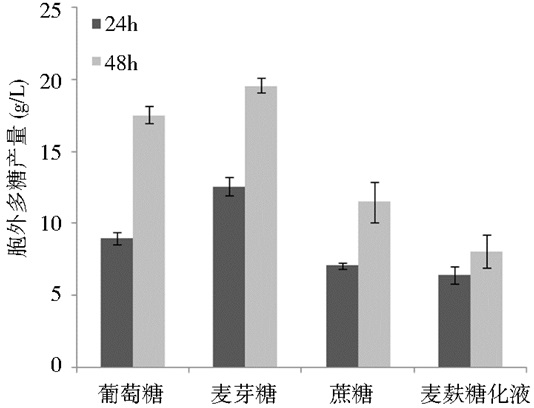
2.3 发酵培养基的优化 2.3.1 不同碳源对胞外多糖产量的影响分别用麦芽糖、蔗糖、麦麸糖化液代替葡萄糖,培养基的初始pH为6,接种量为7%, 其他的成分按照基础产糖培养基的配比,摇床发酵2 d,其胞外多糖的产量如图 6所示。
|
| 图 6 不同碳源对胞外多糖产量的影响 Figure 6 Effects of different carbon sources on EPS fermentation |
碳源是出芽短梗霉产胞外多糖的关键因素[10, 19],因此通过添加不同碳源对发酵产糖的影响,所以由图 6得知,该菌可以利用多种碳源进行产糖发酵,其中以麦芽糖为碳源时,胞外多糖的产量最高,其次是葡萄糖,蔗糖以及麦麸糖化液;由此得知,该菌株的最佳碳源是麦芽糖。
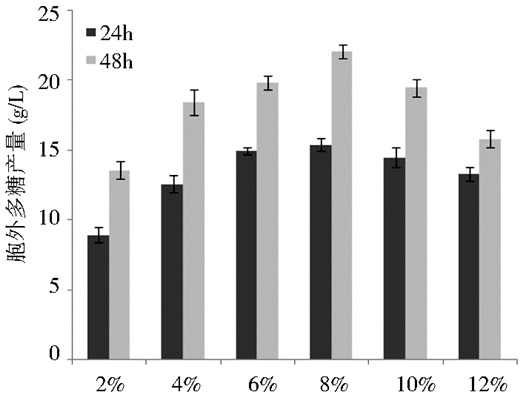
2.3.2 不同麦芽糖浓度对胞外多糖产量的影响以基础产糖培养基为基本培养基,分别向培养基中添加70%(w/v) 麦芽糖,至终浓度为2%、4%、6%、8%、10%以及12%;并分别在24 h和48 h时测量胞外多糖的产量,测定结果如图 7所示。
|
| 图 7 不同麦芽糖浓度对胞外多糖产量的影响 Figure 7 Effects of different concentrations of maltose on EPS production |
碳源的浓度也是一个影响胞外多糖产量的重要因素[26],浓度过低时,菌株利用其生产胞外多糖时会受到影响;浓度过高时,又会抑制菌株的生长,从而影响胞外多糖的产量。由图 7可知,随着麦芽糖浓度的逐渐升高,A5菌株胞外多糖的产量呈现先增加后减少的相关关系,所以当培养基中麦芽糖的浓度为8%时,胞外多糖的产量最高。
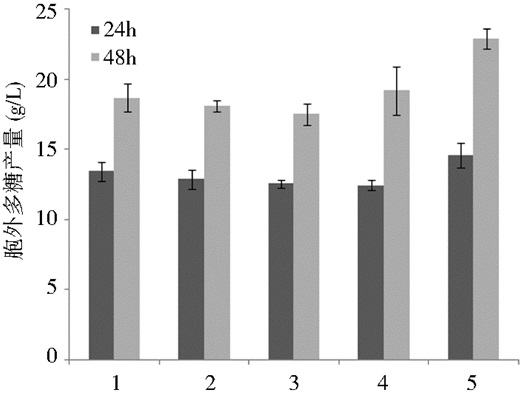
2.3.3 其他离子对胞外多糖产量的影响在基础产糖培养基中,添加70%(w/v) 麦芽糖至终浓度为8%,并分别向其中加入氯化钠、硫酸镁、硫酸锰以及氯化钙,使得培养基中的浓度为0.3 g/L,摇床培养2 d后,其发酵结果如图 8所示。
|
| 图 8 其他离子对胞外多糖产量的影响 Figure 8 Effects of different mental ions on EPS production 1: Contrast; 2: NaCl; 3: MgSO4; 4: MnSO4; 5: CaCl2 |
无机离子是菌株生长不可或缺的营养元素,是菌株体内一些多糖合成酶的重要组成部分,进而会影响胞外多糖的产量[27]。由图 8可知,当在基础产糖培养基的基础上添加0.3 g/L的CaCl2时,胞外多糖的产量达到了最大值。而其他无机离子对多糖产量的影响相对较小一些。因此,在本实验的基础上,需要进一步研究Ca2+浓度对胞外多糖产量的影响。
2.4 结构鉴定 2.4.1 薄层层析 (TLC)由于普鲁兰酶可以特异性地水解α-1, 6糖苷键[28],对其它的糖苷键没有作用。因此在普鲁兰酶的作用下,水解为麦芽三糖;从图 9中可以看出,普鲁兰多糖标准品和多糖样品被普鲁兰酶水解后,都有麦芽三糖产生,说明该多糖样品是由麦芽三糖通过α-1, 6糖苷键连接而成的,亦即普鲁兰多糖[20]。

|
| 图 9 薄层层析 Figure 9 Thin layer chromatography of the products hydrolyzed with pullulanase 1: The standard pullulan (1g/L); 2: The hydrolyzed standard pullulan (1g/L); 3:Maltotriose (10mg/L); 4:The sample (1g/L); 5:The hydrolyzed sample (1 g/L) |
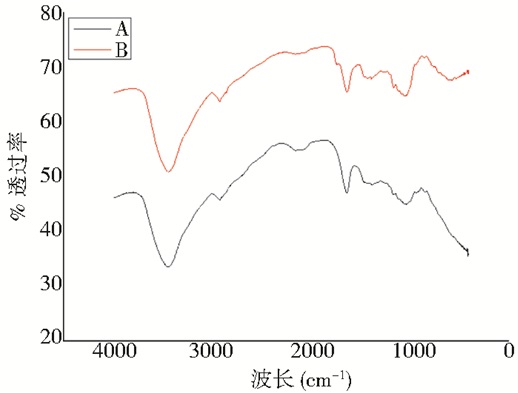
在图 10中由普鲁兰多糖标品 (B) 的红外色谱可知,该多糖的分子的特征峰为1 200~1 030 cm-1处的νC=O峰和930~900 cm-1处的D-吡喃葡萄糖环振动峰[20, 29],所以多糖样品 (A) 出现的特征峰与标品的基本上相同,由此证明该多糖是普鲁兰多糖。
|
| 图 10 红外光谱 Figure 10 FT-IR spectra of pullulan and EPS isolated from fermentation broths |
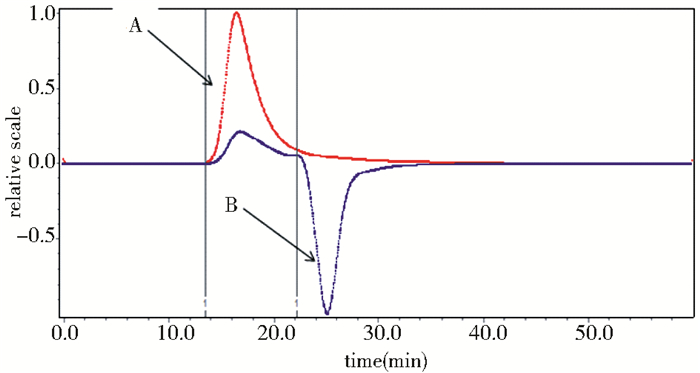
多糖分子量的大小由许多因素决定,例如含有酵母粉的培养基,低的初始pH以及以农业废弃物作为碳源时,要比不含酵母粉的培养基,较高的初始pH以及以葡萄糖为碳源时的分子量大[4, 30-31]。由凝胶渗透色谱图 11可知,A是多糖样品,B是溶剂 (水);并根据GPC软件,数均分子量 (Mw),即该多糖分子的分子量为63.48 kDa。本研究需进一步探究外界因素 (pH,培养基的组成等) 对菌株胞外多糖分子量的影响,获得最佳的发酵条件,使得该多糖的分子量得到进一步的提高,以此来实现普鲁兰多糖更为广泛的应用。
|
| 图 11 凝胶渗透色谱 Figure 11 GPC spectra of EPS produced by Aureobasidium pullulans A5 |
黑色素不溶于水和绝大部分有机溶剂,但可以溶于碱溶液中。在本实验对于发酵液中黑色素的测定,并由图 12可知,在整个发酵过程中,发酵液中几乎无黑色素的产生。这说明该菌株当前的发酵条件下可以生产无色素的普鲁兰多糖,对于提高普鲁兰多糖的产量和质量有着重要的参考价值。
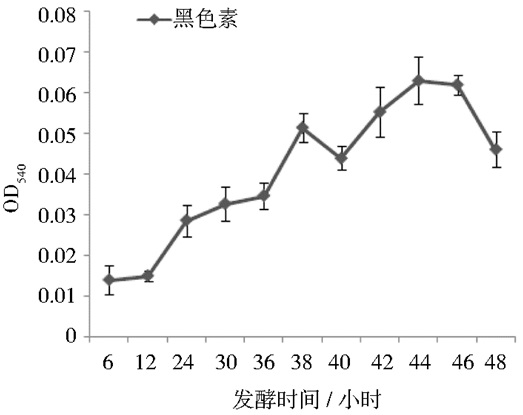
|
| 图 12 发酵液中黑色素的测定 Figure 12 The determination of melanin in fermentation broth |
本实验筛选获得普鲁兰酵母菌株,能够生产无色素、高分子量的普鲁兰多糖。在发酵结束时,发酵液中会包含酵母细胞,细胞碎片,剩余的培养基,胞外多糖等成分,这些成分可以通过高速离心去除。然而,由于合成普鲁兰多糖的菌株,在利用生物糖生产胞外多糖时,会伴有黑色素的产生[1, 23],严重影响普鲁兰多糖的品质,以及增加后续纯化的成本;这种黑色素是在酮内脂途径中产生的,亦即在发酵的后期出芽短梗霉细胞从膨胀的细胞阶段转变成真正的原膜孢子;另外黑色素的产生与培养基的成分也有一定的关系,出芽短梗霉本身就是一种产黑色素的菌株,如果在发酵培养基中添加活性炭,某些溶剂等成分,可以将细胞维持在膨胀阶段,从而来抑制黑色素的产生而得到无色素的多糖[32-33];再就是产生的黑色素会覆盖在菌丝细胞壁上,形成强有力的保护层,从而阻止一些酶进入细胞,进而导致胞外多糖产量的降低[34]。本研究获得的菌株在发酵过程中,并未添加任何其他溶剂等成分,发酵液中无黑色素的产生,不存在黑色素对普鲁兰多糖有关酶的抑制作用,所以该菌株在提高普鲁兰多糖的产量和质量方面和降低生产成本有着较好的参考价值;并通过对所获得菌株发酵条件的优化,并在最优的发酵条件下进行摇瓶 (50/250 ml) 发酵,最高产量达到22.9 g/L,明显要比文献[33]所报道的2.08 g/L无色素普鲁兰多糖高了11倍多,而低于Wei等[35]通过紫外和射线复合诱变获得的25.65 g/L。Roukas等[36]在分批补料培养和分批培养中分别获得24.5 g/L,31.3 g/L, 有研究者对酵母生长和生产普鲁兰多糖阶段分开培养,并在第二阶段获得超过35 g/L普鲁兰多糖,Biliaderis等[37]在分批培养过程中利用橄榄油和蔗糖作为碳源发酵获得51.5 g/L该多糖,以及胡洪森等[38]通过对已知菌株进行溴乙锭诱变,并利用获得的菌株发酵获得68.06 g/L普鲁兰多糖,同时该菌株在后续的研究中若利用以上的方法,筛选获得性能较好的菌株,并利用发酵罐进行分批发酵培养,发酵产量会有较大的提升空间。目前普鲁兰多糖在食物和食品方面,医疗和药品以及农产品保鲜等领域有着广泛的应用[39-40],延展性和黏性是普鲁兰多糖的重要优点,而分子量较高的普鲁兰多糖具有较好的延展性和黏性,具有更广泛的商业用途[1, 31, 35]。在本研究中获得的多糖通过凝胶渗透色谱法测得分子量为63 kDa,是商品普鲁兰多糖平均分子量 (20 kDa) 的3倍多,同时产品表现出较好的延展性和粘度,说明利用该菌株生产普鲁兰多糖具有更大的应用潜力。本菌株能够生产无色素、较高分子量普鲁兰多糖,是一株在提高普鲁兰多糖的产量和质量,同时降低多糖生产成本的重要工业候选菌株,同时它在推动普鲁兰多糖更为广泛的应用方面具有重要的意义。
4 结论本研究基于筛选获得能够生产分子量较高且无色素产生的普鲁兰多糖的酵母菌株,我们从重庆医科大学附近腐质土壤中,筛选到一株酵母菌株A5, 并通过形态学以及分子生物学鉴定为出芽短梗霉属,并命名为Aureobasidium pullulans A5。通过单因素的实验方法,初步对其发酵条件进行了优化,得到的最佳发酵条件为:8%(w/v) 麦芽糖,1%(w/v) 酵母粉, 2%(w/v) 蛋白胨, 0.5% (w/v) K2HPO4,0.06% (w/v) (NH4)2SO4,0.03%(w/v) CaCl2,pH6,7%(v/v) 接种量,在最优的发酵条件下培养,普鲁兰多糖的产量为22.9 g/L,在以后实验过程中需进一步发酵罐放大培养;然后对其产物经过薄层层析和红外光谱分析,得知该菌株的产物是普鲁兰多糖;分子量为63.84 kDa。该菌株经过优化实验为普鲁兰酵母发酵产糖提供了一定的理论基础,并为工业发酵产糖增添了新的菌株资源。
| [1] | Cheng K, Demirci A, Catchmark J M. Pullulan:biosynthesis, production, and applications. Applied Microbiology Biotechnology, 2011, 92(1) : 29–44. DOI:10.1007/s00253-011-3477-y |
| [2] | 刘谋泉. 普鲁兰多糖发酵条件研究. 食品工业科技, 2008, 29(1) : 110–112. Liu M Q. Study on fermentation conditions of pullulan. Science and Technology of Food Intustry, 2008, 29(1) : 110–112. |
| [3] | 邵伟, 刘世玲, 唐明, 等. 茁霉多糖发酵及提取工艺条件研究. 生物技术, 2004, 14(5) : 69–70. Shao W, Liu S L, Tang M, et al. Studies on fermentation and purification of pullulan. Biotechnology, 2004, 14(5) : 69–70. |
| [4] | Lee J, Kim J, Zhu I, et al. Optimization of conditions for the production of pullulan and high molecular weight pullulan by Aureobasidium pullulans. Biotechnology Letters, 2001, 23 : 817–820. DOI:10.1023/A:1010365706691 |
| [5] | Ono K, Yasuda N. Effect of pH on pullulan elaboration by Aureobasidium pullulans S-l. Agricultural Biological Chemistry, 1977, 41(11) : 2113–2118. |
| [6] | Lacroixt C, Leduy A, Noel G, et al. Effect of pH on the batch fermentation of Pullulan from sucrose medium. Biotechnology Bioenggineering, 1985, 27(2) : 202–207. DOI:10.1002/(ISSN)1097-0290 |
| [7] | Bulmer M A, Catley B J, Kelly P J. The effect of ammonium ions and pH on the elaboration of the fungal extracellular polysaccharide, pullulan, by Aureobasidium pullulans. Applied Microbiology Biotechnology, 1987, 25 : 362–365. |
| [8] | Wu S, Jin Z, Tong Q, et al. Sweet potato:A novel substrate for pullulan production by Aureobasidium pullulans. Carbohydrate Polymers, 2009, 76(4) : 645–649. DOI:10.1016/j.carbpol.2008.11.034 |
| [9] | 李世杰, 彭华松, 方尚玲. 玉米淀粉为原料短梗霉多糖发酵条件研究. 粮食与饲料工业, 2000, 12 : 41–42. Li S J, Peng H S, Fang S L. Study on pullulan fermentation with corn starch as culture material. Food and Feed Industry, 2000, 12 : 41–42. |
| [10] | Vijayendra S V, Bansal D, Prasad M S, et al. Jaggery:a novel substrate for pullulan production by Aureobasidium pullulans CFR-77. Process Biochemistry, 2001, 37 : 359–364. DOI:10.1016/S0032-9592(01)00214-X |
| [11] | 韩丛琴, 王兴华. 不同微量元素对出芽短梗霉发酵的影响. 山东农业科学, 2012, 44(3) : 112–114. Han C Q, Wang X H. Effects of different microelements on Aureobasidium pullulans fermentation. Shandong Agricultural Sciences, 2012, 44(3) : 112–114. |
| [12] | 鞠宝, 陈永珉, 林剑, 等. 二价阳离子对短梗霉多糖发酵的影响. 生物技术, 2000, 10(4) : 31–33. Ju B, Chen Y M, Lin J, et al. Effects of two valanceions on pullulan fermentation. Biotechnology, 2000, 10(4) : 31–33. |
| [13] | 牛登飞, 童群义. 金属离子对短梗霉多糖发酵的影晌. 食品工业科技, 2009, 30(9) : 154–157. Niu D F, Tong Q Y. Study on effects of metal ions on pullulan production by Aureobasidium pullulans. Science and Technology of Food Industry, 2009, 30(9) : 154–157. |
| [14] | Kossaczká Z, Machová E, Vojtková-Lepšíková A. D-Xylose metabolism in Aureobasidium pullulans:effects of aeration and vitamins. Applied Microbiology Biotechnology, 1991, 36 : 375–378. DOI:10.1007/BF00208159 |
| [15] | 梁雪.产胞外多糖酵母菌株的筛选鉴定及多糖结构初步分析.哈尔滨:东北林业大学硕士学位论文, 2010. Liang X. Screening, identification of exopolysaccharide-producing yeasts and studies on exopolysaccharide structure elementarily. Haerbin:Master Degree Thesis of Northeast Forestry University, 2010. |
| [16] | 魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979: 103-117. Wei J C. The Manual of Determinative Mycology. Shanghai: Shanghai Scientific & Technical Publishers, 1979: 103-117. |
| [17] | Dong X, Yang J, Zhu N, et al. Sugarcane bagasse degradation and characterization of three white-rot fungi. Bioresource Technology, 2013, 131 : 443–451. DOI:10.1016/j.biortech.2012.12.182 |
| [18] | Lazaridou A, Biliaderis C G, Roukas T, et al. Production and characterization of pullulan from beet molasses using a nonpigmented strain of Aureobasidium pullulans in batch culture. Applied Biochemistry Biotechnology, 2002, 97(1) : 1–22. DOI:10.1385/ABAB:97:1 |
| [19] | Duan X, Chi Z, Wang L, et al. Influence of different sugars on pullulan production and activities of α-phosphoglucose mutase, UDPG-pyrophosphorylase and glucosyltransferase involved in pullulan synthesis in Aureobasidium pullulans Y68. Carbohydrate Polymers, 2008, 73(4) : 587–593. DOI:10.1016/j.carbpol.2007.12.028 |
| [20] | 曹海石, 孙宏, 梁放, 等. 普鲁兰多糖的分离纯化及结构鉴定. 高等学校化学学报, 1999, 20(11) : 1729–1732. Cao H S, Sun H, Liang F, et al. Prification and determination of the structure of pullulan polysaccharide. Chemical Journal of Chinese Universities, 1999, 20(11) : 1729–1732. |
| [21] | 吴少微.鸡骨草多糖的分离纯化、结构分析和抗氧化活性.广州:华南理工大学硕士学位论文, 2013. Wu S W. Preparation, preliminary charecterization and antioxidant activities of polysaccharides from Abrus cantoniensis Hance. Guangzhou:Master Degree Thesis of South China University of Technology, 2013. |
| [22] | 陈萌.四株不同来源海洋微生物胞外多糖的结构及抗氧化活性研究.青岛:中国海洋大学博士学位论文, 2012. Chen M, Structural charecterization and antioxidant properties of exopolysaccharides produced by 4 marine microbe with different sources. Qingdao:Doctoral Dissertation of Ocean University of China, 2012. |
| [23] | Gadd G M. Melanin production and differentiation in batch cultures of the polymorphic fungus Aureobasidium pullulan. FEMS Microbiology Letters, 1980, 9 : 237–240. DOI:10.1111/fml.1980.9.issue-3 |
| [24] | West T P, Reed-Hamer B. Polysaccharide production by a reduced pigmentation mutant of the fungus Aureobasidium pullulans. FEMS Microbiology Letters, 1993, 113(3) : 345–349. DOI:10.1111/fml.1993.113.issue-3 |
| [25] | 张忠智, 将令西, 王利涛, 等. 生物多糖代谢产物的调控过程优化研究. 化学与生物工程, 2005, 11 : 36–38. Zhang Z Z, Jiang L X, Wang L T, et al. Optimization research on the regulation of biopolysaccharides metabolic product. Chemistry & Bioengineering, 2005, 11 : 36–38. |
| [26] | Lazaridou A, Biliaderis C G, Roukas T, et al. Production and characterization of pullulan from beet molasses using a nonpigmented strain of Aureobasidium pullulans in batch culture. Biochemistry and Biotechnology, 2001, 97 : 1–22. |
| [27] | West T P, Reed-Hamer B. lnfluence of vitamins and mineral salts upon pullulan synthesis by Aureobasidium pullulans. Microbios, 1992, 71 : 115–123. |
| [28] | 周瑞芳, 荚恒龙, 彭风鼐. 稻米中普鲁兰酶的纯化与性质的研究. 中国粮油学报, 1994, 9(1) : 11–16. Zhou R F, Jia H L, Peng F N. Study on the purification and characterizations of pullulanase in rice. Journal of the Chinese Cereals and Oils Association, 1994, 9(1) : 11–16. |
| [29] | 谢晶曦. 红外光谱在有机化学和药物化学中的应用. 北京: 北京科学出版社, 1987: 77. Xie J X. Applications of Infrared Spectroscopy in Organic Chemistry and Pharmaceutical Chemistry. Beijing: Beijing Science Press, 1987: 77. |
| [30] | Kim J, Kim M, Lee J, et al. Production of high molecular weight pullulan by Aureobasidium pullulans using glucosamine. Biotechnology Letters, 2000, 22 : 987–990. DOI:10.1023/A:1005681019573 |
| [31] | Israilides C, Scanlon B, Smith A, et al. Characterization of pullulans produced from agro-industrial wastes. Carbohydrate Polymers, 1994, 25 : 203–209. DOI:10.1016/0144-8617(94)90205-4 |
| [32] | Kachhawa D K, Bhattacharjee P, Singhal R S. Studies on downstream processing of pullulan. Carbohydrate Polymers, 2003, 52 : 25–28. DOI:10.1016/S0144-8617(02)00261-8 |
| [33] | Li B, Zhang N, Peng Q, et al. Production of pigment-free pullulan by swollen cell in Aureobasidium pullulans NG which cell differentiation was affected by pH and nutrition. Applied Microbiology Biotechnology, 2009, 84(2) : 293–300. DOI:10.1007/s00253-009-1955-2 |
| [34] | Zheng W, Campbell B S, McDougall B M, et al. Effects of melanin on the accumulation of exopolysaccharides by Aureobasidium pullulansgrown on nitrate. Bioresource Technology, 2008, 99(16) : 7480–7486. DOI:10.1016/j.biortech.2008.02.016 |
| [35] | Wei G, Yu X, Wang Y, et al. Media optimization for elevated molecular weight and mass production of pigment-free pullulan. Carbohydrate Polymers, 2012, 89(3) : 928–934. DOI:10.1016/j.carbpol.2012.04.038 |
| [36] | Roukas T, Youssef F, Biliaderis C G. Pullulan production by a non-pigmented strain of Aureobasidium pullulans using batch and fed-batch culture. Process Biochemistry, 1999, 34 : 355–366. DOI:10.1016/S0032-9592(98)00106-X |
| [37] | Youssef F, Biliaderis C G, Roukas T. Enhancement of pullulan production by Aureobasidium pullulans in batch culture using olive oil and sucrose as carbon sources. Applied Biochemistry Biotechnology, 1998, 74(74) : 13–30. |
| [38] | 胡洪森, 叶斌. 溴乙锭对出芽短梗霉的诱变作用. 武汉生物工程学院学报, 2012, 8(2) : 79–81. Hu H S, Ye B. Mutagenic effect of ethidium bromide on Aureobasidium pullulans. Journal of Wuhan Bioengineering Institude, 2012, 8(2) : 79–81. |
| [39] | Singh R S, Saini G K, Kennedy J F. Downstream processing and characterization of pullulan from a novel colour variant strain of Aureobasidium pullulans FB-1. Carbohydrate Polymers, 2009, 78(1) : 89–94. DOI:10.1016/j.carbpol.2009.03.040 |
| [40] | 曹新志. 普鲁兰的生产和应用研究进展. 四川理工学院学报, 2006, 19(4) : 60–62. Cao X Z. Development of production and applications of pullulan. Journal of Sichuan University of Science & Engineering, 2006, 19(4) : 60–62. |
 2017, Vol. 37
2017, Vol. 37




