文章信息
- 项丽, 王申, 田海山, 钟美娟, 周汝滨, 曹定国, 梁朋, 张国平, 何滔, 庞实锋.
- XIANG Li, WANG Shen, TIAN Hai-shan, ZHONG Mei-juan, ZHOU Ru-bin, CAO Ding-guo, LIANG Peng, ZHANG Guo-ping, HE Tao, PANG Shi-feng.
- 小鼠c-Myc基因的克隆表达及其纯化
- Constructing Mouse pET3C-Myc Vector and Its Expression in Rosetta (DE3) and Its Purification
- 中国生物工程杂志, 2017, 37(2): 20-25
- China Biotechnology, 2017, 37(2): 20-25
- http://dx.doi.org/DOI:10.13523/j.cb.20170204
-
文章历史
- 收稿日期: 2016-11-04
- 修回日期: 2016-12-09
2. 温州医科大学药学院 温州 325035
2. School of Pharmaceutical Science, Wenzhou Medical University, Wenzhou 325035, China
c-Myc基因是Myc基因家族重要成员之一,该家族有3个成员:C-Myc (Cell-myc),N-Myc (human neuroblastomas),L-Myc (small cell lung carcinomas)。c-Myc基因是禽类髓细胞性白血病病毒 (AMN) MC-29中V-Myc的同源序列[1], DNA序列分析表明c-Myc基因由3个外显子和2个内含子组成,第一个外显子不编码,只起调节作用,外显子2和3具有高度的保守性,编码439个氨基酸残基[2],其蛋白质的相对分子量为64kDa[3-7]。该蛋白是一种DNA相关蛋白,属于转录因子范畴,其功能在于维持胚胎干细胞的生物学特征和诱导多能干细胞的形成[8]。已有研究证明c-Myc基因不是诱导重编程过程中的必要基因,其作用可能是改变染色质的构象,使其快速变为可以和其他转录因子结合的状态。同时,文献[9]中报道Pera等小组的研究也表明c-Myc的作用可能是促进细胞的增殖而在重编程的起始阶段并非必要[10]。
因此本研究通过利用Oct4,Sox2, Klf4, c-Myc蛋白诱导体细胞成多能干细胞,通过先加入前3个蛋白进行初步诱导,调整c-Myc蛋白的量和加入的时间从而提高诱导多能干细胞的效率,此外又能控制c-Myc原癌基因的致瘤风险。利用蛋白诱导iPSC, 既避免了整合性病毒载体介导可能导致外源基因整合到宿主基因组上导致基因突变的风险[11],同时其可来源于自身体细胞,无需破坏自身胚胎组织,不涉及伦理道德争议,而且该技术仅将相关蛋白转移到细胞核中诱导细胞逆分化而不涉及基因组基因的任何改变,安全性极高,操作简单,为以后iPS研究进入临床,造福人类提供了可能。
1 材料与方法 1.1 材料 1.1.1 质粒载体和菌种TetO-FUW-OSKM质粒、pET-3C载体为本实验室保存,DH5α感受态,Rosseta (DE3) 感受态均购自上海唯地生物技术有限公司。
1.1.2 限制性内切酶和连接酶BamHⅠ, 和NdeⅠ限制性核酸内切酶,rTaqDNA聚合酶,SolutionI连接酶,高保真酶Prime STAR HS DNA Polymerase均购自TaKaRa公司。
1.1.3 试剂DNA ladder (DL2 000、DL15 000)、蛋白质Marker, 5×DNA Loading Buffer均购自TaKaRa公司;质粒提取试剂盒E.Z.N.A.TM Plasmid Mini Kit、胶回收试剂盒Gel DNA Purification Kit、PCR回收试剂盒E.Z.N.A.Rcycle-Pure Kit均购于Omega公司;His-tag小鼠单克隆抗体IgG, 辣根过氧化物酶标记山羊抗小鼠IgG (h+L) ECL发光试剂盒均购自碧云天生物公司,其它生化试剂均为国产。
1.2 方法 1.2.1 引物设计与合成根据NCBI发表的小鼠c-Myc基因序列设计了上下游引物P1和P2。上游引物引入了NdeⅠ酶切位点和6×His组氨酸标签,下游引物引入了Bam HI酶切位点 (由广州艾基基因合成公司合成) 其上下游引物如下:
PE-Myc-P1 5′GGGAATTCCATATGCACCACCACCACCACCACCTGGATTTCCTTTGGGCGTTG3′;
PE-Myc-P2 5′GAGGATCCTTATGCACCAGAGTTTCGAAG3′。
1.2.2 c-Myc基因PCR扩增以艾基基因公司合成的Oligo d T为扩增引物,以TetO-FUW-OSKM为模板扩增c-Myc基因。PCR反应体系为100μl:Pfu酶0.25μl, pfu buffer 10μl, dNTPmix 8μl, TetO-FUW-OSKM质粒0.5μl, PE-Myc-P1 1μl PE-Myc-P2 1μl,再用无菌水补足100μl。
PCR参数设置:94 ℃预变性5 min,94℃变性30 s,62 ℃退火30s,72 ℃延伸1min,28个循环后,72 ℃总延伸5 min。电泳后的PCR产物用E.Z.N.A.R cycle-Pure Kit试剂盒纯化回收待用。
1.2.3 c-Myc基因克隆到pET-3C载体上将c-Myc基因片段和pET-3C质粒经限制性内切酶NdeⅠ和BamHⅠ双酶切后,经连接酶于16 ℃连接30min,连接产物采用42℃热激法转化感受态DH5α,于含有100 mg/L氨苄青霉素抗性的LB选择平板上筛选转化子,37 ℃,倒置培养12~16 h。次日挑取平板上单个圆润菌落进行菌落PCR鉴定和酶切鉴定。
1.2.4 序列测定将双酶切鉴定正确的质粒命名为pET3C-Myc并送广州艾基基因合成公司测序分析。
1.2.5 小鼠c-Myc原核表达载体的构建取经测序正确的重组菌提取质粒, 将提取的质粒取1μl经42℃热激法转化感受态Rosetta (DE3), 于含100mg/L的氨苄青霉素和34mg/L氯霉素抗性的LB平板上筛选转化子,37℃培养16h左右,挑取平板上单个大小均一圆润的菌落进行菌落PCR鉴定。
1.2.6 小鼠c-Myc融合蛋白的小量表达挑取经PCR鉴定阳性的单菌落接种到含氨苄青霉素和氯霉素的3 ml LB培养基中,37℃ 180r/min摇床培养过夜后按1%比例接种至新的5 ml LB培养基中,余下的菌液继续培养不加诱导剂作为诱导后的空白对照,实验组37℃ 180r/min培养至菌液OD600达到0.6~1.0时,加入终浓度为1 mmol/L的异丙基硫代-β-D-半乳糖苷 (IPTG) 表达4 h后离心收集菌体。分别取不同菌株的诱导前和诱导后的各1 ml,12 000r/min离心2 min,弃上清,加入80 μl裂解液,悬浮沉淀,再加入20 μl 5×SDS-PAGE loading buffer混匀,100℃于电磁炉上煮沸10 min,13 000r/min离心10min,经10%的SDS-PAGE电泳检测。
1.2.7 Western blot鉴定重组蛋白SDS-PAGE电泳结束后,取SDS-PAGE胶进行转膜,进行Western blot检测。一抗为1:1 000稀释的抗His-tag小鼠单克隆抗体; 二抗为1:1 000稀释的HRP标记的山羊抗小鼠IgG, 最后用ECL曝光液于凝胶成像仪中拍照,检测特异性免疫反应条带。
1.2.8 小鼠c-Myc融合蛋白的可溶性分析将鉴定正确的重组菌诱导表达后离心收集菌体并称量,按菌体与预冷的裂解缓冲液1:20(g/ml) 的质量体积比重悬菌体,使菌体充分悬浮,对重悬的细胞进行超声破碎。选定超声振幅为40%,工作时间5s,间隔5s,工作10min;振幅50%,工作5s,间隔5s,工作10min; 振幅60%,工作5s, 间隔5s, 工作10min。超声结束后,通过镜检观察,在视野范围内观察不到完整细胞结构的大肠杆菌,确认破碎完成。15 000r/min,4℃,30 min离心破碎菌液,收集上清和沉淀进行10%的SDS-PAGE电泳分析。
1.2.9 包涵体的洗涤及变复性将菌体与含1%Triton X-100预冷的裂解缓冲液按1:20(g/ml) 比例,充分混匀后在冰浴下进行超声破碎。15 000r/min,4℃离心30 min离心破碎上清,收集上清和沉淀,用10%的SDS-PAGE做检测。由于沉淀中含有绝大部分目的蛋白,确定c-Myc蛋白是以包涵体的形式表达。收集沉淀进行包涵体洗涤,其洗涤方案参考 (吴美玉毕业论文,rhFGF17在E.coli系统中的表达纯化及其对NIH3T3细胞的增殖活性,温州医科大学,药学院,2016年) 洗涤后称取适量包涵体,加入20倍量 (g/V) 变性液 (25 mmol/L Tris,0.15mol/L NaCl,8mol/L脲pH=7.5),溶解包涵体,充分搅拌均匀后,在磁力搅拌条件下溶解过夜12h以上,离心,20 000r/min,4 ℃,30 min,离心,得包涵体变性液和离心后沉淀。收集上清,去沉淀,并测定沉淀重量。将变性液装入烧杯中,用7倍体积平衡液 (25 mmol/L Tris,0.15mol/L NaCl,6%甘油,pH=7.5),4℃,0.2ml/min磁力搅拌条件下由泵泵入变性液中。稀释复性大约20h。
1.2.10 复性蛋白的镊柱纯化将复性后的上清离心,检测上清和沉淀中是否有目的蛋白,上清中有目的蛋白则可进行下一步纯化。其步骤为:① Ni-NTA琼脂糖凝胶装柱,柱床体积为20ml;②用平衡液平衡5个床体积, 柱床体积为10m;③将复性后上清抽滤后上样,流速为0.2ml/min;收集上样穿出。④用25 mmol/L Tris,0.15mol/L NaCl,(pH7.5) 平衡镍柱5个柱体积以上流速为1ml/min。⑤分别用含20、50、200mmol/L咪唑的缓冲液进行阶段洗脱,流速为1ml/min,收集各阶段洗脱峰, 检测波长为280nm,用10%SDS-PAGE检测目的蛋白大小和洗脱的纯度;⑥再生:25 mmol/L Tris,0.15mol/L NaCl,500mmol/L咪唑 (pH7.5) 再生至少5个柱体积 (收峰);⑦平衡:可用水置换咪唑,3个柱床及以上。
2 结果 2.1 目的基因c-Myc的扩增载体构建及测序鉴定TetO-FUW-OSKM质粒经过PCR扩增和DNA凝胶电泳后,可得到大约1 400bp的片段,与预期的结果一致。将c-Myc基因PCR产物和pET3C载体经NdeⅠ和BamHⅠ双酶切后用连接酶SolutionI 16℃连接30min,经氨苄青霉素抗性筛选出候选阳性重组子进行PCR鉴定 (图 1),经琼脂糖凝胶电泳后阳性菌落可见1 400bp左右的条带,大小与阳性对照一致,并小量提取质粒经NdeⅠ和BamHⅠ双酶切后得到了1 400bp目的片段和载体大片段 (图 2),与预期一致,证明c-Myc基因已克隆进pET3C载体中。并将该鉴定阳性的甘油菌送往广州艾基基因合成公司测序,测序结果表明所克隆的基因与原序列一致。
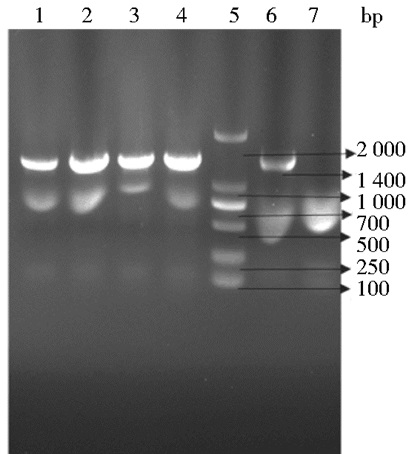
|
| 图 1 重组载体的菌落PCR鉴定 Figure 1 PCR products for recombinant plasmid colony 1~4:PCR products for positive colony; 5: Marker DL 2 000; 6: PCR products for positive control; 7: Negative control |
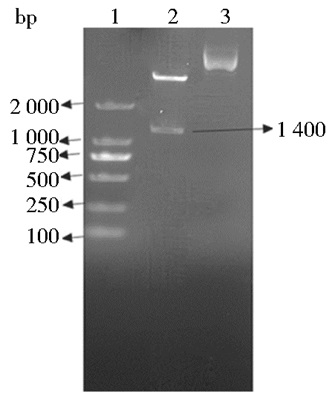
|
| 图 2 双酶切鉴定阳性重组质粒 Figure 2 NdeⅠ and BamHⅠ digestion of recombinant plasmid 1: Marker DL15 000; 2: Enzyme digestion of recombinant plasmid; 3: Recombinant plasmid without digestion |
将阳性重组质粒转入Rosetta (DE3) 大肠杆菌表达菌株,以终浓度为1mmol/L的IPTG诱导4 h后经10%的SDS-PAGE分析,与诱导前对照相比可见明显的蛋白表达条带,分子量约为64kDa左右 (图 3)。与相关文献中提到的分子量大小一致,表明重组蛋白得到了表达。以未诱导的重组菌为阴性对照,以购自碧云天小鼠c-Myc蛋白为阳性对照,加入IPTG诱导后的不同菌株,通过Western blot对重组菌表达蛋白进行鉴定分析。结果显示,所表达的蛋白与阳性对照有相同的特异性免疫反应,阴性对照没有条带,证明表达为c-Myc蛋白 (图 4)

|
| 图 3 融合蛋白的诱导表达 Figure 3 Induction and expression of fusion protein M: Protein Marker; 1:Uninduction; 2~4:Induction for different clones |
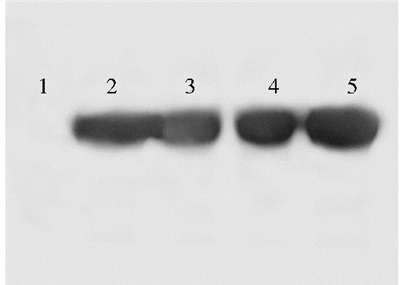
|
| 图 4 c-Myc蛋白的Western blot鉴定 Figure 4 Expression of c-Myc analyzed by Western blot 1: Uninduction; 2~4: Inducted of different clones; 5:Positive control |
诱导表达后收集菌体,经超声破碎后分别取上清和沉淀进行10%的SDS-PAGE电泳,结果发现融合蛋白以包涵体的形式存在于裂解后的沉淀中 (图 5),证明c-Myc蛋白以包涵体的形式在重组载体中表达。
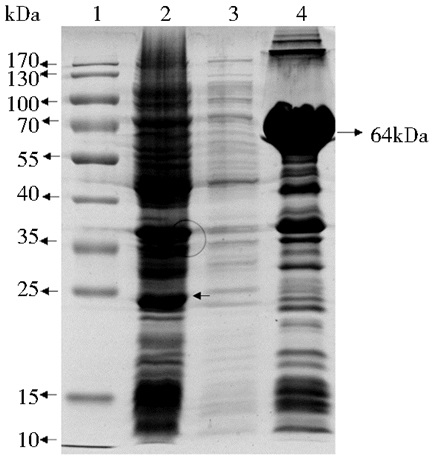
|
| 图 5 重组蛋白的可溶性分析 Figure 5 Analysis the solubility and insolubility for recombinant protein 1: Protein Marker; 2:Uninduction; 3:Induced supermatant; 4:Induced pellet |
破碎后收集的包涵体沉淀中c-Myc蛋白的含量虽然很高,但存在许多杂蛋白,因此需要对包涵体进行洗涤。经过3次洗涤3次离心后,分别取每次的上清和沉淀进行10% SDS-PAGE电泳。结果显示,洗涤后目的蛋白仍在沉淀中,并可洗去部分杂蛋白使包涵体更纯净 (图 6)。
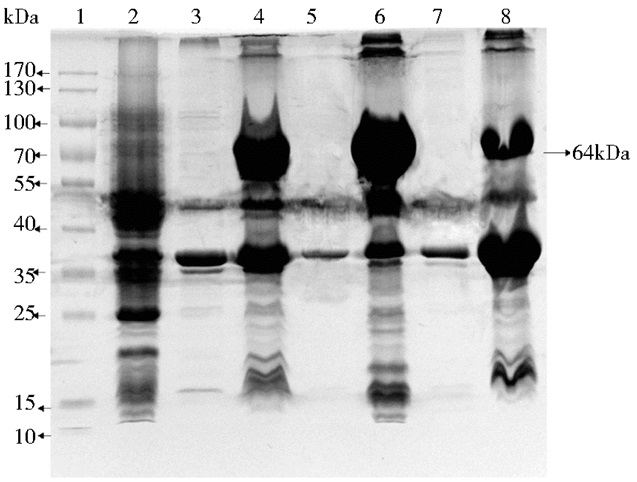
|
| 图 6 包涵体洗涤的SDS-PAGE分析 Figure 6 Washing of the inclusion body protein 1:Protein marker; 2:Uninduction; 3: Supernatant for the first time washing; 4:Pellet for the first time washing; 5: Supernatant for the second time washing; 6: Pellet for the second time washing; 7:Supernatant for the third time washing; 8: Pellet for the third time washing |
洗涤后的包涵体经过变性液变性12h后,再经复性液低温缓慢复性后进行10%的SDS-PAGE电泳,跑胶后的条带可以看到目的蛋白在复性液中 (图 7),此时可以进行下一步镍柱洗脱纯化。
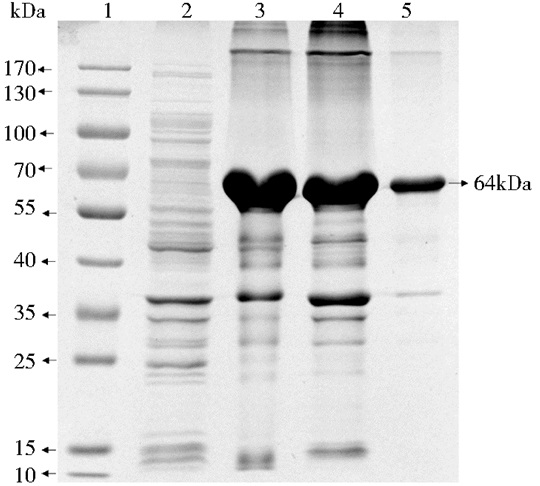
|
| 图 7 融合蛋白的变复性分析 Figure 7 Renaturation analysis of fusion protein 1:Protein marker; 2:Uninduction; 3:Denatured supernatant; 4:Denatured precipitate; 5:Renaturated supernatant |
以0.2 ml/min的流速上样于事先用平衡缓冲溶液平衡好的镍亲和层析柱中。以1ml/min的流速采用20mmol/L, 50mmol/L, 200mmol/L, 500mmol/L浓度的咪唑缓冲液梯度洗脱蛋白。将上样穿出和各个浓度的洗脱峰收集进行10% SDS-PAGE分析 (图 8)。可以看出,经软件扫描蛋白纯度已达90%以上,下一步优化纯化条件,可获得更纯净蛋白产物。

|
| 图 8 c-Myc蛋白纯化SDS-PAGE分析 Figure 8 SDS-PAGE analysis of c-Myc protein purification 1:Protein marker; 2:Renaturated supernatant; 3: Sample out; 4:20 mmol/L imidazole elution; 5: 20mmol/L imidazole elution; 6: 50mmol/L imidazole elution; 7: 200mmol/L imidazole elution; 8: 200mmol/L imidazole elution; 9: 200mmol/L imidazole elution; 10:500 mmol/L imidazole elution |
自2006年日本科学家利用4种重编程因子诱导体细胞成多能干细胞 (iPS) 后,各种诱导多能干细胞的方案相继发表。由于其来源于自身体细胞,无需破坏胚胎组织,而不涉及伦理学问题,诱导的多能干细胞可以定向分化,产生的子细胞可以自体移植且不存在免疫反应为以后的再生医学及临床应用提供了无限可能。使用慢病毒,腺病毒,逆转录病毒等方法[12-13]制备iPS的最大风险就是容易导致外源基因整合到宿主细胞基因组上,导致基因突变,形成的iPS有潜在的致瘤风险。使用病毒载体转染外源基因有可能引发肿瘤形成,此外,每次实验前都要重新制作新的病毒载体,对操作过程和实验室的管理要求很严格,这就阻碍了iPS细胞技术的普及[14]。而通过蛋白诱导iPS,由于不涉及宿主细胞的基因组改变,只是通过把蛋白导入细胞启动细胞的重编程程序,操作简单方法安全,为以后iPS技术真正走向临床打下了坚实基础。而c-Myc蛋白被认为是一种核相关蛋白,在维持胚胎生物学特性及诱导多能干细胞形成方面发挥重要作用。已有研究证明c-Myc蛋白是一种富含脯氨酸磷酸化的核蛋白,和核DNA特异性结合,调控细胞增殖与凋亡等过程。从c-Myc基因序列分析,具有439个氨基酸的c-Myc蛋白的理论分子量应为49kDa, 但经SDS-PAGE分析却有一条大概64kDa左右的蛋白双体。有文献报道称将外源基因c-Myc导入细菌内表达的也是蛋白双体[15]。
本研究以TetO-FUW-OSKM质粒为模板扩增出c-Myc基因片段,根据PCR原理,在c-Myc基因的5′端引入NdeⅠ酶切位点和6×His标签,3′端加入BamHⅠ酶切位点,成功合成融合基因,通过双酶切连接到克隆载体pET-3C上。大肠杆菌常常作为表达重组蛋白的首选实验系统,因为大肠杆菌具有操作简单,生长繁殖快,遗传背景相当了解,容易发酵培养等优点[16]。在表达融合蛋白时,最先选择的是BL21(DE3) 表达菌株,但经过IPTG诱导,SDS-PAGE分析后,并没有看到诱导后的新增条带。经密码子分析后确定基因序列中存在许多稀有密码子,阻碍了蛋白的翻译过程,于是用重组质粒重新转化Rosseta (DE3) 表达菌株,经过IPTG诱导和SDS-PAGE电泳后,能明显地看到诱导后的新增条带,表明融合基因得到了表达。在采取稀释复性蛋白的时候,复性液流加到变性液中的速度一定要慢。如果复性液加入到变性液中的速度过快,变性蛋白容易形成絮状沉淀,蛋白的复性过程是通过逐渐降低变性液的浓度,使变性的蛋白处于复性的蛋白中间状态使其有足够的时间恢复到正确的天然构象,为柱上纯化得到有活性的蛋白打好基础。本文的研究为其应用于iPS的后续研究打下了基础。
我们将在此基础上,通过对比实验探索一种更好的蛋白作用方式,如在蛋白N端增加穿膜肽,以增加其透过细胞膜吸收的能力,再如由11个精氨酸残基组成的细胞穿膜肽 (CPP)、由9个精氨酸组成的CPP或人免疫缺陷病毒编码的反式激活蛋白 (HIV-TAT) 介导的蛋白跨膜肽。
| [1] | Neel B G, Suresh C, Jhanwar R S, et al. Two human C-onc genes are located on the long arm of chromosome8. Proceedings of the National Academy of Science, 1982, 79 : 7842–7846. DOI:10.1073/pnas.79.24.7842 |
| [2] | Jim B, Christopher M, Rebecca T, et al. The human c-Myc oncogene:Structural consequence of translocation into the igh locus in Byrkitt lymphoma. Cell, 1983, 34(3) : 779–787. DOI:10.1016/0092-8674(83)90534-2 |
| [3] | 石晶, 石爱海. 端粒、端粒酶、c-myc与肿瘤. 临床口腔医学杂志, 2004, 20(1) : 61–62. Shi J, Shi A H. Telomere, telomerase, c-Myc and tumor. Jounal of Clinical Stomatology, 2004, 20(1) : 61–62. |
| [4] | Cartwright P, McLean C, Sheppard A, et al. LIF/STAT3 controls ES cell self-renewal and pluripotency by a Myc-dependent mechanism. Development, 2005, 132(5) : 885–896. DOI:10.1242/dev.01670 |
| [5] | De Sauvage F J, Carver-Moore K, Luoh S M, et al. Physiological regulation of early and late stages of megakaryocytopoiesis by thrombopoietin. J Exp Med, 1996, 183(2) : 651–656. DOI:10.1084/jem.183.2.651 |
| [6] | Kaushansky K, Drachman J G. The molecular and cellular biology of thrombopoietin:the primary regulator of platelet production. Oncogene, 2002, 21 : 3359–3367. DOI:10.1038/sj.onc.1205323 |
| [7] | Davis A C, Wires M, Spotts G D, et al. A null c-Myc mutation causes lethality before 10.5 days of gestation in homozygotes and reduced fertility in heterozygous female mice. Genes & Development, 1993, 7(4) : 671–682. |
| [8] | 孙慧慧, 朴敬爱, 李文哲, 等. 原核表达c-Myc蛋白的多克隆抗体制备. 安微农学报, 2011, 17(1) : 56–58. Sun H H, Pu J A, Li W Z, et al. prokaryotic expression of C-Myc protein and preparation for polyclonal antibody. Anhui Agricultural Science Bulletin, 2011, 17(1) : 56–58. |
| [9] | Fernandez P C, Frank S R, Wang L, et al. Genomic targets of the human c-Myc protein. Genes Dev, 2003, 17(9) : 1115–1129. DOI:10.1101/gad.1067003 |
| [10] | Pera M F, Hasegawa K. Simpler and safer cell reprogramming. Nat Biotechnol, 2008, 26(1) : 59–60. DOI:10.1038/nbt0108-59 |
| [11] | 杨阳, 刘斌, 庞卯, 等. 蛋白诱导诱导多能干细胞技术的研究进展. 中华生物医学工程杂志, 2013, 19(3) : 249–252. Yang Y, Liu B, Pang M, et al. The research progress of protein induced pluripotent stem cells. Chin J Biomed Eng, 2013, 19(3) : 249–252. |
| [12] | Liao J, Cui C, Chen S, et al. Generation of induced pluripotent stemcelllines from adult rat cells. Cell Stem Cell, 2009, 4 : 11–15. DOI:10.1016/j.stem.2008.11.013 |
| [13] | Yung S K, Tilgner K, Ledran M H, et al. Brief report:human pluripotent stem cell models of fanconi anemia deficiency revealan important role for fanconi anemia proteins in cellular reprogramming and survival of hematopoietic progenitors. Stem Cells, 2013, 31 : 1022–1029. DOI:10.1002/stem.v31.5 |
| [14] | 马海滨, 侯玲玲, 王晓宇, 等. 诱导性多潜能干细胞 (IPS细胞) 的研究进展. 中国生物工程杂志, 2011, 31(8) : 124–132. Ma H B, Hou L L, Wang X Y, et al. The progress of induced pluripotent stem cell (ips cells). China Biotechnology, 2011, 31(8) : 124–132. |
| [15] | Evan G I, Hancock D C. Studies on the interaction of the human c-myc protein with cell nuclei:p62c-myc as a member of a discrete subset of nuclear proteins. Cell, 1985, 43(1) : 253–261. DOI:10.1016/0092-8674(85)90030-3 |
| [16] | 王伟, 孟超, 朱平, 等. 绿色荧光蛋白标记的表达载体p-His EGFP的构建. 中国生物工程杂志, 2005, 25(9) : 35–39. Wang W, Meng C, Zhu P, et al. Construction of an expression vector pHis-EGFP with the enhanced green fluorescent protein (EGFP) gene. China Biotechnology, 2005, 25(9) : 35–39. |
 2017, Vol. 37
2017, Vol. 37




