文章信息
- 王小莉, 余庆, 袁雅红, 腾智平, 李东升, 曾毅.
- WANG Xiao-li, YU Qing, YUAN Ya-hong, TENG Zhi-ping, LI Dong-sheng, ZENG Yi.
- 打靶恒河猴CD4+ T细胞的TRIM5α基因影响其感染HIV的能力
- Targeting TRIM5α Gene of CD4+ T cells of Macaca mulatta Affect Their Ability on HIV Infection
- 中国生物工程杂志, 2017, 37(2): 15-19
- China Biotechnology, 2017, 37(2): 15-19
- http://dx.doi.org/DOI:10.13523/j.cb.20170203
-
文章历史
- 收稿日期: 2016-08-12
- 修回日期: 2016-10-13
2. 湖北医药学院附属太和医院生命科学研究所 十堰 442000;
3. 中国预防医学科学院病毒所 北京 100052
2. Life Science Institute, Affiliated Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China;
3. Institute of Virology, Chinese Academy of Preventive Medicine, Beijing 100052, China
目前,艾滋病治疗在药物方面虽然取得了进展,如鸡尾酒疗法,延长了感染者的生存时间和生存质量,但是HIV感染者体内的病毒却没有被彻底清除,此外药物治疗的副作用及HIV的耐药性问题也没有得到解决[1]。研制安全有效的疫苗是对付传染性疾病最有效的方法,但至今仍然没有找到有效的艾滋病疫苗[2]。不管是艾滋病药物的开发还是疫苗的研制都离不开合适的动物模型。非人灵长类动物的基因组和生理代谢功能与人极为接近,已成为重大疾病研究和生物医药开发的重要实验动物,但HIV病毒不能有效地在其体内复制[3]。最主要原因就是非人灵长类动物体内存在天然的抗逆转录病毒的固有免疫限制因子。TRIM5α是TRIM (Tripartite motif protein) 家族成员之一,是目前发现的最主要的种属特异性固有免疫因子之一,也是HIV进入感染细胞最先遇到的限制性因子[4]。TRIM5α包含4个主要的结构域,即RING、B-box、coiled-coil以及B30.2结构域,主要以散在形式存在于细胞质中,还能形成细胞质小体。它对HIV-1的限制性作用主要是通过B30.2结构域识别并与HIV-1的衣壳蛋白多聚体结合,从而发挥限制性作用[5-7]。非人灵长类动物的TRIM5α基因对HIV病毒的抵抗作用已被多篇文献报道[8-10],但是否敲除非人灵长类动物的TRIM5α基因就能使其感染HIV病毒,目前还未见相关报道。基因编辑新技术的快速发展,使得可快速精确地对基因进行定向修饰[11]。TALEN (Transcription activator-like effector nuclease) 是一类能够产生与靶位点特异性结合的位点特异性DNA损伤的人工酶,目前已经成为多种生物靶基因中断的重要工具并成功运用于多种动物模型和人类细胞的基因组编辑[12]。本研究利用基因编辑技术TALEN对恒河猴的CD4+ T细胞中的TRIM5α基因进行基因编辑,探讨恒河猴的TRIM5α基因编辑对恒河猴CD4+ T细胞感染HIV能力的影响,为进一步建立非人灵长类HIV感染动物模型奠定基础。
1 材料与方法 1.1 材料100bp DNA marker、基因组提取试剂盒、PCR mix (天根生化技术有限公司);Opti-MEM、RPMI-1640、胎牛血清 (Gibco公司);TALEN试剂盒 (斯丹塞生物技术有限公司);1.077 g/ml Ficol1人淋巴细胞分离液 (天津灏洋生物公司);PE-CD4抗体 (AbD Serotec公司);MidiMACS分选器、LS分选柱、Anti-PE Microbeads (Milteny Biotec公司);重组IL-2、IL-7、IL-15、CD3单克隆抗体、CD28单克隆抗体 (R & D公司);HIV p24 ELISA试剂盒 (Clontech公司);恒河猴外周血 (湖北天勤猕猴繁育生物科技公司)。
1.2 方法 1.2.1 恒河猴CD4+ T淋巴细胞的分选向恒河猴的外周血中按1:5的比例加入分离缓冲液,并将稀释后的外周血按1:1的比例加到1.077 g/ml的Ficol1人淋巴细胞分离液中,经密度梯度离心,收集PBMC层,PBS洗涤3次,重悬计数。加入PE-CD4抗体混匀,4℃孵育30 min,PBS洗涤2次除去未结合的抗体。加入Anti-PE Microbeads混匀,4℃孵育15 min,PBS洗涤2次。将LS柱安装到MidiMACS分选器上加入buffer润洗柱子,将上述细胞加入LS柱中进行磁性分选,加入缓冲液洗去未结合的细胞,将柱子取下收集结合到柱子上的CD4+细胞。分选得到的CD4+ T淋巴细胞通过流式细胞仪检测分选纯度。人外周血由十堰市太和医院提供并且患者知情同意,人外周血中CD4阳性细胞的分选与恒河猴CD4+ T细胞分选的方法相同。
1.2.2 细胞培养分选的CD4+ T细胞加入含2μg/ml CD3单克隆抗体、1μg/ml CD28单克隆抗体、5ng/ml重组IL-7、10ng/ml重组IL-15、在含10%胎牛血清的RPMI-1640培养基中,37℃,5% CO2培养箱中培养。
1.2.3 TALEN质粒打靶细胞及分选根据TRIM5α基因序列设计打靶位点,按TALEN试剂盒说明书构建TRIM5α TALEN左右臂质粒。将10μg TRIM5α TALEN质粒 (左右臂质粒各5μg) 与90 μl含1×106 CD4+ T细胞的Opti-MEM混合,150 V电击5 s后将细胞转移至24孔板中,37℃,5% CO2培养箱中培养。TALEN右臂质粒中含有GFP,电转两天后通过流式细胞仪分选出GFP阳性的细胞。
1.2.4 T7E1酶切经流式细胞仪分选得到的电转TALEN质粒的CD4+ T细胞提基因组。根据TRIM5α打靶位点两端的序列设计PCR上游引物:5′-GACACTGGCTCCAAACA -3′,下游引物:5′-TCTACGAAAACTCCAACAC -3′。PCR反应条件为:95℃ 5 min;95℃ 10 s,56℃ 30 s,72℃ 1 min,30个循环,72℃延长10 min。基因组PCR产物37℃ T7E1酶切30 min后琼脂糖凝胶电泳检测打靶效率。
1.2.5 病毒感染HIV-1NL4-3病毒株来源于美国NIH AIDS Research and Reference Reagent Program,将CD4+ T细胞和打靶分选得到的CD4+ T细胞培养2天后,向培养细胞中加入MOI=50的HIV-1NL4-3病毒4h后,PBS洗3遍除去未感染的病毒并加入新鲜培养基,每隔3天收集培养上清,按HIV p24 ELISA试剂盒说明书进行检测,共培养15天,每个时间点重复3次。
2 结果 2.1 恒河猴CD4+ T淋巴细胞的分选按1.2.1的方法分选出恒河猴CD4+ T淋巴细胞,分选后的细胞立刻用于流式细胞仪检测分选的阳性率。流式细胞仪检测的结果如图 1所示,恒河猴外周血单核细胞中CD4+ T淋巴细胞的比例约为10%,经过分选得到的恒河猴CD4+ T淋巴细胞的阳性率大于99%。结果表明,通过磁珠阳性分选成功获得了高纯度的恒河猴CD4+ T淋巴细胞。
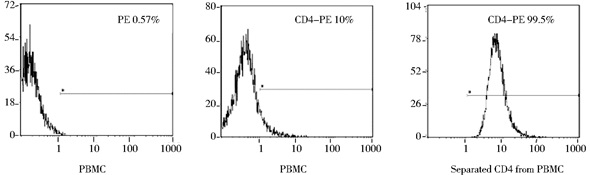
|
| 图 1 流式检测恒河猴CD4+ T淋巴细胞的阳性率 Figure 1 Detection of the positive rate of the separated CD4+ T cells from Macaca mulatta by flow cytometry |
按TALEN试剂盒说明书构建打靶恒河猴CD4+ T淋巴细胞TRIM5α基因的TALEN左右臂质粒,将TALEN质粒电转到通过分选得到的恒河猴CD4+ T淋巴细胞。由于构建的TALEN右臂质粒中含有GFP,因此电转24h后可通过荧光显微镜观察电转情况,结果如图 2a所示。流式检测电转后含GFP细胞的阳性率为24.8%,结果如图 2b所示。
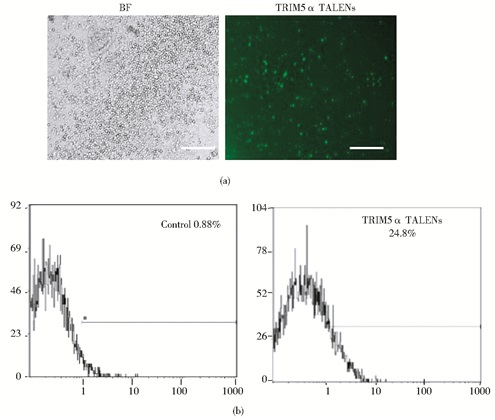
|
| 图 2 TALENs转染CD4+ T淋巴细胞 Figure 2 Transfection TALENs into the CD4+ T cells (a) Detection of GFP fluorescence of the TALENs by Fluorescence microscope (scale bar: 100 μm) (b) Analysis of the percentage of TALENs transduced CD4+ T lymphocytes by FACS |
电转TALEN质粒的恒河猴CD4+ T淋巴细胞通过流式细胞仪分选出GFP阳性的细胞。将此细胞提取基因组按1.2.4的方法PCR扩增打靶位点附近的基因组序列并用T7E1酶切检测打靶效率,结果如图 3所示。结果表明,构建的TALEN质粒可成功打靶恒河猴CD4+ T淋巴细胞的TRIM5α基因,灰度分析打靶效率约为40%。
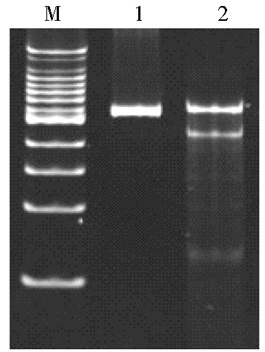
|
| 图 3 T7E1酶切检测TALEN打靶TRIM5α基因的效率 Figure 3 Detection the TALEN targeting efficiency of TRIM5α by T7E1 enzyme digestion M: 100bp DNA marker; 1: The PCR product of the genomes of CD4+ T cells digested with T7E1 enzyme; 2: The PCR product of the genomes of TALEN transduced CD4+ T cells digested with T7E1 enzyme |
将上述流式细胞仪分选出的GFP阳性打靶细胞、未打靶的恒河猴CD4+ T淋巴细胞和人CD4+ T淋巴细胞按1.2.5的方法感染HIV-1病毒。每隔3d收集感染细胞的上清液按ELISA试剂盒说明书检测p24的量,结果如图 4所示。未打靶的恒河猴CD4+ T淋巴细胞不能感染HIV病毒,而通过打靶TRIM5α基因的恒河猴CD4+ T淋巴细胞对HIV-1的感染能力明显增强,但感染能力低于人CD4+ T淋巴细胞对HIV-1的感染能力。结果表明,打靶恒河猴CD4+ T淋巴细胞的TRIM5α基因可增加其对HIV-1病毒的易感性,但感染能力弱于人CD4+ T淋巴细胞。

|
| 图 4 TALEN打靶CD4+ T淋巴细胞TRIM5α对HIV-1感染能力的影响 Figure 4 The influence of targeting TRIM5α of CD4+ T cell from Macaca mulatta by TALEN |
HIV病毒是一种感染人类免疫系统细胞的逆转录病毒,它选择性地侵犯带有CD4分子的免疫细胞,可引起人体CD4+ T淋巴细胞持续性地减少和细胞免疫缺陷,通常伴有机会性感染,恶性肿瘤以及神经损伤等症状,最终发展为艾滋病。艾滋病的研究迫切需要能够被HIV病毒直接感染的动物模型。灵长类动物的免疫系统与人类具有高度的相似性,我国拥有的灵长类动物资源,利用先进的基因编辑技术使建立HIV病毒易感的灵长类动物模型成为可能。HIV病毒不能直接感染动物模型,其首要原因就是很多固有免疫分子在不同物种中的进化限制了病毒的跨种间传播[13]。非人灵长类动物体内存在TRIM5α、APOBEC3G、BST-2、SERINC3/5等多种天然的抗逆转录病毒的固有免疫限制因子,TRIM5α是目前发现的最主要的种属特异性固有免疫因子之一[14]。目前对TRIM5α基因改造方面的研究主要集中在如何将人的TRIM5α基因改造使其具有抵御HIV病毒感染的能力[15-16]。如将人TRIM5α332位上的精氨酸代替B30.2区域脯氨酸,能产生对HIV-1和SIVmac有很强抑制活性的TRIM5α R332P蛋白,TRIM5α 332位上的精氨酸能够调节CA的结合和TRIM5α蛋白的活性[17]。对猴子TRIM5α进行基因改造能否使其易感HIV病毒方面的研究报道非常少。本研究首先通过磁珠阳性分选从恒河猴外周血中成功分离获得了HIV病毒感染的靶细胞CD4+ T淋巴细胞。由于TRIM5α对HIV-1的限制性作用主要通过B30.2结构域发挥限制性作用,因此本实验针对TRIM5α的B30.2结构域设计打靶TRIM5α的TALEN左右臂。由于直接化学转染将TALEN转入猴CD4+ T细胞的转染效率非常低,通常小于1%,本实验通过电转的方法成功地将TALEN质粒转入细胞,经流式检测转染效率大于20%。经T7E1酶切鉴定分析,结果表明利用TALEN基因编辑技术成功打靶了恒河猴CD4+ T淋巴细胞的TRIM5α基因。HIV-1病毒感染实验结果表明,打靶恒河猴CD4+ T淋巴细胞的TRIM5α基因可使其感染HIV病毒,但其感染能力弱于人CD4+ T淋巴细胞。这可能是由于TALEN打靶的细胞中还可能存在一些无义突变使恒河猴TRIM5α基因的功能并未被全部破坏,也有可能是因为恒河猴体内的其它限制性因子也存在一定的限制性作用,具体影响因素还需做进一步的研究确定。本研究结果表明打靶恒河猴TRIM5α基因可使恒河猴CD4+ T淋巴细胞对HIV-1的感染能力增强,将为进一步研究建立非人灵长类动物HIV病毒感染的动物模型奠定理论基础。
| [1] | Richman D D, Margolis D M, Delaney M, et al. The challenge of finding a cure for HIV infection. Science, 2009, 323(5919) : 1304–1307. DOI:10.1126/science.1165706 |
| [2] | Le Grand R, Bosquet N, Dispinseri S, et al. Superior efficacy of an HIV vaccine combined with ARV prevention in SHIV challenged non-human primates. J Virol, 2016, 90(11) : 5315–5328. DOI:10.1128/JVI.00230-16 |
| [3] | Antony J M, Macdonald K S. A critical analysis of the cynomolgus macaque, Macaca fascicularis, as a model to test HIV-1/SIV vaccine efficacy. Vaccine, 2015, 33(27) : 3073–3083. DOI:10.1016/j.vaccine.2014.12.004 |
| [4] | Jia X, Zhao Q, Xiong Y. HIV suppression by host restriction factors and viral immune evasion. Curr Opin Struct Biol, 2015, 31 : 106–114. DOI:10.1016/j.sbi.2015.04.004 |
| [5] | Evans M E, Kumkhaek C, Hsieh M M, et al. TRIM5alpha variations influence transduction efficiency with lentiviral vectors in both human and rhesus CD34(+) cells in vitro and in vivo. Mol Ther, 2014, 22(2) : 348–358. DOI:10.1038/mt.2013.256 |
| [6] | Campbell E. Are we done monkeying around with TRIM5alpha?. Mol Ther, 2014, 22(6) : 1072–1073. DOI:10.1038/mt.2014.74 |
| [7] | Stremlau M, Owens C M, Perron M J, et al. The cytoplasmic body component TRIM5alpha restricts HIV-1 infection in old world monkeys. Nature, 2004, 427(6977) : 848–853. DOI:10.1038/nature02343 |
| [8] | Nakayama E E, Shioda T. TRIM5alpha and species tropism of HIV/SIV. Front Microbiol, 2012, 3 : 13. |
| [9] | Mccarthy K R, Kirmaier A, Autissier P, et al. Evolutionary and functional analysis of old world primate TRIM5 reveals the ancient emergence of primate lentiviruses and convergent evolution targeting a conserved capsid Interface. PLoS Pathog, 2015, 11(8) : e1005085. DOI:10.1371/journal.ppat.1005085 |
| [10] | Puvvada M P, Patel S S. Role of trim5alpha in the suppression of cross-species transmission and its defence against human immunodeficiency virus. Curr HIV Res, 2013, 11(8) : 601–609. |
| [11] | Mussolino C, Alzubi J, Fine E J, et al. TALENs facilitate targeted genome editing in human cells with high specificity and low cytotoxicity. Nucleic Acids Res, 2014, 42(10) : 6762–6773. DOI:10.1093/nar/gku305 |
| [12] | Wei C, Liu J, Yu Z, et al. TALEN or Cas9——rapid, efficient and specific choices for genome modifications. J Genet Genomics, 2013, 40(6) : 281–289. DOI:10.1016/j.jgg.2013.03.013 |
| [13] | Malim M H, Bieniasz P D. HIV restriction factors and mechanisms of evasion. Cold Spring Harb Perspect Med, 2012, 2(5) : a006940. |
| [14] | Harris R S, Hultquist J F, Evans D T. The restriction factors of human immunodeficiency virus. J Biol Chem, 2012, 287(49) : 40875–40883. DOI:10.1074/jbc.R112.416925 |
| [15] | Richardson M W, Guo L, Xin F, et al. Stabilized human TRIM5alpha protects human T cells from HIV-1 infection. Mol Ther, 2014, 22(6) : 1084–1095. DOI:10.1038/mt.2014.52 |
| [16] | Nakayama E E, Shioda T. Impact of TRIM5alpha in vivo. AIDS, 2015, 29(14) : 1733–1743. DOI:10.1097/QAD.0000000000000812 |
| [17] | Yap M W, Nisole S, Stoye J P. A single amino acid change in the SPRY domain of human Trim5alpha leads to HIV-1 restriction. Curr Biol, 2005, 15(1) : 73–78. DOI:10.1016/j.cub.2004.12.042 |
 2017, Vol. 37
2017, Vol. 37




