文章信息
- 邓义熹, 李继东, 李乐, 蒙国基, 于玉根.
- DENG Yi-xi, LI Ji-dong, LI Le, MENG Guo-ji, YU Yu-gen.
- 添加SNS能显著提高CHT填料使用寿命的研究
- SNS:An Effective Strategy for Extending Ceramic Hydroxyapatite Column Life
- 中国生物工程杂志, 2017, 37(1): 81-88
- China Biotechnology, 2017, 37(1): 81-88
- http://dx.doi.org/DOI:10.13523/j.cb.20170112
-
文章历史
- 收稿日期: 2016-07-25
- 修回日期: 2016-11-12
2. 伯乐生命医学产品(上海)有限公司 广州 510095
2. Bio-Rad Laboratories(Shanghai) Ltd., Shenzhen 510095, China
陶瓷羟基磷灰石(CHT)是目前市场上唯一的无机盐填料,成分为磷酸钙,通过高温加热和烧结,形成一种稳定的、容易装填的羟基磷灰石填料[1]。陶瓷羟基磷灰石层析广泛用于生物分子的分离和纯化[2-3],如疫苗、病毒、酶、抗体和核酸等,不仅可以用于精纯阶段,同样也可以和其他层析技术一起联合使用,甚至可以用于层析工艺中最初的样品捕获阶段[4]。
CHT是一种混合机制的填料,一方面,在其表面的钙离子通过金属螯合的机制可以结合目标分子上的羧基和磷酰基;另一方面,填料表面的磷酸基团可以通过经典的阳离子交换模式与蛋白质等生物分子上的氨基或者其他负电基团结合。由于其优越的去除杂质(如聚合体[5]、宿主蛋白[6]、病毒、内毒素、Protein A和DNA)的性能,CHT填料通常被用于医药工业中药物蛋白的生产和制备[7]。
在工业规模的层析应用上,洗脱步骤中氢原子的释放会很大程度上影响CHT的使用性能。在实际特定工艺条件下,CHT表面的磷酸基团表现出很强的质子化作用[8]。这些质子化的氢离子可被流动相中的其他阳离子替代,如氯化钠中的钠离子。当流动相中阳离子浓度不断增加时(如从低盐到高盐的梯度洗脱),基团上的氢离子会逐步释放到流动相中去,使溶液的pH出现短暂的降低[9],如果长期暴露于低pH条件下,CHT的钙离子会流失,造成填料的性能降低[10-11]。
基于以上原理,在实际工艺过程中可在洗脱步骤前引入表面中和体系(surface neutralization system,SNS),即增加一个在中性pH条件用于去除氢离子的步骤,通过改善pH降低的程度来保护填料。本文先通过筛选得到适用的SNS条件,再通过实验研究得到不同规格层析柱压力变化趋势、钙离子流失、pH变化等数据,表明添加SNS可以显著提高CHT填料的使用寿命;同时,将CHT填料应用于一种单克隆抗体的精纯步骤,结果表明,增加SNS不影响单克隆抗体在CHT填料上的载量、质量及杂质的残留量。
1 材料与方法 1.1 材料CHT(Ⅰ型80μm)填料,EasyPack100/600层析柱,NGC Discover层析系统,Skid00层析系统购自美国伯乐公司;Tricorn10/100、XK16、XK26、XK50层析柱,AKTA Avant层析系统均购自GE医疗;Epoch微孔板分光光度计(BioTek)、钙离子检测诊断试剂盒QuantiChrom Calcium Assay Kit(BioAssay)、DNA检测试剂盒resDNA SEQTM(Applied Biosystems)、CHO细胞宿主蛋白检测试剂盒(CYGNUS)、Protein A酶联检测试剂盒(ArrayBridge)、其他化学试剂均通过商业途径购买;WLB304单克隆抗体样品由万乐药业有限公司生产。
1.2 SNS溶液的筛选 1.2.1 不同SNS溶液对层析过程的影响CHT层析一般工艺步骤包括预平衡、平衡、上样、淋洗、洗脱、再生等,如表 1所示。实验在洗脱步骤前分别设计加入A、B、C、D 4种不同的SNS缓冲溶液,做对比研究,见表 2。实验选用1.0cm×10cm规格的CHT层析柱,按照表 1工艺流程在洗脱前分别加入上述4种不同的溶液,并观察层析过程中pH的变化。
| 序号 | 步骤 | 溶液 | 体积(CV) |
| 1 | 预平衡 | 500mmol/L NaPi,pH6.8 | 3 |
| 2 | 平衡 | 10mmol/L NaPi,pH7.2 | 5 |
| 3 | 上样 | — | |
| 4 | 淋洗 | 10mmol/L NaPi,pH7.2 | 3 |
| 5 | SNS | 5mmol/L NaPi,20mmol/L Tris-HCl,20mmol/L NaCl,pH7.8 | 5 |
| 6 | 洗脱 | 10mmol/L NaPi,700mmol/L NaCl,pH7.2 | 7 |
| 7 | 再生 | 500mmol/L NaPi,pH6.8 | 3 |
| 8 | CIP | 1mol/L NaOH | 3 |
| 编号 | 溶液 |
| A | 5mmol/L NaPi,20mmol/L Tris-HCl,pH7.4 |
| B | 5mmol/L NaPi,20mmol/L Tris-HCl,20mmol/L NaCl,pH7.4 |
| C | 5mmol/L NaPi,20mmol/L Tris-HCl,20mmol/L NaCl,pH7.8 |
| D | 10mmol/L NaPi,pH7.2(空白对照) |
1.2.2 SNS对CHT填料钙流失量的影响
实验选用1.6cm×8cm规格的层析柱,SNS溶液为1.2.1 步骤中得到的最佳溶液,按照表 1的工艺流程设计对照实验(表 3) ,实验过程中分别收集平衡、SNS、洗脱和再生步骤的流穿液,通过用钙离子检测试剂盒检测其钙流失率来考察CHT层析过程中各步骤钙流失的变化。
| 序号 | SNS溶液 |
| 实验组 | 20mmol/L Tris-HCl,5mmol/L NaPi,20mmol/L NaCl,pH7.8 |
| 对照组 | N/A |
同时,在添加SNS溶液实验组条件下,连续重复运行CHT工艺方案200次,收集每个循环的洗脱液,比较每个循环钙流失量的变化。
1.3 SNS对层析工艺的影响 1.3.1 SNS对填料载量的影响在实际工艺生产中填料的载量和寿命直接影响生产成本,本实验选用1.0cm×10cm规格的层析柱,在洗脱前添加SNS溶液连续循环运行200次,测定每50次时的动态载量,研究添加SNS对CHT动态载量的影响,具体参数见表 4。
| 参数 | 数值 |
| 样品浓度 | 2.58mg/ml |
| 穿透终点 | 10% |
| 保留时间(RT) | 6min |
| SNS溶液 | 5mmol/L NaPi,20mmol/L Tris-HCl,20mmol/L NaCl,pH7.8 |
1.3.2 SNS对小试规模的CHT层析过程中压力和pH变化的影响
层析柱在使用过程中,往往因为所使用的填料的反压过高而达到寿命终点,实验选用1.0cm×10cm规格的层析柱,添加SNS循环运行200次并做空白对照实验,观察并记录洗脱过程中pH和压力,比较添加SNS步骤对CHT层析柱在使用过程中压力和pH的影响。
1.3.3 SNS在CHT层析工艺放大过程中的pH和压力变化将添加SNS的CHT工艺分别逐级放大应用于直径为16mm、26mm、50mm、100mm规模的层析柱中,重复运行20次,观察和记录每个循环使用过程中洗脱步骤的压力和pH的变化。
1.3.4 SNS在放大过程中对WLB304单克隆抗体质量的影响实验选用100mm×600mm的层析柱,CHT装填柱体积为1.6L,工艺中WLB304单克隆抗体的最大上样载量为30g/L。实验组执行表 1的工艺条件,对照组用5CV的10mmol/L NaPi,以pH7.2的溶液替代SNS溶液,实验结果比较洗脱收集得到的单体纯度、回收率,以及DNA、HCP和Protein A残留水平。然后连续稳定运行20次循环,比较抗体质量结果和层析图谱的变化。
2 结果与讨论 2.1 SNS溶液的筛选 2.1.1 不同SNS溶液对层析过程的影响由图 1可以看出,在对照实验中(溶液D),洗脱过程中pH下降幅度最大,最低降至pH5.5,且填料暴露于较低pH条件的时间较长;CHT填料的磷酸基团质子化程度随着pH的升高而降低,所以将SNS溶液的pH提高至7.4(溶液A),洗脱过程中被钠离子置换出来的质子减少,导致pH漂移幅度有所减少,如图中SNS溶液A曲线所示,最低pH仍降至5.7;由于洗脱前CHT表面大部分质子化的基团在SNS步骤中被中和,会使得洗脱过程中可被钠离子置换的质子减少,所以在溶液A的基础上添加20mmol/L NaCl(溶液B),洗脱过程中pH漂移有显著改善;继续提高SNS溶液的pH至7.8(溶液C),洗脱过程中pH在短暂降低后有一定幅度的回升,然后保持在6.7左右。根据pH变化得到不同SNS溶液的效果为:C>B>A。

|
| 图 1 不同SNS对洗脱过程中pH变化的影响 Figure 1 pH excursion during the elution step with different SNS buffers Buffer A: 5mmol/L NaPi,20mmol/L Tris-HCl,pH7.4. Buffer B: 5mmol/L NaPi,20mmol/L Tris-HCl,20mmol/L NaCl,pH7.4; Buffer C: 5mmol/L NaPi,20mmol/L Tris-HCl,20mmol/L NaCl,pH7.8; Control buffer D: 10mmol/L NaPi,pH7.2 |
结果表明,SNS溶液的加入能有效减少pH漂移,适当的提高SNS溶液的pH至略微偏碱性,可以大幅度改善洗脱过程中pH的降低幅度,同时,在SNS溶液中加入一定量的Na+也可以减少pH的波动。推测其原理,首先在于CHT填料在碱性条件下可质子化的程度(或基团数量)降低(溶液A);其次,在含有Na+的SNS条件下,Na+对填料表面预先完成了部分的质子化交换反应,并将游离的H+中和,使得填料在后续的洗脱过程中被Na+置换出的H+数量更少(Buffer B和Buffer C),洗脱pH漂移程度减少,见图 2。
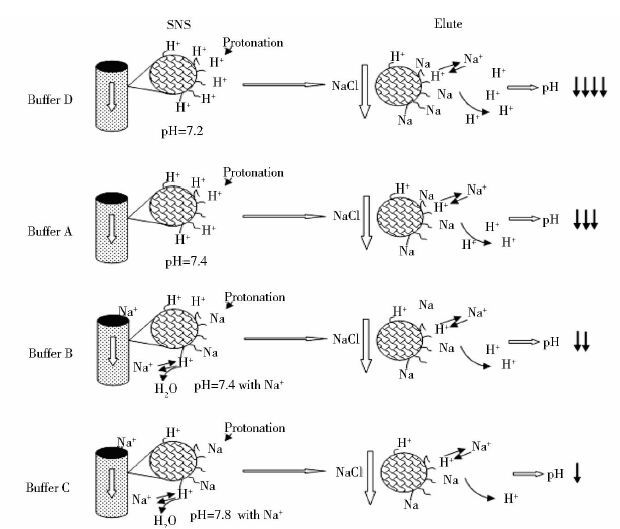
|
| 图 2 不同SNS的作用机制示意图 Figure 2 Mechanism of different SNS buffer |
由此可见,SNS的碱性条件与Na+是双重效应,目的是在洗脱阶段之前减弱填料表面的质子化程度,达到减少洗脱过程中H+释放、减弱pH漂移的效果。
2.1.2 SNS对CHT填料钙流失量的影响如表 5所示的实验结果可以看出,层析过程中的钙离子流失主要发生在洗脱阶段,加入SNS之后,洗脱阶段的钙离子流失可以有显著的下降(由41ppm降至7ppm),并且由图 3可见,SNS可以使洗脱全过程的钙离子流失整体减少。
| 步骤 | Ca2+浓度(ppm) | |
| 实验组 | 对照组 | |
| 平衡 | 0.2 | 0.2 |
| SNS | 0.1 | N/A |
| 洗脱 | 7.0 | 41.0 |
| 再生 | 0.2 | 0.2 |
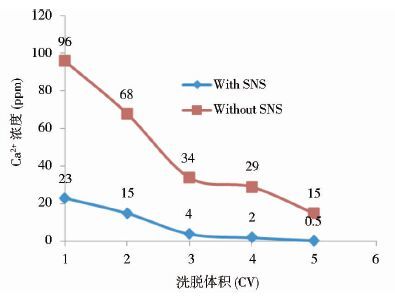
|
| 图 3 洗脱过程中Ca2+流失的变化 Figure 3 Amount of calcium depletion during elution step of CHT chromatography |
实验在添加SNS溶液条件下连续运行200个循环,测得洗脱过程的钙离子流失均在10ppm以内(平均值为7.8ppm,图 4) ,与上述单次层析实验中的钙离子流失水平(7.0ppm)保持一致。可见,该SNS工艺对减少钙离子流失的影响是稳定可靠的。

|
| 图 4 不同使用次数时的钙离子流失量 Figure 4 Calcium depletion in different run cycles |
实验结果如图 5所示,WLB304单克隆抗体在CHT填料上的初始动态载量约为48.6g/L填料,使用200个循环,填料载量变化不超过10%,表明加入SNS步骤不会明显影响WLB304抗体在CHT填料上的动态载量。

|
| 图 5 不同使用次数条件下,WLB304单克隆抗体对填料的载量变化 Figure 5 Binding capacity variation of WLB304 antibody loading in CHT resin with different run cycles |
从图 6可以看出,不添加SNS条件下,CHT填料循环运行50次后压力达到13psi并开始迅速上升;添加SNS后,填料可稳定循环使用100次后压力才开始上升。同时SNS可稳定CHT洗脱过程中最低pH为6.4左右(图 7) 。
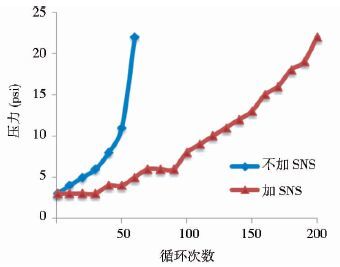
|
| 图 6 SNS对CHT填料压力的影响对比 Figure 6 Comparison of back pressures of CHT column with or without SNS insertion |
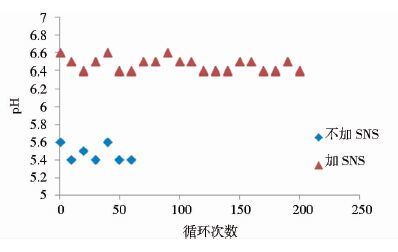
|
| 图 7 SNS对CHT填料pH变化的对比 Figure 7 Comparison of pH of CHT column with or without SNS insertion |
如表 6所示,随着层析柱规模的逐渐增大,洗脱过程中最低pH有略微降低,当层析柱直径达到100mm时,最低pH为6.1;同时,所有规格的CHT层析柱填料使用20次以内,未见压力迅速升高。
| 层析柱直径(mm) | 线性流速(cm/h) | 循环次数 | 最低pH | 最终压力(psi) |
| 16 | 200 | 20 | 6.5 | 10 |
| 26 | 200 | 20 | 6.4 | 11 |
| 50 | 200 | 20 | 6.2 | 10 |
| 100 | 200 | 20 | 6.1 | 9 |
结果表明,在CHT层析工艺中添加SNS方法在逐级放大过程中压力变化保持一致,SNS可稳定的应用于中试规模的CHT层析工艺中。在逐级放大过程中,由于在固定体积的SNS淋洗过程中,越大规格的层析柱柱床溶液分散效率越低,使得放大后SNS对pH漂移调整效果减弱。
2.2.4 SNS在放大过程中对WLB304单克隆抗体质量的影响如表 7所示,SNS并不影响WLB304单克隆抗体中试纯化的回收率、纯度和HCP等杂质的去除。中试规模生产中连续运行20批次,如图 8所示第1次和第20次层析图洗脱阶段的pH波动和OD280峰型基本一致;每批纯化后的单克隆抗体质量也一致。
| 项目 | 不添加SNS | 添加SNS |
| 单体纯度(%) | 99.3 | 99.5 |
| 回收率(%) | 96.8 | 96.4 |
| DNA(pg/mg) | <1.0 | <1.1 |
| HCP(ng/mg) | 4.2 | 2.9 |
| Protein A(ng/mg) | <0.1 | <0.1 |
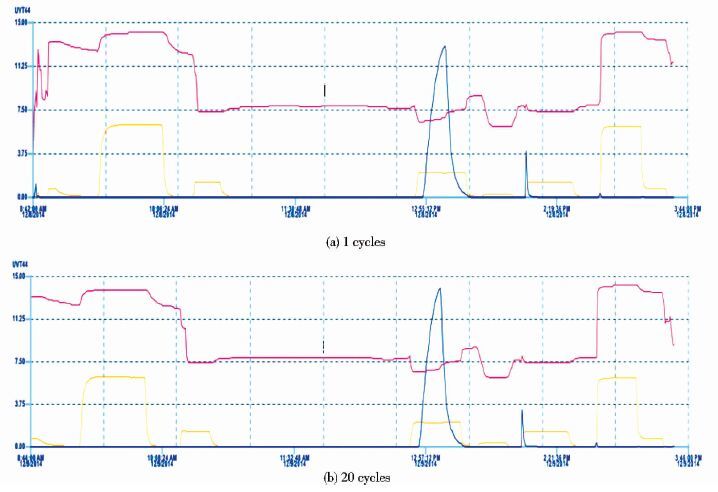
|
| 图 8 中试生产规模首批次和20批次层析图对比 Figure 8 Comparison of chromatographic profile in pilot scale (a) The first run of CHT chromatography (b) The twentieth run of CHT chromatography |
中试放大实验结果表明,添加SNS不影响CHT填料的纯化效果,多批次纯化结果一致性很高(表 8) 。说明在工艺中加入SNS溶液作为填料保护手段不会影响工艺的稳定性,可用于工艺放大。
| 批次 | 回收率(%) | 单体纯度(%) | DNA(pg/mg) | HCP(ng/mg) | Protein A(ng/mg) |
| 1 | 94.9 | 99.5 | <0.6 | <2.0 | <0.1 |
| 5 | 94.2 | 99.0 | <0.4 | <2.1 | <0.1 |
| 10 | 94.2 | 98.9 | <0.4 | <2.2 | <0.1 |
| 15 | 95.3 | 98.9 | <0.4 | <2.2 | <0.1 |
| 20 | 95.3 | 99.0 | <0.4 | <2.2 | <0.1 |
3 结论
表面中和体系(SNS)是基于CHT填料在洗脱过程中质子化的机制而设计的,本研究筛选得到一种用于CHT层析的SNS溶液(5mmol/L NaPi,20mmol/L Tris-HCl,20mmol/L NaCl,pH7.8) ,证明在洗脱前添加这种SNS溶液可以减少洗脱过程中的pH漂移程度和使用过程中层析柱反压的升高。钙离子浓度测试是一种简易有效的辅助手段,通过测定洗脱收集液中钙离子浓度的变化证明SNS溶液能有效地减少填料的钙离子流失,SNS有助于提升CHT填料的使用寿命。
将SNS应用在CHT层析工艺中,在层析柱直径为10mm小试规模试验中,SNS在200个使用循环内基本不改变填料的载量。在工艺放大过程(层析柱直径100mm)中不影响工艺的重复性,也不影响工艺放大的效果,同时SNS也不影响聚合体、HCP、DNA和Protein A等杂质的去除效果。
总之,初步研究结果表明,将SNS引入到CHT层析工艺之中,能够显著地改善CHT层析洗脱过程中pH的漂移程度,缩短其在低pH条件下的暴露时间,从原理上可预期提高填料的使用寿命。且SNS的引入不会对CHT层析工艺的效果带来不良影响。在工艺放大过程中,SNS对改善CHT层析洗脱过程中pH漂移幅度的效果减弱,究其机制(图 2) ,当前影响SNS中和效果的条件包括pH、Na+浓度、淋洗体积等,对放大后的CHT层析柱表面质子化的中和效果不够充分,可以在后续的研究中加以优化,实现对填料更有效的保护。
| [1] | Cummings L J, Ogawa T, Tunón P. CHT ceramic hydroxyapatite:new life for an old chromatographic technique.. http://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_1927B.pdf. |
| [2] | Nakamura S, Matsumoto T, Sasaki J, et al. Effect of calcium ion concentrations on osteogenic differentiation and hematopietic stem cell niche-related protein expressions in osteoblasts. Tissue Engineering, 2010, 18(8) : 2467–2473. |
| [3] | Yachelini P, Falk I, Eichmann K. Deviations in thymocyte development induced by divalent and monovalent ligation of the alpha/beta T cell receptor and by its cross-linking to CD8. J Immunol, 1990, 145(5) : 1382–1389. |
| [4] | Grun J B, et al. Viral removal/inactivation by purification of biopharmaceuticals. Biopharm, 1992, 5 : 22–30. |
| [5] | Juarez-Salinas H, et al. Separation of IgG idiotypes by high-performance hydroxylapatite chromatography. Methods Enzymol, 1986, 121(58) : 615–622. |
| [6] | Gagnon P, Paul N G, Jie H, et al. Platform purification of IgG with CHT ceramic hydroxyapatite.. www.ibclifesciences.com. |
| [7] | Ng P K, Snyder M A. pH-based cation exchange chromatography in the capture and elution of monoclonal antibodies. J Sep Sci, 2012, 35 : 29–35. DOI:10.1002/jssc.v35.1 |
| [8] | Bankston T, Theresa E, Dattolo L, et al. pH transients in hydroxyapatite chromatography columns-Experimental evidence and phenomenological modeling. J of Chromatography A, 2010, 1217 : 2123–2131. DOI:10.1016/j.chroma.2010.02.004 |
| [9] | Belcher R, Close R A, West T S, et al. The complexometric titration of calcium in the presence of magnesium a critical study. Talanta, 1958, 1 : 238–244. DOI:10.1016/0039-9140(58)80039-9 |
| [10] | Kim J, Vipulanandan C. Effect of pH, sulfate and sodium on the EDTA titration of calcium. Cem Concr Res, 2003, 33 : 621–627. DOI:10.1016/S0008-8846(02)01043-8 |
| [11] | Pabst T, Antos D, Carta G, et al. Protein separations with induced pH gradients using cation-exchange chromatographic columns containing weak acid groups. J of Chromatogr A, 2008, 1181 : 83–94. DOI:10.1016/j.chroma.2007.12.054 |
 2017, Vol. 37
2017, Vol. 37




