文章信息
- 张璟, 张文强, 秦慧民, 毛淑红, 薛家禄, 路福平.
- ZHANG Jing, ZHANG Wen-qiang, QIN Hui-min, MAO Shu-hong, XUE Jia-lu, LU Fu-ping.
- 胆固醇7,8位脱氢酶的表达及催化活性研究
- Expression of Related Cholesterol Dehydrogenation Protein and Bioactivity Research
- 中国生物工程杂志, 2017, 37(1): 21-26
- China Biotechnology, 2017, 37(1): 21-26
- http://dx.doi.org/DOI:10.13523/j.cb.20170104
-
文章历史
- 收稿日期: 2016-05-13
- 修回日期: 2016-09-06
2. 河南利伟生物医药股份有限公司 焦作 454800
2. Henan Li Wei Medicine Co., Ltd, Jiaozuo 454800, China
7-脱氢胆固醇(7-DHC)是合成维生素D3的重要前体,主要由化学合成法制备,但化学合成的方法反应步骤长、副反应较多、条件难以控制。生物技术作为一门新兴技术,已被广泛应用于各个领域。迄今,生物法从头合成7-脱氢胆固醇的研究已有相关报道[1-2],但存在产率低下、后续提纯步骤繁琐等问题。
胆固醇经胆固醇7,8位脱氢酶作用生成7-脱氢胆固醇的反应广泛存在于甲壳类动物C.antennarius[3]、C.maenas[4]、M.mercenaria[5]中,许多昆虫的前胸腺也有此转化反应[6-7],其实质是节肢类动物形成脱皮激素的第一步酶促反应。2011年,Yoshiyama-Yanagawa等[8]印证了来自Drosophila melanogaster、Bombyx mori等节肢类动物的neverland为胆固醇的7,8位脱氢反应所必需的一个酶基因。
neverland基因属于Rieske非血红素离子单加氧酶[9],在进化过程中高度保守,它编码的蛋白质中都含有一个Rieske[2Fe-2S]中心结合模体(C-X-H-X16-17-C-X2-H)用以作为电子受体或者通过该模体将电子传递给其他酶[10],在蛋白质的C端还含有一个单核的、非血红素离子结合模体(E/D-X3-D-X2-H-X4-H),该模体的作用通常被认为与分子氧结合[11]。NVD的跨膜段在蛋白质的N端,其主要结构类似于原核生物的IA型末端加氧酶[12],如Rhodococcus erythropolis的Ksh A[13]。
目前,胆固醇7,8位脱氢的酶促反应机制以及参与此氧化反应所需的蛋白质种类等问题至今仍然没有解释清楚。本研究针对胆固醇脱氢反应存在的问题,将胆固醇7,8位脱氢酶在果蝇S2细胞以及酿酒酵母表达系统中进行表达,并采用杂交技术和HPLC进行验证。同时,还进行了采用酿酒酵母所表达的neverland产物和昆虫细胞的破碎液共孵育转化胆固醇等实验,为进一步研究胆固醇7,8位脱氢酶在胆固醇氧化过程中所起的作用,阐明胆固醇7,8脱氢反应奠定了基础。
1 材料与方法 1.1 材 料 1.1.1 质粒、细胞和抗体质粒载体pIEx-6、pXY212,大肠杆菌DH5α,酿酒酵母W303-1A均由本室保存;果蝇S2细胞由天津科技大学刁爱坡教授惠赠;鼠抗6×His单克隆抗体购自Abcam公司;neverland基因委托金唯智公司合成。
1.1.2 工具酶与试剂限制性内切核酸酶(BamH I、Xho I、EcoR I、Hind III)、Pyrobest高保真酶及其缓冲液、T4 DNA连接酶、质粒DNA提取纯化试剂盒和DNA凝胶回收试剂盒均为TaKaRa公司产品。Effectene Transfection Reagent购自Qiagen公司,胆固醇、7-脱氢胆固醇标准品购自Sigma公司。
1.2 方 法 1.2.1 pIEx-6-nvd及pXY212-nvd重组质粒的构建以果蝇基因组数据库中neverland的基因序列为参考,在基因的开发阅读框两侧设计引物NVD6F: 5′-CGGGATCCCATGACGAGCTATTCTCTGTTC-3′和NVD6R:5′-CCGCTCGAGTTACCCAGCCCACACGTC-3′以及NVD2F:5′-CCGGAATTCATGACGAGCTATTCTCTG-3′和NVD2R:5′-CCGAAGCTTTTAGTGGTGGTGGTGGTG-3′,以合成的neverland为模板,PCR扩增DNA片段。PCR产物回收后用BamH I/Xho I及EcoR I/Hind III酶切,随后与BamH I/Xho I及EcoR I/Hind III双酶切并切胶回收的pIEx-6和pXY212连接,将连接反应混合物转化大肠杆菌DH5α后,氨苄青霉素(Amp+)抗性筛选重组转化子并测序。
1.2.2 重组质粒转染S2细胞在1.5ml EP管中分别加入100μl EC buffer及300ng的pIEx-6-nvd和pIEx6涡旋振荡后静置5min,再加入5μl Enhancer涡旋振荡后静置5min,最后再加10μl effecfene涡旋振荡后静置5min后加入500μl培养基并转移至6孔板中,12h后更换新鲜培养基。
1.2.3 NVD的表达鉴定以12% SDS-PAGE 电泳鉴定目的蛋白相对分子质量大小,以Western印迹法鉴定NVD免疫原性。首先进行浓度为12%的SDS-PAGE电泳,然后将蛋白质从PAGE胶转至PVDF膜,再以BSA封闭非特异性结合位点,加入1∶2 000稀释的鼠抗6×His单克隆抗体,室温放置3h。TBS缓冲液清洗3遍,用1∶1 000稀释HRP标记的羊抗鼠二抗结合2h,充分洗膜、显色。
1.2.4 NVD纯化离心(1 000g)收集放大培养的重组S2细胞,重悬于缓冲液(50mmol/L Tris-HCl,pH 7.5,20%甘油,0.1mmol/L DTT)中。将10%的胆酸钠添加到细胞重悬液至终浓度0.6%,轻轻搅拌30min。45 000r/min离心45min收集上清液,并用缓冲液(50mmol/L Tris-HCl,pH 7.5,20%甘油)将胆酸钠稀释至0.2%。最后,利用Ni2+-NTA色谱柱吸附上清液中的NVD。
1.2.5 NVD的生物学活性鉴定在转染12h后的S2细胞培养基中添加50μmol/L胆固醇进行孵育,24h后收集培养基及细胞,加入等体积的乙酸乙酯,震荡混匀、冻干。酿酒酵母则是在接种培养36h后添加1%的胆固醇进行转化,底物添加24h后收集培养基及细胞,加入等体积的乙酸乙酯,震荡混匀、冻干。将纯化后的NVD同50μmol/L胆固醇置于HEPES缓冲液中(20mmol/L,pH 7.0,10μmol/L NAD+),避光孵育2h后,加入等体积的乙酸乙酯,震荡混匀、冻干。冻干粉末均复溶于甲醇中,过滤并进行HPLC分析。HPLC分析采用Agilent C18 column(4.6×100mm),流动相为甲醇,流速为1ml/min,检测波长为281nm。
2 结 果 2.1 重组质粒pIEx-6-nvd及pXY212-nvd的构建及验证将NVD基因连接到载体pIEx-6-nvd及pXY212-nvd上(图 1),转入E.coli DH5α中;提取重组质粒pIEx-6-nvd及pXY212-nvd,经BamH I和Xho I及EcoR I和Hind III双酶切鉴定。如图 2所示,DNA凝胶电泳的结果与预期值相符,表明重组质粒构建成功,经测序鉴定后氨基酸的序列与原始序列相似性为100%。

|
| 图 1 重组质粒pIEx-6-nvd及pXY212-nvd的构建图谱 Figure 1 Construction maps of the expression vector pIEx-6-nvd and pXY212-nvd (a) pIEx-6-nvd (b) pXY212-nvd |

|
| 图 2 pIEx-6-nvd重组质粒经BamH I和Hind III双酶及BamH I单酶酶切(a)、pXY212-nvd重组质粒经EcoR I和Not I双酶及EcoR I单酶酶切(b)的鉴定电泳图 Figure 2 The agarose gel electrophoresis identification of pIEx-6-nvd and pXY212-nvd recombinant plasmid (a)pIEx-6-nvd (b)pXY212-nvd |
经Western blot鉴定,NVD 末端的6×His标签能与鼠抗6×His单克隆抗体发生特异性结合,而对照的S2细胞及酿酒酵母并不能发生结合,表明NVD表达成功(图 3、图 4)。

|
| 图 3 果蝇胆固醇7、8位脱氢酶在S2细胞中的Western blot分析 Figure 3 Western blot analysis of NVD expression in S2 1,2:S2/pIEx-6-nvd; 3,4:S2/pIEx-6; M:Marker 55kDa |

|
| 图 4 果蝇胆固醇7,8位脱氢酶在酿酒酵母中的Western blot分析 Figure 4 Western blot analysis of NVD expression in S.cerevisiae W303-1A 1,2:S.cerevisiae W303-1A/pXY212; 3,4:S.cerevisiae W303-1A/pXY212-nvd |
NVD利用Ni2+-NTA色谱柱纯化后,经SDS-PAGE分析目的条带在50kDa处,大小与预期相符(图 5)。

|
| 图 5 纯化后的胆固醇7,8位脱氢酶的SDS-PAGE分析 Figure 5 Purification of recombinant NVD via a Ni2+-NTA resin chromatography column M: Protein markers; 1: NVD |
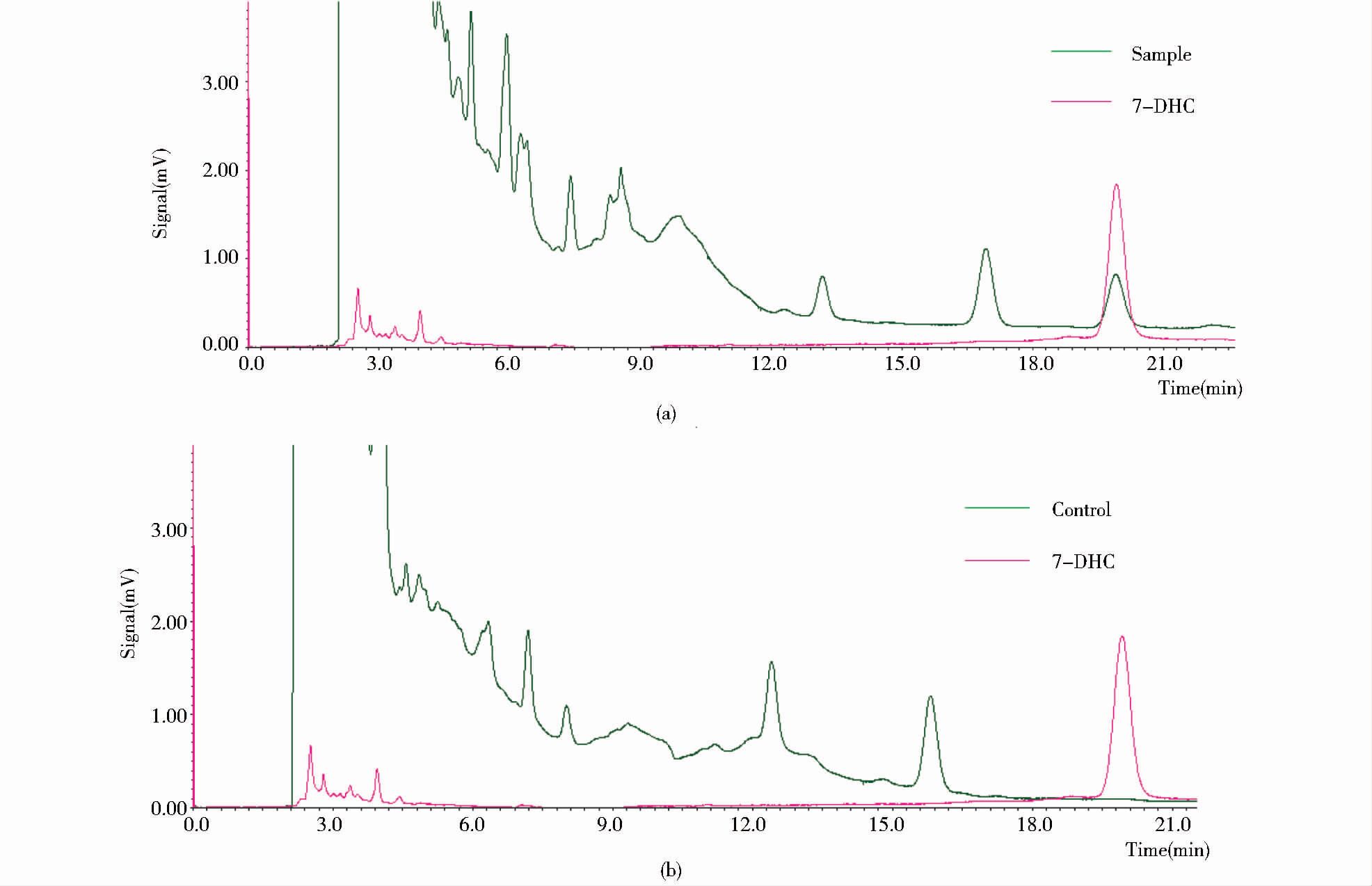
S2细胞所表达的NVD活性检测结果如图 6所示,转染pIEx-6-nvd的S2细胞孵育胆固醇后,经HPLC检测能产生与标准品7-脱氢胆固醇出峰时间一致的产物峰,而对照组并没有检测到与产物一致的峰。因此通过S2细胞表达系统所表达的NVD是有生物学活性的,可以将胆固醇氧化成7-脱氢胆固醇。但是,纯化后的NVD在体外实验中不能够将胆固醇转化为7-脱氢胆固醇(数据未给出)。
|
| 图 6 HPLC分析S2细胞对胆固醇的转化产物 Figure 6 HPLC analysis of the product of cholesterol bioconversion in the S2 cell (a) S2/pIEx-6-nvd (b) S2/pIEx-6 |
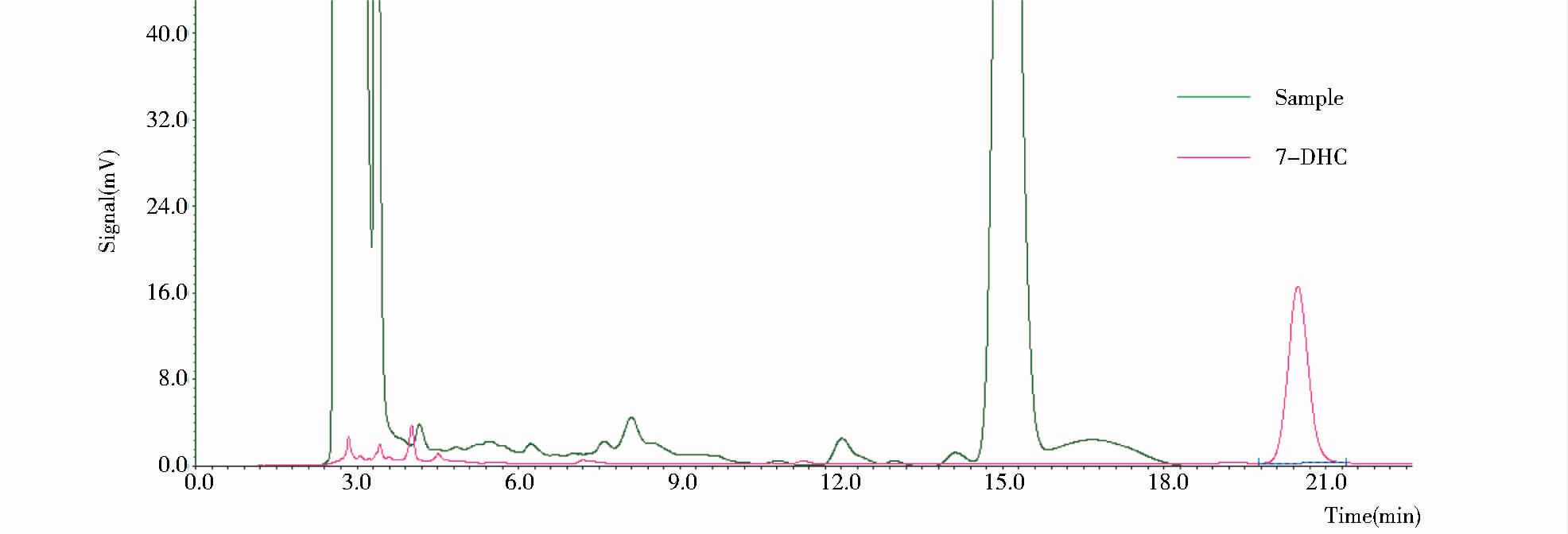
酿酒酵母所表达的NVD活性检测结果如图 7所示,胞内含有质粒pXY212-nvd的酿酒酵母不能将培养基中的胆固醇转化为7-脱氢胆固醇。经HPLC检测,未能产生与标准品7-脱氢胆固醇出峰时间一致的产物峰。因此通过酿酒酵母所表达的NVD不具备胆固醇的7,8位脱氢活性。
|
| 图 7 HPLC分析酿酒酵母重组菌对胆固醇的转化产物 Figure 7 HPLC analysis of the product of cholesterol bioconversion in the S.cerevisiae W303-1A/pXY212-nvd cell |
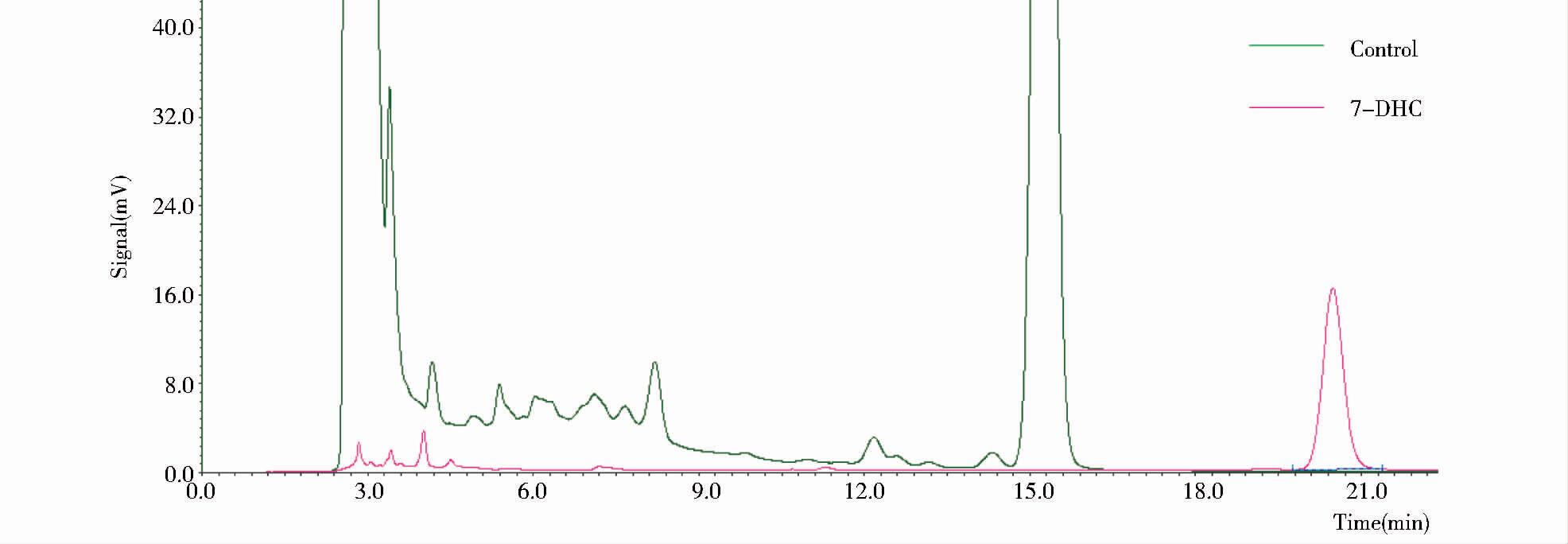
将含有质粒pXY212-nvd的酿酒酵母以及S2细胞在PBS缓冲液中裂解,裂解液对胆固醇的转化实验结果如图 8所示,经HPLC检测,未能产生与标准品7-脱氢胆固醇出峰时间一致的产物峰。因此通过毕赤酵母所表达的NVD同S2细胞的裂解液没能够产生协同作用将胆固醇转化为7-脱氢胆固醇。
|
| 图 8 HPLC分析酿酒酵母重组菌及S2细胞裂解液对胆固醇的转化产物 Figure 8 HPLC analysis of the product of cholesterol bioconversion in the lysis of S.cerevisiae W303-1A/pXY212-nvd cell and S2 |
现有研究已经证实,neverland基因的表达产物就是胆固醇的7,8位脱氢酶[8]。作为Rieske氧还酶家族,氧化底物时往往需要具有相同亚结构的氧化酶和还原酶共同完成,组合在一起形成一条完整的电子传递链,使电子由DADH经黄素和[2Fe-2S]还原中心到最后的氧化酶[11, 14]。与neverland在一级结构上同源性最高的是来源于原核生物的Ksh A,而Ksh A在氧化底物时也需要它的还原蛋白Ksh B的帮助。因此,胆固醇的整个脱氢氧化反应中,neverland并不能独自完成该酶促反应,它在氧化胆固醇的过程中同样需要一个来自Rieske家族的还原酶来帮助其完成一系列的电子传递过程。在哺乳动物的基因组中没有与nvd相类似的蛋白质[15],因此这个还原酶蛋白有可能只存在于含有胆固醇的7,8位脱氢酶的物种当中。
本研究中我们将neverland基因转染入S2细胞中进行表达,细胞转化实验证实重组的S2细胞能够将胆固醇转化为7-脱氢胆固醇,但纯化后的NVD并不能够在体外将胆固醇氧化,表明NVD不能够单独完成这一催化反应。由于S2细胞培养基价值昂贵、培养费时且对胆固醇的转化率很低,不利于胆固醇的大规模高效转化。因此,将neverland基因转化入酿酒酵母中进行表达,Western blot结果显示NVD能够在酿酒酵母中表达,但表达产物经HPLC分析不能够将底物胆固醇转化成为7-脱氢胆固醇,表明在酿酒细胞中极有可能不含有NVD的还原酶或者经酿酒酵母异源表达出的NVD没有生物活性。将酿酒酵母重组菌同S2细胞进行破碎并利用破碎液转化胆固醇也不能将胆固醇转化为7-脱氢胆固醇,可能的原因有两点:①NVD的还原酶在S2细胞中的表达并不是组成型而是处于一种诱导状态,需要有NVD蛋白的存在才能够启动它的表达从而帮助NVD完成电子传递过程产生胆固醇的脱氢反应;②NVD在酿酒酵母中的翻译后修饰或者蛋白质的空间折叠不正确导致表达出来的NVD不具备生物活性。
在Yoshiyama-Yanagawa等[8]的实验中,S2细胞转染了果蝇来源的neverland基因后并没有检测到NVD的表达,但仍然在后续的实验中检测到了7-脱氢胆固醇的生成;而本实验中的Western印迹实验证实了neverland基因在S2细胞中的表达,同时还证实经瞬时转染neverland基因的果蝇S2细胞也能够成功的将胆固醇转化为7-脱氢胆固醇。上述结果为以后研究NVD的作用机制奠定了一定基础。
| [1] | Lang C, Markus V. Preparation of 7-dehydrocholesterol and/or the biosyntheticintermediates and/or secondary products thereof in transgenic organisms:US,2006/0240508. 2006-10-26. |
| [2] | 张莹, 张璐, 刘夺, 等. 7-脱氢胆甾醇合成功能模块与底盘细胞的适配性. 生物工程学报 , 2014, 30 (1) : 30–42. Zhang Y, Zhang L, Liu D, et al. Match of functional module with chassis in 7-dehydrocholesterol synthesis. Chinese Journal of Biotechnology , 2014, 30 (1) : 30–42. |
| [3] | Spaziani E, Mattson M P, Wang W L, et al. Signaling pathways for ecdysteroid hormone synthesis in crustacean Y-organs. American Zoologist , 1999, 39 (3) : 496–512. DOI:10.1093/icb/39.3.496 |
| [4] | Lachaise F, Carpentier G, Sommé G, et al. Ecdysteroid synthesis by crab Y-organs. Journal of Experimental Zoology , 1989, 252 (3) : 283–292. DOI:10.1002/(ISSN)1097-010X |
| [5] | Rudolph P H, Spaziani E, Wang W L. Formation of ecdysteroids by Y-organs of the crab, Menippe mercenaria I biosynthesis of 7-dehydrocholesterol in vivo. General and Comparative Endocrinology , 1992, 88 (2) : 224–234. DOI:10.1016/0016-6480(92)90254-H |
| [6] | Warren J T, Sakurai S, Rountree D B, et al. Synthesis and secretion of ecdysteroids by the prothoracic glands of Manduca sexta. Journal of Insect Physiology , 1988, 34 (7) : 571–576. DOI:10.1016/0022-1910(88)90061-3 |
| [7] | Warren J T, Sakurai S, Rountree D B, et al. Regulation of the ecdysteroid titer of Manduca sexta:reappraisal of the role of the prothoracic glands. Proceedings of the National Academy of Sciences of the United States of America , 1988, 85 (3) : 958–962. DOI:10.1073/pnas.85.3.958 |
| [8] | Yoshiyama-Yanagawa T, Enya S, Shimada-Niwa Y, et al. The conserved Rieske oxygenase DAF-36/Neverland is a novel cholesterol-metabolizing enzyme. The Journal of Biological Chemistry , 2011, 286 (29) : 25756–25762. DOI:10.1074/jbc.M111.244384 |
| [9] | Schmidt C L, Lee S. A comprehensive phylogenetic analysis of rieske and rieske-type iron-sulfur proteins. Journal of Bioenergetics and Biomembranes , 2001, 33 (1) : 9–26. DOI:10.1023/A:1005616505962 |
| [10] | Link T A. The structures of rieske and rieske-type proteins. Advances in Inorganic Chemistry , 1999, 47 (1) : 83–157. |
| [11] | Mason J R, Cammack R. The electron-transport proteins of hydroxylating bacterial dioxygenases. Annual Review of Microbiology , 1992, 46 (1) : 277–305. DOI:10.1146/annurev.mi.46.100192.001425 |
| [12] | Jiang H, Parales R E, Lynch N A, et al. Site-directed mutagenesis of conserved amino acids in the alpha subunit of toluene dioxygenase:potential mononuclear non-heme iron coordination sites. Journal of Bacteriology , 1996, 178 (11) : 3133–3139. DOI:10.1128/jb.178.11.3133-3139.1996 |
| [13] | Geize R V D, Hessels G I, Gerwen R V, et al. Molecular and functional characterization of kshA and kshB, encoding two components of 3-ketosteroid 9α-hydroxylase, a class IA monooxygenase, in Rhodococcus erythropolis strain SQ1. Journal of Bacteriology , 2002, 45 (4) : 1007–1018. |
| [14] | Senda M, Kishigami S, Kimura S, et al. Molecular mechanism of the redox-dependent interaction between NADH-dependent ferredoxin reductase and rieske-type ferredoxin. Journal of Molecular Biology , 2007, 373 (2) : 382–400. DOI:10.1016/j.jmb.2007.08.002 |
| [15] | Lee E Y, Shim Y H, Chitwood D J, et al. Cholesterol-producing transgenic Caenorhabditis elegans lives longer due to newly acquired enhanced stress resistance. Biochem Biophys Res Commun , 2005, 328 (4) : 929–936. DOI:10.1016/j.bbrc.2005.01.050 |
 2017, Vol. 37
2017, Vol. 37




