文章信息
- 胡立强, 郑文, 钟艺, 杜丹, 杨浩, 龚萌.
- HU Li-qiang, ZHENG Wen, ZHONG Yi, DU Dan, YANG Hao, GONG Meng.
- 抗病毒蛋白RC28在大肠杆菌和毕赤酵母中的表达及活性比较
- Comparison of Expression and Activity of Antiviral Protein RC28 in Escherichia coli and Pichia pastoris
- 中国生物工程杂志, 2017, 37(1): 14-20
- China Biotechnology, 2017, 37(1): 14-20
- http://dx.doi.org/DOI:10.13523/j.cb.20170103
-
文章历史
- 收稿日期: 2016-08-22
- 修回日期: 2016-11-12
病毒性疾病在人与动物传染病中约占60%,严重危害生命健康[1],因而抗病毒药物研究受到广泛关注,成为国际研究开发热点之一。但是由于病毒在结构、生存及繁殖方式上的特殊性,不易与宿主细胞区别,因而大多数抗病毒药要么抗病毒作用弱,要么副作用大,开发理想的抗病毒药物难度很大。现有的抗病毒药的临床疗效均不理想,并存在应用面窄、穿透性差、毒副作用大等问题[1-2],而对于SARS、禽流感等新型病毒更缺乏有效治疗的药物。更严峻的是对已有药物的耐药株出现,使本来就种类匮乏的抗病毒类药物雪上加霜。因此,开发具有不同作用机制、高效广谱、安全的抗病毒新药的任务格外艰巨而紧迫。
RC28蛋白是从一类可食用野生蕈类皱盖罗鳞伞(Rozites caperata)中分离得到的一种抗病毒蛋白,分子质量为28kDa。实验证实,纯化的RC28对多种被膜病毒(包括单疱病毒、劳斯肉瘤病毒、流感病毒等)有广谱的抑制作用,但不作用于无被膜病毒(如埃克病毒、柯撒奇病毒等)。RC28对单疱病毒KOS株的半抑制浓度(MIC50)低于0.08mg/ml,仅2.8μmol/L,而相应的细胞毒性在浓度为2.5mg/ml时也无明显的表现[3]。
蕈类皱盖罗鳞伞为树木的外生菌根菌野生蕈类,至今无法人工种植,而其采集和保存也比较受限制。为了克服RC28来源的限制,现实可行的方法是通过转基因微生物来发酵生产具有活性的RC28蛋白,这对进一步研究RC28蛋白的抗病毒能力、实用领域以及抗病毒的机制具有重要意义。在我们前期工作中,通过3′-RACE方法,从皱盖罗鳞伞总RNA中克隆获得了RC28的cDNA翻译区片段[3]。在本项研究中,我们分别使用大肠杆菌与毕赤酵母表达体系,研究RC28蛋白的表达与纯化,并对表达产物进行活性分析,以确定RC28最佳的工程表达体系。
1 材料与方法 1.1 质粒、菌种及细胞株大肠杆菌E. coli TOP10、BL21(DE3)、大肠杆菌M15菌株和毕赤酵母GS115由本实验室保存。质粒构建载体pMD18-T、质粒载体pPIC9K、表达载体pET28a(+)来自QIAGEN公司。人宫颈癌细胞(HeLa)来自于美国ATCC细胞库。
1.2 主要试剂酵母提取物和胰蛋白胨购自Oxiod公司;质粒抽提纯化试剂盒和胶回收试剂盒为Omega公司产品;限制性内切核酸酶及DNA Marker购自TaKaRa公司,DNA连接酶购自Fermentas公司; 1640培养基,胎牛血清,胰蛋白酶购自Amresco公司;MTT购自Sigma公司;蛋白质定量试剂盒购自Trans Gen公司;小鼠抗His-tag抗体和辣根酶标记山羊抗小鼠抗体购自中杉金桥公司;Immobilon Western Chemiluminescent HRP Substrate购自Millipore公司;其他常用试剂购自长征试剂公司,均为分析纯。
1.3 方 法 1.3.1 RC28蛋白在大肠杆菌的原核表达体系构建、表达及分离纯化(1) RC28蛋白表达质粒构建。在我们前期工作中,通过3′-RACE方法,从皱盖罗鳞伞总RNA中克隆获得了RC28的cDNA翻译区片,并通过TA克隆装载于pMD18-T载体上,命名为pMD18-T-RC28。提取pMD18-T-RC28质粒用BamHI 和HindIII双酶切,然后回收RC28基因片段,与同样双酶切后的pET28a(+)质粒载体连接,将RC28插入pET28a(+)表达载体中,并经测序验证。序列正确的表达质粒命名为pET28a-RC28。
(2) RC28蛋白诱导表达。将成功构建的pET28a-RC28质粒转化入表达菌BL21(DE3)后,菌液涂布于含卡那霉素(30μg/ml)的LB固体培养基上,37℃静置培养过夜。挑取单克隆接种于5ml含卡那霉素(30μg/ml)的LB液体培养基中,37℃、220r/min培养过夜,再按1∶1 000比例接种于1L LB液体培养基中。37℃、220r/min培养至A600nm大约0.5左右时,取出1ml菌液,离心收集菌体作为诱导前样品。然后,向培养基中添加诱导剂异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalacto -pyranoside,IPTG)至终浓度为0.1mmol/L诱导4h。再取1ml菌液离心收集菌体作为诱导后样品。诱导前和诱导后菌体用100μl上样缓冲液(50mmol/L Tris,pH6.8,100mmol/L疏基乙醇,2% SDS,0.1%溴酚蓝,10%甘油)重悬,沸水浴20min裂解,然后经SDS-PAGE和Western blot检测目的蛋白表达情况。
选取表达量最高的克隆子进行放大培养,为了增加表达蛋白质的可溶性,在菌液加入终浓度为0.1mmol/L的IPTG后25℃振荡培养过夜。诱导表达后的菌液7 000g,4℃离心10min收集菌体。重悬于20ml pH8.0的Tris-HCl缓冲液(50mmol/L Tris,pH8.0,300mmol/L NaCl,10%甘油,20mmol/L 咪唑)中,再加入200μl,100mmol/L的苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)和14μl β-巯基乙醇,冰浴条件下超声破菌(功率300W,工作10s,间隔50s)。破菌完成后,分别收集上清液和沉淀进行SDS-PAGE鉴定。向上清液中加入1ml Ni-NTA凝胶,4℃缓慢振荡结合2h。然后将凝胶装入层析柱,用洗涤液(50mmol/L Tris,pH8.0,300mmol/L NaCl,10%甘油,40mmol/L 咪唑)冲洗30倍柱体积以上,再用洗脱液(50mmol/L Tris,pH8.0,300mmol/L NaCl,10%甘油,300mmol/L咪唑)洗脱蛋白质,按1ml/管进行收集。获得的蛋白质经SDS-PAGE 电泳分析纯度,通过Western blot验证蛋白质的正确性。
1.3.2 RC28蛋白在毕赤酵母构建、表达(1) RC28蛋白表达质粒构建。设计引物,以pMD18-T-RC28为模板进行PCR扩增,在RC28 cDNA片段上游引入6个His DNA片段和EcoR I酶切位点,下游引入Not I位点。将PCR产物用EcoR I和Not I双酶切,回收RC28片段并连接到同样双酶切后的pPIC9K载体中,并经测序验证。序列正确的表达质粒命名为pPIC9K-RC28。
(2) 转化及高拷贝转化子的筛选。提取pPIC9K-RC28质粒载体,选择Sal I位点线性化,以转化GS115后产生基因型为His+ Mut+的转化子。电泳鉴定线性化效率后,用电穿法转化毕赤酵母GS115:使用Bio-Rad GenePulser和0.2cm电转化杯,采用高电压低电容的模式:电压1 500V、电容25μF、电阻200Ω。用组氨酸缺陷的MD平板筛选阳性克隆。选取100个阳性克隆,在含G418的YPD培养基中筛选高拷贝菌株。
(3) RC28蛋白的诱导表达。挑取高拷贝单克隆菌株接种于BMGY培养基,于29.5℃,280r/min培养16~18h,至OD600达到2~6。离心收集菌体,重悬于含3%甲醇的BMMY培养基中,280r/min,连续诱导96h,8 000g离心10min收取上清液。
(4) RC28蛋白分离纯化。毕赤酵母表达体系诱导96h后,菌液于室温8 000g离心10min,收集上清液。上清液样品首先对10倍体积的Tris-HCl缓冲液(50mmol/L Tris,500mmol/L NaCl,pH 8.0)透析过夜。然后于4℃、20 000g离心20min,弃沉淀。使用pH 8.0、含0.5mol/L NaCl的50mmol/L Tris-HCl缓冲液平衡Ni-NTA亲和柱后,加入样品溶液,使用含0.5mol/L NaCl、20mmol/L咪唑的 50mmol/L Tris-HCl (pH 8.0)缓冲液充分洗涤层析柱。最后用含0.5mol/L NaCl、300mmol/L咪唑的50mmol/L Tris-HCl (pH 8.0)缓冲液洗脱样品,获得纯化蛋白质。
1.3.3 SDS-PAGE和Western blot十二烷基磺酸钠-聚丙烯酰胺凝胶电泳[sodium dodecyl (lauryl) sulfate-polyacrylamide gel electrophoresis,SDS-PAGE]参照Laemli[4]的方法进行。分离胶浓度为12.7%、浓缩胶浓度为4%。蛋白质样品用上样缓冲液等体积混匀后,在沸水中加热处理5min,冷却后上样。先用80V恒压电泳30min左右,再将电压升至120V继续电泳直至溴酚蓝到达凝胶边缘。电泳完成后,凝胶用考马斯亮蓝染色显示蛋白质条带。通过SDS-PAGE分离后的蛋白质,可进一步转移至PVDF膜(polyvinylidene fluoride membrane),通过Western blot检测蛋白质。将凝胶与PVDF膜组装后,在电转移缓冲液(25mmol/L Tris,192mmol/L glycine,15%甲醇)中恒压100V转膜1h。取出PVDF膜用5%脱脂奶粉(溶于磷酸盐缓冲液,50mmol/L,pH7.2)4℃封闭过夜,再与兔抗RC28抗体(稀释于2.5%脱脂奶粉)于37℃共同孵育2h。用含有0.05% Tween20的磷酸盐缓冲液(50mmol/L,pH7.2)洗膜6次,每次5min,然后再用二抗(辣根酶标记山羊抗兔抗体)孵育1h。洗涤2次后,PVDF膜用显色试剂显影,凝胶成像仪上采集图像。
1.3.4 蛋白质浓度测定利用蛋白质定量试剂盒,通过Bradford法测定蛋白质浓度。根据试剂盒说明,先取5μl蛋白质样品于酶标板中,然后再加入100μl考马斯亮蓝溶液,混匀后15min内用酶标仪于A595nm。以牛血清白蛋白为标准制定标准曲线。根据线性回归方程计算样品蛋白质浓度。
1.3.5 测定表达RC28的抗病毒活性为了方便阐述,我们把大肠杆菌表达的RC28蛋白命名为RC28-E,酵母表达的RC28命名为RC28-Y。将HeLa细胞按1×104/孔的种入96孔板,37℃培养6~8h后,按0.2MOI加入HSV-1病毒溶液,37℃孵育1h后,除去上清液,分别加入含0.4mg/ml、0.2mg/ml、0.1mg/ml、0.05mg/ml和0.025mg/ml RC28-E及RC28-Y的培养基(每个浓度3个复孔),对应使用空白培养基做为阴性对照,继续培养20h后,采用MTT法检测细胞活性,绘制RC28蛋白与HeLa细胞存活率的量效关系曲线。细胞存活率=(实验组-本底)/(对照组-本底)×100%。
同时培养基游离HSV-1病毒增长曲线通过荧光定量PCR测定:取感染病毒24h后的细胞培养液上清液(500μl/样)使用病毒基因组提取试剂盒(天根生化科技有限公司)提取病毒总DNA;以获得的病毒DNA为模板,使用正向引物CGCCATGTGACCCCCTGACTT、反向引物GGGGCGTGTCTCTGTGTATGAGTCA进行荧光定量PCR测定,判断HSV-1病毒的增殖趋势。
2 结 果 2.1 pET28a(+)-RC28和pPIC9K-RC28表达质粒的构建提取pMD18-T-RC28质粒,用BamHI和HindIII双酶切下RC28片段。该片段与经同样酶切的pET28a(+)载体连接,构建RC28融合蛋白表达载体,命名为pET28a-RC28。RC28蛋白在pET28a(+)中的表达元件简要构成如图 1(a)所示。
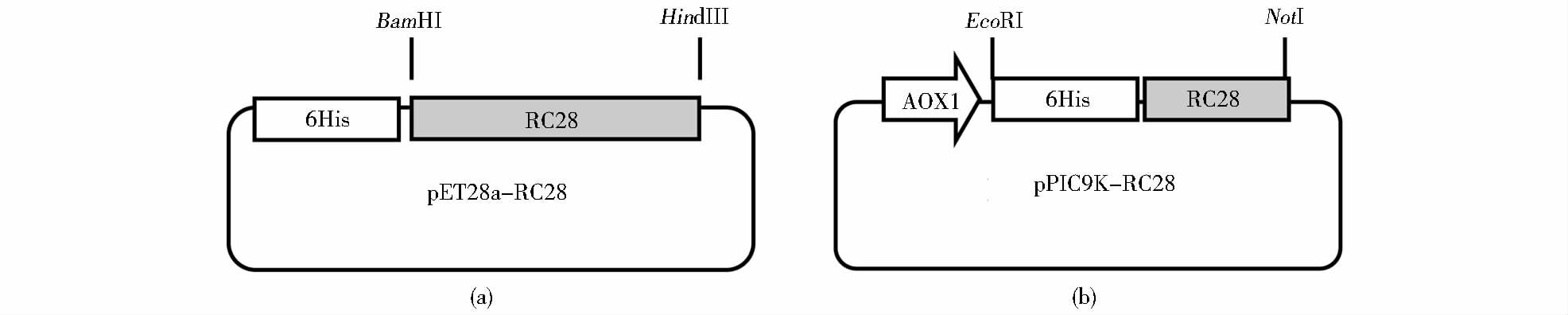
|
| 图 1 质粒的结构示意图 Figure 1 Schematic diagram of the expression vector (a) pET28a -RC28 (b) pPIC9K-RC28 |
以pMD18-T-RC28为模板进行PCR扩增,在RC28 cDNA片段上游引入6-His标签序列和EcoR I酶切位点,下游引入Not I位点,使重组蛋白N端将带上6His标签,以便蛋白质纯化和鉴定。将PCR产物用EcoR I和Not I双酶切,回收RC28片段并连接到同样双酶切后的pPIC9K载体中,并经测序验证。序列正确的表达质粒命名为pPIC9K-RC28。pPIC9K-RC28重组表达质粒框架如图 1(b)所示。
2.2 RC28蛋白在大肠杆菌表达体系的诱导表达及分离纯化用构建的pET28a-RC28表达质粒转化大肠杆菌BL21(DE3),然后挑取单克隆接种于含有氨苄西林的液体培养基中进行诱导表达。37℃诱导表达4h后,取样检查蛋白质诱导表达情况。结果如图 2(a)所示,菌体总蛋白质电泳分析表明,与诱导前样品(泳道1)相比,IPTG诱导后样品(泳道2、3、4)在分子质量大约为26kDa处均观察到明显的新增蛋白质条带,提示目的基因得到诱导表达。
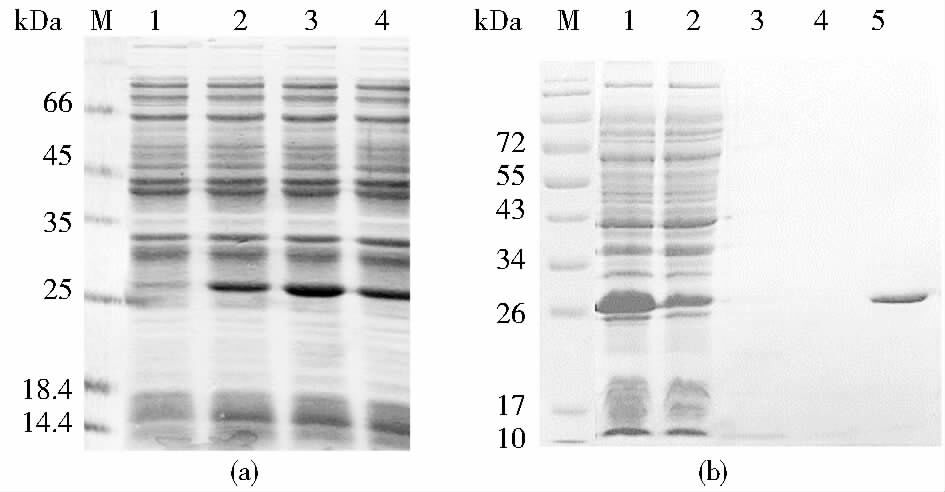
|
| 图 2 RC28蛋白在pET28a(+)-BL21(DE3)体系中的表达情况及分离纯化 Figure 2 Inducible expression of RC28 under the condition of in the culture media (a) RC28-E protein induction M: Protein markers; Total proteins from bacteria before induction (1) or induced (2,3,4) (b) RC28-E case of soluble and identification M: Protein molecular weight standard; Broken bacterial supernatant total protein (1); Over Ni-NTA Agarose column flowthrough post (2); 5mmol/L imidazole elution fractions (3); 10mmol/L imidazole elution component (4); 250mmol/L imidazole elution component (5) |
诱导表达后的菌体经超声破碎后,对破菌上清液和沉淀中的蛋白质进行SDS-PAGE凝胶电泳发现,在破菌上清液中和沉淀中均可见较大量目的蛋白,由于N端含有6His标签序列,目的蛋白可用Ni-NTA亲和层析进行纯化。破菌上清液中可溶蛋白与Ni-NTA结合后,用洗涤液洗掉杂蛋白,再用咪唑将目的蛋白洗脱下来。电泳发现,纯化后的蛋白质[图 2(b)泳道5]分子质量大约为26kDa,与预期分子质量一致,通过Ni-NTA亲和层析获得纯度达到80%以上的RC28-E蛋白。通过Bradford定量试剂盒测定获得的蛋白质溶液总蛋白质浓度结合纯度进行换算,可得产量约为每升菌液得3.5mg RC28蛋白。最后通过Western blot验证了目的蛋白的正确性(图 4泳道3)。
2.3 RC28蛋白在毕赤酵母表达体系的诱导表达及分离纯化用构建的pPIC9K-RC28表达质粒转化毕赤酵母GS115菌株后,分别用含有G418的MD平板和含有Zeocin的MD平板进行筛选。RC28-Y蛋白表达情况经SDS-PAGE电泳发现,诱导24h开始有RC28蛋白的表达,在诱导72h后表达量达到高峰[图 3(a)],通过Ni-NTA亲和层析也获得纯度达到80%以上的蛋白质,计算产量约为每升菌液得0.2mg RC28蛋白,结果如图 3(b)所示。同时,通过Western blot验证了目的蛋白的正确性(图 4泳道2)。

|
| 图 3 RC28在毕赤酵母中的表达与纯化 Figure 3 RC28 Expression and purification in Pichia pastoris (a) The expression of different induction time of RC28 1~5 is respectively induction time of 0h,24h,48h,72h and 96h RC28 expression (b) Using Ni-NTA affinity column purified RC28 expression 1:The sample before purification; 2: 300mmol/L imidazole elution fractions |
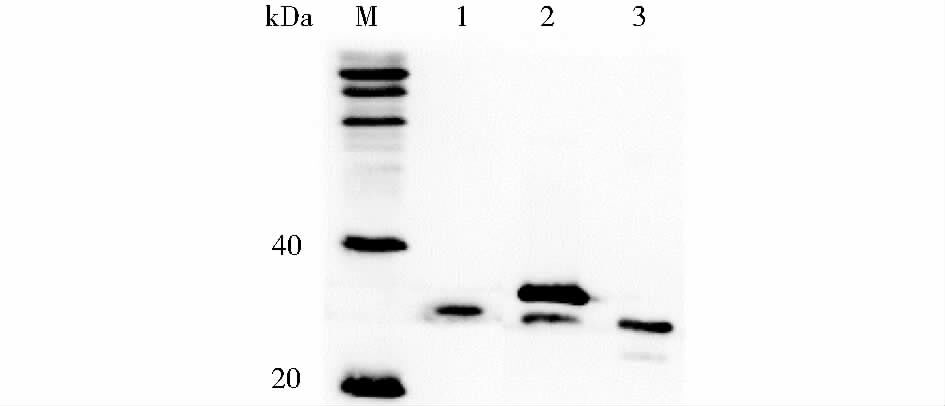
|
| 图 4 不同来源的RC28的Western blot鉴定 Figure 4 Western blot identification of different sources RC28 M: Protein molecular weight standards 1:Natural origin RC28 protein; 2: Pichia expression RC28-Y; 3: E. coli expressed RC28-E |
用MTT法测试RC28酵母表达的RE28-Y和大肠杆菌表达的RC28-E的抗病毒活性,结果如图 5(a)所示,相对于正常细胞,HSV-1病毒可以让HeLa细胞大量死亡,细胞活性降低约90%。RC28-Y蛋白则显示出强的保护作用,0.4mg/ml的RC28-Y可以使细胞保持约87%的活性。而RC28-E则活性不理想,0.4mg/ml的浓度只能使细胞保持不到40%的活性。结果表明,从酵母表达体系来源的RE28-Y显示出了较强地抗病毒活性,而原核来源的RE28-E则活性不理想。荧光定量PCR反映出游离HSV-1的结果如图 5(b)所示,可见随着RC28-Y浓度增加,细胞培养基中游离HSV-1 DNA的增加受到明显抑制,其中0.4mg/ml的RC28-Y浓度可以减少接近90%的游离病毒量,而RC28-E对游离HSV-1病毒增殖抑制作用不明显。

|
| 图 5 酵母表达的RE28-Y和大肠杆菌表达的RC28-E的抗病毒活性比较 Figure 5 Comparison the antiviral activity of RE28-Y in yeast and RC28-E in the E. coli expression (a) Cell protection of RC28 protein at different concentration against HSV-1,tested by MTT assany (b) Effect of RC28 proten at different concentration on the amount of free HSV-1 in culture media of infected cells in 24h |
人们在大型真菌中已经发现了许多具有抗病毒活性的成分,如木蹄提取物具有抗烟草花叶病毒的作用[5];日本香菇中含有抑制单纯疱疹病毒、西方马脑炎病毒、脊髓灰质炎病毒、麻疹病毒、腮腺炎病毒复制的成分[6-7];Hypsizigus marmoreus中的甾醇类化合物可以抑制EB病毒活性[8];Kuehneromyces mutabilis菌丝体提取物可以抑制流感病毒A[9];在多叶奇果菌中发现具有抗单疱病毒I型的29.5kDa蛋白质[10];一种从绒状火菇中发现的核糖体失活蛋白质可抑制HIV-1的反转录[11];等等。也许新的一类或多类新型的抗病毒药物将从对这些真菌成分的研究中得以发现。不过,现有的研究也存在较多问题,如很多抗病毒成分不清楚、机制不明确等。
本研究成功构建了原核、真核的两套表达体系用于RC28蛋白的工程表达。原核大肠杆菌体系,具有遗传背景成熟、基生长速率快和周期短、生产成本低等特点,然而由于大肠杆菌是原核生物,当用它表达外源的蛋白质时,不能对蛋白质进行翻译后修饰,使得重组蛋白的生物学活性较低或没有活性。真核毕赤酵母体系与其他真核表达系统相比毕赤酵母表达体系操作略显繁琐,培养周期略长;但毕赤酵母表达体系具有真核表达体系的许多优点,可以重组蛋白进行表达、加工、折叠和翻译后修饰等,这些可大大提高所表达的重组蛋白的生物学活性。
翻译后修饰是很多蛋白质折叠形成正确高级结构以及发挥正常生物学功能的重要步骤。通过RC28蛋白氨基酸序列计算,该蛋白质的理论分子质量大约为26kDa,但实际天然RC28蛋白分子质量接近28kDa,这个差异提示RC28蛋白可能存在着翻译后的修饰。在前期研究中,我们通过将生物信息学软件预测,RC28蛋白可能存在着N-糖基化、磷酸化及N-豆蔻酰化的修饰。Western blot的结果显示,RC28-E的分子质量明显小于天然RC28蛋白的,这可能正是由于大肠杆菌表达系统不具备真核生物的蛋白质翻译后修饰功能所导致。而在真核表达体系毕赤酵母中表达的RE28-Y蛋白的分子质量则与天然RC28蛋白接近,符合我们的预期。同时,在抗病毒的活性测定中,毕赤酵母表达的RE28-Y蛋白显示出了很好的抗病毒活性,而RC28-E的抗病毒活性则不明显。这个结果表明翻译后的修饰可能对于RC28蛋白发挥抗病毒活性具有重要的作用。
总之,本研究在大肠杆菌表达系统和毕赤酵母表达系统中成功地表达了RC28蛋白,并做了两种表达系统表达的RC28蛋白的活性比较,这将为进一步发展抗病毒药物研究奠定基础,也为研究RC28蛋白的功能提供了可能。
| [1] | 蒋军. 抗病毒药物的研究进展与发展趋势. 海峡药学 , 2004, 16 (6) : 1–3. Jiang J. Research progress and development trend of antiviral drugs. Strait Pharmaceutical Journal , 2004, 16 (6) : 1–3. |
| [2] | 刘琨, 谢蓝. 新型核苷类抗病毒药物的研究进展. 药学学报 , 2006, 41 (8) : 689–693. Liu K, Xie L. Advances in the study of nucleoside antiviral drugs. Acta Pharmaceutica Sinica , 2006, 41 (8) : 689–693. |
| [3] | Gong M, Piraino F, Yan N, et al. Purification, partial characterization and molecular cloning of the novel antiviral protein RC28. Peptides , 2009, 30 (4) : 654–659. DOI:10.1016/j.peptides.2008.11.016 |
| [4] | Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature , 1970, 227 (5259) : 680–685. DOI:10.1038/227680a0 |
| [5] | Aoki M, Tan M, Fukushima A, et al. Antiviral substances with systemic effects produced by basidiomycetes such as fomes fomentarius. Bioscience Biotechnology & Biochemistry , 1993, 57 (2) : 278–282. |
| [6] | Sorimachi K, Niwa A, Yamazaki S, et al. Anti-viral activity of water-solubilized lignin derivatives in vitro. Agricultural & Biological Chemistry , 1990, 54 (5) : 1337–1339. |
| [7] | Matsumoto Y, Sarkar G, Sommer S S, et al. A yeast antiviral protein, SKI8, shares a repeated amino acid sequence pattern with beta-subunits of G proteins and several other proteins. Yeast , 1993, 9 (1) : 43–51. DOI:10.1002/(ISSN)1097-0061 |
| [8] | Akihisa T, Franzblau S G, Tokuda H, et al. Antitubercular activity and inhibitory effect on epstein-barr virus activation of sterols and polyisoprenepolyols from an edible mushroom, Hypsizigus marmoreus. Biological & Pharmaceutical Bulletin , 2005, 28 (6) : 1117–1119. |
| [9] | Mothana R A A, Ali N A A, Jansen R, et al. Antiviral lanostanoid triterpenes from the fungus Ganoderma pfeifferi. Fitoterapia , 2003, 74 (1-2) : 177–180. DOI:10.1016/S0367-326X(02)00305-2 |
| [10] | Gu C Q, Li J W, Chao F, et al. Isolation, identification and function of a novel anti-HSV-1 protein from Grifola frondosa. Antiviral Research , 2007, 75 (3) : 250–257. DOI:10.1016/j.antiviral.2007.03.011 |
| [11] | Wang H, Ng T B. Isolation and characterization of velutin, a novel low-molecular-weight ribosome-inactivating protein from winter mushroom (Flammulina velutipes) fruiting bodies. Life Sciences , 2001, 68 (1) : 2151–2158. |
 2017, Vol. 37
2017, Vol. 37




