文章信息
- 辛林, 杨伟锋, 张厚停, 李祎帆.
- XIN Lin, YANG Wei-feng, ZHANG Hou-ting, LI Yi-fan.
- 叶酸-壳聚糖Prdx6 shRNA纳米粒的构建及其对胃癌细胞增殖的影响
- Preparation of Folic Acid/chitosan-Prdx6 shRNA Nanoparticles and Its Anti-carcinoma Effect on Gastric Cancer Cell Proliferation
- 中国生物工程杂志, 2017, 37(1): 7-13
- China Biotechnology, 2017, 37(1): 7-13
- http://dx.doi.org/DOI:10.13523/j.cb.20170102
-
文章历史
- 收稿日期: 2016-08-08
- 修回日期: 2016-11-13
胃癌是严重影响人类健康、威胁人类生命的主要疾病之一。近年来国内外诸多研究证实胃癌细胞内基因的异常表达是其产生的重要原因之一。基因表达异常能够引起胃癌细胞生物学特性的改变,导致肿瘤细胞无限制繁殖。因此,靶向性阻断胃癌细胞内异常基因的高表达成为胃癌治疗的一种新方法。Prdx6 (Peroxiredoxin 6) 蛋白是Peroxiredoxin家族中的一员。 Peroxiredoxin 属于抗氧化蛋白超家族,广泛存在于原核生物和真核生物中,是新近发现的一类过氧化物酶。有研究表明,Prdx6基因高表达与胃癌细胞的侵袭及转移密切相关[1]。Prdx6蛋白能够阻止H2O2在细胞内的聚积,保护细胞免于死亡。因此,阻断Prdx6蛋白的表达可以干扰肿瘤细胞内氧化还原反应的稳定,诱导肿瘤细胞凋亡。近年来,RNA干扰(RNA interfering,RNAi)发展成为一种新的基因沉寂技术。相比普通的siRNA,具有短发夹结构的双链RNA(short hairpin RNA,shRNA)产生的RNA干扰效应更强[2]。本研究通过制备携带Prdx6 shRNA的靶向性纳米基因载体,研究其对胃癌细胞Prdx6蛋白表达及细胞增殖的影响,探讨该基因纳米复合物的靶向治疗作用,为胃癌的基因治疗提供新的方法。
1 材料与方法 1.1 材 料壳聚糖购自玉环奥星生物化学有限公司(批号D07041381),N-(3-二甲氨基丙基)-N′-乙基碳二亚胺盐酸盐(EDC) 购自鼎国生物技术有限公司(纯度: 99%),N,N′-二环己基碳酰亚胺(DCC) (纯度: 95%) 和N-羟基琥珀酰亚胺 (NHS) (试剂级) 购自吉尔生化(上海)有限公司,叶酸(纯度>99%)、 mPEG(批号23414)购自美国Sigma-Aldrich公司,鼠抗人Prdx6单克隆抗体(批号11257-MM01-50)购自Abcam公司,鼠抗人β-actin 抗体(批号CW0096)购自BD公司,DMEM培养液(批号 SH30021.01B)购自赛默飞世尔科技公司,十八烷基季铵化羧甲基壳聚糖(OQC)、OQC-叶酸偶联物(OQC-FOL)、PEG修饰的OQC (PEG-OQC)由实验室制备,人胃癌 SNU-16细胞株由上海消化外科研究所提供。Prdx6 shRNA重组质粒由上海吉凯基因化学技术有限公司提供。
1.2 叶酸偶联壳聚糖的制备及红外光谱、磁共振谱分析将叶酸和N-羟基琥珀酰亚胺、N,N′-二环己基碳酰亚、三乙胺混合溶解在二甲基亚砜35℃下反应12h,得到叶酸活性脂。用无水乙醚洗涤后真空干燥,磁力搅拌下将叶酸活性脂溶于二甲基亚砜,用磷酸氢二钠缓冲液调节pH后加入十八烷基季铵化羧甲基壳聚糖(OQC),30℃下反应24h,去除多余杂质后得到叶酸-十八烷基季铵化羧甲基壳聚糖偶联物(OQC-FOL),行红外光谱及磁共振谱分析评估偶联情况。用电子天平称取2mg OQC-FOL样本,溶解于2%的乙酸中,用10ml容量瓶定容至10ml,然后在363nm处用紫外分光光度计测定吸光度,结合叶酸浓度-吸光度标准曲线,查出相应吸光度下的叶酸浓度,计算每毫克OQC-FOL中叶酸的含量,测定叶酸偶联率。
1.3 叶酸-壳聚糖Prdx6 shRNA纳米粒形态观察及粒径测定磁力搅拌下将溶解在无水乙醇中的异硫氰酸荧光素(FITC)加入OQC-FOL的乙酸溶液中避光反应4h进行标记,NaOH调节pH后离心,将沉淀用2%乙酸溶液溶解后用NaOH调节pH,磁力搅拌下加入多聚磷酸钠(TPP)溶液中反应20min后得到荧光标记的OQC-FOL纳米粒。取OQC-FOL纳米粒与Prdx6 shRNA重组质粒混合置于50℃水浴恒温中30min后得到叶酸-壳聚糖Prdx6基因纳米复合物(folate-targeted chitosan polymeric nanoparticle,FPN)。同时制备无叶酸修饰的壳聚糖Prdx6基因纳米粒(non-targeted chitosan polymeric nanoparticles,NPN)和不装载Prdx6 shRNA重组质粒的空白壳聚糖纳米粒(chitosan polymeric nanoparticle,CPN) 作为对照组。将基因纳米复合物混悬液滴加于云母片上,原子力显微镜观察其形态,激光粒度分析仪测定纳米粒的粒径。
1.4 纳米粒与质粒的结合实验及包埋率的测定分别取 10μl OQC-FOL纳米粒混悬液和10μl、20μl、30μl、40μl Prdx6 shRNA重组质粒(0.5μg/μl)加入不同的Eppendorf 管中,50℃水浴20min,均匀漩涡30s即制成叶酸-壳聚糖Prdx6基因纳米复合物,经1%琼脂糖凝胶70V电泳75min,DNA经溴化乙锭染色显示,紫外透射仪观察并凝胶照相鉴定。取上述不同比例叶酸-壳聚糖Prdx6基因纳米复合物及壳聚糖Prdx6基因纳米复合物以13 000r/min 离心30min,紫外分光光度计检测上清液中 DNA 的含量[DNA的含量=吸光度(A)260×稀释倍数×体积×50/1 000],通过公式,即包埋率 G(%)=[(W0-W1)/W0]×100%(W0为加入的 DNA 的总量,W1为上清液中剩余的 DNA 的量)计算包埋率并选择最佳的配比率。
1.5 DNA酶保护实验将10μl裸露质粒DNA样本、壳聚糖Prdx6 shRNA纳米粒及3种不同叶酸偶联率的叶酸-壳聚糖Prdx6 shRNA纳米粒分别加入Eppendorf 管中,加入2μl DNaseΙ酶,37℃水浴1h后用1%琼脂糖凝胶电泳检测消化产物。
1.6 荧光显微镜观察叶酸-壳聚糖Prdx6 shRNA纳米粒的转染效率将胃癌SNU-16细胞按3×104/孔分别接种于6孔细胞培养板中,各取200μl叶酸-壳聚糖Prdx6 shRNA纳米粒和壳聚糖Prdx6 shRNA纳米粒加入培养液中,37℃、5%CO2培养48h后,倒置荧光显微镜观察两种纳米粒转染细胞的情况。
1.7 转染叶酸-壳聚糖Prdx6 shRNA纳米粒后胃癌细胞Prdx6蛋白表达的检测将叶酸-壳聚糖Prdx6 shRNA纳米粒、壳聚糖Prdx6 shRNA纳米粒及壳聚糖纳米粒分别转染胃癌细胞,取转染48h后的胃癌SNU-16细胞总蛋白质50μg进行SDS-PAG凝胶电泳。电泳结束后转移蛋白质至PVDF 膜上,5%脱脂奶粉室温封闭2h,加入Prdx6鼠抗人多克隆抗体(1∶500) 及GAPDH 鼠抗人多克隆抗体(1∶500) 室温孵育3h,TBST 洗膜,加入碱性磷酸酶标记的羊抗鼠多克隆Ⅱ抗(1∶2 000) 1h,TBST 洗膜,用DAB 显色。凝胶图像分析仪分析图像,以相应蛋白质条带的平均灰度表示Prdx6蛋白表达水平。
1.8 转染叶酸-壳聚糖Prdx6 shRNA纳米粒后胃癌细胞增殖的检测胃癌SNU-16细胞培养于96孔板,2×103 cells /well,实验分为3组,即正常对照组(正常培养细胞)、非靶向组(壳聚糖Prdx6 shRNA纳米粒)和靶向组(叶酸-壳聚糖Prdx6 shRNA纳米粒),每种处理方式接种5复孔,24h后细胞处于指数生长阶段加入各组纳米粒,分别在处理后24h、48h、72h、96h、120h 加入CCK8 10μl,37℃ 培育4h,酶标仪(Bio-TEK,型号Quant) 检测其450nm 的吸光度(A),取5个时点的A值平均值并绘制生长曲线。
1.9 统计学处理数据用均数±标准差(x±s)表示,多组间比较采用方差分析,SPSS10.0统计软件包完成。P<0.05为差异有统计学意义。
2 结 果 2.1 叶酸偶联壳聚糖红外光谱及磁共振谱分析结果从叶酸偶联壳聚糖的红外光谱图及磁共振谱图中可以看出,壳聚糖上的氨基与叶酸上的羧基形成了酰胺键,两者偶联成功,见图 1。本实验通过改变叶酸及壳聚糖不同的反应比,合成3种偶联率分别为3%、7.5%、11.5%的OQC-FOL。

|
| 图 1 叶酸偶联壳聚糖的红外光谱及磁共振谱 Figure 1 The FTIR spectrum and 1H-NMR spectrum of the folate conjugate (OQC-FOL) (a) FTIR spectrum of OQC-FOL (b)1H-NMR spectrum of OQC-FOL |
从原子力显微镜观测及激光粒度分析仪的分析结果可以发现,叶酸-壳聚糖纳米粒的颗粒粒径比较集中,无颗粒团聚现象,水溶液中粒径为355.1nm,分散指数为0.222,纳米球表面电位为(-8.82±4.06)mV,具有纳米粒特征,可以方便的被细胞吞噬,见图 2。
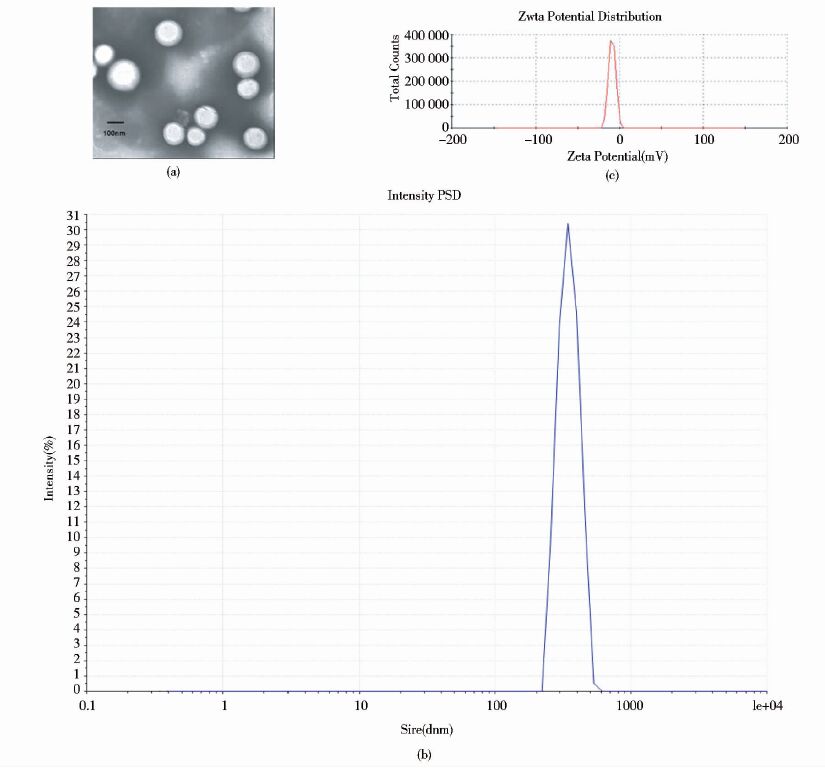
|
| 图 2 叶酸-壳聚糖Prdx6 shRNA纳米粒的物理特征 Figure 2 Physical characterization of folate chitosan Prdx6 shRNA nanoparticles (a)Nanoparticles surface morphology and diameter (b)Nanoparticles polydispersity (c)Nanoparticles surface charge |
1%的凝胶电泳显示,第1道为空白Prdx6 shRNA重组质粒,在其泳道上出现清晰DNA条带,第2道为壳聚糖Prdx6 shRNA纳米粒;第3~6道为叶酸-壳聚糖Prdx6 shRNA纳米粒(纳米粒∶质粒结合比分别为10∶10、10∶20、10∶30、10∶40);第2~6泳道所有样本电泳后都发生移动延滞,基本不出孔,见图 3。证实OQC-FOL纳米粒能有效地结合Prdx6 shRNA重组质粒。结合了质粒的OQC-FOL纳米粒经高速离心后取上清液,紫外分光光度计检测 DNA 的含量。 不同比例结合(纳米粒∶质粒)质粒的叶酸-壳聚糖Prdx6 shRNA纳米粒的包埋率分别为:3 道 98.6%(10∶10);4 道 97.1% (10∶20);5 道 95.7% (10∶30);6道 86.1%(10∶40)。
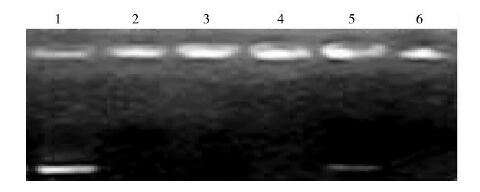
|
| 图 3 OQC-FOL纳米粒与质粒的结合实验凝胶电泳图 Figure 3 Nanoparticles and plasmids combination test gel electrophoresis 1: Blank plasmid; 2: Non-targeted chitosan polymeric nanoparticles; 3~6: Folate-targeted chitosan polymeric nanoparticles |
壳聚糖Prdx6 shRNA纳米粒和不同偶联率的叶酸-壳聚糖Prdx6 shRNA纳米粒经DNaseΙ酶消化后,1%的琼脂糖凝胶电泳,结果见图 4。第1道为裸露质粒,DNaseΙ酶消化后未见明显条带,完全被消化;第2道为壳聚糖Prdx6 shRNA纳米粒;第3~5道为叶酸-壳聚糖Prdx6 shRNA纳米粒(偶联率分别为3%、7.5%、11.5%)。第2~5泳道所有样本电泳后在加样孔都发生移动延滞。

|
| 图 4 DNA酶保护实验凝胶电泳图 Figure 4 DNA enzyme protection test gel electrophoresis 1: Blank plasmid were treated with DNaseΙ; 2: Non-targeted chitosan polymeric nanoparticles were treated with DNaseΙ; 3~5: Folate-targeted chitosan polymeric nanoparticles were treated with DNaseΙ |
叶酸-壳聚糖Prdx6 shRNA纳米粒(靶向组)和壳聚糖Prdx6 shRNA纳米粒(非靶向组)分别转染48h后荧光显微镜下观察,两组细胞内均观察到绿色荧光,两组细胞内绿色荧光点特征一致,但靶向组荧光表达的细胞数量及强度明显多于对照组,见图 5。
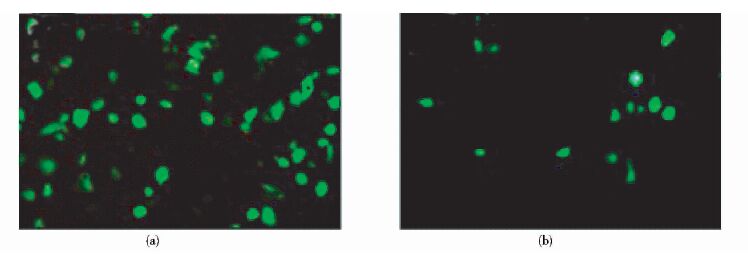
|
| 图 5 Prdx6 shRNA纳米粒转染胃癌细胞48h效果图(×200) Figure 5 Fluorescent microscopy after gene transfection of shRNA plasmid DNA with 48h incubation in SNU-16 cells (a) Cells were treated with folate chitosan Prdx6 shRNA nanoparticles (b) Cells were treated with non-targeted chitosan Prdx6 shRNA nanoparticles(×200) |
将叶酸-壳聚糖Prdx6 shRNA纳米粒(靶向组)、壳聚糖Prdx6 shRNA纳米粒(非靶向组)及壳聚糖纳米粒(空白对照组)分别转染胃癌细胞,72h后抽提蛋白质,经Western blotting 检测发现,叶酸-壳聚糖Prdx6 shRNA纳米粒组Prdx6蛋白表达显著低于壳聚糖Prdx6 shRNA纳米粒组,两组的蛋白质表达量均低于壳聚糖纳米粒组,见图 6。
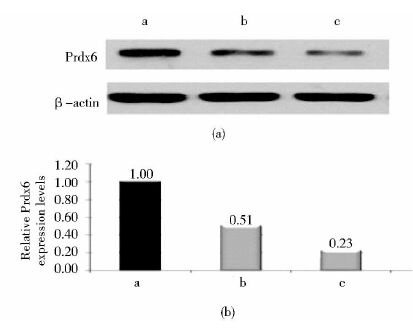
|
| 图 6 Western blotting 检测纳米粒转染后胃癌细胞Prdx6蛋白的表达 Figure 6 Protein changes of SNU-16 cells after transfection by different nanoparticles with Western blotting assay (a) Cells were treated with chitosan polymeric nanoparticles (b) Cells were treated with non-targeted chitosan Prdx6 shRNA nanoparticles (c) Cells were treated with folate chitosan Prdx6 shRNA nanoparticles |
CCK8细胞增殖实验检测发现,叶酸-壳聚糖Prdx6 shRNA纳米粒转染人胃癌细胞SNU-16 72h后,靶向纳米组及非靶向纳米组胃癌细胞的增殖速率均低于正常对照组(P<0.05),120h后靶向纳米组胃癌细胞的增殖速率和非靶向纳米组相比有显著下降(P<0.01),见图 7。
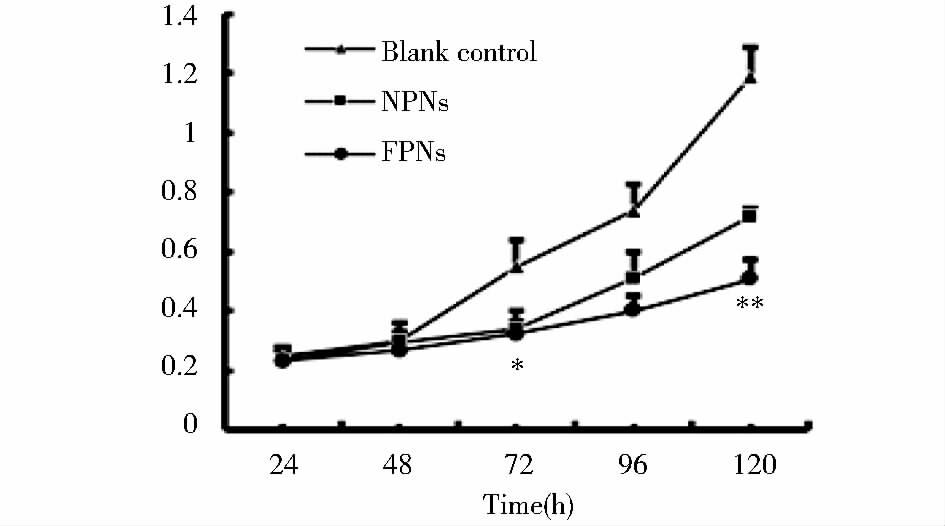
|
| 图 7 转染叶酸-壳聚糖Prdx6 shRNA纳米粒后胃癌细胞生长的变化 Figure 7 The growth curves of SNU-16 cell after folate chitosan Prdx6 shRNA nanoparticles transfection x±s,n=3; * P< 0. 05,** P< 0. 01;Vs non targeting nanoparticles group |
近年来,活性氧(reactive oxygen species,ROS)与肿瘤的关系引起国内外学者的重视[3-4]。人们发现低浓度的ROS能够促进肿瘤细胞的有丝分裂与细胞增殖,增加基因组不稳定性而诱导肿瘤的发生、进展。但是,如果肿瘤细胞内ROS浓度升高的过快则能够损伤DNA、蛋白质及脂质,引起细胞凋亡和坏死。研究表明,肿瘤细胞对ROS的敏感性高于正常组织,因此,通过增加肿瘤细胞内的ROS浓度进而达到抑制其生长可以成为肿瘤治疗的一种新方法[5]。
细胞在新陈代谢过程中不断生成ROS,同时,对抗ROS的机制也在发挥作用,从而维持细胞内氧化与抗氧化的一个相对平衡。抗氧化酶是对抗ROS的重要物质之一。抗氧化蛋白Prdx6是一种带有GSH过氧化物酶和PLA2活性的多功能蛋白质,在清除H2O2、短链过氧化物、脂肪酸过氧化物和磷脂过氧化物中起着重要作用[6-7]。近年来多项研究表明,Prdx6基因与肿瘤的发生、发展密切相关。Lee等[8]发现,Prdx6能够通过激活PI3K、p38 及Akt等信号转导通路提高肺癌细胞的侵袭能力。Ho等[9]发现,Prdx6基因的高表达能够促进肺癌细胞的转移。此外 还有研究者发现,Prdx6基因的高表达能够增加卵巢癌细胞对化疗药物顺铂的耐药性[10]。由于所有利用氧的生物体代谢过程中都会产生氧自由基,作为一种抗氧化蛋白,Prdx6能够阻止H2O2在细胞内的聚积,在保护细胞免受氧自由基损害的过程中发挥重要作用,同时,Prdx6基因的表达与肿瘤的发生、发展密切相关。因此,我们推测,阻断Prdx6蛋白的表达可以干扰肿瘤细胞内氧化还原反应的稳定,导致细胞凋亡。因此,本研究设计出叶酸-壳聚糖Prdx6 shRNA纳米粒,期望通过阻断Prdx6蛋白的表达来干扰胃癌细胞内氧化还原反应的稳定,达到抑制其生长的目的。
尽管RNA干扰有很强的抑制目的基因的作用,比反义寡核苷酸抑制目的基因的效果更强,但是,RNA干扰的应用还存在一些问题,如其导入细胞内的能力较弱、血液中稳定性较差以及具有非特异免疫原性等。因此,保证尽可能多的siRNA分子进入目的细胞内,并持久发挥干扰作用是基因治疗的关键。制备高效、安全的基因转染载体是目前研究的热点问题。其中,纳米基因载体作为一种新型的非病毒载体越来越引起人们的重视[11-12]。
本研究制备出能抑制胃癌细胞生长的转染率高、安全可靠、携带针对Prdx6基因的叶酸-shRNA纳米基因载体。与病毒载体相比较,该纳米载体具有以下几个优势:①无免疫原性;②无遗传毒性与细胞毒性;③由于其特殊的结构及表面电荷,具有很高的基因转移效率;④可介导外源基因在宿主细胞染色体DNA中的整合,从而获得转基因的长期、稳定表达;⑤可保护siRNA不受机体血浆,或组织细胞中各种补体及酶的破坏,有利于目的基因在转导进入靶细胞后,能更好、更稳定地发挥作用。同时,我们设计了叶酸靶向配体耦合到纳米颗粒上,由于胃癌细胞表面叶酸受体的高表达,导致该纳米基因复合物具有主动靶向性,能够特异性地识别胃癌细胞并杀伤。因此,靶向纳米治疗是一种有潜力的能作为肿瘤治疗的新平台,已经展现出美好的前景。
| [1] | Choi H, Chang J W, Jung Y K. Peroxiredoxin 6 interferes with TRAIL-induced death-inducing signaling complex formation by binding to death effector domain caspase. Cell Death Differ , 2011, 18 (3) : 405–414. DOI:10.1038/cdd.2010.113 |
| [2] | Wittrup A, Lieberman J. Knocking down disease:a progress report on siRNA therapeutics. Nat Rev Genet , 2015, 16 (9) : 543–552. DOI:10.1038/nrg3978 |
| [3] | Tong L, Chuang C C, Wu S, et al. Reactive oxygen species in redox cancer therapy. Cancer Lett , 2015, 367 (1) : 18–25. DOI:10.1016/j.canlet.2015.07.008 |
| [4] | Kang S W, Lee S, Lee E K. ROS and energy metabolism in cancer cells:alliance for fast growth. Arch Pharm Res , 2015, 38 (3) : 338–345. DOI:10.1007/s12272-015-0550-6 |
| [5] | Glasauer A, Chandel N S. Targeting antioxidants for cancer therapy. Biochem Pharmacol , 2014, 92 (1) : 90–101. DOI:10.1016/j.bcp.2014.07.017 |
| [6] | Zhou S, Sorokina E M, Harper S, et al. Peroxiredoxin 6 homodimerization and heterodimerization with glutathione S-transferase pi are required for its peroxidase but not phospholipase A2 activity. Free Radic Biol Med , 2016, 94 : 145–156. DOI:10.1016/j.freeradbiomed.2016.02.012 |
| [7] | Ma S, Zhang X, Zheng L, et al. Peroxiredoxin 6 is a crucial factor in the initial step of mitochondrial clearance and Is upstream of the PINK1-parkin pathway. Antioxid Redox Signal , 2016, 24 (9) : 486–501. DOI:10.1089/ars.2015.6336 |
| [8] | Lee S B, Ho J N, Yoon S H, et al. Peroxiredoxin 6 promotes lung cancer cell invasion by inducing urokinase-type plasminogen activator via p38 kinase, phosphoinositide 3-kinase, and Akt. Mol Cells , 2009, 28 (6) : 583–588. DOI:10.1007/s10059-009-0152-6 |
| [9] | Ho J N, Lee S B, Lee S S, et al. Phospholipase A2 activity of peroxiredoxin 6 promotes invasion and metastasis of lung cancer cells. Mol Cancer Ther , 2010, 9 (4) : 825–832. DOI:10.1158/1535-7163.MCT-09-0904 |
| [10] | Pak J H, Choi W H, Lee H M, et al. Peroxiredoxin 6 overexpression attenuates cisplatin-induced apoptosis in human ovarian cancer cells. Cancer Invest , 2011, 29 (1) : 21–28. DOI:10.3109/07357907.2010.535056 |
| [11] | Gebremedhin S, Singh A, Koons S, et al. Gene delivery to carcinoma cells via novel non-viral vectors:nanoparticle tracking alysis and suicide gene therapy. Eur J Pharm Sci , 2014, 60 : 72–79. DOI:10.1016/j.ejps.2014.03.003 |
| [12] | Askar S, Abnous K, Taghavi S, et al. Cellular delivery of shRNA using aptamer-conjugated PLL-alkyl-PEI nanoparticles. Colloids Surf B Biointerfaces , 2015, 136 : 355–364. DOI:10.1016/j.colsurfb.2015.09.023 |
 2017, Vol. 37
2017, Vol. 37




