文章信息
- 李超, 刘波, 陶玉芬, 李昕潼, 刘建生, 刘红旗.
- LI Chao, LIU Bo, TAO Yu-fen, LI Xin-tong, LIU Jian-sheng, LIU Hong-qi.
- EV71病毒中和表位和诺如病毒P结构域嵌合蛋白的原核表达
- Expression of Chimeric Protein of Norovirus P Domain and Neutralizing Epitopes of EV71 in Prokaryotic Escherichia coli
- 中国生物工程杂志, 2017, 37(1): 1-6
- China Biotechnology, 2017, 37(1): 1-6
- http://dx.doi.org/DOI:10.13523/j.cb.20170101
-
文章历史
- 收稿日期: 2016-08-04
- 修回日期: 2016-09-18
诺如病毒(Norovirus)是首个确认为引起人类急性胃肠炎的病毒[1],也是造成儿童和成人胃肠炎流行的重要原因[2],诺如病毒感染性腹泻在全世界范围内均有流行。肠道病毒71型(Enterovirus71,EV71)是导致5岁以下儿童患手足口病(hand-foot-and-mouth disease,HFMD)的主要病原体之一,在我国大部分的省份均有流行[3],同时该病毒具有嗜神经组织的特性,可引起部分患儿发生重症感染,并引起多种与神经系统相关的并发症[4]。目前,还没有有效的药物能治疗这两种病毒的感染,疫苗仍然是防治它们最有效的途径之一。
诺如病毒衣壳蛋白VP1由N端的S结构域和C端的P结构域组成[5]。P结构域(P domain)与病毒衣壳外部形成的刺突有关,也是诺如病毒与受体结合的关键区域;每个P结构域上包含3个环形(loop)结构,这些环中可容纳较大基因片段的插入,是外来抗原提呈的位点[6-8]。P结构域可单独表达形成P蛋白,近年来的研究表明,P蛋白可在原核表达系统中获得,它自发组装形成的P粒子具有良好的免疫原性,该粒子不仅是外来抗原的良好提呈载体,而且也是诺如病毒亚单位疫苗研究的热点[9-10]。
EV71病毒的颗粒为二十面体立体对称的球形结构,包含VP1、VP2、VP3、VP4 四个结构蛋白,其中VP1、VP2、VP3暴露在病毒外壳的表面,而VP4包埋在病毒外壳的内侧,因此抗原决定簇基本位于VP1、VP2、VP3上。文献表明[11-13],在EV71不同基因亚型之间存在具有高度保守性的三个线性中和抗原表位,即结构蛋白VP1上的SP55(163~177aa)和SP70(208~222aa)以及VP2上的SP28(136~150aa),它们是亚单位疫苗的理想候选分子。
本研究主要是在原核表达系统中表达诺如病毒P结构域和EV71线性中和抗原表位的嵌合蛋白,通过免疫印迹分析表明,表达获得的嵌合蛋白分别能与抗诺如病毒P结构域血清、抗EV71的血清发生特异性结合,表明其具有较好的抗原性,这些嵌合蛋白有望作为诺如病毒和EV71二价亚单位疫苗以及检测试剂盒研发的候选抗原。
1 材料与方法 1.1 质粒和菌株原核表达质粒p42(图 1)来自美国辛辛那提儿童医学研究中心,包含诺如病毒GII.4 VA387的P结构域和GST标签,由本实验室保存。E.coli DH5α 和E.coli BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。
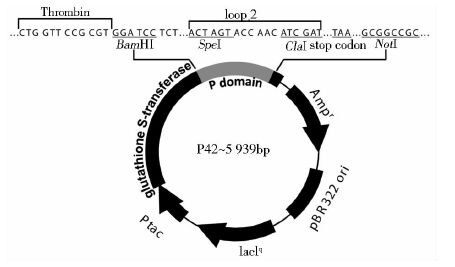
|
| 图 1 P42的质粒图谱及其P结构域loop 2 的核苷酸序列 Figure 1 Map of p42 plasmid and nucleotide sequence of loop 2 of P domain |
限制性内切酶Spe I、Cla I和T4 DNA Ligase购自New England Biolabs(NEB)公司;DNA聚合酶GoTaq®G2 Green Master Mix购自Promega公司;无缝克隆试剂In-Fusion® HD Cloning Kit购自宝生物工程(大连)有限公司;质粒提取试剂盒EasyPure Plasmid MiniPrep Kit购自北京全式金生物技术有限公司;GST融合蛋白纯化磁珠BeaverBeadsTM GSH购自海狸纳米科技(苏州)有限公司;还原型谷胱甘肽L-Glutathione reduced购自Sigma-Aldrich公司;GST Rabbit mAb、Anti-rabbit IgG(HRP-linked antibody)购自Cell Signaling Technology(CST)公司;抗EV71兔血清来自于本研究所;抗诺如病毒P结构域小鼠血清来自本实验室;PierceTM Fast Western blot Kit,ECL Substrate购自Thermo Fisher Scientific公司。
1.3 实验方法 1.3.1 表位序列的设计与合成根据文献报道,获取EV71病毒三个中和表位SP55、SP70和SP28的氨基酸序列如表 1所示,由这3个单表位进行不同的组合设计出4个串联表位,串联表位中各单表位之间由连接肽(G4S)3连接,依据大肠杆菌密码子表达使用的偏好性来设计核苷酸序列。EV71单个中和抗原表位先人工合成2条互补的寡核苷酸链(上海Invitrogen公司),通过退火形成双链DNA用于克隆,而串联表位是先通过人工方法合成基因,再利用Primer Premier 5软件设计无缝克隆引物将其从合成的基因质粒(北京唯尚立德公司)中扩增出来。最后,这些基因片段均通过P结构域的loop 2克隆到限制性内切核酸酶Spe I和Cla I酶切过的p42质粒中。优化后EV71中和表位的单表位和串联表位的核苷酸序列见表 2。
| 表位名称 | 长度(aa) | 氨基酸序列 |
| SP55 | 15 | PESRESLAWQTATNP |
| SP70 | 15 | YPTFGEHKQEKDLEY |
| SP28 | 13 | GTGTEDSHPPYKQ |
| SP55-SP70 | 45 | PESRESLAWQTATNP(G4S)3YPTFGEHKQEKDLEY |
| SP55-SP28 | 43 | PESRESLAWQTATNP(G4S)3GTGTEDSHPPYKQ |
| SP70-SP28 | 43 | YPTFGEHKQEKDLEY(G4S)3GTGTEDSHPPYKQ |
| SP55-SP70-SP28 | 73 | PESRESLAWQTATNP(G4S)3YPTFGEHKQEKDLEY(G4S)3GTGTEDSHPPYKQ |
| 合成的表位 | 核苷酸序列(5′→3′) | 长度(bp) |
| SP55-F | CTAGTCCGGAAAGCCGTGAATCTCTGGCTTGGCAGACGGCAACCAACCCGAT | 52 |
| SP55-R | CGATCGGGTTGGTTGCCGTCTGCCAAGCCAGAGATTCACGGCTTTCCGGA | 50 |
| SP70-F | CTAGTTACCCGACCTTCGGTGAACACAAACAGGAAAAAGACCTGGAATATAT | 52 |
| SP70-R | CGATATATTCCAGGTCTTTTTCCTGTTTGTGTTCACCGAAGGTCGGGTAA | 50 |
| SP28-F | CTAGTGGTACCGGCACCGAAGACTCTCACCCGCCGTACAAACAGAT | 46 |
| SP28-R | CGATCTGTTTGTACGGCGGGTGAGAGTCTTCGGTGCCGGTACCA | 44 |
| SP55-SP70-SP28 | ACTAGTCCGGAAAGCCGTGAATCTCTGGCTTGGCAGACGGCAACCAACCCGggtggtggtggtagcggtg gcggtggctctggtggtggtggctctTACCCGACCTTCGGTGAACACAAACAGGAAAAAGACCTGGAATATg gtggtggcggctctggtggcggtggctccggtggtggcggttctGGTACCGGCACCGAAGACTCTCACCCGCCGTACAA ACAGATCGAT | 231 |
| SP55-SP70 | ACTAGTCCGGAAAGCCGTGAATCTCTGGCTTGGCAGACGGCAACCAACCCGggtggtggtggtagcggtgg cggtggctctggtggtggtggctctTACCCGACCTTCGGTGAACACAAACAGGAAAAAGACCTGGAATATATCGAT | 147 |
| SP55-SP28 | ACTAGTCCGGAAAGCCGTGAATCTCTGGCTTGGCAGACGGCAACCAACCCGggtggtggtggtagcggt ggcggtggctctggtggtggtggctctGGTACCGGCACCGAAGACTCTCACCCGCCGTACAAACAGATCGAT | 141 |
| SP70-SP28 | ACTAGTTACCCGACCTTCGGTGAACACAAACAGGAAAAAGACCTGGAATATggtggtggcggctctggt ggcggtggctccggtggtggcggttctGGTACCGGCACCGAAGACTCTCACCCGCCGTACAAACAGATCGAT | 141 |
| Note: Partial or full sequences of recognition sites of Spe I(ACTAGT),Cla I(ATCGAT) were underlined. Lowercase letters were nucleotide sequences of (G4S)3 linker | ||
1.3.2 重组质粒的构建
用限制性内切核酸酶Spe I和Cla I酶切p42质粒,得到线性化的载体。将表 2中单表位的两条核苷酸链退火成双链(退火缓冲液:10mmol/L Tris-HCl,pH7.5、1mol/L EDTA、0.1mol/L NaCl),用T4 DNA连接酶连接退火的双链与双酶切后的p42质粒。通过设计的无缝克隆引物将表 2中各串联表位从合成的基因中扩增出来,然后通过无缝克隆试剂盒将它们克隆到经Spe I和Cla I酶切后的p42质粒中。连接后的7个质粒分别转化DH5α感受态细胞,涂布于含0.01%氨苄西林的LB平板生长后挑阳性克隆送昆明硕擎生物科技有限公司进行测序验证。
1.3.3 诱导表达嵌合蛋白将测序正确的7个重组质粒分别转化到E. coli BL21(DE3)感受态细胞中,涂布于含0.01%氨苄西林的LB平板生长后挑阳性克隆接种到含0.01%氨苄西林的LB液体培养基中,37℃摇床培养至OD600约为0.5时,加入IPTG至终浓度为0.5mmol/L,22℃过夜诱导表达。将诱导表达的菌液离心(12 000g、4℃、10min),收集的菌体用PBS(pH:7.4)重悬,超声破碎菌体,再次离心(12 000g、4℃、10min),分别收集上清液和沉淀,用SDS-PAGE(10%)进行分析。
1.3.4 嵌合蛋白的纯化及鉴定诱导表达的嵌合蛋白大部分存在于超声破碎菌体所获取的上清液中,按BeaverBeadsTM GSH磁珠使用说明书,用磁珠对上清液中的目的蛋白进行纯化,其中目的蛋白洗脱液中还原型谷胱甘肽浓度为20mmol/L。纯化后的目的蛋白再用SDS-PAGE和免疫印迹法进行分析。用于免疫印迹分析的抗体分别为抗GST单抗、抗EV71兔血清、抗诺如病毒P结构域小鼠血清。
1.3.5 嵌合蛋白的结构预测基于各个嵌合蛋白的氨基酸序列,通过在线蛋白质结构预测工具SWISS-MODEL(http://swissmodel.expasy.org/interactive)对其蛋白质结构进行预测。
2 结 果 2.1 重组表达质粒的鉴定测序结果提示EV71各单表位和串联表位都被正确地克隆到p42质粒P结构域loop 2的Spe I和Cla I酶切位点之间,成功地构建了7个诺如病毒P结构域和EV71中和抗原表位嵌合基因重组质粒。
2.2 原核系统表达的嵌合蛋白通过10%胶的SDS-PAGE分析全菌体发现,EV71各单表位、串联表位与诺如病毒P结构域形成的嵌合蛋白均有表达,分子质量与理论值基本相符,位于55~72kDa(图 2)。各表位嵌合蛋白主要以可溶性的形式表达于超声破碎菌体后的上清液。
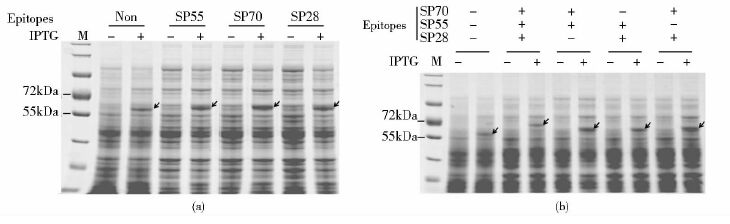
|
| 图 2 SDS-PAGE和考马斯亮蓝染色分析蛋白质表达 Figure 2 Analysis of protein expression via SDS-PAGE and Commassie blue staining (a) EV71 single neutralizing epitopes (b) EV71 tandem neutralizing epitopes |
IPTG诱导表达后的细菌经超声破碎和离心后的上清液,用Beaver BeadsTM GSH磁珠对各GST融合蛋白进行纯化,并用10%的胶SDS-PAGE进行分析。考马斯亮蓝染色结果显示,获得了预期分子质量大小的纯化蛋白质(图 3)。
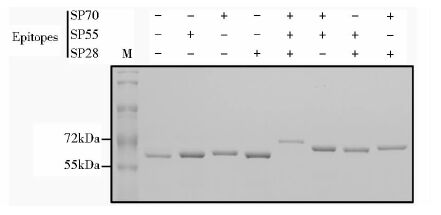
|
| 图 3 纯化后的GST融合蛋白的SDS-PAGE和考马斯亮蓝染色分析 Figure 3 Analysis of purified GST-fused proteins via SDS-PAGE and Commassie blue staining |
首先我们利用抗GST单克隆抗体和通过免疫印迹法验证了表达的融合蛋白都有GST标签,蛋白质分子量为预期大小,位于55~72kDa,这也表明我们通过GST亲和磁珠得到的蛋白质为GST融合蛋白[图 4(a)]。然后,我们通过免疫印迹法对表达的EV71和诺如病毒P结构域嵌合蛋白的免疫原性进行了分析。利用抗EV71病毒多克隆抗体的免疫印迹分析表明,除单表位SP55和SP28没有明显的免疫反应外,其它的5个单表位或串联表位都有很强的反应[图 4(b)]。抗诺如病毒P结构域的多克隆抗体分析发现,所有7个嵌合蛋白都能与这一抗体反应[图 4(c)]。这些结果表明,我们表达的EV71中和抗原表位与诺如病毒P结构域嵌合蛋白具有针对这两种病毒的抗原性。
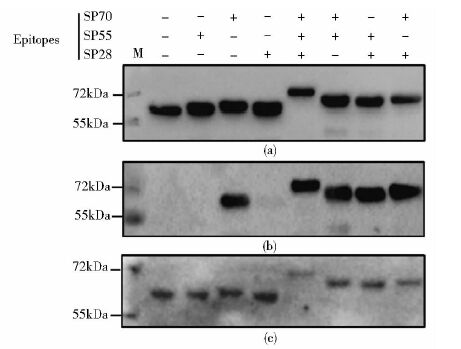
|
| 图 4 免疫印迹法分析EV71中和抗原表位和诺如病毒P结构域嵌合蛋白 Figure 4 Immunoblot analysis of chimeric proteins of EV71 neutralizing epitopes and Norovirus P domain (a) Rabbit anti-GST mAb (b) Rabbit anti-EV71 pAb (c) Mouse anti-P domain pAb |
我们通过在线蛋白质结构预测工具SWISS-MODEL对诺如病毒P结构域及其与EV71各中和表位形成的7个嵌合蛋白结构进行了预测(图 5)。除EV71的3个表位串联的嵌合蛋白是单体外,其它6个嵌合蛋白都可以形成二聚体,且EV71的各个表位及组合均能较好地展示在诺如病毒P结构域的表面,这进一步从理论上支持了这些嵌合蛋白的抗原性。

|
| 图 5 EV71各表位和诺如病毒P结构域嵌合蛋白空间结构的模型 Figure 5 Structural models of chimeric proteins of EV71 neutralizing epitopes and norovirus P domain The box with dotted lines marked EV71 neutralizing epitopes |
诺如病毒和肠道病毒71型是严重危害人类健康的两类病毒,尤其给儿童的健康甚至生命构成威胁。目前,这两类病毒感染在中国部分地区已出现了暴发和流行。疫苗免疫仍然是有效预防这两类疾病的重要措施。然而,由于这两类病毒均为单股正链RNA病毒,该病毒在复制过程中没有校对功能,容易发生突变,这给灭活疫苗的研发带来困难。基因工程疫苗的优点是:一旦建立起了平台,可以快速地更换中和抗原表位,以应对病毒的变异。多个研究清楚地表明,诺如病毒P结构域是诱导中和抗体产生的主要抗原。对于EV71来说,其结构蛋白上许多线性中和抗原表位也已被确定[14]。因此,本研究基于诺如病毒和EV71已知的中和抗原表位设计二价亚单位疫苗的载体,在原核系统中进行表达,可以高效地获得具有抗原性的嵌合中和抗体表位蛋白,为二价疫苗的研发建立一个新型平台。
本研究选用的载体p42中已经包含了诺如病毒P结构域,它不仅可以用于诺如病毒本身疫苗的研发,也可作为疫苗载体来提呈其他病原体抗原成分研发二价疫苗。比如,用它来提呈轮状病毒、流感病毒的抗原成分表明,这两个嵌合的疫苗都能很好的诱导机体产生针对诺如病毒与轮转病毒、诺如病毒与流感病毒特异性的抗体以及免疫保护力[15-17]。我们成功地利用该载体展示了EV71的3个高度保守的线性中和抗原表位。在构建EV71串联表位的重组质粒时,我们在两表位之间加入了甘氨酸(G)和丝氨酸(S)组成的连接肽(G4S)3,这样不仅能使各表位保持相对独立,还有利于抗原提呈[18-19]。我们最终获得的EV71线性中和抗原表位和诺如病毒P结构域的嵌合蛋白均能与抗诺如病毒P结构域的小鼠血清发生特异性的结合。对于抗EV71的多克隆抗体,除SP55和SP28单表位的嵌合蛋白不表现抗原性外,其它单表位和串联表位形成的嵌合蛋白均有一定的抗原性,这可能是因为:①3个线性中和抗原表位中,SP70的抗原性较SP55和SP28的抗原性相对较强;②SP55和SP28嵌合在P结构域中可能不能够被充分地展示出来(图 5);③SP55和SP28串联表位嵌合蛋白有抗原性,表明它们之间可能存在协同增强的作用。
总之,本研究成功地在大肠杆菌中表达了EV71病毒的线性中和抗原表位和诺如病毒P结构域的嵌合蛋白,且具有抗原性,这为将来开发诺如病毒和EV17病毒的二价疫苗及检测试剂盒奠定了一定的基础。
| [1] | Kapikian A Z, Wyatt R G, Dolin R, et al. Visualization by immune electron microscopy of a 27-nm particle associated with acute infections nonbacterial gastroenteritis. Journal of Virology , 1972, 10 (5) : 1075–1081. |
| [2] | Dolin R. Noroviruses-challenges to control. N Engl J Med , 2007, 357 (11) : 1072–1073. DOI:10.1056/NEJMp078050 |
| [3] | Yang F, Ren L L, Xiong Z H, et al. Enterovirus 71 outbreak in the People's Republic of China in 2008. Journal of Clinical Microbiology , 2009, 47 (7) : 2351–2352. DOI:10.1128/JCM.00563-09 |
| [4] | Chen S C, Chang H L, Yan T R, et al. An eight-year study of epidemiologic features of Enterovirus 71 infection in Taiwan. Am J Trop Med Hyg , 2007, 77 (1) : 188–191. |
| [5] | Prasad B V V, Hardy M E, Dokland T, et al. X-ray crystallographic structure of the Norwalk virus capsid. Science , 1999, 286 (5438) : 287–290. DOI:10.1126/science.286.5438.287 |
| [6] | Cao S, Lou Z Y, Tan M, et al. Structural basis for the recognition of blood group trisaccharides by norovirus. Journal of Virology , 2007, 81 (11) : 5949–5957. DOI:10.1128/JVI.00219-07 |
| [7] | Tan M, Fang P A, Chachiyo T, et al. Noroviral P particle:structure, function and applications in virus-host interaction. Virology , 2008, 382 (1) : 115–123. DOI:10.1016/j.virol.2008.08.047 |
| [8] | Tan M, Jiang X. The P domain of norovirus capsid protein forms a subviral particle that binds to histo-blood group antigen receptors. Journal of Virology , 2005, 79 (22) : 14017–14030. DOI:10.1128/JVI.79.22.14017-14030.2005 |
| [9] | Fang H, Tan M, Xia M, et al. Norovirus P particle efficiently elicits innate, humoral and cellular immunity. PLoS One , 2013, 8 (4) : e63269. DOI:10.1371/journal.pone.0063269 |
| [10] | Tan M, Huang P W, Xia M, et al. Norovirus P particle, a novel platform for vaccine development and antibody production. Journal of Virology , 2011, 85 (2) : 753–764. DOI:10.1128/JVI.01835-10 |
| [11] | Liu C C, Chou A H, Lien S P, et al. Identification and characterization of a cross-neutralization epitope of Enterovirus 71. Vaccine , 2011, 29 (26) : 4362–4372. DOI:10.1016/j.vaccine.2011.04.010 |
| [12] | Foo D G W, Alonso S, Phoon M C, et al. Identification of neutralizing linear epitopes from the VP1 capsid protein of Enterovirus 71 using synthetic peptides. Virus Research , 2007, 125 (1) : 61–68. DOI:10.1016/j.virusres.2006.12.005 |
| [13] | Li Y X, Zhao H, Cao R Y, et al. Recombinant tandem multi-linear neutralizing epitopes of human Enterovirus 71 elicited protective immunity in mice. Virology Journal , 2014, 11 (1) : 79–86. DOI:10.1186/1743-422X-11-79 |
| [14] | 高文超, 国泰, 王玉琳. EV71抗原表位的研究方法及研究进展. 中国生物制品学杂志 , 2014, 27 (6) : 852–855. Gao W C, Guo T, Wang Y L. Method for and advance in research on neutralizing epitope of EV71. Chin J Biologicals , 2014, 27 (6) : 852–855. |
| [15] | Tan M, Jiang X. Norovirus P particle, a subviral nanoparticle for vaccine development against norovirus, rotavirus and influenza virus. Nanomedicine , 2012, 7 (6) : 889–897. DOI:10.2217/nnm.12.62 |
| [16] | Xia M, Tan M, Wei C, et al. A candidate dual vaccine against influenza and noroviruses. Vaccine , 2011, 29 (44) : 7670–7677. DOI:10.1016/j.vaccine.2011.07.139 |
| [17] | Wang L Y, Cao D J, Wei C, et al. A dual vaccine candidate against norovirus and hepatitis E virus. Vaccine , 2014, 32 (4) : 445–452. DOI:10.1016/j.vaccine.2013.11.064 |
| [18] | Li P, Zheng Q S, Wang Q, et al. Immune responses of recombinant adenoviruses expressing immunodominant epitopes against Japanese encephalitis virus. Vaccine , 2008, 26 (46) : 5802–5807. DOI:10.1016/j.vaccine.2008.08.035 |
| [19] | Su C X, Duan X G, Wang X Q, et al. Heterologous expression of FMDV immunodominant epitopes and HSP70 in P. pastoris and the subsequent immune response in mice. Veterinary Microbiology , 2007, 3-4 : 256–263. |
 2017, Vol. 37
2017, Vol. 37




