文章信息
- 高红桃, 郭晓威, 孙丹, 解长睿, 王法微, 李海燕.
- GAO Hong-tao, GUO Xiao-wei, SUN Dan, XIE Chang-rui, WANG Fa-wei, LI Hai-yan.
- 亚麻芥种子油体的提取及稳定性研究
- Extraction of Camelina Seed Oil Body and Analysis of Stability
- 中国生物工程杂志, 2017, 37(9): 98-104
- China Biotechnology, 2017, 37(9): 98-104
- http://dx.doi.org/DOI:10.13523/j.cb.20170913
-
文章历史
- 收稿日期: 2017-01-20
- 修回日期: 2017-03-11
近年来,针对不同来源的植物油体的提取分离及其特点进行了诸多的研究[1-2]。研究表明,油体是由单层的磷脂膜包裹液态的三酰甘油(TAG)组合而成,其中油体蛋白、钙结合蛋白、固醇结合蛋白镶嵌于磷脂膜中[3],其中,油体蛋白是主要的膜蛋白,为碱性的疏水蛋白,由三部分组成:亲脂性的N端、C端及中间的输水区域[4];以使油体产生电阻及空间排斥的作用,进而使油体能够稳定独立的存在[5-7]。同时,其内部包裹存在的TAG为植物种子的萌发也起到了很重要的作用。因油体具有类似天然脂质体的作用,可以对油体进行加工处理,在生产食品、饲料、药物、个人护理和工业产品等中得到广泛的应用[8-10]。此外,油体具有乳化剂的性质,还可以将其用于疫苗、食品、化妆品和个人护理产品的开发[11-16]。
植物中油体提取的相关研究已有所报道,在Tzen等[17]的研究基础上,熊丽东等[18]采用梯度离心、萃取抽提的方法得到红花油体蛋白,李玉琴[19]从油菜种子中提取油体及油体蛋白。Jacks等[20]用含有氯化钠的Tris-HCl缓冲液,蒸馏水洗涤数次得到纯净的油体。Nikiforidis和Kiosseoglou[21]提出的整个过程只用水来清洗离心提取油料中油体的方法,提取率高,是一种适合工业化生产的提取方法。Vesna等[22]对小油桐种子油体进行提取并对油体蛋白进行了分析。结果表明,由于提取过程中受到许多杂质的干扰,油体及其蛋白质的纯度会受到影响。曹艳云等[23]研究表明,虽然高碱性提取条件下能够获得纯净、不含过敏性蛋白及杂蛋白的油体,但它在一定程度上会改变所提取油体的成分及性质。尤其是对大豆油体表面蛋白质和磷脂成分产生较显著的影响。所得结果并不理想。据此,本研究首次对亚麻芥种子油体提取方法进行了研究,通过显微镜及激光粒度仪对亚麻芥种子中油体的结构及大小进行分析,采用SDS-PAGE对逐步清洗纯化的亚麻芥油体进行检测,确定杂蛋白的清除效果,并探讨了不同条件温度、pH、NaCl的处理对油体稳定性的影响,为建立以油体为基质的相关产品的开发奠定基础。
1 材料与方法 1.1 材料亚麻芥种子由吉林农业大学生物反应器与药物开发教育部工程研究中心提供。
1.2 方法 1.2.1 亚麻芥种子油体的提取方法称取亚麻芥种子10g,加入300ml 0.1mol/L NaOH过胶体磨充分研磨1min,于50ml离心管中分装配平,4℃、12 000r/min,条件下离心10min去杂;取上层油体于5倍A液(pH=7.5 0.5mol/L NaCl 0.4mol/L Sucrose)充分混匀稀释于4℃、12 000r/min,条件下离心10min;取上层油体加入5倍体积的无菌水(pH=9) 洗液吹打混匀4℃、12 000r/min,离心20min,去杂;重复上一步骤;取油体4℃放置。
根据Jacks等[20]研究的Tris-HCl油体提取法有所改动。称取亚麻芥种子10g;种子加入30倍体积0.15mol/L Tris-HCl缓冲液(pH=7.5 0.15mol/L Tris、0.01mol/L KCl、0. 001mol/L MgCl2、0.6mol/L Sucrose)研磨,12 000r/min,4℃离心20min,除去多余液体及残渣;取上层油体加入5倍的pH=7.5 Tris-HCl缓冲液(0.15mol/L Tris、0.01mol/L KCl、0.001mol/L MgCl2、0.6mol/L Sucrose)重悬吹打混匀12 000r/min、4℃离心20min,除残渣;取上层油体加入5倍体积pH=7.5 Tris-HCl缓冲液B(0.15mol/L Tris、0.01mol/L KCl、0. 001mol/L MgCl2、0.4mol/L Sucrose)重悬12 000r/min、4℃离心20min,除杂, 洗涤油体;取油体于空管中加入5倍体积0.1mol/L NaHCO3重悬离心12 000r/min,4℃,20min;取油体4℃放置。
根据Nikiforidis和Kiosseoglou等[21]研究的的水法提取油体进行改动。称取亚麻芥种子10g;种子加入300ml去离子水研磨,12 000r/min、4℃离心10min;取上层油体加入5倍体积的pH=7.0 C液(0.5mol/L NaCl、0.4mol/L Sucrose)吹打混匀10 000r/min、4℃离心10min,去杂;取上层油体加入5倍体积去离子水(0.1%吐温-20) 混合, 静止30min,10 000r/min、4℃离心10min,取上层油体加入5倍体积去离子水离心洗涤沉淀,10 000r/min,4℃离心10min;取油体4℃放置。
根据Vesna等[22]研究的Tricine-KOH法有所改动提取亚麻芥油体。称取亚麻芥种子10g;种子加入300ml pH=7.5的缓冲液(0.15mol/L Tricine、0.01mol/L KCl、0.001mol/L MgCl2、0.001mol/L EDTA)研磨粉碎,充分混匀,10 000r/min、4℃条件下离心30min去除杂质;取上层油体加入2.5倍体积的pH=7.5缓冲液D(0.15mol/L Tricine、0.01mol/L KCl、0.001mol/L MgCl2、0.001mol/L EDTA、0.6mol/L Sucrose)及2.5倍体积的pH=7.5缓冲液E(0.15mol/L Tricine、0.01mol/L KCl、0.001mol/L MgCl2、0.001mol/L EDTA、0.1mol/L Sucrose)混匀于10 000r/min、4℃条件下离心30min,去除杂质;重复上一步;取上层油体加入5倍的E液混匀10 000r/min、4℃离心30min,去杂;取油体4℃放置。
根据以上方法对亚麻芥种子油体进行提取,并对其粒径、显微结构、电位等指标进行检测,确定亚麻芥种子油体提取的最佳方法,并对其稳定性进行初步研究。
1.2.2 亚麻芥油体提取率的比较油体提取率(%)=提取油体的重量/种子的重量×100%。
1.2.3 亚麻芥油体显微结构的观察取少量亚麻芥种子油体,用蒸馏水将其稀释后滴在载玻片上,盖好盖玻片,于荧光倒置显微镜下(10倍目镜× 40倍物镜)观察亚麻芥油体的显微结构。
1.2.4 亚麻芥油体粒径及电位的测定用PSS 380ZLS激光粒度仪测定其平均粒径d,测定时样品稀释50~100倍使仪器达到相应的遮光度后进行测定,每个样品平行测定3次,进行统计分析。
1.2.5 亚麻芥油体蛋白SDS-PAGE检测收集4种油体提取方法提取的亚麻芥油体,取20μl样品加入20μl去离子水后加入10μl的5×Loading buffer,混合均匀后于沸水中煮10min,制备12%的SDS-PAGE液,上样量为10μl做蛋白质鉴定。
1.3 亚麻芥油体稳定性的初步研究不同pH、温度对离体油体稳定性的影响参照Iwanaga等的方法进行优化。
1.3.1 不同pH的亚麻芥湿油体的制备分别称取亚麻芥新鲜油体2ml,用0.1mol/L HCl或0.1mol/L NaOH调节样品值为4、5、6、7、8、9、10的样品,置于4℃冰箱放置36h后检测油体的显微结构及粒径。
1.3.2 不同温度处理的亚麻芥油体的制备分别称取亚麻芥新鲜油体2ml于20℃、40℃、60℃、80℃水浴锅内水浴加热30min后,4℃冰箱放置36h后检测油体的显微结构及粒径。
1.3.3 不同氯化钠浓度的亚麻芥油体的制备取亚麻芥新鲜油体20ml,用10mmol/L磷酸盐缓冲溶液(pH=7.0)1:5稀释混匀,分别取10ml稀释后的溶液依次加入50mmol/L、100mmol/L、150mmol/L、200mmol/L、250mmol/L的氯化钠,4℃冰箱放置36h后检测油体的显微结构及粒径。
注意:粒径检测用PSS 380ZLS激光粒度仪测定其平均粒径d,测定时样品稀释50~100倍使仪器达到相应的遮光度后进行测定,每个样品平行测定3次后进行统计分析。
2 结果与分析 2.1 亚麻芥油体的提取 2.1.1 不同提取方法对亚麻芥油体提取率及外观的影响根据不同提取方法回收所得的油体对其外观及提取率进行比较。由图 1可以看出,4种提取方法所得油体均为乳白色,Tris-HCl法和碱法所提取的油体含量明显高于水法和Tricine法,分别为17%和25%;水法和Tricine法油体提取率低于10%。

|
| 图 1 不同提取方法下的油体提取率及外观 Figure 1 Different method rate of extraction and surfaces of oil bodies |
从图 2中可见,在荧光及可见光条件下,4种油体提取方法回收所得油体的显微结构可明显看出:Tris-HCl法回收所得油体大小均一、分散均匀,而水法、Tricine法提取油体大小不均一。其中碱法回收所得的油体较少,可能是强碱性条件下油体的一些结构被破坏而导致油体减少。

|
| 图 2 可见光及荧光条件下的显微结构 Figure 2 Microstructure for visible and fluorescence conditions (a), (e) Oil bodies was recovered by Tris-HCl (b), (f) Oil bodies was recovered by Alkaline (c), (g) Oil bodies was recovered by water (d), (h) Oil bodies was recovered by Tricine |
为了测定不同提取方法对亚麻芥油体的粒径及油体表面电荷的影响,本实验采用激光纳米粒度仪检测4种方法所得油体的粒径及电位值如图 3所示,梯度离心之后,各提取方法收集到的油体大小均在400~1 000nm,且Tris-HCl法所得油体粒径最小。Tris-HCl法、水法及Tricine法所得油体电位值分别为-6.205mV、-7.505mV、-8.63mV,无太大差距;但与碱法相比,其电位值的绝对值均大于碱法回收所得油体的电位值的绝对值,有利于油体的稳定存在。
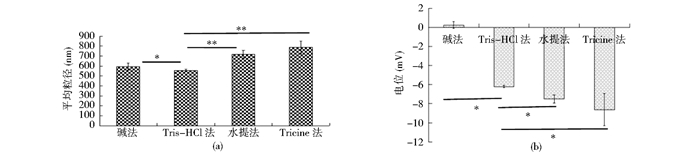
|
| 图 3 4种油体提取方法油体粒径(a)及电位(b)分析(P < 0.05) Figure 3 The oil bodies particle and zeta potentialas detected by four kinds of extraction method (P < 0.05) |
验证4种油体提取方法对亚麻芥油体蛋白的影响,本研究对4种油体提取方法下回收的油体进行SDS-PAGE分析,进一步确定4种油体提取方法对亚麻芥油体蛋白的影响,由图 4明显可以看出在20.1kDa处出现亚麻芥油体蛋白条带,经过4步洗涤之后碱法所回收的油体杂蛋白最少,其他三种方法所得油体杂蛋白均要多于碱法。
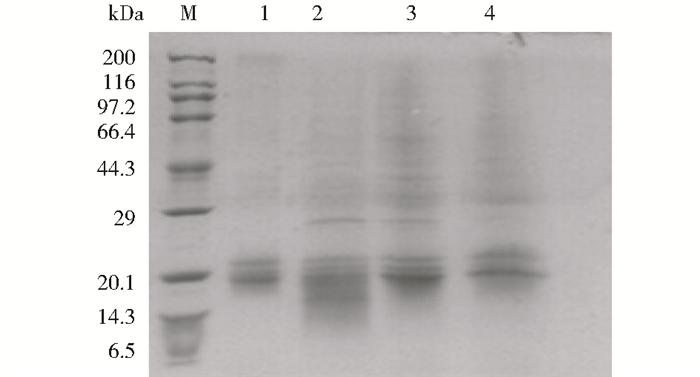
|
| 图 4 油体蛋白SDS-PAGE Figure 4 SDS-PAGE for oleosin M: Marker; 1-4:Alkali, water, Tris-HCl and Tricine method |
采用PSS 380ZLS激光粒度仪和荧光倒置显微镜分别测定得到不同温度处理下的油体粒度分布及显微结构。与未经过任何处理的亚麻芥油体比较,经过不同温度处理后的油体均不同程度破裂。说明不同温度处理对亚麻芥油体的稳定性并未起到任何作用,油体稳定性破坏(图 5)。
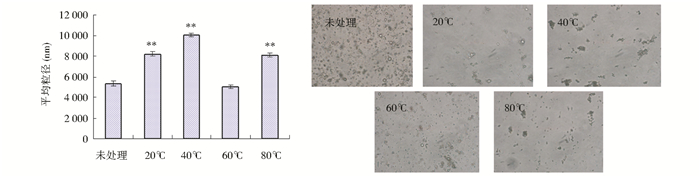
|
| 图 5 不同温度下亚麻芥油体粒度分布及显微结构(P < 0.05) Figure 5 The size distribution and microstructure of oil bodies under the different conditions of temperature (P < 0.05) |
采用PSS 380ZLS激光粒度仪和荧光倒置显微镜分别测定得到不同氯化钠浓度处理下的油体粒度(图 6)及显微结构。未经过NaCl处理时,油体粒径为5.0μm。NaCl浓度在0~150mmol/L时,油体粒径有所减小,显微镜下观察油体少量聚集。NaCl浓度在200~250mmol/L时,油体粒径变大,显微镜下观察油体之间明显聚集,稳定性破坏。
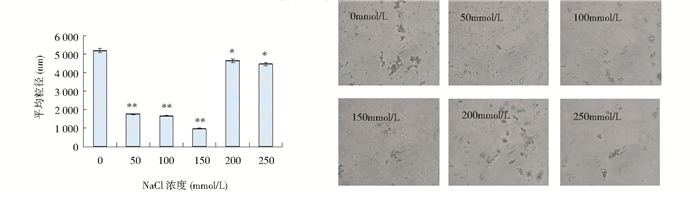
|
| 图 6 不同NaCl浓度下的油体粒度分布及显微结构(P < 0.05) Figure 6 The size distributionand microstructure of oil bodies under the different concertration of NaCl (P < 0.05) |
采用PSS 380ZLS激光粒度仪和荧光倒置显微镜分别测定得到不同pH条件下的油体粒度分布(图 7)及显微结构。当4≤pH≤7时,油体粒径明显增加,显微镜下油体明显聚集,形状不规则甚至破裂,稳定性显著下降。当8≤pH≤10时,油体粒径基本不变,平均粒径在0.5~3μm,镜检仅有少数油体聚集油体,油体较稳定,有助于油体储存,这与油体外观观察的结果一致。
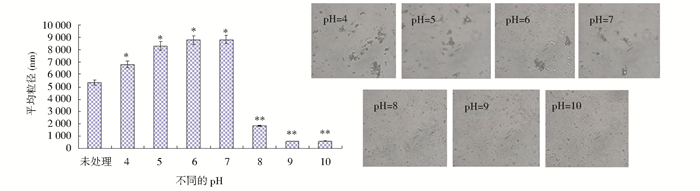
|
| 图 7 不同pH条件下的油体粒度分布及显微结构(P < 0.05) Figure 7 The size distribution and microstructure of oil bodies under the different conditions of pH (P < 0.05) |
Tzen等[17]提出的油体结构模型认为,油体是由包裹TAG的磷脂单分子层及油体蛋白镶嵌而成的, 具有亲水性的磷脂分子的头部暴露在外面,而其疏水性的结构位于油体的内侧。油体表面存在电荷,当油体表面的静电荷接近于零,通过静电聚合作用,油体之间发生聚集,形状不规则,导致油体的粒径增大;当远离油体蛋白的等电点时,包裹TAG的油体表面静电荷的绝对值增加,油体之间的排斥力也增强,可以保证油体稳定单个的存在而不发生聚集。因此,油体这种特殊的结构对其抵抗外界环境压力具有重要的作用。
目前,有关于大豆、花生、红花等油料作物油体的提取及稳定性的研究已经逐渐被报道。而针对油料作物亚麻芥油体的提取还未见报道,亚麻芥油体作为一种天然的纳米级大小的微型细胞器,并且内部含有丰富的不饱和脂肪酸,对油体及其在食品及化妆品行业等产品的开发具有研究意义。因此本研究首次对亚麻芥种子油体的提取及稳定性做了初步的研究。
本研究通过对亚麻芥种子油体的提取方法进行筛选,最终确定Tris-HCl法为亚麻芥油体提取的最佳方法。其油体回收率达17%,PSS 380ZLS激光粒度仪检测平均粒径在0.5~0.8μm,粒径最小;荧光及可见光条件才可观察到油体稳定均匀分散。
将回收获得新鲜的亚麻芥油体分别置于不同的pH、温度及NaCl浓度的PBS缓冲溶液中。当不同pH的处理时,改变了油体表面电荷状态;当pH在4~7时油体粒径变大,显微结构观察油体大量聚集破裂。在酸性及中性条件下,油体表面静电荷减小,导致油体表面的静电斥力减小,油体之间发生聚集甚至破裂,使其粒径变大。当pH在8~10时油体稳定分散,未发生聚集。因油体表面所带电荷为负电荷,在偏碱性条件下处理时静电荷量增加,油体之间的静电斥力足够大,使油体之间保持平衡而不发生聚集。当加入不同浓度的NaCl时,随着NaCl浓度的增加,油体的粒径呈先减小后增加的趋势,这与李宁等[24]的研究结果一致,李宁等[24]的研究也发现pH在4~6时油菜油体稳定性明显下降,油体直径显著增加;pH在7~8时油体粒径较小,稳定性较好,即油菜油体处在中性偏碱性条件下稳定存在。同时,高浓度的NaCl降低油体储存的稳定性。本研究结果显示这与前人研究结果一致。温度的处理对亚麻芥油体稳定性并未起到任何作用,这与康波[25]、吴娜娜等[26]对大豆油体热稳定性的研究不一致,有可能是由亚麻芥本身材料的性质所导致的。研究结果表明,亚麻芥种子油体于酸性条件下并不能稳定存在,由于油体本身带有负电荷这一结构,中性偏碱性条件下更适合于亚麻芥种子油体储存。为其以油体为基质的产品开发奠定了基础。
| [1] |
Acevedo F, Rubilar M, Shene C, et al. Seed oil bodies from Gevuina avellana and Madia sativa. Journal of Agricultural and Food Chemistry, 2012, 60(28): 6994-7004. DOI:10.1021/jf301390d |
| [2] |
Adams G G, Imran S, Wang S, et al. Extraction, isolation and characterisation of oil bodies from pumpkin seeds for therapeutic use. Food Chemistry, 2012, 134(4): 1919-1925. DOI:10.1016/j.foodchem.2012.03.114 |
| [3] |
Tzen J T C, Lie G C, Huang A H C. Characterization of the charged components and their topology on the surface of plant seed oil bodies. J Biol Chem, 1992, 267(22): 15626-15634. |
| [4] |
Capuano F, Beaudoin F, Napier J A, et al. Properties and exploitation of oleosins. Biotechnol Adv, 2007, 25(2): 203-206. DOI:10.1016/j.biotechadv.2006.11.006 |
| [5] |
Huang A H C. Oil-bodies and oleosins in seeds. Annu Rev Plant Physiol Plant Mol Biol, 1992, 43(5): 177-200. |
| [6] |
Huang A H C. Oleosion and oil bodies in seeds and other organs. Plant Physiology, 1996, 110(4): 1055-1061. DOI:10.1104/pp.110.4.1055 |
| [7] |
Tzen J T C, Lai Y K, Chan K L, et al. Oleosion isoforms of high and low molecular weights are present in the oil bodies of diverse seed species. Plant Physiol, 1990, 94(3): 1282-1289. DOI:10.1104/pp.94.3.1282 |
| [8] |
Tai S S K, Chen M C M, Peng C C, et al. Gene family of oleosin isoforms in sesame seed oil bodies and their structural stabilization to reconstituted oil bodies. Biosci Biotechnol Biochem, 2002, 66(10): 2146-2153. DOI:10.1271/bbb.66.2146 |
| [9] |
Roberts N, Scott R, Tzen J. Recent biotechnological applications using oleosins. Open Biotech J, 2008, 2(3): 13-21. |
| [10] |
Deckers H M, Van Rooijen G, Boothe J, et al. Sembiosys Genetics Inc. Oil Body Based Personal Care Products:United States, US 6183762. 2001.
|
| [11] |
Chiang C J, Chen H C, Kuo H F, et al. A simple and effective method to prepare immobilized enzymes using artificial oil bodies. Enzyme Microb Tech, 2006, 39(5): 1152-1158. DOI:10.1016/j.enzmictec.2006.02.024 |
| [12] |
Chiang C J, Chen H C, Chao Y P, et al. One-step purification of insoluble hydantoinase overproduced in Escherichia coli. Protein Expr Purif, 2007, 52(1): 14-18. DOI:10.1016/j.pep.2006.07.008 |
| [13] |
Bhatla S C, Vandana S, Kaushik V. Recent developments in the localization of oil body associated signalling molecules during lipolysis in oilseeds. Plant Signal Behav, 2009, 4(3): 176-182. DOI:10.4161/psb.4.3.7799 |
| [14] |
Blixt O, Allin K, Pereira L, et al. Efficient chemoenzymatic synthesis of O-linked sialy oligosaccharides. J Am Chem Soc, 2002, 124(20): 5739-5746. DOI:10.1021/ja017881+ |
| [15] |
Nikiforidis C V, Karkani O A, Kiosseoglou V. Exploitation of maize germ for the preparation of a stable oil body nanoemulsion using a combined aqueous extraction ultrafiltration method. Food Hydrocolloids, 2011, 25(5): 1122-1127. DOI:10.1016/j.foodhyd.2010.10.009 |
| [16] |
Nikiforidis C V, Kiosseoglou V. Physicochemical stability of maize germ oil body emulsions as influenced by oil body surface xanthangum interactions. Journal of Agricultural and Food Chemistry, 2010, 58(1): 527-532. DOI:10.1021/jf902544j |
| [17] |
Tzen J T C, Cao Y, Laurent P, et al. Lipids, proteins, and structure of seed oil bodies from diverse species. Plant Physiologic, 1993, 101: 267-276. DOI:10.1104/pp.101.1.267 |
| [18] |
杨晶, 韩高强, 刘忠良, 等. 红花油体提取条件优化及稳定性研究. 生物技术通报, 2015, 31(3): 185-190. Yang J, Han G Q, Liu Z L, et al. Optimization of extract condition of safflower oil body and analysis of stability. Biotechnology Bulletin, 2015, 31(3): 185-190. |
| [19] |
李玉琴. 不同含油量甘蓝型油菜种子全蛋白及油体蛋白的双向电泳分析. 郑州: 郑州大学生物工程学院, 2012. Li Y Q. Two-dimensional Electrophoresis Analysis of Whole Protein and Oil Body Protein of Brassica napus with Different Oil Content. Zhengzhou:Biological Engineering College, Zhengzhou University, 2012. http://cdmd.cnki.com.cn/article/cdmd-10459-1012352092.htm |
| [20] |
Jacks T J, Hensarling T P, Neucere J N, et al. Isolation and physicochemical characterization of half-unit membranes of oil seed lipid bodies. Journal of the American Oil Chemists, Society, 1990, 67(1): 353-361. |
| [21] |
Nikiforidis C V, Kiosseoglou V. Aqueous extraction of oil bodies from maize germ (Zea Mays)and characterization of the resulting natural oil-in-water emulsion. Journal of Agricultural and Food Chemistry, 2009, 57(12): 5591-5596. DOI:10.1021/jf900771v |
| [22] |
Vesna K, Ganesh K A, Martin H, et al. Protein and lipid composition analysis of oil bodies from two Brassica napus cultivars. Proteomics, 2006, 6(16): 4586-4598. DOI:10.1002/(ISSN)1615-9861 |
| [23] |
曹艳云, 陈业明, 华欲飞, 等. 高碱性提取的大豆油体的成分变化研究. 中国粮油学报, 2014, 29(3): 38-41. Cao Y Y, Chen Y M, Hua Y F, et al. Study on the change of composition of soybean oil body with alkaline extraction. Journal of the Chinese Cereals and Oils Association, 2014, 29(3): 38-41. |
| [24] |
李宁, 梁从敏, 臧新, 等. 油菜油体的提取方法优化及稳定性探讨. 河南农业科学, 2015, 44(4): 154-158. Li N, Liang C M, Zang X, et al. Optimization of extracted method and stability for rape oil body. Journal of Henan Agricultural Sciences, 2015, 44(4): 154-158. |
| [25] |
康波. 花生油体乳液稳定性及乳液凝胶的研究. 华南理工大学轻工与食品学院, 2012. Kang B. Study on Emulsion Stability and Emulsion Gel of Peanut oil. Light Industry and Food College, South China University of Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10561-2010229028.htm |
| [26] |
吴娜娜, 杨晓泉, 郑二丽, 等. 大豆油体乳液稳定性和流变性分析. 农业工程学报, 2012, 28(1): 369-374. Wu N N, Yang X Q, Zheng E L, et al. Stability and rheology analysis of soybean oil body emulsion. Journal of Agricultural Engineering, 2012, 28(1): 369-374. |
 2017, Vol. 37
2017, Vol. 37




