文章信息
- 张宸, 陈韶华, 吴文倩, 周建芹.
- ZHANG Chen, CHEN Shao-hua, WU Wen-qian, ZHOU Jian-qin.
- 微生物谷氨酰胺转氨酶催化细胞色素c赖氨酸残基的定点修饰
- Modifiation of Cytochrome c at the Level of Lysine Residues Mediated by Microbial Transglutaminase
- 中国生物工程杂志, 2017, 37(9): 82-88
- China Biotechnology, 2017, 37(9): 82-88
- http://dx.doi.org/DOI:10.13523/j.cb.20170911
-
文章历史
- 收稿日期: 2017-02-14
- 修回日期: 2017-05-08
2. 苏州大学医学部实验中心 苏州 215123
2. Experimental Center of Medical College, Soochow University, Suzhou 215123, China
细胞色素c(cytochrome c,简称Cyt c)是一种以铁卟啉为辅基的呼吸酶,广泛存在于各种具有线粒体的生物中,它参与生物呼吸链中的电子传递[1]。作为药物,静脉注射Cyt c用于急救或者辅助治疗各种原因引起的组织缺氧,如一氧化碳中毒、催眠药中毒、新生儿窒息、严重休克缺氧、麻醉及肺部疾病引起的呼吸困难、高山缺氧、脑缺氧、心脏疾病引起的缺氧等。但是,Cyt c一般从动物的心脏中分离,作为药物注射到身体中会引起人的免疫反应,如局部痉挛、皮疹、发热、口渴及暂时性休克等反应。聚乙二醇(PEG)修饰蛋白质药物是降低蛋白质药物过敏反应最常用最有效的方法之一。另外,Cyt c在体外也是一种非常好的生物催化剂,可以催化多种反应,如羟化反应和芳香族化合物的氧化反应等[2]。将Cyt c进行PEG修饰后,Cyt c的活性中心会发生变化,催化特性也随之发生变化。PEG修饰的Cyt c能够催化20种芳香族化合物中的17种发生氧化反应,而未修饰的Cyt c只能催化其中8种发生氧化反应[2]。总之,PEG修饰Cyt c能够消除其作为药物在体内引起的免疫反应,能够改变其作为催化剂在体外的催化特性。
PEG修饰蛋白质分子通常采用化学反应法修饰多肽链中的赖氨酸(Lys)残基。然而化学修饰法通常修饰蛋白质分子中的多个Lys残基,产生多种不定点随机修饰产物和多点修饰产物等多种产物的混合物,导致产物的不均一性和活性的降低[3]。克服这个问题的方法之一是采用酶催化法定点修饰蛋白质分子[4]。谷氨酰胺转氨酶催化定点修饰蛋白质分子是近年来的研究热点。
谷胺酰胺转氨酶(EC2.3.1.13,transglutaminases,TG)是一种催化酰基转移的酶,它能催化多肽链中谷氨酰胺(Gln)残基的γ-羧酰胺基(酰基供体)与氨基供体(酰基受体)之间进行酰基转移形成异肽键,其中氨基供体可以是一系列伯氨基化合物,也可以是肽链中赖氨酸残基的ε-氨基[5-6]。因此,TG可以用于蛋白质的修饰或者交联,在医药、纺织、食品生产中具有广泛的应用[7]。最早商品化的TG是来源于动物的,其活性需要依赖钙离子参与,来源稀少,分离纯化过程复杂。发酵法生产的微生物来源的谷氨酰胺转氨酶(microbial transglutaminases,mTG)来源广泛,其活性不依赖钙离子,产量高,底物特异性强,因此在实践中广泛应用的是微生物来源的谷氨酰胺转氨酶[8]。
蛋白质分子中的Gln残基和Lys残基都是mTG潜在的修饰位点。本研究:① 首先在单甲氧基聚乙二醇氨(mPEG-NH2)分子上引入Gln残基制备N-苄氧羰基-谷氨酰胺-甘氨酰-单甲氧基聚乙二醇(CBZ-QG-mPEG),然后利用mTG分别催化Cyt c和mPEG-NH2(氨基供体)、Cyt c和CBZ-QG-mPEG(酰基供体)反应,并检测mTG催化mPEG-NH2或CBZ-QG-mPEG修饰Cyt c的可行性。② 优化谷胺酰胺转氨酶催化修饰Cyt c的反应条件。③ 比较酶法和化学法修饰Cyt c的反应结果。④ 最后探讨了PEG修饰后的Cyt c的性质。本研究提出的谷胺酰胺转氨酶催化修饰法解决了蛋白质Lys残基难以定点修饰的难题,也拓展了mTG在蛋白质修饰方面的应用。
1 材料与方法 1.1 主要试剂谷胺酰胺转氨酶,由江苏一鸣生物股份有限公司赠送;单甲氧基聚乙二醇氨(mPEG-NH2,相对分子质量5 000)、单甲氧基聚乙二醇-琥珀酰亚胺基丙酸酯(mPEG-SPA,相对分子质量5 000),购自厦门赛诺邦格生物科技有限公司;细胞色素c(猪心,Cyt c)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC),购自苏州亚科科技股份有限公司;N-苄氧羰基-谷氨酰胺-甘氨酸(carboxybenzyl-glutaminyl-glycine,CBZ-QG)、L-谷氨酸-γ-羟肟酸、还原型谷胱甘肽等试剂均购自Sigma-Aldrich公司;羟氨,购自Alfa Aesar公司;N-羟基琥珀酰亚胺(NHS),3, 3′, 5, 5′-四甲基联苯胺盐酸盐(TMB),购自Aladdin公司。
1.2 方法 1.2.1 CBZ-QG-mPEG的制备参照参考文献[9]的方法制备。169mg CBZ-QG、58mg NHS和93mg EDC溶解于2ml二甲亚砜(DMSO),在室温中磁力搅拌24h。将25mg mPEG-NH2溶解于1ml硼酸缓冲溶液(pH9.0, 0.1mol/L)中,并与上述二甲亚砜反应液混合,继续在室温中磁力搅拌24h。反应完成后,溶液加水稀释至12ml,用超滤离心管(Millipore,Amicon® Ultra-4,截留分子质量3K)进行超滤浓缩以除去反应液中剩余的CBZ-QG、EDC、NHS和二甲亚砜。反复超滤离心,最后将超滤浓缩液冷冻干燥。
1.2.2 mTG催化mPEG-NH2或CBZ-QG-mPEG修饰Cyt c的可行性研究分别为Cyt c提供mPEG-NH2(氨基供体)和CBZ-QG-mPEG(酰基供体),检测mTG催化mPEG-NH2修饰Cyt c谷氨酰胺残基或CBZ-QG-mPEG修饰Cyt c赖氨酸残基的可行性。
mTG催化CBZ-QG-mPEG修饰Cyt c方法:4mg/ml的Cyt c溶液25μl与15mg/ml的CBZ-QG-mPEG溶液(0.05mol/L,pH 8.0 Tris-HCl缓冲液)75μl混合均匀,加入100μl 1mg/ml的mTG溶液启动反应。在37℃水浴,反应2h后,取样50μl,加入50μl的2×SDS loading buffer沸水浴3min,进行SDS-PAGE,电泳结束后,考马斯亮蓝染色,脱色后采用Bio-Rad Gel Doc XR+凝胶成像系统对凝胶进行拍照、分析。
mTG催化mPEG-NH2修饰Cyt c方法同上,用15mg/ml的mPEG-NH2溶液代替CBZ-QG-mPEG溶液即可。
1.2.3 mTG催化修饰Cyt c条件的优化在可行性研究的基础上,进一步研究mTG浓度、温度、反应时间、pH对修饰反应的影响,优化mTG催化CBZ-QG-mPEG修饰Cyt c的反应条件。
(1) mTG浓度对mTG催化修饰Cyt c的影响。按照1.2.2的方法,分别用1.0mg/ml、2.0mg/ml、4.0mg/ml、8.0mg/ml、12.0mg/ml的mTG溶液(mTG在反应体系中的终浓度分别为0.5mg/ml、1.0mg/ml、2.0mg/ml、4.0mg/ml、6.0 mg/ml)催化CBZ-QG-mPEG修饰Cyt c,pH8.0,37℃下反应2h,取样进行SDS-PAGE分析。
(2) 温度对mTG催化修饰Cyt c的影响。按照1.2.2的方法,分别在17℃、27℃、37℃、47℃进行修饰反应,其余条件不变,反应2h后,取样进行SDS-PAGE分析。
(3) 反应时间对mTG催化修饰Cyt c的影响。按照1.2.2的方法,在37℃下修饰反应10min、20min、40min、1h、2h、4h后,其余条件不变,分别取样进行SDS-PAGE分析。
(4) pH对mTG催化修饰Cyt c的影响。分别在pH4.0、5.0、6.0、7.0、8.0、9.0的缓冲溶液中,37℃下,其余条件不变,修饰反应2 h后,取样进行SDS-PAGE分析。
1.2.4 化学法PEG修饰Cyt c化学法PEG修饰Cyt c采用mPEG-SPA作为活化的修饰剂。取100μl 2mg/ml的Cyt c溶液(0.2mol/L硼酸盐缓冲液,pH 8.0) 与100μl 0.225% (m/V) mPEG-SPA溶液(0.2mol/L硼酸盐缓冲液,pH 8.0) 混匀。37℃反应2h后,加入100μl甘氨酸溶液(20mg/ml)终止反应。取样50μl,加入50μl的2×SDS loading buffer,进行SDS-PAGE。
1.2.5 PEG修饰Cyt c的分离利用Bio-Rad蛋白层析系统NGC chromatography system以及ENrichTM SEC 70柱对修饰产物进行分离。样品经0.45μm针式过滤器过滤,进样量为1ml。使用pH6.0、0.05mol/L的磷酸盐缓冲液,以1ml/min的流速进行洗脱,每支试管收集1ml洗脱液。
1.2.6 Cyt c及PEG修饰Cyt c活力的测定参照参考文献[3]的方法,稍加调整,进行活力测定。以过氧化氢和TMB为底物配制底物显色液(含0.04%的过氧化氢和0.14mg/ml的TMB,现配现用)。底物显色液在37℃水浴预热5min,加入100μl 25μg/ml的待测Cyt c溶液。反应5min后,每管加2ml的2mol/L硫酸溶液终止反应,测定OD450nm的数值。空白对照为Cyt c溶液先加入2mol/L硫酸溶液失活,再加入底物显色液。
Cyt c活力的定义:在特定催化条件下,使OD值变化0.001的酶量为一个酶活力单位。
1.2.7 Cyt c及PEG修饰Cyt c热稳定性和酸碱稳定性的测定Cyt c分别在pH 4.0~10.0的缓冲溶液中放置3h后,于37℃下测定活力。另取新配制的Cyt c测定活力作为初始酶活力。以初始酶活力为标准,作为100%,经缓冲溶液处理过的酶活力值与其相比计算残留活力,反映Cyt c的酸碱稳定性。
Cyt c溶液分别在17~67℃各温度下放置3h后,于37℃下测定活力。另取新配制的Cyt c测定活力作为初始酶活力。以初始酶活力为标准,作为100%,经缓冲溶液处理过的酶活力值与其相比计算残留活力,反映Cyt c的热稳定性。
2 结果与讨论 2.1 mTG催化CBZ-QG-mPEG修饰Cyt c的可行性Cyt c分子中含有3个Gln残基和18个Lys残基[10],这些Gln残基和Lys残基都是mTG潜在的修饰位点。在mTG的反应体系中,分别为Cyt c提供mPEG-NH2(氨基供体)和CBZ-QG-mPEG(酰基供体),检测mTG催化mPEG-NH2或CBZ-QG-mPEG修饰Cyt c的可行性。mTG在37℃、pH 8.0的Tris-HCl缓冲液中分别催化CBZ-QG-mPEG、mPEG-NH2和Cyt c的修饰反应2h。反应结果用SDS-PAGE进行分析,结果如图 1所示。
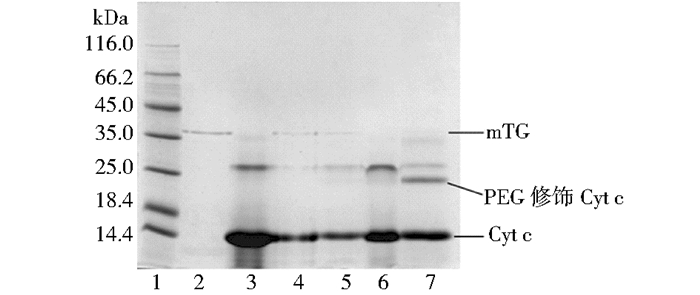
|
| 图 1 mTG催化CBZ-QG-mPEG修饰Cyt c的SDS-PAGE分析 Figure 1 Image of the SDS-PAGE for the coupling CBZ-QG-mPEG to Cyt c catalyzed by mTG 1: Molecular weight marker; 2: mTG, 1.0mg/ml; 3: Cyt c, 4mg/ml; 4: Cyt c 0.5mg/ml+ mTG 0.5mg/ml; 5: Cyt c 0.5mg/ml+mTG 0.5mg/ml+mPEG-NH25.6mg/ml; 6: Cyt c 0.5mg/ml+CBZ-QG-mPEG 5.6mg/ml; 7:Cyt c 0.5mg/ml+CBZ-QG-mPEG 5.6mg/ml+mTG 0.5mg/ml, 37℃, 2h |
从图 1可以看出,mTG的分子质量约为38.0kDa (Lane 2),Cyt c的分子量约为13.4kDa (Lane 3)。Lane 4中无新的电泳条带出现,说明mTG不能催化Cyt c分子自身聚合。Lane 5中也没有新的电泳条带产生,说明mTG不能催化mPEG-NH2修饰Cyt c,即Cyt c中的3个Gln残基均不符合mTG的催化条件。Lane 6中没有新的电泳条带产生,说明在没有mTG催化时Cyt c和CBZ-QG-mPEG不能自动发生反应。Lane 7中,在mTG和CBZ-QG-mPEG同时存在时,新的电泳条带产生,表明mTG可以催化CBZ-QG-mPEG(酰基供体)修饰Cyt c的Lys残基。经SDS-PAGE凝胶成像系统分析,新的修饰产物分子质量约为24.0kDa,这个分子质量相当于Cyt c本身的分子质量(13.4kDa)加上CBZ-QG-mPEG (约5.3kDa)分子质量的2倍,这个结果说明在mTG的催化作用下CBZ-QG-mPEG以1:1的比例修饰Cyt c分子。通常,PEG修饰蛋白质之后分子质量的增加值远远大于PEG本身的分子质量,这是因为PEG分子中每个乙氧基会结合2~3个水分子导致PEG水化物的水动力学半径增大[4]。因此,PEG修饰的蛋白质分子在电泳中表现出来的分子质量远大于蛋白质分子质量和PEG分子质量的和,一般相当于蛋白质分子质量与大约2.5倍PEG分子量的和。Scaramuzza和Caliceti等也分别报道了PEG修饰蛋白质时相似的试验结果[4-5]。
蛋白质分子中Gln或Lys残基所在的空间构象和邻近的氨基酸残基决定了mTG的底物特异性。能够被mTG修饰的Gln或Lys残基必须位于高度柔性的多肽链区域,而且必须完全暴露在溶剂中[11-14]。Cyt c分子中含有3个Gln残基和18个Lys残基。Gln13和Gln17位于肽链中的刚性区域,尤其是Gln17还被包埋在Cyt c分子内部。Gln43虽然位于肽链的无规则区域,但是邻近的Pro45降低了肽链的柔性,阻碍了mTG对Gln43的结合。因此3个Gln残基都不能作为mTG选择性修饰的位点。
根据mTG对Lys残基的选择性,18个Lys残基中只有4个位于肽链的柔性区域,是潜在的修饰位点,即Lys23、Lys26、Lys28和Lys40。这4个Lys残基邻近的氨基酸残基将决定mTG的特异选择性。与Lys23相邻的Glu22残基带有负电荷,会降低mTG对Lys23的选择性,因为mTG活性中心也带有负电荷,由于静电排斥作用而不能与Lys23残基结合[15]。Lys40位于肽链的无规则区域,但是没有完全暴露在溶剂中,而不容易被mTG结合。Lys26和Lys28均位于肽链的柔性区域而且完全暴露在溶液中,Lys26的亲水性高于Lys28。综上分析,Lys26是Cyt c肽链中最有可能被mTG修饰的位点。
2.2 mTG催化CBZ-QG-mPEG修饰Cyt c条件的优化温度、mTG用量、反应时间等条件都会影响酶催化反应的效率,对反应条件进行优化,提高修饰效率。
2.2.1 酶的用量对mTG催化修饰Cyt c的影响分别用0.5mg/ml、1mg/ml、2mg/ml、4mg/ml、6mg/ml mTG催化修饰反应,研究酶的用量对修饰反应的影响,结果如图 2所示。
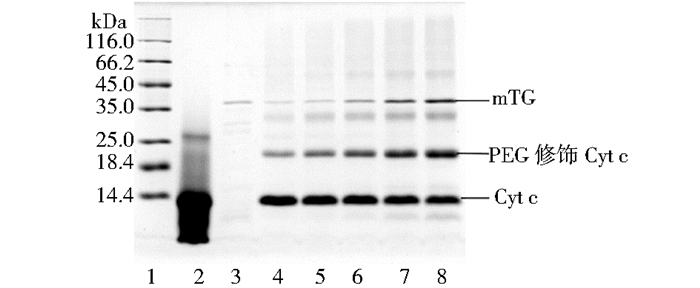
|
| 图 2 酶的用量对mTG催化Cyt c修饰的影响 Figure 2 Effects of concentration of mTG on the PEGylation of Cyt c catalyzed by mTG 1: Molecular weight marker; 2: Cyt c, 4mg/ml; 3:mTG, 1.0mg/ml; 4~8: Cyt c 0.5mg/ml+CBZ-QG-mPEG 5.6mg/ml, reaction time 2h, temperature 37℃, pH 8.0, mTG concentration 0.5mg/ml, 1mg/ml, 2mg/ml, 4mg/ml, 6mg/ml, respectively |
从图 2可以看出,随着mTG用量的增加,修饰的Cyt c逐渐增多,PEG修饰率逐渐提高。但在本研究选择的mTG用量范围内,酶用量的影响不是非常显著。因此,综合考虑实验成本和转化率,选择mTG用量为1mg/ml。
2.2.2 温度对mTG催化修饰Cyt c的影响在17℃、27℃、37℃和47℃ 4个温度下进行mTG催化修饰,研究温度对修饰反应的影响,结果如图 3所示。
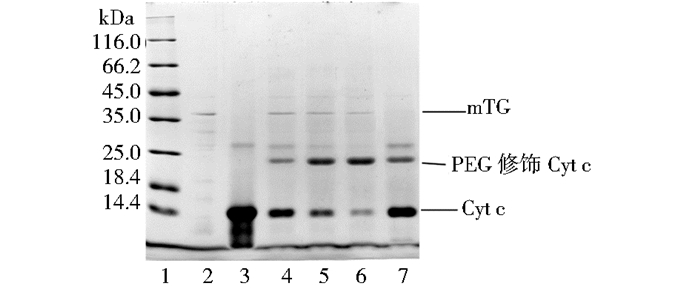
|
| 图 3 温度对mTG催化Cyt c修饰的影响 Figure 3 Effects of temperature on the PEGylation of Cyt c catalyzed by mTG 1: Molecular weight marker; 2: mTG, 1.0mg/ml; 3: Cyt c, 4mg/ml; 4~7: Cyt c 0.5mg/ml+mTG 1.0mg/ml+CBZ-QG-mPEG 5.6mg/ml, reaction time 2h, pH 8.0, temperature 17℃, 27℃, 37℃, 47℃, respectively |
从图 3可以看出,温度对mTG催化CBZ-QG-mPEG修饰Cyt c有显著影响。随温度升高,PEG修饰的Cyt c逐渐增加,剩余的Cyt c逐渐减少;但温度升高到47℃时,mTG催化产生的修饰Cyt c反而减少。原因是温度过低,mTG的活性较弱;温度过高,mTG容易变性活力降低。37℃是mTG催化修饰的最适温度。
2.2.3 反应时间对mTG催化修饰Cyt c的影响mTG在37℃温度下催化修饰反应10min、20min、40min、1h、2h、4h和6h,研究时间对修饰的影响,结果如图 4所示。
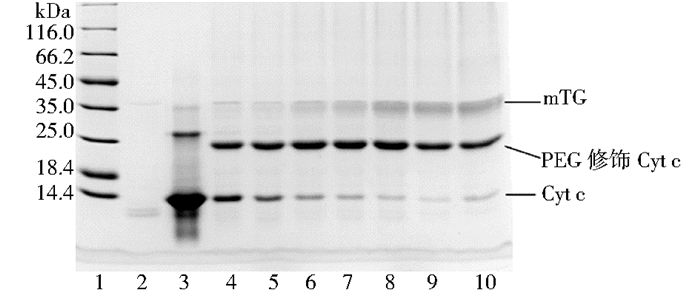
|
| 图 4 反应时间对mTG催化CBZ-QG-mPEG修饰Cyt c的影响 Figure 4 Effects of reaction time on the PEGylation of Cyt c catalyzed by mTG 1: Molecular weight marker; 2: mTG, 1.0mg/ml; 3: Cyt c, 4mg/ml; 4~10: Cyt c 0.5mg/ml+mTG 1.0mg/ml+CBZ-QG-mPEG 5.6mg/ml, temperature 37℃, pH 8.0, reaction time 10min, 20min, 40min, 1h, 2h, 4h, 6h, respectively |
如图 4所示,mTG催化修饰反应,随着反应时间的延长,PEG修饰的Cyt c逐渐增加,剩余的Cyt c逐渐减少。反应时间在2h以上时,时间增加1倍(4h)或者两倍(6h),Cyt c的修饰转化率变化并不显著,而且延长时间会导致变性蛋白质的增多。因此,从综合提高修饰转化率和缩短反应时间来考虑,确定反应时间为2h。
2.2.4 pH对mTG催化CBZ-QG-mPEG修饰Cyt c的影响mTG在37℃温度下催化修饰反应2h,反应体系的pH在4~9时,研究pH对修饰反应的影响,结果如图 5所示。
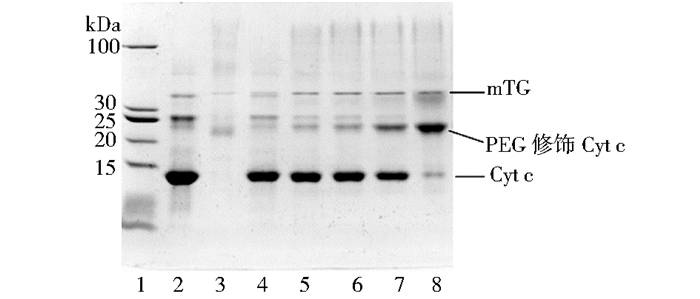
|
| 图 5 pH对mTG催化Cyt c修饰的影响 Figure 5 Effects of buffer pH on the PEGylation of Cyt c catalyzed by mTG 1: Molecular weight marker; 2: Cyt c, 4mg/ml; 3:mTG, 1.0mg/ml; 4~7: Cyt c 0.5mg/ml+mTG 1.0 mg/ml+CBZ-QG-mPEG 5.6mg/ml, reaction time 2h, temperature 37℃, buffer pH 4.0, 5.0, 6.0, 7.0, 8.0, respectively |
如图 5所示,pH对mTG的催化反应影响显著。随着反应pH的升高,PEG修饰转化率逐渐提高,尤其是pH8.0时mTG催化修饰Cyt c转化率最高。溶液pH会影响底物及酶活性部位上基团的解离,从而影响酶与底物的结合,最终影响酶活性的表达。因此,选择溶液pH为8.0。
综上考虑,最佳修饰反应条件为:1mg/ml的mTG,37℃温度下,pH8.0的溶液中,催化修饰反应2h。
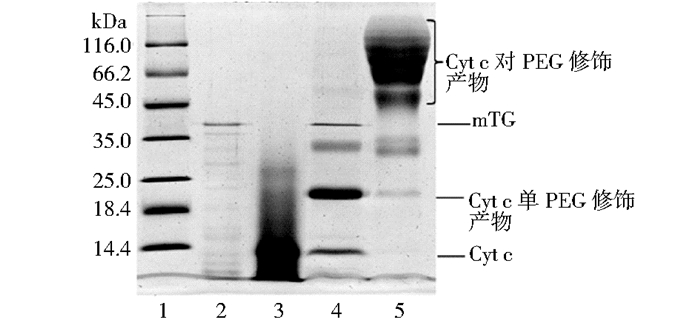
2.3 酶法和化学法PEG修饰Cyt c的比较化学法PEG修饰Cyt c采用mPEG-SPA作为活化的修饰剂修饰Cyt c,然后进行SDS-PAGE分析比较酶法和化学法PEG修饰Cyt c的差别,结果如图 6所示。
|
| 图 6 化学法和酶法修饰Cyt c的比较 Figure 6 Image of the SDS-PAGE for the comparison of enzymatic and chemical PEGylation of Cyt c 1: Molecular weightmarker; 2: mTG, 1.0mg/ml; 3: Cyt c, 4.0mg/ml; 4: The enzymatic PEGylation of Cyt c, CBZ-QG-mPEG 5.6mg/ml, Cyt c 0.5mg/mL, mTG 0.5mg/mL, 37℃, 2h. 5: The chemical PEGylation of Cyt c, mPEG-SPA 11.2mg/ml, Cyt c 1.0mg/ml, 37℃, 2h |
从图 6中可以看出,酶法催化修饰反应2h后,Cyt c的条带消失,只有一个新的产物条带产生(如Lane 4所示),说明修饰产物只有一种。而化学法修饰反应2h后,Cyt c的条带消失,但是在分离胶的顶端产生了一个很宽的产物条带(如Lane 5所示),说明Cyt c中有多个Lys残基位点与mPEG-SPA反应,导致修饰Cyt c的分子质量与Cyt c相比大大提高,而且产生了不同修饰度的不均一修饰产物。与化学法相比,很明显可以看出,mTG催化的修饰反应的优势是修饰位点的高特异性和产物的均一性。
2.4 修饰Cyt c的性质测定了PEG修饰后Cyt c的活力、稳定性等,并分别与天然Cyt c比较。
2.4.1 PEG修饰对Cyt c活力的影响传统的化学法修饰是对蛋白质分子中多个Lys残基随机修饰,会造成活性蛋白质的活力下降。本研究采用酶法对Cyt c进行定点修饰,通过比较修饰前后Cyt c的活力变化可以反映这种修饰对其活力的影响。
从表 1中可以看出,修饰后Cyt c的活力没有降低,反而会大大提高。说明酶法对Cyt c特定位点Lys残基的定点修饰不影响其活性的表达。另外,PEG的两亲性使得TMB分子更容易通过扩散作用进入Cyt c活性中心的底物结合位点,使其催化速率提高。
| Protein | Relative activity(%) |
| Cyt c | 100 |
| Modified Cyt c | 148±3.3 |
2.4.2 PEG修饰Cyt c的热稳定性
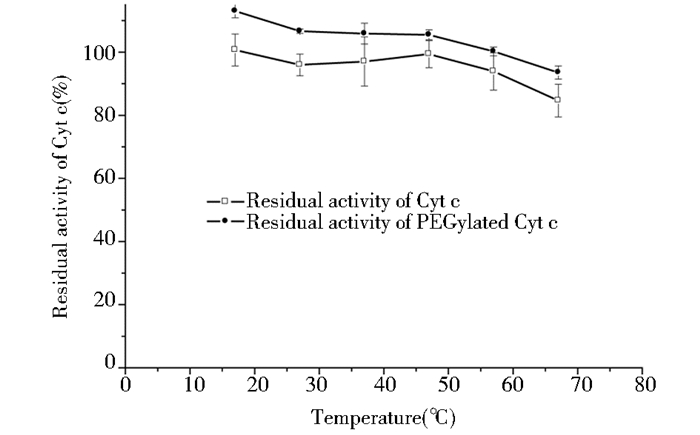
一般,大分子修饰后,蛋白质的稳定性会有改善。PEG修饰后的Cyt c在各17~67℃下保温处理,测定其热稳定性,结果如图 7所示。
|
| 图 7 PEG修饰Cyt c的热稳定性 Figure 7 Thermal stability of PEGylated Cyt c |
从图 7中可以看出,热处理后,修饰Cyt c的残余活力比较高,与天然Cyt c相比,修饰后Cyt c的热稳定性有所提高。这种提高可能是由于PEG长链与Cyt c共价结合后,长链分子覆盖在Cyt c表面,减少了热变性作用。
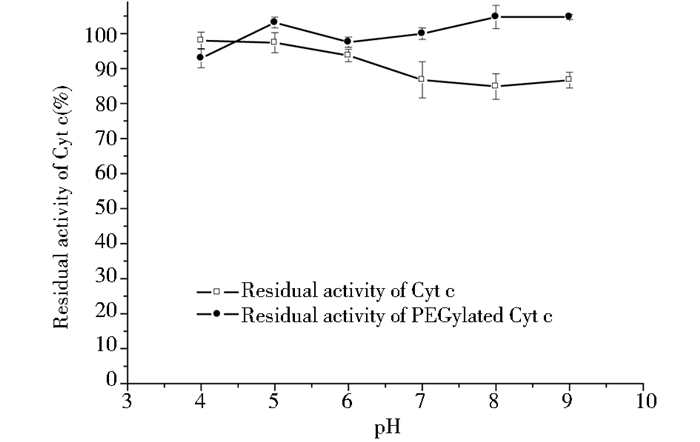
2.4.3 PEG修饰Cyt c的酸碱稳定性PEG修饰后的Cyt c在pH4~9的缓冲溶液中浸泡处理3h,测定其酸碱稳定性,结果如图 8所示。
|
| 图 8 PEG修饰Cyt c的酸碱稳定性 Figure 8 pH stability of PEGylated Cyt c |
从图 8中可以看出,修饰Cyt c经缓冲溶液处理3h后,残余活力比未修饰的Cyt c要高,说明Cyt c经过PEG的修饰后pH耐受性有明显的提高。
3 结论mTG不能催化mPEG-NH2修饰Cyt c分子,但mPEG-NH2末端引入CBZ-QG后生成的CBZ-QG-mPEG可以作为mTG的酰基供体,在mTG的催化作用下,与Cyt c的Lys残基的氨基发生共价结合,而且基于mTG的底物特异性实现了PEG定点修饰Cyt c。酶法催化PEG修饰Cyt c只产生单一产物,而化学法PEG修饰Cyt c产物复杂,是多种多点修饰产物的混合物。谷胺酰胺转胺酶催化修饰法解决了蛋白质Lys残基难以定点修饰的难题,拓展了mTG在蛋白质修饰方面的应用。
| [1] |
Vazquez-Duhalt R. Cytochrome c as a biocatalyst. Journal of Molecular Catalysis B Enzymatic, 1999, 7(s 1-4): 241-249. |
| [2] |
Tinoco R, Vazquez-Duhalt R. Chemical modification of cytochrome c improves their catalytic properties in oxidation of polycyclic aromatic hydrocarbons. Enzyme & Microbial Technology, 1998, 22(1): 8-12. |
| [3] |
Scaramuzza S, Tonon G, Olianas A, et al. A new site-specific monoPEGylatedfilgrastim derivative prepared by enzymatic conjugation:Production and physicochemical characterization. Journal of Controlled Release Official Journal of the Controlled Release Society, 2012, 164(3): 355-363. DOI:10.1016/j.jconrel.2012.06.026 |
| [4] |
Caliceti P, Veronese F M. Pharmacokinetic and biodistribution properties of poly(ethylene glycol)-protein conjugates. Advanced Drug Delivery Reviews, 2003, 55(10): 1261-1277. DOI:10.1016/S0169-409X(03)00108-X |
| [5] |
Djoullah A, Krechiche G, Husson F, et al. Size measuring techniques as tool to monitor pea proteins intramolecular crosslinking by transglutaminase treatment. Food Chemistry, 2016, 190: 197-200. DOI:10.1016/j.foodchem.2015.05.091 |
| [6] |
Jian Q Z, He T, Jian W W. The microbial transglutaminase immobilization on carboxylatedpoly(N-isopropylacrylamide) for thermo-responsivity. Enzyme & Microbial Technology, 2016, 87-88: 44-51. |
| [7] |
Djoullah A, Sok N, Djemaoune Y, et al. Monitoring of transglutaminase crosslinking reaction by 1 H-NMR spectroscopy on model substrates. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2015, 475(1): 69-74. |
| [8] |
Gundersen M T, Keillor J W, Pelletier J N. Microbial transglutaminase displays broad acyl-acceptor substrate specificity. Applied Microbiology & Biotechnology, 2013, 98(1): 219-230. |
| [9] |
Zhou J Q, He T, Wang J W. PEGylation of cytochrome c at the level of lysine residues mediated by a microbial transglutaminase. Biotechnology Letters, 2016, 38(7): 1-9. |
| [10] |
Everse J, Liu C J J, Coates P W. Physical and catalytic properties of a peroxidase derived from cytochrome c. BiochimicaEtBiophysicaActa, 2011, 1812(9): 1138-1145. |
| [11] |
Jeger S, Zimmermann K, Blanc A, et al. Site-Specific and stoichiometric modification of antibodies by bacterial transglutaminase. AngewandteChemie, 2010, 49(51): 9995-9997. |
| [12] |
Sato H. Enzymatic procedure for site-specific pegylation of proteins. Advanced Drug Delivery Reviews, 2002, 54(54): 487-504. |
| [13] |
Sato H, Hayashi E, Yamada N, et al. Further studies on the site-specific protein modification by microbial transglutaminase. Bioconjugate Chemistry, 2001, 12(5): 701-710. DOI:10.1021/bc000132h |
| [14] |
Hu B H, Messersmith P B. Rational design of transglutaminase substrate peptides for rapid enzymatic formation of hydrogels. Journal of the American Chemical Society, 2003, 125(47): 14298-14299. DOI:10.1021/ja038593b |
| [15] |
Spolaore B, Raboni S, Ramos Molina A, et al. Local unfolding is required for the site-specific protein modification by transglutaminase. Biochemistry, 2012, 51(43): 8679-8689. DOI:10.1021/bi301005z |
 2017, Vol. 37
2017, Vol. 37




