文章信息
- 袁小川, 连芳, 赵荫农, 陈闯, 黄山, 李科志, 曾爱屏, 何剑波, 邬国斌.
- YUAN Xiao-chuan, LIAN Fang, ZHAO Yin-nong, CHEN Chuang, HUANG Shan, LI Ke-zhi, ZENG Ai-ping, HE Jian-bo, WU Guo-bin.
- 基于电泳温度提升建立大鼠肝快速透明化模型
- Elevated Temperature Induced Acceleration of Electrophoretic Tissue Clearing Process of Rat Liver Tissue
- 中国生物工程杂志, 2017, 37(9): 65-70
- China Biotechnology, 2017, 37(9): 65-70
- http://dx.doi.org/DOI:10.13523/j.cb.20170909
-
文章历史
- 收稿日期: 2017-05-22
- 修回日期: 2017-07-21
2. 广西医科大学基础医学院 南宁 530021
2. Department of Physiology, Basic Medical School of Guangxi Medical University, Nanning 530021, China
CLARITY是一种近年来出现的组织透明化技术,其核心原理是使用丙烯酰胺为主要成分的水凝胶固定组织中的蛋白质和核酸,并使用十二烷基磺酸钠(sodium dodecyl sulfate,SDS)为主要成分的去垢剂移除组织中的脂质成分,使大分子物质和光线能够透过组织,从而能够产生结构完整但光学透明的组织。这一技术能够从组织器官的层面研究神经、脉管系统及蛋白质/核酸等结构,因此打破了传统的组织形态学研究在三维层面的局限性[1]。
该技术由Deisseroth等于2013年在Nature杂志首次介绍[2],最初应用于神经系统的研究之中,目前在神经系统方面有了较多的应用和报道[3-4],尤其是脑组织的透明化,已经有了较为全面的探索和量化条件。然而其他的一些器官,如肝脏,由于很难彻底去除脂质成分,其透明化研究现在还缺乏文献报道和数据支持,这阻碍了CLARITY技术在该领域的应用。另外,虽然目前器官整体已经能实现透明化,但是在对完整器官进行免疫标记时,抗体的被动弥散渗入依然受到限制,500μm的免疫标记深度已是极限[2]。因此有必要对大鼠肝脏切片进行透明化条件的探索和优化,并系统量化这一过程。
CLARITY技术中脂质的去除可以在电泳(electrophoretic tissue clearing,ETC)的条件下进行以加快这一过程。已有文献报道提高温度可以进一步加快清除速率,但是会有损伤组织破坏组织形态的风险[5]。基于此,我们根据Deisseroth等在文章中介绍的原理,自制了专用的电泳设备[2],并对大鼠肝切片电泳清除的温度进行了调控,初步总结了快速构建大鼠肝脏透明化模型所需要的方法和条件。
1 材料与方法 1.1 材料20只8周龄雌性SD大鼠购自广西医科大学实验动物中心,体重180~220g,饲养室温度(20~25℃),湿度50%~60%,12h/12h昼夜光周期,大鼠维持自由摄食和饮水。
丙烯酰胺(40%)、甲叉双丙烯酰胺(2%)购自Bio-Rad公司;热引发剂VA-044(98%)购自Wako公司;分析纯多聚甲醛(95%)、分析纯氢氧化钠(96%)购自天津致远化学试剂有限公司;PBS磷酸盐缓冲液购自迈新试剂公司;SDS(98.5%)、硼酸(99.5%)、TritonX-100、DAPI购自Sigma公司;FocusClear购自CellExplorer公司;凝胶成像仪为Bio-Rad公司Universal Hood Ⅲ型;激光共聚焦显微镜为奥林巴斯公司FV3000型;电泳设备、切片模具自制。
水凝胶制备:冰上操作,以200ml水凝胶(HG)为例:丙烯酰胺(40%)20ml、甲叉双丙烯酰胺(2%)5ml、VA-044 0.5g、10×PBS 20ml,加双蒸水至200ml,分装后-20℃冰冻保存备用。
清除液的制备:常温操作,以1L清除液为例:硼酸12.4g、SDS 40g,加双蒸水至1L,用10mol/L NaOH调节pH至8.5。
1.2 大鼠灌注提前在4℃冰箱或冰上解冻水凝胶溶液,去除气泡,同时备好1×PBS溶液,所有溶液均放置在冰桶内;在通风橱中备好手术及灌注器械。大鼠腹腔注射400mg/kg水合氯醛溶液,待完全麻醉后仰卧位固定四肢,沿双侧肋弓及胸骨切开,充分暴露心脏,针头插入左心室,并以血管钳固定,同时在心耳戳一小孔放血。先用蠕动泵以10ml/min的速率推入100ml PBS溶液,至排空大鼠血管内血液,改灌注50ml水凝胶溶液。完整解剖出肝脏迅速浸于50ml水凝胶中,在冰桶内转移至4℃冰箱中3日,以便水凝胶进一步渗透到组织中[6]。
1.3 大鼠肝脏水凝胶固定和切片将标本瓶置于带有三通接口的专用容器内;充入氮气2min;关闭氮气方向接口,打开抽真空方向接口,抽真空15~20min;停止抽真空,再次充入氮气,迅速封闭标本瓶盖;标本瓶放入37℃温箱3h,待水凝胶凝固后取出,小心去除组织外周多余的水凝胶。将肝脏固定于专用切片模具上,选择组织较为平整的部位做1mm切片,共计18片。
1.4 肝切片透明度测定为了便于分析肝切片在何种条件下清除效果更好,即组织更透明、抗体渗入效果更好。我们引入了相对透明度的概念,并使用国内实验室较为普遍的凝胶成像仪测量透明度,同时使用激光共聚焦显微镜测定DAPI对于肝切片的渗入深度来量化这一过程。
(1) 相对透明度测定。将肝切片覆盖于凝胶成像仪的测试卡上,使肝切片能够完全覆盖住测试卡的底片部位,然后透过肝切片组织使用凝胶成像仪测试底片的灰度值(组织透光性越好则测定灰度值越高),即
 |
(2) 细胞核荧光染料DAPI在肝组织中渗入深度测定。将肝切片从清除液中取出,放入盛有PBST液(含0.1% Triton X-100的1×PBS)的50ml离心管中,置于摇床上常温洗涤24h以去除残余的SDS清除液。然后将切片置于避光容器中,加入DAPI工作液(10μg/ml)孵育过夜。PBST液的避光洗涤10min×3次,浸泡于FocusClear折射率匹配液中孵育过夜[7]后置于载玻片上准备上样。激光共聚焦显微镜调整激发波长360nm,将样品置于载物台上采用20倍目镜进行观测。实时观测结束后,以5μm的层厚扫描Z轴,对样品作光学切片式逐层扫描,计算有荧光信号的组织渗透深度。
1.5 肝切片透明化(1) 肝切片ETC清除基线数据获取。随机取6例肝切片,分为ETC实验组和被动清除对照组,每组各3例,并测定初始透明度。实验组切片置于网状的组织包埋盒中,固定在电泳小室电极的中间位置,使用水浴锅控制清除液温度为37℃恒温,调节电源固定电压12V,总计电泳120h,每24h更换一次清除液并测定组织相对透明度;对照组切片置于盛有SDS清除液的50ml离心管中,放于37℃温箱120h,每24h更换一次清除液并测定组织相对透明度。
(2) 肝切片ETC温度提高效果对比。随机取12例肝切片,分为42℃组、47℃组、52℃组和57℃组,每组各3例,并测定初始相对透明度。每组切片首先于37℃ 12V的条件下电泳清除48h,并测定相对透明度。更换清除液调节水浴锅分别控制各组清除液温度为42℃、47℃、52℃、57℃,保持电压不变,继续清除24h,并分别测定各组组织相对透明度和DAPI渗入深度。
1.6 统计学处理实验数据采用均数±标准差表示,采用SPSS19.0统计分析软件进行统计检验,组间比较采用t检验和方差分析,P<0.05认为结果具有统计学意义。
2 结果 2.1 ETC设备原理示意图ETC设备原理示意图,见图 1。

|
| 图 1 ETC设备原理图 Figure 1 Schematic diagram of ETC |
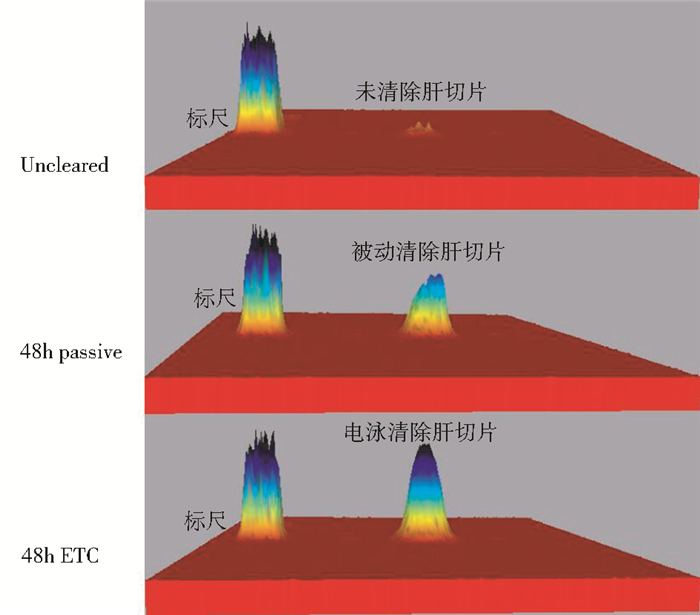
图 2示经过48h清除后使用凝胶成像仪透过肝切片测定底片灰度值(左侧峰值为标尺,峰值越高组织越透明),如图 2所示ETC组在12V 37℃条件下经过48h清除后底片灰度值快速上升,且明显高于37℃被动清除组(P=0.006)。说明肝切片ETC脂质清除速率比被动清除更快。
|
| 图 2 肝切片常规ETC与被动清除48h灰度值对比 Figure 2 Grey level improvement of liver slices, basal ETC compared with passive clearing |
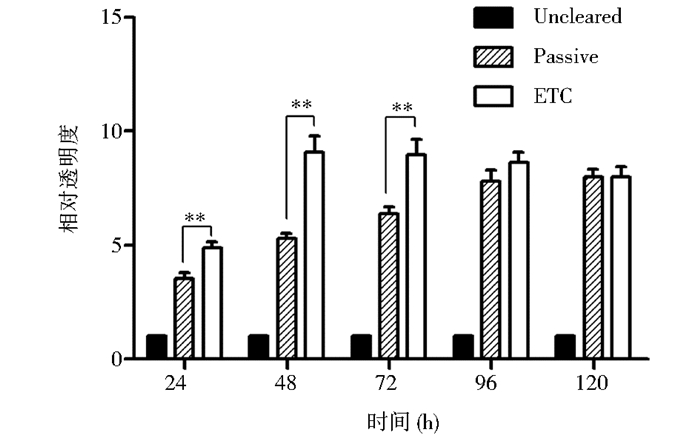
如图 3所示,ETC实验组肝切片12V 37℃条件下进行脂质清除,切片相对透明度经过ETC清除持续提高,在24~48h达到最大且与被动清除对照组差异最明显,48~96h实验组切片相对透明度维持在一个相对稳定的值,96~120h实验组切片相对透明度开始下降。与ETC实验组相比,37℃被动清除对照组相对透明度提升较慢,清除速率低于ETC组。
|
| 图 3 肝切片常规ETC与被动清除相对透明度对比 Figure 3 The relative-transparency improvement of liver slices, basal ETC compared with passive clearing |
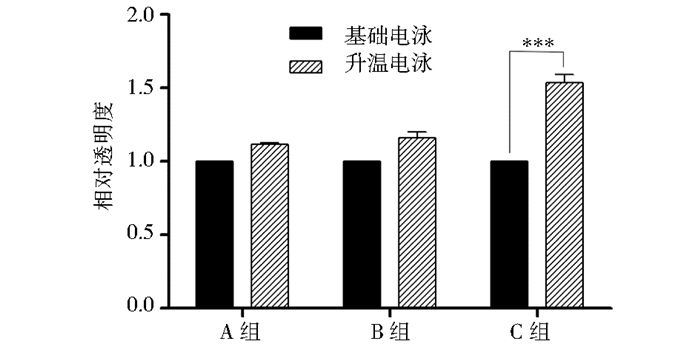
图 4示在经过48h 12V 37℃的基础电泳清除后,再增加48h的升温冲击清除肝切片的相对透明度继续提升,A、B、C各组分别示增加48h 12V 42℃电泳、48h 12V 47℃电泳、48h 12V 52℃电泳。其中52℃升温电泳组与基础电泳清除相比较相对透明度提升更为明显(P=0.001),而57℃组组织发生形变未纳入统计。
|
| 图 4 肝切片升温ETC后相对透明度变化 Figure 4 The relative-transparency with ETC temperature elevated |
图 5示各组清除后效果肉眼观,可见清除后各组切片组织均有膨胀,与初始组织相比48h 12V 37℃的基础电泳清除使肝切片具有一定透明度,但是仍然有较多脂质成分未清除,再升温冲击清除48h后52℃组效果最明显,42℃/47℃组效果一般,而57℃组虽然肝切片透明度得到一定提升但是组织形态遭到破环发生了卷曲。被动清除120h后肝切片仍然不够透明。

|
| 图 5 肝切片升温ETC后光学透明度变化 Figure 5 Optical transparency with ETC temperature elevated |
图 6示使用奥林巴斯FV3000共聚焦显微镜扫描各升温ETC组肝切片DAPI渗入深度。可见肝切片的DAPI渗入深度随ETC温度提升而提高。其中52℃升温组的肝切片DAPI渗入深度为110μm,明显高于42℃升温组的54μm,而47℃升温组DAPI渗入深度介于两者之间。结果与相对透明度测定一致。

|
| 图 6 肝切片升温ETC后DAPI渗入深度对比 Figure 6 The effect of ETC temperature elevated on imaging depth |
CLARITY技术自2013年问世以来已经在脑及神经结构、功能和相关疾病机制研究方面有了广泛的应用[8-10]。由于脑组织脂质成分较容易清除,通常采用被动清除即可取得比较好的透明化效果,而被动清除相对ETC来说不需要额外设备,技术要求低,更利于推广[11]。但是对于肝组织而言,常规的被动清除手段很难取得较满意的透明化效果,本项目研究发现,大鼠肝组织切片经过120h的被动清除后相对透明度仍然不理想,而脑组织通常只需要48h被动清除即可取得比较好的效果[12]。因此需要ETC的方式加速肝组织的脂质清除。对于透明化组织的结构研究一般基于特定部位的荧光标记,目前有透明化组织的免疫荧光标记及器官自发荧光的GFP转基因鼠器官的直接透明化两种常用方法。后者不依赖抗体的被动渗入标记成像效果更好,但是成本较高且器官中的荧光蛋白不能长期保存,不利于持续研究[13]。而免疫荧光标记相对而言更为灵活,可以随时对已透明化的器官组织进行标记,而且可以搭配不同的抗体进行多重荧光标记,但是这些依赖于抗体对组织的被动渗入深度。就目前的文献报道来看1 000μm的深度已经能够展示组织局部的三维层面结构[14],因此选择大鼠肝脏1mm切片作为我们的研究对象。
决定组织透明化ETC清除速率的因素有很多,如清除的组织类型、清除液SDS浓度、水凝胶成分、ETC电压、ETC温度等[15],其中ETC温度对组织清除速率有着很大影响[5]。针对这点我们重点探讨了ETC温度对大鼠肝组织1mm切片的清除影响,从而提供一种肝组织快速透明化的手段和思路。通常来说,在其他条件不变的前提下提高温度可以加快组织脂质清除速率,但是随之带来了组织结构损伤变形的问题。Deisseroth等在文章中介绍透明化专用ETC设备采用了一个电极距离短、电场力强的电泳小室来对组织进行强力的脂质清除[2],我们自制并改良了这一设备,在电泳液交换设备上增加过滤层滤除清除过程中产生的泡沫和电极杂质,最大限度减少电泳设备对组织造成的损伤。一般来说,37℃的ETC温度是一个较为安全的值,在我们的实验过程中很少观察到低电压(12V)37℃电泳清除而导致组织变形的情况。然而在狭小的电泳小室中局部清除液可能会因为电极而升温而对组织产生损伤,尤其是在使用外部加热设备提高清除液温度的情况下组织的局部温度可能会更高,因此提高ETC温度对于组织脂质清除来说是把双刃剑。
我们对大鼠肝切片的基础电泳(12V 37℃)的观察中发现,大鼠肝切片经过48h的清除可以达到一定的相对透光度但是仍有较多脂质成分未去除,后续即使再增加3d的ETC,清除效果依然不明显,甚至组织可能因为长时间的ECT清除而使水凝胶产生变性导致相对透明度下降的趋势。脂质清除的主要原理是通过SDS与膜质结合形成胶束,胶束内部亲水外部疏水从而将脂质成分从凝胶复合物中带出去[16]。另外,在Hammouda[17]的研究中已证实,通过提高温度可以减小SDS胶束的尺寸,使携带膜质的SDS胶束更容易从凝胶复合物中扩散出来。因此我们希望针对大鼠肝切片寻求一个合适的温度提升,在12V 37℃电泳的基础上加以短时间的升温电泳,从而在保护组织结构的前提下来进一步提高肝切片的相对透明度。考虑到这些我们在12V 37℃电泳的基础上设置了37~57℃梯度的48h升温电泳,最后发现在52℃的升温电泳对大鼠肝切片来说脂质清除效果最好,肝切片透亮并且也没有发生形变,而继续升温可能有组织变性的风险。另外,透明化技术的应用与免疫荧光标记密不可分,而透明化组织的荧光标记深度往往决定了能否在三维层面对组织结构进行研究。为了能说明使用这种清除方法得到的肝透明化组织具备一定的荧光标记深度,我们使用DAPI对清除后的肝切片进行核标记,并在激光共聚焦显微镜下扫描,结果也说明了经过12V 37℃ 48h+12V 52℃ 48h电泳清除的肝切片具备良好的荧光标记深度。当然对于不同规格的电泳设备和不同的组织来说,脂质清除所需要的时间可能会有所不同。对于肝组织的透明化,尤其是针对肝组织ETC的功率和电泳设备改良,仍然值得我们的进一步研究。
综上所述,我们的研究针对大鼠肝切片进行了ETC温度条件的探索,并基于一般实验室的条件进行了量化,给出了ETC快速脂质清除的温度参考指标,初步建立了大鼠肝脏透明化模型,有利于CLARITY技术在肝脏的结构功能以及乙肝、肝硬化、肝癌等疾病机制研究方面的进一步应用。
| [1] |
邬国斌, 何剑波, 连芳. CLARITY技术及其在生物学研究中的应用进展. 中国癌症防治杂志, 2015, 7(2): 139-141. Wu G B, He J B, Lian F. The developments of CLARITY in biological research. Chin J of Oncol Prev and Treat, 2015, 7(2): 139-141. |
| [2] |
Chung K, Wallace J, Kim S Y, et al. Structural and molecular interrogation of intact biological systems. Nature, 2013, 497(7449): 332-337. DOI:10.1038/nature12107 |
| [3] |
Phillips J, Laude A, Lightowlers R, et al. Development of passive CLARITY and immunofluorescent labelling of multiple proteins in human cerebellum:understanding mechanisms of neurodegeneration in mitochondrial disease. Scientific Reports, 2016, 6(1): 26013. DOI:10.1038/srep26013 |
| [4] |
Liu A K, Hurry M E, Ng O T, et al. Bringing CLARITY to the human brain:visualization of Lewy pathology in three dimensions. Neuropathology and Applied Neurobiology, 2016, 42(6): 573-587. DOI:10.1111/nan.2016.42.issue-6 |
| [5] |
Epp J R, Niibori Y, Liz Hsiang H L, et al. Optimization of CLARITY for clearing whole-brain and other intact organs. eNeuro, 2015, 2(3): e0022-15. |
| [6] |
Yang B, Treweek J B, Kulkarni R P, et al. Single-cell phenotyping within transparent intact tissue through whole-body clearing. Cell, 2014, 158(4): 945-958. DOI:10.1016/j.cell.2014.07.017 |
| [7] |
Mao Z, Zhu D, Hu Y, et al. Influence of alcohols on the optical clearing effect of skin in vitro. Journal of Biomedical Optics, 2008, 13(2): 021104. DOI:10.1117/1.2892684 |
| [8] |
Willard A M, Gittis A H. Mapping neural circuits with CLARITY. eLife, 2015, 4(1): e11409. |
| [9] |
Zheng H, Rinaman L. Simplified CLARITY for visualizing immunofluorescence labeling in the developing rat brain. Brain Structure & Function, 2016, 221(4): 2375-2383. |
| [10] |
Zhang M D, Tortoriello G, Hsueh B, et al. Neuronal calcium-binding proteins 1/2 localize to dorsal root ganglia and excitatory spinal neurons and are regulated by nerve injury. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(12): e11409-1158. |
| [11] |
Woo J, Lee M, Seo J M, et al. Optimization of the optical transparency of rodent tissues by modified PACT-based passive clearing. Experimental & Molecular Medicine, 2016, 48(12): e274. |
| [12] |
Yu T, Qi Y, Zhu J, et al. Elevated-temperature-induced acceleration of PACT clearing process of mouse brain tissue. Scientific reports, 2017, 7(1): 38848. |
| [13] |
Pan C, Cai R, Quacquarelli F P, et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nature Methods, 2016, 13(10): 859-867. DOI:10.1038/nmeth.3964 |
| [14] |
Tomer R, Ye L, Deisseroth K, et al. Advanced CLARITY for rapid and high-resolution imaging of intact tissues. Nature Protocols, 2014, 9(7): 1682-1697. DOI:10.1038/nprot.2014.123 |
| [15] |
Lee H, Park J H, Seo I, et al. Improved application of the electrophoretic tissue clearing technology, CLARITY, to intact solid organs including brain, pancreas, liver, kidney, lung, and intestine. BMC Developmental Biology, 2014, 14(1448): 781. |
| [16] |
Li J, Czajkowsky D M, Li X, et al. Fast immuno-labeling by electrophoretically driven infiltration for intact tissue imaging. Scientific Reports, 2015, 5(1): 10640. DOI:10.1038/srep10640 |
| [17] |
Hammouda B. Temperature effect on the nanostructure of SDS micelles in water. Journal of Research of the National Institute of Standards and Technology, 2013, 118(1): 151-167. |
 2017, Vol. 37
2017, Vol. 37




