文章信息
- 陈小丽, 邹明园, 谢鑫, 王生育, 吴婷, 苏金华.
- CHEN Xiao-li, ZOU Ming-yuan, XIE Xin, WANG Sheng-yu, WU Ting, SU Jin-hua.
- 新型可控性栓塞剂MNPs-tTF的构建
- Construction of a Neotype Controllability Magnetic Targeting Restructuring Truncated Tissue Factor
- 中国生物工程杂志, 2017, 37(9): 60-64
- China Biotechnology, 2017, 37(9): 60-64
- http://dx.doi.org/DOI:10.13523/j.cb.20170908
-
文章历史
- 收稿日期: 2017-04-17
- 修回日期: 2017-07-12
2. 厦门大学实验动物中心 厦门 361005;
3. 解放军第174医院厦门大学附属成功医院肿瘤科 厦门 361000
2. Laboratory Animal Center, Xiamen University, Xiamen 361005, China;
3. Department of Oncology, Chenggong Hospital Affiliated to Xiamen University, No. 174 Hospital of People's Liberation Army, Xiamen 361000, China
血栓性疾病是由血栓形成和血栓栓塞两种病理过程引起的疾病,如冠状动脉、脑动脉、肠系膜动脉、肢体动脉、腘静脉、股静脉、肠系膜静脉及门静脉等的栓塞。血栓性疾病的病因及发病机制十分复杂,迄今尚未完全明确[1]。针对不同的病因建立适合血栓性疾病研究的血栓动物模型非常重要,现已建立的血栓动物模型制备的常用方法主要有注射凝血酶法、自体血栓注入法、结扎法和损伤血管内膜法(包括机械损伤法、电流损伤法、光化学法和三氯化铁腐蚀法等)[2]。它们从不同侧面反映不同诱发因素血栓性疾病的病理状况,但尚存在不容易控制、重复性较差、需要手术等不足。本文首次使用基因工程技术制备高纯度的凝血蛋白,并结合超顺磁性纳米材料,建立一种可控靶向性的栓塞剂,为动物血栓模型的建立提供新的工具。
1 材料与方法 1.1 材料大肠杆菌E.coli BL21(DE3) 和质粒pET22b(+)购自Novagen公司。人肝癌细胞SMMC7721由厦门大学抗癌研究中心保存。
1.2 磁流体的化学合成及磁性能测定以氨水为沉淀剂、羧甲基化壳聚糖为稳定剂,参考传统的化学共沉淀法一步合成具有较高稳定性的磁流体(magnetic nanoparticles, MNPs)。具体过程为[3]:将羧甲基壳聚糖(OCMCs)、FeCl3溶液按一定比例加入反应器中,机械搅拌使其混匀。然后以Fe3+:Fe2+的摩尔比为2:1的量加入FeSO4·7H2O,缓慢加热至65℃待其完全溶解后,一边强烈搅拌一边逐滴加入50%的氨水,直到反应液pH为9~10为止,保持温度继续反应60min。然后在80℃下水浴,使反应混悬液熟化1h。然后,冷却至室温于7 000r/min离心20min以除去大颗粒。最后,将悬浮液用截留分子质量为50 000的透析膜透析24h,以除去游离的氨水、铁离子、羧甲基壳聚糖分子等杂质,即得羧甲基壳聚糖稳定的磁性氧化铁胶体,也称为磁流体。
取微量MNPs干粉,称重后封入胶囊,在室温(300K)磁场强度变化范围为-30 000~300 000e的条件下,用超导量子干涉磁强针(SQUID)测定其磁性能。
1.3 凝血蛋白的基因表达及鉴定利用基因工程技术,设计引物、扩增基因、酶切连接构建凝血蛋白(truncated tissue factor, tTF)的原核表达载体pET22b(+) /tTF,再转化大肠杆菌E.coli BL21(DE3),经筛选、测序获取高效表达基因工程菌株,优化IPTG诱导浓度、时间及培养条件。在最适条件下大量表达凝血蛋白,以供后续实验所需。
表达获取的凝血蛋白tTF通过镍亲和层析柱进行纯化,并在含有梯度尿素的复性缓冲液中透析复性。透析后的蛋白质用超滤管进行浓缩,用Bradford法测凝缩后的蛋白质以确定是否达到实验所需浓度。准备就绪的凝血蛋白,采用12% SDS-PAGE法鉴定表达结果的正确与否及纯度。
1.4 磁靶向凝血蛋白的构建及稳定性分析磁靶向凝血蛋白(MNPs-tTF)的构建,通过戊二醛法来交联,并通过磁分离法来纯化。具体过程如下:称取本实验前期制备的MNPs,溶于含5%戊二醛的PBS(pH6.8),终浓度为5mg/ml,室温振荡孵育10h,磁分离并洗涤数遍;接着将MNPs加入到tTF的PBS(pH7.4) 稀释液,于4℃振荡孵育4h。交联反应完后,利用磁分离出tTF-MNPs复合物,用PBS(pH7.4) 洗涤数遍以去除未结合的tTF蛋白。
在室温下对MNPs-tTF进行稳定性观察,将MNPs和MNPs-tTF溶液放置0h、24h、48h,观察溶液的外观、色泽及纳米粒沉淀析出情况,直观地比较溶液的稳定性。
1.5 体外分析磁靶向凝血蛋白的磁控靶向性及凝血效力为观察MNPs-tTF的磁控靶向性,对加有药物培养的细胞施加外界磁场,使其处于不同磁场强度的环境中,进而观察药物分布与磁场强度的关联性。具体步骤如下:在细胞培养皿中均匀接种SMMC-7721细胞,加药孵育的同时在培养皿的一侧放置磁铁,使培养皿不同区域的细胞处于不同的磁场强度中,并利用数字特拉斯针测得培养皿不同区域的磁场强度。在外加磁场作用下,药液孵育细胞一段时间后,进行普鲁士蓝染色,普通显微镜下观察拍照分析。
利用Xa化学显色分析MNPs-tTF的凝血效力。具体过程按Ruf等[4]的方法进行,用Tris缓冲液中配制系列浓度(0.01~100μmol/L)的BSA、tTF和tTF/MNPs溶液;加100nmol/L FⅦ,37℃温育10min;加FX至终浓度5nmol/L,混匀后室温温育10min;加入100mmol/L EDTA终止反应;加2nmol/L生色底物S2222;在5min之内用酶标仪测OD405值。
2 结果分析 2.1 磁流体的磁化率分析利用超导量子干涉仪(SQUID)在300K下测定MNPs颗粒的磁滞回线。由图 1可见,MNPs具有较高的饱和磁化强度(63.4emu/g),同时其可逆矫顽力和剩磁接近零,表现出超顺磁性,即随着磁场的减弱,磁体的磁化强度由平稳值降低到零,在H=0时没有矫顽力和剩磁。
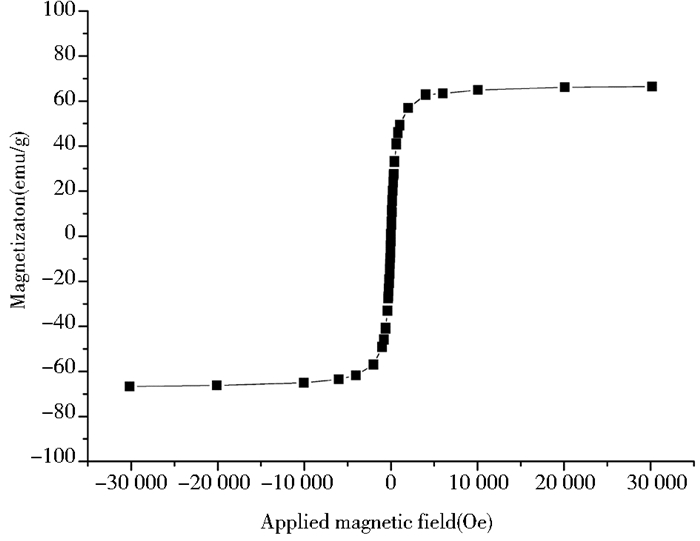
|
| 图 1 MNPs的磁滞回线 Figure 1 Magnetization curve of MNPs |
采用12% SDS-PAGE法鉴定表达结果的正确与否及纯度。如图 2所示,参照蛋白Marker比较未诱导表达菌和IPTG诱导表达菌的泳道(泳道1、2),可以发现在分子质量为32kDa处有特异条带(为目的蛋白条带)。其大小比理论值24.8kDa略大。这与Stone等[5]报道的情况相似,是蛋白质分子的特殊构型在SDS-PAGE中的异常迁移造成的。应用凝胶分析系统分析泳道1、2,目的蛋白的表达量分别占总菌体目的蛋白表达量的29%、47%。收集菌体破碎后的上清和沉淀(泳道3、4) 进行电泳分析,发现目的蛋白主要以包涵体形式存在。溶解后的包涵体采用不同pH梯度洗脱液纯化蛋白质,比较纯化前后的蛋白质溶液(泳道4、6),用凝胶分析系统分析,结果表明目的蛋白纯度达95%以上。比较洗涤液和洗脱液流出液(泳道5、6),说明对杂蛋白洗涤的相对彻底,适用于后续实验使用。
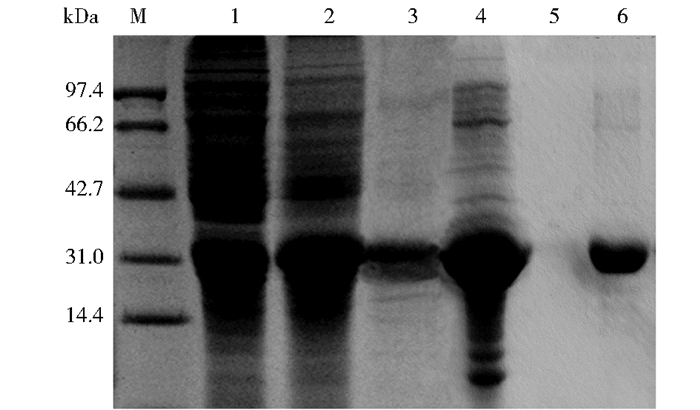
|
| 图 2 凝血蛋白tTF的SDS-PAGE分析 Figure 2 SDS-PAGE analysis for the clotting protein tTF M: Protein marker; 1: Total protein from BL21(DE3) without IPTG induciton; 2: Total protein from BL21(DE3) with IPTG induciton; 3: The supernatant of the bacteria cell suspensions after ultrasonic treatment; 4: The precipitate of the bacteria cell suspensions after ultrasonic treatment; 5: The sample washed from the Ni-NTA column with wash buffer; 6: The purified product of tTF by Ni-NTA column |
用Bradford法测定浓缩后蛋白质的浓度。以三蒸水为空白调零,系列总浓度(2.5μg/ml、5μg/ml、7.5μg/ml、10μg/ml、12.5μg/ml、15μg/ml、17.5μg/ml、20μg/ml)BSA测OD595nm做标准曲线(图 3)。将复性浓缩后的蛋白让父母稀释100倍,测得两个平行样的平均OD595nm为0.338 7,计算浓缩后的蛋白质浓度约为1.2mg/ml。
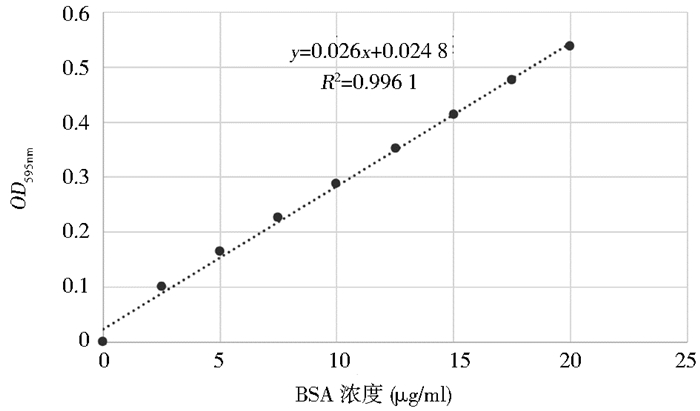
|
| 图 3 Bradford法测定蛋白质浓度的标准曲线 Figure 3 Calculation of protein concentation by the method of Bradford |
静置观察磁靶向凝血蛋白的稳定性,如图 4所示,随着放置时间的延长(0h、24h、48h),MNPs和MNPs-tTF溶液一直保持胶体状态,在48h时MNPs略微呈现沉降现象。如图 4(d)所示,当外界施加足够的磁场强度,MNPs-tTF能够被定向富集,即在自然重力场下有均匀分散性,而在外加磁场的情况下又能现磁靶向性。分别取静置0h、12h、24h、48h后的MNPs和MNPs-tTF溶液上清测OD600nm值,以双蒸水调零,结果如图 5所示,MNPs随着时间的增加,OD600nm值呈明显的下降趋势。而MNPs-tTF无明显变化,说明经重组凝血蛋白tTF的修饰更能增强纳米粒的稳定性,从而使其适用于生物学实验研究。

|
| 图 4 MNPs和MNPs-tTF的稳定性观察 Figure 4 Stability of the MNPs and MNPs-tTF (a) 0h (b) 24h (c) 48h (d)Applied magnetic field |
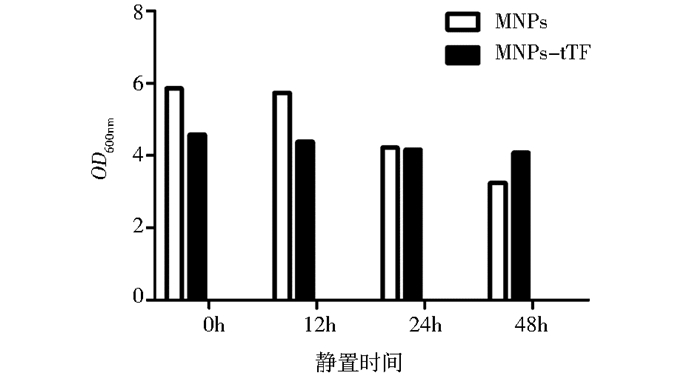
|
| 图 5 MNPs和MNPs-tTF的OD600nm值 Figure 5 OD600nm value of MNPs and MNPs-tTF |
在MNPs-tTF溶液孵育细胞的同时施加不同的磁场强度,使不同区域的MNPs-tTF浓度分布随磁场强度的不同而不同。细胞经普鲁士蓝染色后,显微镜下观察MNPs-tTF的分布进而指示MNPs-tTF的磁控靶向性。如图 6所示,右侧为高磁场区左侧为低磁场区,经细胞染色后高磁场区的细胞呈深蓝色、低磁场区的细胞不显色,说明MNPs-tTF在磁场力的引导下表现出了定向分布的特征,在磁场强度高的地方分布浓度也高。
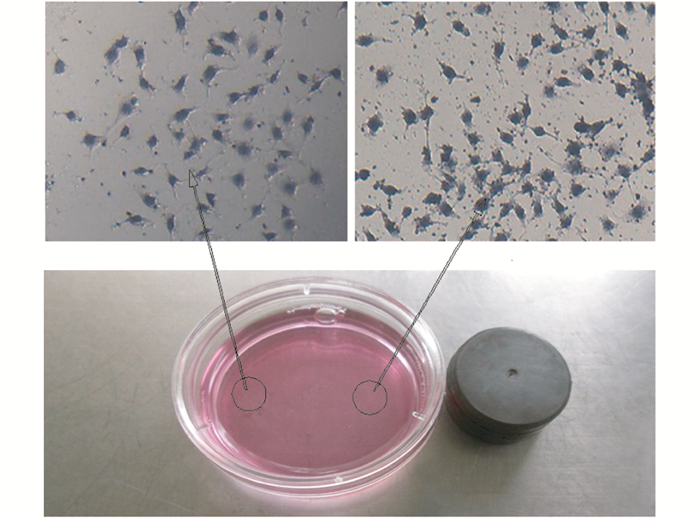
|
| 图 6 普鲁士蓝染色分析MNPs-tTF的磁控靶向性 Figure 6 Prussian blue staining analysis for the magnetic-induced targeting effect of MNPs-tTF in different magnetic field |
分别测0.01μmol/L、0.1μmol/L、1μmol/L、10μmol/L、100μmol/L的tTF、MNPs-tTF和BSA在Factor X活化反应后的OD405nm。结果如图 7所示,tTF和MNPs-tTF在1μmol/L以上时都能有效活化FX而增强405nm处吸收峰,且无明显差异,而同浓度的BSA没反应。可见MNPs-tTF保留有tTF凝血蛋白活化FX而启动外源性凝血通路的活性。
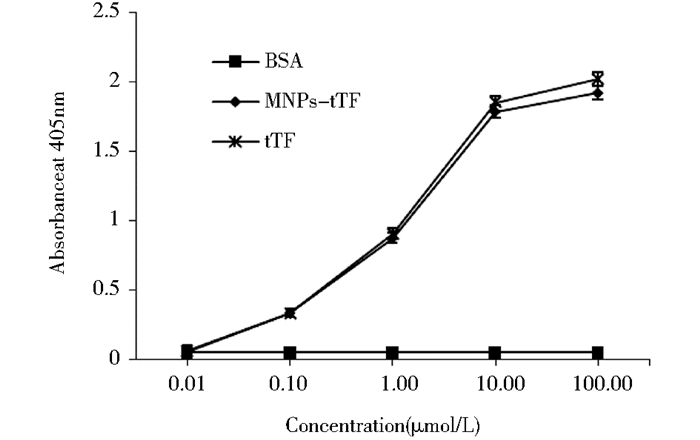
|
| 图 7 Factor X活化实验分析MNPs-tTF的促凝血活力 Figure 7 Blood coagulation activity of MNPs-tTF by Factor X activation assay |
随着人类心脑血管疾病发生率的增加,近年来有关缺血脑卒中、心肌梗死等研究也相应增加。动物血栓模型是研究人类栓塞形成、血栓栓塞机制与治疗最常用方法之一,几乎所有的研究均可以使用动物血栓模型来模拟。这就需要大量制备过程简单、可重复率高、血栓部位可控的动物模型,理想的栓塞材料应该符合以下要求:无毒、无抗原性、具有良好的生物相容性,且尽可能易得、易消毒。更智能的栓塞剂可以控制栓塞时间的长短,一旦需要,可以使血管再通[6-9]。磁性纳米作为载药系统是近年来研究的一个新热点。磁性纳米具有一般纳米材料特有的小尺寸效应、量子效应,更重要的是它具有独特的超顺磁性能,在磁场作用下具有磁控导向,将栓塞药物靶向特定的组织器官[10],且磁性纳米氧化铁在血管内聚集,本身也能起到一定的栓塞效果,应用于动脉栓塞,能够完全阻断或部分阻断血管内的血液流动[11]。本课题制备的磁流体MNPs具备良好磁靶向性,可以在外加磁场的作用下,主动靶向需要栓塞的血管部位。组织因子(tissue factor,TF)是唯一不存在于正常人血浆中的凝血因子,是外源性凝血级联反应的始发因子,是塑造血栓动物模型的天然材料。但是,凝血蛋白存在蛋白质不纯、活性不稳定,以及难定向、定位等缺点。传统的动物栓塞模型是通过血管插管的方式放置弹簧圈、明胶、明胶海绵等栓塞剂在特定的血管从而达到栓塞效果的。介入给药的方法不仅操作复杂,且对动物伤害很大,而且很难对小血管进行栓塞[12-13]。本课题结合磁流体纳米材料和重组凝血蛋白的特点,构建了一种新型的栓塞剂,实现凝血蛋白的定向传递与定位分布。该新型栓塞剂可通过静脉注射方式给药,如小鼠的尾静脉、家兔的耳缘静脉等。给药后,在外加磁场的控制下,实现动物体内的定位血管或组织的血栓形成,为定向诱发血栓动物模型提供一种新的可控工具。
总而言之,本课题构建的栓塞剂,有操作简单、可定位、成本廉价、可同时进行多个部位的栓塞等优点。而且是利用组织因子形成血栓栓塞,相比其他明胶或金属环等固体栓塞剂更趋近于血栓形成与血栓栓塞的病理过程,更有利于研究血栓形成与血栓栓塞的基本生理与病理过程[14-15]。
| [1] |
Cooley B C. Murine arterial thrombus induction mechanism influences subsequent thrombodynamics. Thrombosis Research, 2015, 135(5): 939-943. DOI:10.1016/j.thromres.2015.02.016 |
| [2] |
Guven M, Aras A B, Akman T, et al. Neuroprotective effect of p-coumaric acid in rat model of embolic cerebral ischemia. Iranian Journal of Basic Medical Science, 2015, 18(4): 356-363. |
| [3] |
Lei Z, Pang X, Li N, et al. A novel two-step modifying process for preparation of chitosan-coated Fe3O4/SiO2 microspheres. Journal of Materials Processing Tech, 2009, 209(7): 3218-3225. DOI:10.1016/j.jmatprotec.2008.07.044 |
| [4] |
Ruf W, Rehemtulla A, Morrissey J H, et al. Phospholipid-independent and-dependent interactions required for tissue factor receptor and cofactor function. Journal of Biological Chemistry, 1991, 266(4): 2158-2166. |
| [5] |
Stone M J, Ruf W, Miles D J, et al. Recombinant soluble human tissue factor secreted by Saccharomyces cerevisiae and refolded from Escherichia coli inclusion bodies:glycosylation of mutants, activity and physical characterization. Biochem J, 1995, 310(Pt 2): 605-614. |
| [6] |
Zhou F, Chen L, An Q, et al. Novel hydrogel material as a potential embolic agent in embolization treatments. Scientific Reports, 2016, 6: 32145. DOI:10.1038/srep32145 |
| [7] |
Berenstein A. Treatment of experimental aneurysms with a new liquid embolic agent and a retrievable stent:proof of concept and feasibility study. Journal of Neurointerventional Surgery, 2016, 8(9): 934. DOI:10.1136/neurintsurg-2015-011930 |
| [8] |
Leyon J J, Chavda S, Thomas A, et al. Preliminary experience with the liquid embolic material agent PHIL (precipitating hydrophobic injectable liquid) in treating cranial and spinal dural arteriovenous fistulas:technical note. Journal of Neurointerventional Surgery, 2015, 8(6): 596-602. |
| [9] |
Brassel F, Meila D. Evolution of embolic agents in interventional neuroradiology. Clinical Neuroradiology, 2015, 25(2): 333. |
| [10] |
An Y, Jiang G, Qi Y, et al. Synthesis of nano-plugging agent based on AM/AMPS/NVP terpolymer. Journal of Petroleum Science & Engineering, 2015, 135: 505-514. |
| [11] |
Choi S Y, Kwak B K, Shim H J, et al. MRI traceability of superparamagnetic iron oxide nanoparticle-embedded chitosan microspheres as an embolic material in rabbit uterus. Diagnostic & Interventional Radiology, 2015, 21(1): 47. |
| [12] |
张永永. pH响应聚氨基酸的合成、性能及在肿瘤栓塞中的应用. 兰州: 西北师范大学医学院, 2016. Zhang Y Y.Synthesis Properties and Application in Tumor Embolism of pH-responsive Poly(amino acid).Lanzhou:Medical College, Northwest Normal University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10736-1016237993.htm |
| [13] |
谭衍, 边远, 汤树洪, 等. 液体栓塞剂在颅内动脉瘤栓塞中的应用. 广西医科大学学报, 2015, 32(2): 299-301. Tan Y, Bian Y, Tang S H, et al. Application of liquid embolization in intracranial aneurysm embolization. Journal of Guangxi Medical University, 2015, 32(2): 299-301. |
| [14] |
李成, 施昌盛, 虞希祥, 等. Embosphere微球靶血管栓塞治疗中晚期肺癌大咯血的疗效. 中华介入放射学电子杂志, 2016, 4(3): 155-157. Li C, Shi C H, Yu X X, et al. Evaluation on the efifcacy of the target-vessel embolization with Embosphere microspheres for the treatment of massive haemoptysis in advanced lung cancer. Chinese Journal of Interventional Radiology, 2016, 4(3): 155-157. |
| [15] |
姚群立, 陆建东, 徐向荣, 等. 不同栓塞剂栓塞子宫动脉治疗子宫腺肌症的中远期随访分析. 介入放射学杂志, 2015(3): 248-252. Yao Q L, Lu J D, Xu X R, et al. Uterine artery embolization for the treatment of uterine adenomyosis:comparison study of different embolic agents. Journal of Interventional Radiology, 2015(3): 248-252. |
 2017, Vol. 37
2017, Vol. 37




