文章信息
- 付理文, 张宇, 依含, 李雪, 朱乃硕.
- FU Li-wen, ZHANG Yu, YI Han, LI Xue, ZHU Nai-shuo.
- Taqman多重实时荧光PCR同步定量检测6种动物源性成分方法的建立
- Establishment and Application of Multiplex Fluorescent Real-time PCR for Detecting Six Kinds of Animal Derived Materials
- 中国生物工程杂志, 2017, 37(9): 48-59
- China Biotechnology, 2017, 37(9): 48-59
- http://dx.doi.org/DOI:10.13523/j.cb.20170907
-
文章历史
- 收稿日期: 2017-03-13
- 修回日期: 2017-04-18
当前,食品领域掺假尤其是动物肉类掺假十分严重,不仅损害了消费者的利益,也给食品安全带来了潜在风险。传统依靠感官与经验的肉类形态学鉴别手段已远不能满足对肉制品掺假监控的需要。猪、牛、羊、鸡、鸭、鹅等肉类基本囊括了目前市场80%的禽畜食用肉类,由于价格差异较大,一些不法分子为牟取暴利大肆掺杂使假,损害禽畜产品质量;除此以外,其他掺假的肉类也种类繁多,如马肉①、驴肉②、狐狸肉③、骆驼肉,甚至有在老鼠肉中加入明胶、胭脂红、硝盐等以此冒充羊肉售予顾客④。随着科技含量的日益提高,造假手段也不断翻新,监管部门虽然掌握着一定的鉴定技术,但这些技术主要是对单一物种的检测鉴定,或对常见少数物种的定性鉴定,不能做到定量检测,更无法得知掺假肉品中各成分所占的比例。因此,开发出一种多物种基因快速同步定量检测方法是当前国家市场监督、肉类食品产供销企业和广大消费者对食品安全保证及质量控制的迫切需要。
① http://news.qq.com/a/20130211/000255.htm
② http://news.99.com.cn/jiankang/20110629/132692.htm
③ http://news.40777.cn/htmlnews/1466/1466704.htm
④ http://video.sina.com.cn/p/news/s/v/2013-05-03/073562377445.html
目前,基于PCR的肉类食品鉴定方法在国内外已有不少报道。例如,Dooley等[1]基于线粒体细胞色素b基因,分别建立了牛肉、猪肉、羊肉、鸡肉和火鸡肉的实时荧光定量PCR检测方法;曾少灵等[2]根据动物线粒体细胞色素b基因的差异性位点设计特异性引物和不同荧光素标记的Taqman探针,建立用于牛、山羊和绵羊源性成分DNA快速检测的方法等。这些检测方法大多建立在以线粒体基因为检测对象的基础上,在理论上只能用于定性鉴别基因的种属来源,不能真正检测出各肉类成分量的比例。而且,以线粒体作为检测对象并不能真正地反映细胞数目,因为不同细胞内所含线粒体的数目不尽相同,除此之外,线粒体的分解也使得检测结果变得不可靠。
本室以细胞核基因组DNA为分子靶标进行定量检测。由于基因组DNA在动物体细胞核内拷贝数确定(通常为两份拷贝),所以通过对基因拷贝数的测定可以直接推算出细胞数目,实现肉类成分的绝对定量,真实地反映不同成分肉类所占的比例。而且,基因组DNA序列相对保守,物种品系覆盖度广,使检测方法有更好的灵活性、适应性和稳定性。本研究选取了猪、牛、鸡、鸭、鹅的保守基因actb及羊的prolactin receptor基因,通过全局比对针对基因序列的差异位点分别设计了猪、牛、羊、鸡、鸭、鹅的引物与探针,并分别以Cy5、HEX、FAM、Cyan500、ROX和Red640荧光素进行标记,第一次成功建立了能在同一管中同时检测出猪、牛、羊、鸡、鸭、鹅源性成分的六重实时荧光PCR方法,灵敏度高、特异性强、重复性好、高效快速,适用于肉品、奶品、生皮和动物饲料油脂等动物产品中猪、牛、羊、鸡、鸭、鹅源性成分的鉴定。
1 材料与方法 1.1 样品DNA样品来源于18种动物:猪肉、牛肉、羊肉、鸡肉、鸭肉、狗肉、兔肉、鸽子肉、火鸡肉、鸵鸟肉和鱼肉购自上海超市;鹅肉购自江苏扬州超市;驴肉购自河北石家庄超市;马肉、骆驼肉购自内蒙古呼和浩特超市;梅花鹿肉购于吉林长春;猫血在上海梵华宠物医院采集;鼠肉在复旦大学生命科学学院实验动物中心采集。
此外,200份不同来源样品:各种肉制品116份,奶品21份,动物皮革毛发制品33份,动物源性成分作为添加剂的其他产品如奶茶、奶油、饲料、肉骨粉、乳清粉等30份。200份样品购于全国各地,涵盖了肉制品市场新鲜生肉、超市鲜肉、培根烟熏肉、腊肉、火腿、香肠、烤摊肉类、火锅用肉,超市及淘宝袋装肉品、奶品、骨粉、饲料等,部分饲料(狗粮、猫粮)购于宠物医院,动物皮革毛发样品取自废旧皮革衣物。
1.2 试剂和仪器血液、细胞、组织基因组DNA提取试剂盒购自天根生化科技(北京)有限公司。2×HLingene PCR Master Mix购自惠凌生物技术(上海)有限公司,AceQTM qPCR Probe Master Mix购自南京诺唯赞生物科技有限公司。DNA分子质量Marker DL2000、电泳上样缓冲液等PCR生化反应试剂购自宝生物工程(大连)有限公司。引物与探针由生工生物工程(上海)股份有限公司及德国Tib Molbiol公司合成。DNA测序由上海睿迪生物科技有限公司完成。
Mx3000P荧光定量PCR仪为Agilent公司产品,LightCycler 480Ⅱ荧光定量PCR仪为Roche公司产品,Veriti®96-Well ThermalCycler PCR仪为Applied Biosystems公司产品,GENESPEED 416型低速离心机为Gene公司产品,5424型高速离心机为Eppendorf公司产品,FR-200A全自动紫外与可见分析装置为上海复日科技有限公司产品,PowerPacTM Universal电泳仪为Bio-Rad公司产品。
1.3 方法 1.3.1 引物与探针的设计从GenBank获取猪(Sus scrofa)、牛(Bos taurus)、鸡(Gallus gallus)、鸭(Anas platyrhynchos)、鹅(Anser cygnoides domesticus)的actb基因组DNA(gDNA)序列,获取羊(Ovis aries)的prolactin receptor(PR)基因组DNA序列。用在线多序列比对工具MAFFT对猪、牛、鸡、鸭、鹅actb,羊PR基因序列进行全局比对,针对基因序列的差异位点设计用于定量PCR的引物和探针。引物和探针的设计由DNAMAN和在线工具Primer 3完成,并通过NCBI的序列比对工具Blastn、Primer-BLAST和软件Oligo 6.0对选取的引物和探针的特异性及其他各项参数进行评价(表 1、表 2)。
| Simplex | Sequence(5′ to 3′) |
| Pig-FP | GGAGTGTGTATCCCGTAGGTG |
| Pig-RP | CTGGGGACATGCAGAGAGTG |
| Pig-Probe | Cy5-TCTGACGTGACTCCCCGACCTGG-BHQ3 |
| Bovine-FP | GTAGGTGCACAGTACGTTCTGAAG |
| Bovine-RP | GGCCAGACTGGGCACATG |
| Bovine-Probe | HEX-CGGCACACTCGGCTGTGTTCCTTGC-BHQ1 |
| Sheep-FP | CAGACCAACATGCTTTTAAACC |
| Sheep-RP | AACTGTAGCCTTCTGACTCGC |
| Sheep-Probe | FAM-AGACTGGCGGGGAAGGAAAGAC-BHQ1 |
| Chicken-FP | AAGTGCTGGCTGTGAGTTGG |
| Chicken-RP | CGCTCCGCTACCTAATTCCT |
| Chicken-Probe | FAM-CTGTACCTTAAGCCTGCTCAGACTCTGG-BHQ1 |
| Duck-FP | CTGTGTCCTTTCTGTTTAGGGTC |
| Duck-RP | GCCTCCTGCTCTACTGCTG |
| Duck-Probe | HEX-TGTGTTCTACTGCAAAATCTTAACCTGTCC-BHQ1 |
| Goose-FP | GCTGGGAGGAGAAAGGACT |
| G00se-RP | AGACCCTGTGTGCCCTCT |
| Goose-Probe | Cy5-TGGTAACTGAATCCCCATCTCTAGCTC-BHQ3 |
| Hexa-plex | Sequence(5′ to 3′) |
| Pig-Probe | Cy5-TCTGACGTGACTCCCCGACCTGG-BHQ3 |
| Bovine-Probe | HEX-CGGCACACTCGGCTGTGTTCCTTGC-BHQ1 |
| Sheep-Probe | FAM-AGACTGGCGGGGAAGGAAAGAC-BHQ1 |
| Chicken-Probe | Cyan500-CTGTACCTTAAGCCTGCTCAGACTCTGG-BBQ |
| Duck-Probe | ROX-TGTGTTCTACTGCAAAATCTTAACCTGTCC-BHQ2 |
| Goose-Probe | Red640-TGGTAACTGAATCCCCATCTCTAGCTC-BHQ2 |
1.3.2 样品DNA的提取
血液样品、肉制品、生皮、骨骼、动物源性饲料及饲料添加剂等组织样品依照天根血液、细胞、组织基因组DNA提取试剂盒中的操作说明提取全基因组DNA,鲜奶、酸奶参照田雨[3]、徐仙等[4]、关潇等[5]的方法提取DNA,奶粉、奶茶等奶品参照CTAB法[6]提取DNA。皮革、毛发等DNA参照毛小慧和刘敏[7]、柯振华等[8]、刘颖等[9]的方法提取。用NanoDrop2000c测定标准品原液gDNA浓度和纯度,并按10倍连续梯度稀释的方法依次稀释,即100、10-1、10-2、10-3、10-4等5个梯度以用于定量检测。
1.3.3 单一荧光PCR方法的建立引物与探针分组配对,分别对猪、牛、羊、鸡、鸭、鹅6种不同动物DNA进行检测,验证引物与探针的扩增有效性和特异性,建立分别检测猪、牛、羊、鸡、鸭、鹅源性成分的单一荧光PCR方法。用2%琼脂糖凝胶电泳检测目的产物条带,并将DNA模板分别为猪、牛、羊、鸡、鸭、鹅的荧光定量PCR阳性产物送上海睿迪生物科技有限公司测序,分析比对序列,确定阳性扩增产物是否为目的片段。
1.3.4 单一荧光定量PCR方法反应体系和反应条件的优化分别以猪、牛、羊、鸡、鸭、鹅为研究对象, 反应体系设定为50μl, 筛选引物、探针最佳浓度以及最高扩增效率时的最适模板量。单一模板的Real-time qPCR反应体系:总体积50μl,2 × AceQTM qPCR Probe Master Mix 25μl (终浓度1 ×),50 × ROX ReferenceDye 2 1μl (终浓度1 ×),上、下游引物终浓度在0.1~1.0μmol/L内调整,Taqman探针终浓度在50~250nmol/L内调整,模板上样量不超过5μl (每50μl体系以1μg为上限),用灭菌MilliQ水补足。依据控制变量法每次试验只设一个变量,以Ct值、荧光增量、扩增效率、重复性和平台期等因素为考察依据,每个成分的浓度筛选重复实验3次,若结果稳定,可确定为最佳浓度值。根据引物与探针的退火温度,以优化好的反应体系摸索PCR最佳反应条件,在“95℃ 5~10min; 95℃ 10~15s,55~62℃ 15~45s,35~45个循环”范围内反复进行实验,每次实验只改变一个条件,每个反应条件重复试验3次,以Ct值、荧光增量、扩增效率、平台期和耗时等因素为考察依据,确定最佳反应条件。
1.3.5 单一荧光定量PCR方法的灵敏度实验将提取的猪、牛、羊、鸡、鸭、鹅来源的DNA模板原液进行梯度稀释,即100、10-1、10-2、10-3、10-4 5个梯度,以1.3.4部分优化好的反应体系和反应条件,分别进行猪、牛、羊、鸡、鸭、鹅源性成分的荧光PCR检测、溶解曲线检测和PCR产物电泳检测。以上每组检测至少重复3次,每个检测设置3个平行实验,只有当每次重复检测和所有平行实验结果都一致时,才确定为物种该方法能检测到的最低模板量。
1.3.6 六重实时荧光PCR方法的建立及反应体系和反应条件的优化6对引物和6条荧光探针组合起来,模板采用相同浓度梯度混合的猪、牛、羊、鸡、鸭、鹅DNA原液,参照1.3.4部分的方法对六重实时荧光PCR反应体系和反应条件进行优化并完成溶解曲线检测。
1.3.7 六重实时荧光PCR方法的特异性实验利用1.3.6部分建立好的六重实时荧光PCR方法分别对狗、兔、鼠、驴、马、骆驼、猫、鱼、鸽子、火鸡、鸵鸟和梅花鹿等其他12种动物DNA进行六重实时荧光PCR检测,并通过琼脂糖凝胶电泳检测扩增结果,以评价检测方法的特异性。
1.3.8 六重实时荧光PCR方法的灵敏度实验依照1.3.5部分的方法,利用六重实时荧光PCR(6-plex qPCR)方法对猪、牛、羊、鸡、鸭、鹅六种动物的5个(100、10-1、10-2、10-3、10-4)混合梯度模板液进行检测,以确定六重实时荧光PCR方法能检测到的各物种最低模板量(灵敏度)。
1.3.9 样品检测将200份不同来源的样品称重后剪碎,研磨至匀浆状(液体离心),用天根生物技术公司基因组DNA提取试剂盒及其他参考方法抽提gDNA;采用六重实时荧光PCR方法对200份不同来源的DNA样品进行猪、牛、羊、鸡、鸭、鹅源性成分检测,进一步验证六重实时荧光PCR方法的特异性;以之前制备好的猪、牛、羊、鸡、鸭、鹅混合梯度模板液作为标准品绘制标准曲线,待测DNA分别对应标准曲线作绝对定量,以分析样品中是否含有猪、牛、羊、鸡、鸭、鹅源性成分及其各自含量、比例。每份DNA样品的检测至少重复2次,每次均设置2个平行实验,只有当2次重复实验和所有平行实验结果都一致时,才确定该份DNA样品的检测结果,否则需重新检测。
2 结果 2.1 单一荧光PCR检测方法的建立(Mx3000P)用试剂盒分别抽提猪、牛、羊、鸡、鸭、鹅肉组织基因组DNA,分别利用对应的引物和探针进行单重荧光定量PCR实验和交叉实验,2%琼脂糖凝胶电泳如图 1~图 3所示:扩增产物条带单一,猪目的基因actb条带大小为103bp,牛目的基因actb条带大小为96bp,羊目的基因prolactin receptor条带大小为90bp,鸡目的基因actb条带大小为122bp,鸭目的基因actb条带大小为142bp,鹅目的基因actb条带大小为119bp,均与目标相符。交叉实验结果表明所建立的单重荧光定量PCR体系具有较高的特异性,在所考察的范围内,除了对种属内的DNA模板呈阳性外,对其他种属的DNA模板均显阴性。定量PCR扩增曲线及溶解曲线分析结果均与电泳结果吻合。
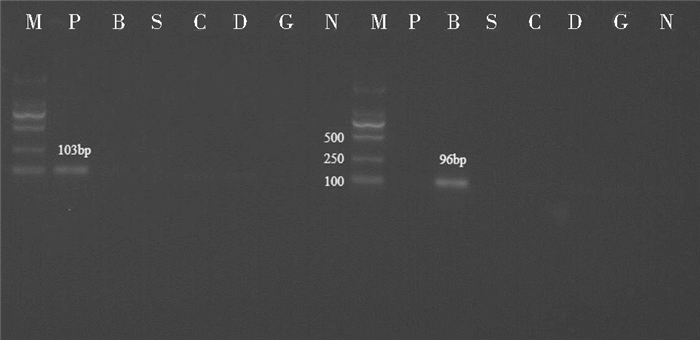
|
| 图 1 猪、牛目的片段单一荧光PCR扩增电泳检测结果及交叉实验 Figure 1 Electrophoresis results of simplex qPCR products amplified (pig & bovine) and crossover experiments M: DL2000 DNA marker Left side: Primers and probe of pig; P: +Pig DNA; B: +Bovine DNA; S: +Sheep DNA; C: +Chicken DNA; D:+ Duck DNA; G: +Goose DNA; N: The negative control of pig Right side: Primers and probe of bovine; P: +Pig DNA; B: +Bovine DNA; S: +Sheep DNA; C: +Chicken DNA; D:+ Duck DNA; G: +Goose DNA; N: The negative control of bovine |
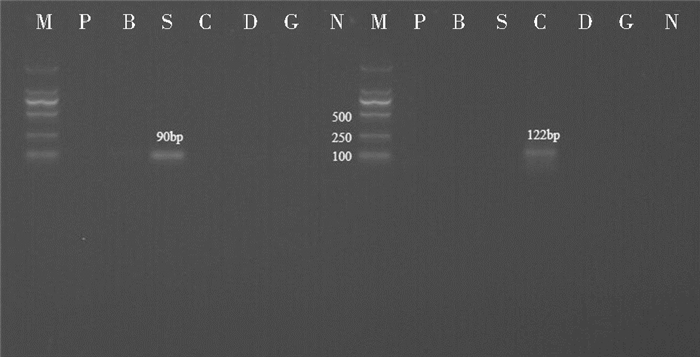
|
| 图 2 羊、鸡目的片段单一荧光PCR扩增电泳检测结果及交叉实验 Figure 2 Electrophoresis results of simplex qPCR products amplified (sheep & chicken) and crossover experiments M: DL2000 DNA marker Left side: Primers and probe of sheep; P: +Pig DNA; B: +Bovine DNA; S: +Sheep DNA; C: +Chicken DNA; D:+ Duck DNA; G: +Goose DNA; N: The negative control of sheep Right side: Primers and probe of chicken; P: +Pig DNA; B: +Bovine DNA; S: +Sheep DNA; C: +Chicken DNA; D:+ Duck DNA; G: +Goose DNA; N: The negative control of chicken |
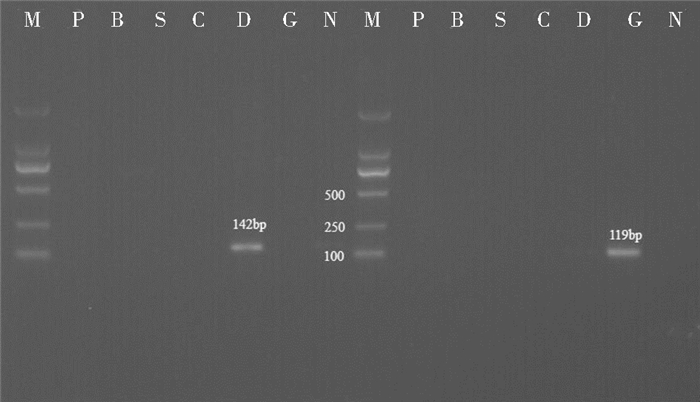
|
| 图 3 鸭、鹅目的片段单一荧光PCR扩增电泳检测结果及交叉实验 Figure 3 Electrophoresis results of simplex qPCR products amplified (duck & goose) and crossover experiments M: DL2000 DNA marker Left side: Primers and probe of duck; P: +Pig DNA; B: +Bovine DNA; S: +Sheep DNA; C: +Chicken DNA; D:+ Duck DNA; G: +Goose DNA; N: The negative control of duck Right side: Primers and probe of goose; P: +Pig DNA; B: +Bovine DNA; S: +Sheep DNA; C: +Chicken DNA; D:+ Duck DNA; G: +Goose DNA; N: The negative control of goose |
经筛选优化,确定了单一荧光PCR的反应体系(50μl):总体积50μl,2 × AceQTM qPCR Probe Master Mix 25μl (终浓度1 ×),50 × ROX ReferenceDye 2 1μl (终浓度1 ×),上、下游引物各1μl (终浓度0.2μmol/L),Taqman探针0.5μl (终浓度0.1μmol/L),模板上样量以每50μl体系不超过1μg为宜,无菌水补足。单一荧光PCR反应条件(两步法):95℃预变性5min,95℃变性10s,60℃退火延伸30s,反应循环数40,信号采集设在延伸步骤。
2.3 单一荧光PCR检测方法的灵敏度实验(Mx3000P)将提取后稀释至同一浓度的猪、牛、羊、鸡、鸭、鹅来源的DNA 5个梯度,以上述1.3.4部分的反应体系和反应条件,分别进行单物种DNA样品的荧光定量检测。将检测结果绘制成标准曲线,如图 4所示。分析溶解曲线反映PCR有很好的特异性,无非特异扩增产物及引物二聚体。在50μl反应体系中,猪、牛、羊的DNA检测灵敏度均达到0.02ng,鸡、鸭为0.093ng,鹅为0.04ng,大约相当于单个体细胞。在100~10-4 5个梯度范围内均呈现很好的线性关系。凝胶电泳检测扩增条带的结果与溶解曲线分析结果一致,条带的亮度变化清楚地反映了模板DNA浓度的变化梯度。测序验证扩增条带均与数据库中数据一致,为目的基因片段。
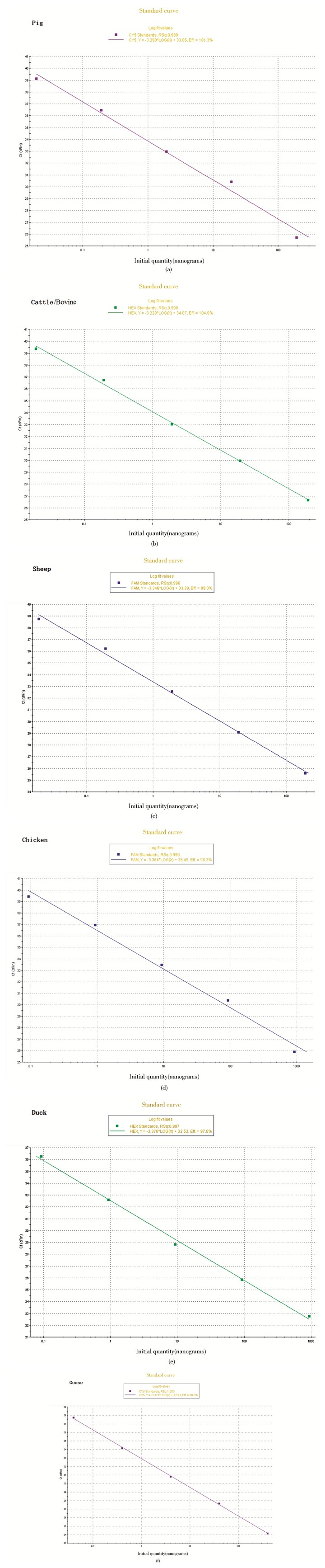
|
| 图 4 单一荧光定量PCR检测方法的灵敏度实验结果 Figure 4 Results of sensitivity tests of simplex fluorescent real-time PCR (a) The standard curve of the actb gene of pig (singled by FAM) (b) The standard curve of the actb gene of bovine (singled by HEX) (c) The standard curve of the prolactin receptor gene of sheep (singled by Cy5) (d) The standard curve of the actb gene of chicken (singled by FAM) (e) The standard curve of the actb gene of duck (singled by HEX) (f) The standard curve of the actb gene of goose (singled by Cy5) |
经筛选优化,确定50μl反应体系中各成分分别为:2 × AceQTM qPCR Probe Master Mix 25μl (终浓度1×),上、下游引物各0.4μl (终浓度0.08μmol/L),Taqman探针0.2μl(终浓度0.04μmol/L),各物种模板上样量每50μl体系不超过160ng为宜,无菌水补足。六重实时荧光PCR反应条件(两步法):95℃预变性5min,95℃变性10s,60℃退火延伸30s,反应循环数40,信号采集设在延伸步骤。
2.5 六重实时荧光PCR方法的特异性实验(LightCycler 480Ⅱ)利用上述1.3.6部分建立的六重实时荧光PCR方法进行特异性试验,结果显示,对狗、兔、鼠、驴、马、骆驼、猫、鱼、鸽子、火鸡、鸵鸟和梅花鹿12种动物DNA无特异性扩增,而猪、牛、羊、鸡、鸭、鹅均可扩增出预期大小的条带(图 5),经测序后确定是目的基因序列,表明该方法有良好的特异性。
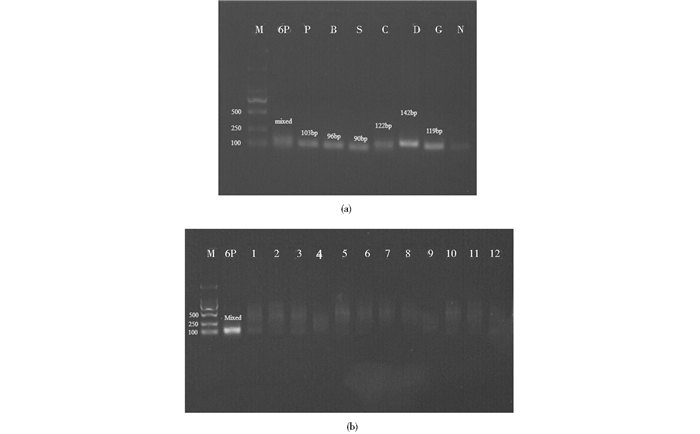
|
| 图 5 六重实时荧光PCR检测方法的特异性实验结果 Figure 5 Specificity results of hexa-plex fluorescent real-time PCR (a) M: DL2000 DNA marker; 6p: 6-plex qPCR products of pig & bovine & sheep & chicken & duck & goose; P: 6-plex qPCR product of pig; B: 6-plex qPCR product of bovine; S: 6-plex qPCR product of sheep; C: 6-plex qPCR product of chicken; D: 6-plex qPCR product of duck; G: 6-plex qPCR product of goose; N: Negative control (b) M: DL2000 DNA marker; 6p: 6-plex qPCR products of pig & bovine & sheep & chicken & duck & goose; 1: 6-plex qPCR product of dog; 2: 6-plex qPCR product of rabbit; 3: 6-plex qPCR product of rat; 4: 6-plex qPCR product of donkey; 5: 6-plex qPCR product of horse; 6: 6-plex qPCR product of camel; 7: 6-plex qPCR product of cat; 8: 6-plex qPCR product of carp; 9: 6-plex qPCR product of pigeon; 10: 6-plex qPCR product of turkey; 11: 6-plex qPCR product of ostrich; 12: 6-plex qPCR product of sika deer |
按1.3.5部分和1.3.8部分的方法,对10倍梯度稀释的模板进行六重实时荧光PCR灵敏度实验,经多次试验后,确定六重实时荧光PCR方法对猪、牛、羊、鸡、鸭、鹅源性成分的最低检测限都至少能达到10-3模板梯度,50μl体系能检测到猪、牛、羊、鸡、鸭、鹅的最低DNA模板量分别为0.049ng、0.048ng、0.085ng、0.13ng、0.162ng、0.074ng(图 6)。

|
| 图 6 六重实时荧光PCR检测方法的灵敏度实验结果 Figure 6 Results of sensitivity tests of hexa-plex fluorescent real-time PCR (a) The amplification curves of pig(Cy5) & bovine(HEX) & sheep(FAM) & chicken(Cyan500) & duck(ROX) & goose(Red640) (b) The standard curves of pig(Cy5) & bovine(HEX) & sheep(FAM) & chicken(Cyan500) & duck(ROX) & goose(Red640) |
按1.3.8部分的方法,采用六重实时荧光PCR方法分别对收集的200份不同来源DNA样品进行猪、牛、羊、鸡、鸭、鹅源性成分检测。结果表明,六重实时荧光PCR方法具有良好的特异性和灵敏度,21份奶品中检测出3份奶品掺假,33份皮毛7份与商品名不符,116份肉制品19份掺假使杂,其他产品30份中8份与商品标识的成分不完全相符。具体检测结果见表 3。
| Kinds of animal source | Meat | Milk | Pelt | Others | Total |
| Pig only-derived | 23 | 0 | 0 | 8 | 31 |
| Bovine only-derived | 15 | 12 | 8+1 | 6 | 42 |
| Sheep only-derived | 9 | 5 | 6 | 2 | 22 |
| P+B-derived | 2 | 0 | 0 | 0 | 2 |
| P+S-derived | 7 | 0 | 0 | 1 | 8 |
| B+S-derived | 3 | 3 | 0 | 2 | 8 |
| P+B+S-derived | 3 | 0 | 0 | 0 | 3 |
| Chicken only-derived | 15 | 0 | 0 | 4 | 19 |
| Duck only-derived | 11 | 0 | 8 | 2 | 21 |
| Goose only-derived | 7 | 0 | 4 | 0 | 11 |
| C+D-derived | 2 | 0 | 0 | 0 | 2 |
| D+G-derived | 2 | 0 | 1 | 0 | 3 |
| Negative | 17(其他肉) | 1(马奶) | 5 | 5 | 28 |
| Total | 116 | 21 | 33 | 30 | 200 |
3 讨论
本研究建立了用于检测市场最常见6种肉制品的六重实时荧光定量PCR方法,分别针对猪、牛、鸡、鸭、鹅的β-actin基因、绵羊的prolactin receptor基因的保守区域设计了6对特异性的引物和6条特异性的荧光探针,可一次同时扩增出103bp、96bp、90bp、122bp、142bp、119bp的条带,经测序与目的序列相符。虽然由于目的序列间大小差异不大,琼脂糖凝胶电泳不能清楚地将条带分开(图 5),但real-time qPCR很好的弥补了这一缺陷,通过观察溶解曲线及荧光扩增曲线就能判断某种成分是否存在,相比传统完全依赖跑胶、测序的多重PCR方法[10]有明显的优势。除此之外本方法还能定量检测,通过制好的标准品绘制标准曲线,待测DNA分别对应标准曲线作绝对定量,可快速分析出样品中是否含有猪、牛、羊、鸡、鸭、鹅源性成分及其各自的含量、比例。
与普通PCR相比,多重荧光定量PCR除了要求不同引物对能在同一反应体系中对多个不同模板序列进行特异性扩增以外,还要求添加的不同荧光报告基团标记的多个探针能特异地结合靶序列,准确地对各靶序列进行定量。本研究共设计了6条荧光探针,按照荧光基团Reporter波长大小依次是Cyan500、FAM、HEX、ROX、Red640和Cy5,并双标BBQ、BHQ1、BHQ1、BHQ2、BHQ2和BHQ3作为Quencher。由于相邻通道的荧光可能部分存在overlap,所以本实验还做了颜色补偿(color compensation)实验以对数据进行校正。本研究中用到的荧光定量PCR仪LightCycler 480/LightCycler 480Ⅱ为Roche公司产品,是现今仅少数同时支持六荧光通道检测的仪器;而六通道中第一通道对荧光波长要求太高,Excitation/Emision为440nm/488nm,很少染料能满足要求,本室从德国合成LC480第一通道专用Cyan500荧光探针,真正实现了一次PCR反应同时检测6种动物源性成分的目标,且通过实验验证该方法特异性好、灵敏度高,检测核酸含量可达pg级。本研究采用AceQTM qPCR Probe Master Mix代替传统的PCR反应体系(dNTP、Taq酶、10 × PCR buffer组合体系),减少了加样的烦琐步骤以及可能产生的污染,同时提高了反应的灵敏度。
利用本研究建立的六重实时荧光定量PCR方法对收集来自全国各地200份不同的样品进行猪、牛、羊、鸡、鸭、鹅源性成分检测,结果显示:购买的21份奶品中12份牛奶产品均只检测到牛源性成分,8份羊奶产品均含有羊源性成分,但其中1份鲜羊奶、2份羊奶粉中同时检测到牛源性成分,酸马奶未发现任何牛、羊源性成分。收集的33份皮革毛皮等样品,经检测10份牛皮产品(皮鞋、皮带、皮包、皮衣夹克)中只有8份牛皮,2份不明;10份羊皮毛(羊皮鞋、皮包、羊毛大衣羊毛衫)6份检测到羊源性成分,1份(皮包)为牛源性成分,与商品名不符,其余3份不明;8份鸭绒产品(鸭绒被、鸭绒枕、鸭绒服)均只含鸭源性成分;5份鹅绒产品(鹅绒被、鹅绒服)均含鹅源性成分,但有一件羽绒服同时检测到了鸭源性成分。116份肉制品2份牛肉中掺入猪肉,7份羊肉中掺入猪肉,3份羊肉中掺入牛肉,3份羊肉火锅中同时检测到猪、牛、羊三种肉;2份鸭肉中发现鸡肉,2份鹅肉中掺入鸭肉,17份其他种肉制品(驴肉火烧、阿胶、鱼丸、狗肉、兔肉等)不含上述6种动物成分,但也不排除掺杂其他肉类。30份其他产品主要为奶茶、奶油、饲料、肉骨粉等,具体检测结果见表 3。
上述检测结果表明,目前国内肉制品市场上依然存在着严重的掺假使杂现象,主要为低价肉品冒充高价肉类,如猪肉冒充牛肉、羊肉,鸡肉、鸭肉冒充鹅肉,鸭绒冒充鹅绒等,而火锅用羊肉卷更是羊肉掺假的重灾区。利用本研究建立的六重实时荧光定量PCR方法对肉制品等进行检测,不仅可快速灵敏有效地鉴别猪、牛、羊、鸡、鸭、鹅源性成分,杜绝不法行为,还能提高执法的科学性和效率,加快检疫检验通关速率,切实维护消费者的利益与安全。
| [1] |
Dooley J J, Paine K E, Garrett S D, et al. Detection of meat species using TaqMan real-time PCR assays. Meat Science, 2004, 68(3): 431-438. DOI:10.1016/j.meatsci.2004.04.010 |
| [2] |
曾少灵, 秦智锋, 阮周曦, 等. 多重实时荧光PCR检测牛、山羊和绵羊源性成分. 生物工程学报, 2009, 25(1): 139-146. Zeng S L, Qin Z F, Ruan Z X, et al. Multiplex fluorescent real-time PCR detection of bovine, goat and sheep derived materials in animal products. Chin J Biotech, 2009, 25(1): 139-146. |
| [3] |
田雨. 从牛奶中分离DNA方法的建立. 乳业科学与技术, 2006, 29(3): 112-113. Tian Y. Establishment of method of separating DNA from milk. Journal of Dairy Science and Technology, 2006, 29(3): 112-113. |
| [4] |
徐仙, 陈沁, 雍克岚, 等. PCR方法在区分牛奶牧场来源中的应用. 食品科技, 2008, 33(12): 258-261. Xu X, Chen Q, Yong K L, et al. Application of PCR in analyzing farm sources. Food Science and Technology, 2008, 33(12): 258-261. DOI:10.3969/j.issn.1005-9989.2008.12.067 |
| [5] |
关潇, 蔡琴, 陈沁. 基于α-乳白蛋白基因序列的牛奶过敏原PCR检测. 乳业科学与技术, 2013, 36(4): 19-22. Guan X, Cai Q, Chen Q. Establishment of PCR method based on the α-lactalbumin-encoding gene for detecting milk allergens. Journal of Dairy Science and Technology, 2013, 36(4): 19-22. |
| [6] |
张文举, 许庆金, 邓志瑞, 等. 芝麻过敏原PCR检测方法. 食品与机械, 2012, 28(2): 52-55. Zhang W J, Xu Q J, Deng Z R, et al. Establishment of PCR method for detecting sesame allergen. Food & Machinery, 2012, 28(2): 52-55. |
| [7] |
毛小慧, 刘敏. 天然皮革定性PCR检测方法的研究. 中国皮革, 2014, 43(14): 97-99, 106. Mao X H, Liu M. Research on the PCR detective method for nature leather qualitation. China Leather, 2014, 43(14): 97-99, 106. |
| [8] |
柯振华, 罗海英, 陈筱婷, 等. 牛皮革PCR鉴别方法研究. 皮革科学与工程, 2013, 23(1): 32-36, 42. Ke Z H, Luo H Y, Chen X T, et al. Identification of bovine leather using PCR technology. Leather Science and Engineering, 2013, 23(1): 32-36, 42. |
| [9] |
刘颖, 孙蓓, 马彦, 等. 从一根毛发中分别提取nDNA和mtDNA的简易方法. 天津医药, 2008, 36(7): 510-512. Liu Y, Sun B, Ma Y, et al. The study of the DNA extraction procedure from a single hair. Tianjin Medical Journal, 2008, 36(7): 510-512. |
| [10] |
罗宁, 王冬冬, 杨宗统, 等. 猪6种常见病毒多重PCR检测方法的建立及应用. 动物医学进展, 2016, 37(12): 1-6. Luo N, Wang D D, Yang Z T, et al. Establishment and application of multiplex PCR for detecting six kinds of swine viruses. Progress in Veterinary Medicine, 2016, 37(12): 1-6. DOI:10.3969/j.issn.1007-5038.2016.12.001 |
 2017, Vol. 37
2017, Vol. 37




